含镁铝杂质硫酸氧钛溶液水热水解规律
杨卓颖,杨 帆,易美桂,向 兰
(1.四川大学化学工程学院,四川成都610065;2.清华大学化学工程系)
含钛高炉渣是钒钛磁铁矿高炉冶炼副产物,典型组成(以质量分数计)为20%~22%TiO2,22%~26%SiO2,22%~29%CaO,12%~16%Al2O3,7%~9%MgO。受技术经济的影响,目前中国含钛高炉渣的总堆积量已超过8 000万t,既占用土地又浪费资源,亟待开发利用[1-3]。
由含钛高炉渣制备二氧化钛的方法主要有高温碳化-低温氯化法[4-5]、熔盐焙烧法[6-10]、盐酸法[11-13]和硫酸法[14-15]等,其中硫酸法具有对原料适应性强等特点,应用前景广阔[16]。但是,含钛高炉渣经硫酸法处理一般形成镁铝杂质含量高、黏度大的硫酸氧钛溶液[15,17-18][典型组成为0.5~1.5 mol/L Ti O2,0.2~1.0 mol/L MgSO4,0.3~0.8 mol/L Al2(SO4)3,1.3~3.1 mol/L H2SO4],导致除杂流程繁琐、常压水解困难(时间>20 h,钛水解率<90%)、产物粒径细小(100~300 nm)、固液分离困难。前人也曾研究硫酸氧钛溶液水热水解规律[19-21],但尚未涉及含镁铝杂质的硫酸氧钛溶液体系。
为此,笔者探讨了含镁铝杂质硫酸氧钛溶液的水热水解规律,分别从热力学平衡计算和实验角度考察了镁铝杂质和温度对水解过程的影响,初步建立了适宜的水热水解工艺。
1 理论水解率
纯硫酸氧钛溶液(1 mol/L TiOSO4+2.4 mol/L H2SO4)和含镁铝杂质硫酸氧钛溶液[1 mol/L TiOSO4+0.5 mol/L MgSO4+0.25 mol/L Al2(SO4)3+2.4 mol/L H2SO4]水解体系涉及的化学反应见式(1)~(18),相关平衡常数见图1[22-23]。
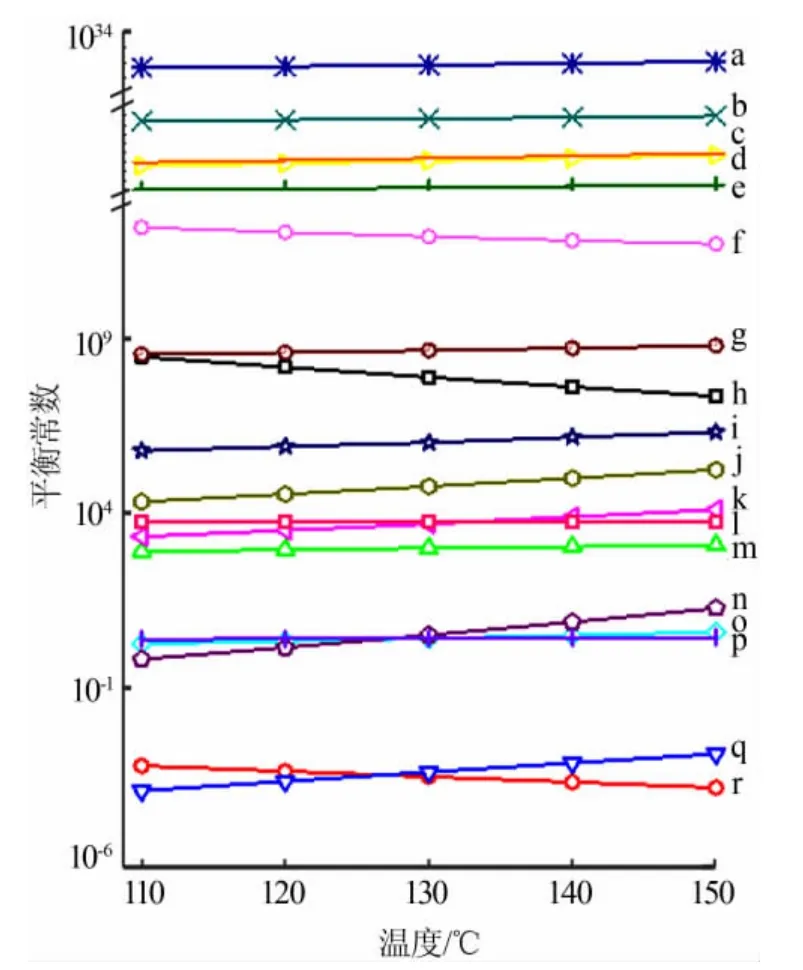
图1 反应(1)~(18)的平衡常数Fig.1 Equilibrium constant of reactions(1)~(18)
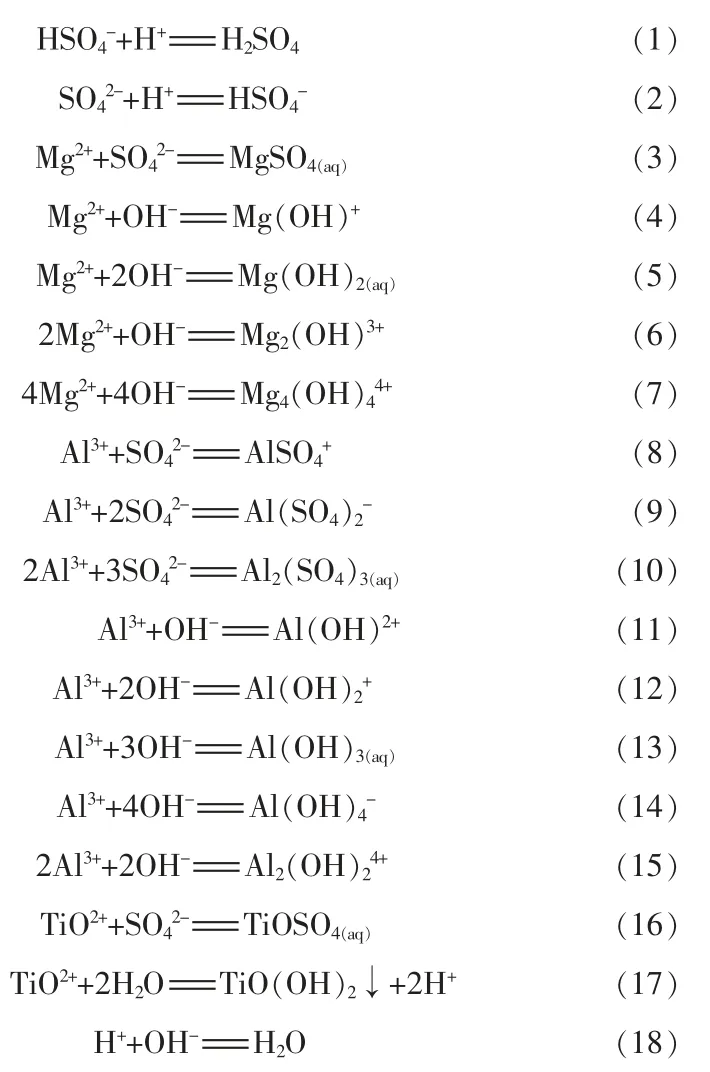
纯硫酸氧钛溶液涉及的反应有(1)~(2)和(16)~(18),含镁铝杂质硫酸氧钛溶液涉及的反应有(1)~(18)。根据物料守恒、电荷守恒和相关平衡方程可求出两种溶液中各组分的平衡浓度,并由此求出达到沉淀平衡时两种溶液中含钛组分的平衡总浓度([TiO2+]和[TiOSO4(aq)]),则钛理论水解率(φ):
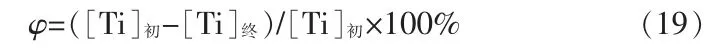
式中:[Ti]初为硫酸氧钛初始浓度;[Ti]终为平衡时溶液中含钛组分总浓度([TiO2+]+[TiOSO4(aq)])。
图2为含镁铝杂质硫酸氧钛溶液中含镁/铝组分的平衡浓度随温度的变化规律。110~150℃镁以MgSO4(aq)为主、铝以Al(OH)2+为主,其平衡浓度随温度的升高变化均不明显。其他含镁组分[如Mg2(OH)3+、Mg(OH)+、Mg(OH)2(aq)、Mg4(OH)44+等]和含铝 组 分[如Al(SO4)+、Al(SO4)2-、Al3+、Al(OH)2+等]的平衡浓度在110~150℃均小于1×10-3mol/L。含镁组分平衡浓度由大到小的顺序为MgSO4(aq)、Mg2+、Mg2(OH)3+、Mg(OH)+、Mg(OH)2(aq)、Mg4(OH)44+;含铝组分平衡浓度由大到小的顺序为Al(OH)2+、Al(SO4)+、Al(SO4)2-、Al3+、Al(OH)2+、Al2(OH)24+、Al(OH)3(aq)、Al(OH)4-、Al2(SO4)3(aq)。
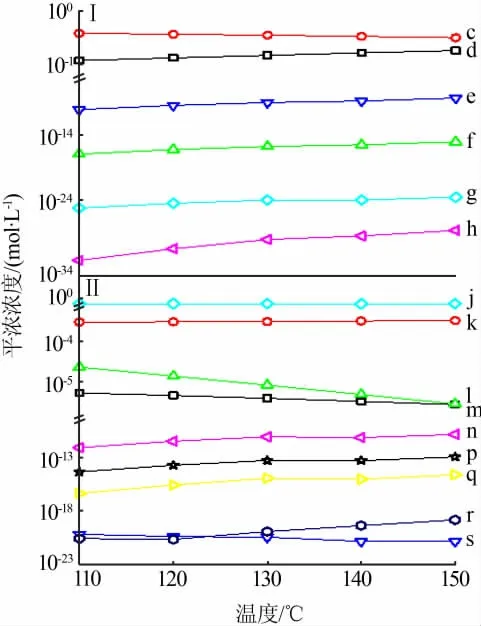
图2 含镁铝杂质硫酸氧钛溶液中含镁(Ⅰ)/铝(Ⅱ)组分平衡浓度随温度的变化Fig.2 Variations of equilibrium concentration of Mg-bearing(Ⅰ)and Al-bearing(Ⅱ)components in TiOSO4 solution with temperature
图3为纯硫酸氧钛溶液与含镁铝杂质硫酸氧钛溶液中含钛组分平衡浓度和理论水解率随温度的变化规律。从图3看出,110~150℃,两种溶液中的含钛组分均以TiOSO4(aq)为主,[TiOSO4(aq)]随温度的升高逐渐降低,而[TiO2+]变化均不明显。110~150℃,两种溶液的含钛组分理论水解率均大于99%,且升高温度有利于提高含钛组分理论水解率(纯硫酸氧钛溶液和含镁铝杂质硫酸氧钛溶液在110℃的理论水解率分别为99.3%和99.1%,二者在150℃的理论水解率分别为99.8%和99.7%)。与纯硫酸氧钛溶液相比,含镁铝杂质[MgSO4、Al2(SO4)3]硫酸氧钛溶液中的[SO42-]较高,使反应(16)右移,导致[TiOSO4(aq)]升高而[TiO2+]降低,总体效应使含钛组分理论水解率略有降低。
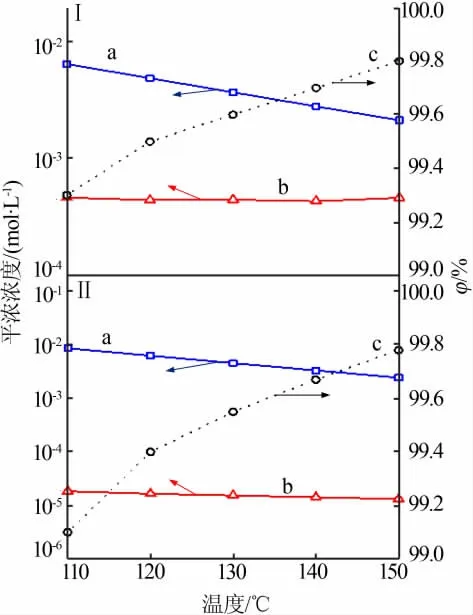
图3 纯硫酸氧钛(Ⅰ)和含镁铝杂质硫酸氧钛(Ⅱ)溶液中含钛组分平衡浓度与理论水解率随温度的变化Fig.3 Variations of equilibrium concentrations and theoretical hydrolysis ratios of Ti-containing components in TiOSO4(Ⅰ)and Mg/Al-bearing TiOSO4(Ⅱ)solution with temperature
2 实验研究
图4为纯硫酸氧钛溶液和含镁铝杂质硫酸氧钛溶液中钛水解率随温度和时间的变化规律。在实验条件下,升高温度或延长时间均有利于提高两种溶液的钛水解率。但是,温度、时间相同时,含镁铝杂质硫酸氧钛溶液的钛水解率均小于纯硫酸氧钛溶液的水解率(例如,含镁铝杂质硫酸氧钛溶液在130℃、水解时间为2、6、10 h的水解率分别为47.1%、71.3%、87.2%,相应的纯硫酸氧钛溶液的钛水解率则分别为82.6%、95.9%、99.2%),说明镁铝杂质的存在可降低硫酸氧钛的水解速率,且时间越短、温度越低,杂质影响越显著。在150℃反应10 h后,含镁铝杂质硫酸氧钛溶液(钛水解率为98.3%)和纯硫酸氧钛溶液(钛水解率为99.2%)均几乎完全水解,钛水解率差距不大。因此,确定含镁铝杂质硫酸氧钛溶液的优化水解条件为150℃、10 h。
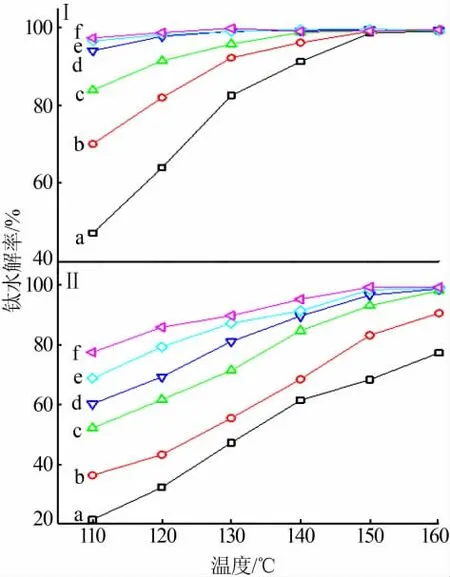
图4 纯硫酸氧钛(Ⅰ)与含镁铝杂质硫酸氧钛(Ⅱ)溶液中钛水解率随温度与时间的变化Fig.4 Variations of hydrolysis ratios of Ti-bearing components in TiOSO4(Ⅰ)and Mg/Al-bearing TiOSO4(Ⅱ)solutions with temperature at varying time
图5为150℃条件下含镁铝杂质硫酸氧钛溶液水解产物偏钛酸的形貌,其由原始粒径为100~300 nm的小晶粒聚集而成,聚集体呈不规则状,粒径为1~3μm。

图5 150℃条件下含镁铝杂质硫酸氧钛溶液水解产物偏钛酸的形貌Fig.5 Morphology of metatitanic acid hydrolysate from Mg/Al-bearing TiOSO4 solution at 150℃
3 结论
研究了含镁铝杂质硫酸氧钛溶液的水热水解规律。热力学计算表明:含镁铝杂质硫酸氧钛溶液中的镁铝形态分别以MgSO4(aq)和Al(OH)2+为主,镁铝杂质的存在使含钛组分理论水解率略有降低,升高温度可促进含镁铝杂质硫酸氧钛溶液的水解。实验研究表明:升高温度可显著强化含镁铝杂质硫酸氧钛溶液的水解,在150℃反应10 h可制得原始粒径为100~300 nm、团聚粒径为1~3μm的不规则状偏钛酸颗粒,含钛组分水解率高达98.3%。

