细胞融合促进诱导多能干细胞向心肌细胞分化的效率
熊挺淋,应梦慧,张丽莎,张晓刚
细胞融合参与许多组织器官的生成发育,如肌肉、骨骼和胎盘等的形成,在自然界发生率很低[1-3]。较早的干细胞移植治疗促进组织修复实验中,观察到了细胞融合现象[4,5]。之后许多研究证实,胚胎干细胞(ESCs)和成熟体细胞的杂交细胞,主要表现出多潜能ESCs的特点[6,7],将杂交细胞移植入皮下后,能形成包含三个胚层细胞的畸胎瘤[8,9],表明杂交细胞仍具有全能性。Matsuura等[10]将心肌细胞与非心肌细胞融合后,杂交细胞维持了心肌细胞的特点,并能重新回到细胞循环中。可见,细胞融合可能成为再生医学的一种有效方法。
心肌细胞在缺血、缺氧和损伤等病理条件下死亡后,只能靠其他心肌细胞的过度肥大来代偿,但这种代偿机制本身对心脏不利,因此心肌细胞的再生研究成为了临床医生的棘手问题。ESCs具有全能分化性,体外可分化为起搏细胞、心房细胞、心室细胞或蒲氏细胞等多种心肌组织细胞[11],但ESCs移植入体内存在着致畸胎瘤的风险,同时其固有的免疫原性和伦理道德问题使其研究和应用受到限制。Yamanaka等[12]成功将体细胞重编程为具有类似胚胎干细胞的诱导多能干细胞,解决了ESCs用于移植治疗时存在的免疫排斥及伦理难题,且也能够定向分化为心肌细胞,但是,体外自然分化为心肌细胞的能力低于ESCs[13],本实验在体外研究iPSCs与心肌细胞通过聚乙二醇介导融合,检测杂交细胞的心肌细胞分化效率。
1 材料和方法
1.1 实验动物及细胞株出生1~3 d的新生乳鼠及怀孕12.5~14.5 d的孕鼠由重庆医科大学动物中心提供。次黄嘌呤-鸟嘌呤磷酸核苷转移酶基因缺陷和绿色荧光蛋白转基因(Oct-4)的诱导多能干细胞株购自中国科学院动物研究所。
1.2 主要试剂和仪器DMEM-H培养基、HAT选择培养基、10% FBS购自Gibco;β-巯基乙醇、L-谷氨酰胺、1%非必需氨基酸、胰酶、胶原酶、1%的牛血清白蛋白、DAPI购自Sigma;白血病抑制因子(LIF)购自Millipore;丝裂霉素C、多聚甲醛、聚乙二醇购自Roche;秋水仙素、吉姆萨染液、0.1% Triton X-100、Gold view购自Genview;甲醇、冰醋酸、0.56% KCL购自北京鼎国生物工程公司;cTnT单克隆抗体、Tritc标记的兔抗山羊IgG荧光二抗购自Santa cruz;Trizol、逆转录酶、Tap聚合酶购自Takara;RT-PCR所用引物由Invitrogen公司合成;S1000Tm Thermal cycler逆转录系统由BIO-RAD公司提供;显微镜由Olympus公司提供。
1.3 实验方法
1.3.1 iPSCs培养iPSCs接种在事先经丝裂霉素C处理过的小鼠胚胎成纤维细胞上,培养方法及培养条件同前[14],细胞培养在含有10%胎牛血清、1000 IU/mL LIF、0.1mmol/L β-巯基乙醇、0.1 mmol/L L-谷氨酰胺、1%非必需氨基酸的DMEM-H中。
1.3.2 心肌细胞提取和培养新生乳鼠取出心脏,放在无菌的预冷PBS中,去除心包,将心肌组织剪成碎块,用胶原酶消化2次,15 min/次,再用0.1%胰酶消化3次,6 min/次,分别收集消化液,用含10%FBS的DMEM-H培养基分别中和、离心和重悬细胞,差异贴壁1 h后分离培养。
1.3.3 细胞融合iPSCs与心肌细胞混合,离心弃上清,用PBS冲洗一次,加入1 ml预温过的聚乙二醇,将细胞吹打并混匀,在37℃作用3 min,缓慢加入1 ml预温过的无血清iPSCs培养基,在37℃作用1 min,再加入无血清iPSCs培养基3 mL,作用3 min,最后加入10 ml无血清iPSCs培养基,作用5 min,离心弃上清,用iPSCs完全培养基重悬细胞,接种在事先经丝裂霉素C处理过的小鼠胚胎成纤维细胞上,24 h后换用含有1000 IU/ml LIF和0.1 mmol/Lβ-巯基乙醇的HAT选择培养基(10-4M次黄嘌呤、7×10-7M氨基蝶呤、10-3M胸腺嘧啶脱氧核苷)继续培养杂交细胞,每1~2 d更换一次选择培养基,以去掉死细胞。抗HAT的杂交细胞收获后,采用标准的iPSCs方法进行传代培养。
1.3.4 染色体核型分析含0.4 μg/ml秋水仙素的培养基培养细胞3 h后收集杂交细胞,加入5 ml的0.56% KCL溶液,将细胞吹打均匀后,室温放置30 min,加入3 ml新配置的固定液(甲醇:冰醋酸 3:1),轻轻混匀后,室温下固定8 min,离心弃上清,加入 5 ml固定液并充分将细胞混匀,室温下固定30 min,再次离心弃上清,加入0.3 ml固定液,将细胞吹打均匀并制成细胞悬液,将细胞悬液滴于预冷的载玻片上(以每张载玻片3滴细胞悬液为宜),室温晾干,用PBS稀释10倍的吉姆萨染液染色15 min,自来水冲洗载玻片,文火烤干。显微镜下观察、拍照,随机取50个染色体计数。
1.3.5 拟胚体(EBs)的制备及向心肌细胞分化收集对数生长期的杂交细胞和iPSCs,EBs的制备参照Zhang法[15]进行。EBs在体视学显微镜下吸出并接种,让其贴壁生长,采用分化培养基培养,每天换液,分别在EBs贴壁后第10 d、15 d、20 d、25 d和30 d时测定杂交细胞和iPSCs形成搏动EBs的比率。
1.3.6 RT-PCR细胞的总RNA采用TRIzol提取,提取的RNA保存在-80℃冰箱中。使用RNAiso Plus逆转录试剂盒以及S1000Tm Thermal cycler逆转录系统将RNA转化为cDNA,PCR采用标准的25 μl扩增体系,扩增条件是:94℃变性30 s、94℃退火30 s、72℃ 延伸30 s,循环30次。PCR产物用2%琼脂糖做凝胶电泳分离条带并用Gold view显色,结果采用quantity one凝胶电泳仪进行图像半定量分析和数据处理。
1.3.7 免疫荧光细胞培养在玻璃载玻片上,PBS洗涤3次,4%多聚甲醛在室温条件下固定30 min,在室温下用0.1% Triton X-100穿孔10 min,PBS洗3次,用1%的牛血清白蛋白封闭30 min,甩掉多于的封闭液,在37℃下用PBS稀释的单克隆山羊抗心肌肌钙蛋白T一抗(cTnT)(1:100)孵育2 h,一抗孵育后用PBS洗3次,在37℃下用PBS稀释的Tritc标记的兔抗山羊IgG二抗(1:100)孵育2 h,二抗孵育后用PBS洗3次,并用DAPI复染细胞核,最后抗淬灭剂封片以及用荧光显微镜照相。
1.4 统计学分析所有数据均采用SPSS 21.0统计学软件分析。计量资料采用均数±标准差()表示,两组间均数的比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 杂交细胞形态观察聚乙二醇介导iPSCs和心肌细胞融合,在选择培养基的培养条件下,细胞融合4 d后见到成iPSCs样生长的杂交细胞,呈集落样生长,集落呈隆起的圆形、椭圆形或不规则形态,折光性强,界限和形态不清(图1A),荧光显微镜下克隆团呈现出绿色荧光(Oct-4启动)(图1B),表明杂交细胞保持了干细胞全能性。
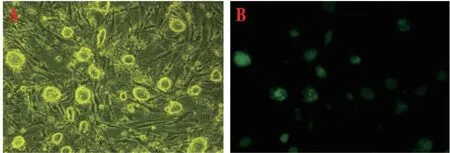
图1 杂交细胞形态学观察(×100)
2.2 染色体核型分析结果iPSCs和心肌细胞染色体数目为正常的二倍体核型,染色体数为40条。因此iPSCs与心肌细胞融合后,杂交细胞预期的染色体数目为80条,但本实验结果表明,只有35%的杂交细胞染色体数目为80条,超过75%的杂交细胞染色体数目在76~80条之间,近25%的杂交细胞染色体数目变异较大(图2)。
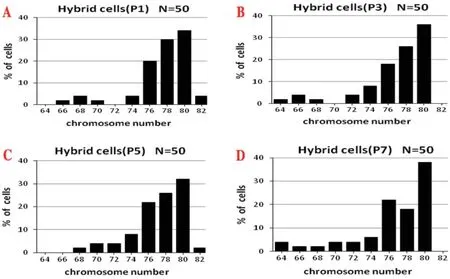
图2 杂交细胞染色体数分布情况
2.3 RT-PCR结果干细胞特异性基因Oct-4和Nanog在iPSCs和杂交细胞中成阳性表达,心肌细胞中成阴性表达;半定量分析结果显示,与iPSCs相比,Oct-4在杂交细胞中的表达量没有统计学差异(P>0.05),Nanog的表达在P1代杂交细胞中低于iPSCs(P<0.05),其他时间点与iPSCs无统计学差异(P>0.05),而心肌细胞中Oct-4和Nanog的表达明显低于iPSCs(P<0.05)。心肌细胞特异性基因α-MHC和β-MHC在心肌细胞中成阳性表达,在iPSCs中表达阴性,在杂交细胞初期,α-MHC和β-MHC表达阳性,随着时间延长,表达量逐渐降低,到P3代以后的杂交细胞不表达β-MHC,P5代以后的杂交细胞不表达α-MHC;半定量分析结果显示,与心肌细胞相比,α-MHC和β-MHC在iPSCs、P3、P5、P7代杂交细胞中的表达明显低于心肌细胞,差异有统计学差异(P<0.05)(图3)。
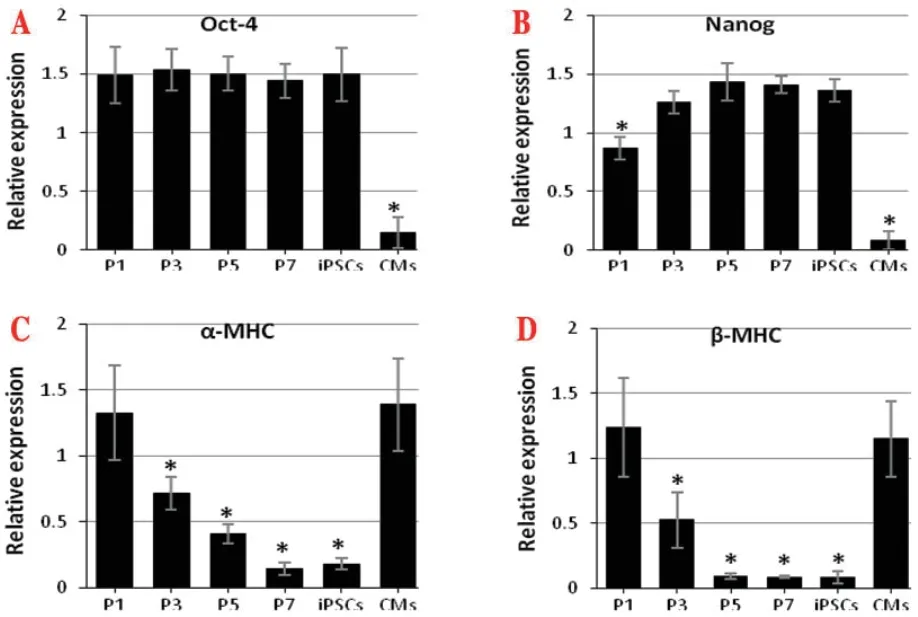
图3 RT-PCR半定量分析结果
2.4 免疫荧光结果免疫荧光分析表明Oct-4在iPSCs和杂交细胞中呈阳性表达,在心肌细胞中呈阴性表达(图4A、C)。cTnT在心肌细胞中阳性表达,在iPSCs中阴性表达,在早期杂交细胞中呈阳性表达(图4B、C),而P3代以后的杂交细胞呈阴性表达。随着时间的延长,cTnT在杂交细胞克隆中的阳性表达逐渐降低,在P3代杂交细胞时,阳性率降到26%。因此,免疫荧光结果表明,大多杂交细胞初期表现为iPSCs和心肌细胞的特点,P3代以后失去心肌细胞表型,而维持了干细胞的特点。

图4 免疫荧光结果(×400)
2.5 杂交细胞分化而来的心肌细胞形态学观察在体外悬浮培养条件下(图5A),杂交细胞能够形成EBs,说明杂交细胞在体外仍具有多能性。经悬浮培养形成的EBs,大小较一致,呈立体球形,边缘较光滑。随着分化天数的增加,EBs体积逐渐增大,少量EBs出现融合,贴壁后,EBs铺开生长,在外围分化出上皮样形态细胞,最早在第8 d出现搏动区域,表现为个别EBs局部的搏动,频率较快,约90~120 次/min。随着分化天数的增加,各组出现搏动的拟胚体逐渐增多,在分化的第14~20 d,搏动的拟胚体数达到高峰,但是搏动频率降低,约40~60 次/min(图5B、C)。

图5 分化心肌细胞观察
2.6 杂交细胞与iPSCs向心肌细胞分化效率的比较采用悬浮培养法,杂交细胞能够形成EBs,连续观察30 d EBs搏动情况,结果表明杂交细胞和iPSCs均能形成搏动的EBs(心肌细胞分化),两种细胞都在第20~25 d间达到心肌细胞分化效率的最高值,分化培养10 d及15 d时的杂交细胞心肌细胞分化率与iPSCs无明显差异(P>0.05),分化培养20 d、25 d及30 d时的杂交细胞心肌细胞分化率明显高于iPSCs,差异有统计学意义(P<0.05),图6。
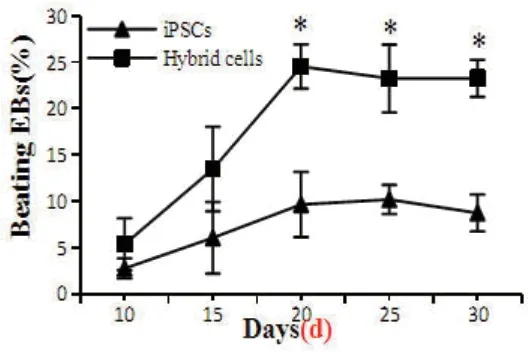
图6 杂交细胞和iPSCs的心肌细胞分化率比较
3 讨论
iPSCs来源于自身成体细胞的逆分化,不存在伦理道德及免疫排斥问题,目前尚未见iPSCs与心肌细胞的融合实验报道,因此找到一种既具有无限增殖能力,又具有心肌细胞功能的杂交细胞是再生医学的需要。本研究在体外通过聚乙二醇介导构建iPSCs和心肌细胞的杂交细胞,杂交细胞无论是生长特点还是基因、蛋白表达层面均与iPSCs相似。本研究的杂交细胞生物学特点与胚胎干细胞和成体细胞的杂交细胞表现出单向胚胎干细胞特点的结果一致[16,17]。也有研究表明,二倍体胚胎干细胞和四倍体成纤维细胞的杂交细胞显示出单向成纤维细胞的特征[18],可能是由所选亲本细胞的染色体倍性不同引起的。两个二倍体亲本细胞的杂交细胞,理论上应为四倍体的核型,预期的染色体数应该是两亲本细胞之和。本研究中,二倍体iPSCs与二倍体心肌细胞的杂交细胞,大多表现出近似四倍体的核型,而少部分杂交细胞染色体数只有60~70条之间,甚至更少,说明在这一过程中可能存在亲本染色体的丢失或融合不完全[19]。
所有的杂交细胞均表达干细胞特异性的基因和蛋白,而心肌特异性基因和蛋白只在早期的杂交细胞中表达,后期的杂交细胞呈阴性表达,这种趋势变化可能是由于干细胞相关基因或因子使基因去甲基化后重新表达,或者甲基化而致基因表达沉默造成的[20,21]。Oct-4和Nanog是维持干细胞多能性的关键基因,杂交细胞不仅表达Oct-4和Nanog,且在体外也能形成EBs,说明杂交细胞仍然保持了多潜能性[22,23]。我们采用经典的悬浮培养EBs法诱导杂交细胞向心肌细胞分化,以检测杂交细胞和iPSCs的心肌细胞分化能力。实验结果表明,两种细胞均能分化为搏动的心肌细胞,在相同培养及诱导条件下杂交细胞的心肌细胞分化率高于iPSCs。以往研究结果可能用于解释杂交细胞分化率提高的原理,这是我们需进一步研究的方向:①Nkx2.5、GATA-4、Tbx5/20、Mef2c、Myocardin、HAND等早期心肌转录因子协同调控心肌特异性基因和蛋白的表达,是ESCs向心肌细胞分化的启动因子[24]。此外,如TGF-b、BMP、Wnt家族蛋白、FGF等心肌发生相关因子可以促进ESCs分化为心肌细胞,提高心肌细胞的分化效率[25,26]。有发现Notch 受体的上调可抑制小鼠ESCs 的心肌分化,而下调则能提高心肌细胞分化的效率[27]。②外源性心肌细胞基因组的加入可能也是导致杂交细胞向心肌细胞分化率提高的原因。③表观遗传修饰可以通过特定酶调节干细胞分化过程中特定基因的沉默或活化,并影响分化过程;DNA去甲基化和组蛋白乙酰化调节ESCs向心肌细胞分化的过程[28]。
研究表明,iPSCs向心肌细胞的分化过程中,伴随心肌骨架蛋白、肌联蛋白、α辅肌动蛋白、cTnT的表达[13],本试验检测到EBs中伴随心肌特异基因α-MHC和β-MHC mRNA及心肌特异性蛋白cTnT的表达,在基因及蛋白水平鉴定了杂交细胞分化而来的心肌细胞。本研究中,杂交细胞能够向心肌细胞分化,但由于我们检测方法所限,目前并不清楚这种分化是亲本心肌细胞重新表达(亲本心肌细胞基因被重编程或者去甲基化),还是杂交细胞完全转化为另外一种细胞。设想在心肌细胞引入外源性干细胞基因的的情况下,能否使心肌细胞内原本“表达沉默”的干细胞相关基因(Oct4、Nanog等)被激活并重新表达。在不丢失心肌细胞表型的同时,并获得增殖与分化能力。ESCs和成体细胞的杂交细胞的DNA甲基化分析结果表明,体细胞基因组被重编程到了ESCs状态[29]。因此,杂交细胞的表观遗传修饰是以后值得重点研究的内容。
由此可见,iPSCs与心肌细胞形成的杂交细胞表现为干细胞样的生长特点,仍具有分化全能性。杂交细胞能够向心肌细胞分化,在相同培养及诱导条件下,杂交细胞的心肌细胞分化效率高于iPSCs,分化心肌细胞中心肌细胞特异性基因和蛋白呈阳性表达。但杂交细胞失去心肌细胞特点,这种改变是亲本心肌细胞基因组被重编程,还是化学促融剂对心肌细胞生长造成的影响,尚不清楚,下一步的研究方向是采用不同促融方法诱导融合(如电融合法、离心振动法),检测杂交细胞的分子生物学功能。

