益心泰醇提物对阿霉素致慢性心力衰竭兔TGF-β1/Smad3信号通路相关因子表达的影响
雷洋,罗莉,郭志华,魏佳明,刘承鑫,龙云,唐云
益心泰醇提物对阿霉素致慢性心力衰竭兔TGF-β1/Smad3信号通路相关因子表达的影响
雷洋1,罗莉2,郭志华2,魏佳明2,刘承鑫2,龙云3,唐云3
1.湖南省中医药研究院文献信息研究所,湖南 长沙 410006;2.湖南中医药大学,湖南 长沙 410208;3.湖南中医药大学第一附属医院,湖南 长沙 410007
观察益心泰醇提物对阿霉素致慢性心力衰竭(CHF)兔TGF-β1/Smad3信号通路相关因子表达的影响,探讨其作用机制。采用阿霉素耳缘静脉注射建立CHF兔模型,将成模兔随机分为对照组、模型组、氯沙坦钾组(2.73 mg/kg)及益心泰醇提物低、中、高剂量组(1.77、3.54、7.08 g/kg),分别给予相应药物灌胃,模型组和对照组予等体积蒸馏水灌胃,1次/d,连续4周。超声心动仪检测兔左室射血分数(LVEF);ELISA检测兔血清N末端B型利钠肽原(NT-proBNP)、血管紧张素Ⅱ(AngⅡ)含量;TUNEL染色法检测兔心肌细胞凋亡率;Western blot检测兔心肌组织Bax、Bcl-2、转化生子因子β1(TGF-β1)、Smad3、Ⅰ型胶原(CollagenⅠ)、Ⅲ型胶原(CollagenⅢ)蛋白表达。与对照组比较,模型组兔LVEF明显降低(<0.01),血清NT-proBNP、AngⅡ含量明显增加(<0.01),心肌细胞凋亡率明显升高(<0.01),心肌组织Bax、TGF-β1、Smad3、CollagenⅠ、CollagenⅢ蛋白表达明显升高,Bcl-2蛋白表达明显降低(<0.01);与模型组比较,益心泰醇提物各剂量组兔LVEF明显升高(<0.05),血清NT-proBNP、AngⅡ含量明显减少(<0.05,<0.01),心肌细胞凋亡率明显降低(<0.05,<0.01),心肌组织Bax、TGF-β1、Smad3、CollagenⅠ、CollagenⅢ蛋白表达降低,Bcl-2蛋白表达升高,其中益心泰醇提物高剂量组差异有统计学意义(<0.05,<0.01)。益心泰醇提物可能通过调节TGF-β1/Smad3信号通路,改善兔心肌纤维化,抑制心肌细胞凋亡,从而发挥治疗CHF作用。
益心泰醇提物;慢性心力衰竭;心肌细胞凋亡;心肌纤维化;TGF-β1/Smad3;兔
慢性心力衰竭(chronic heart failure,CHF)是各种心脏疾病发展至终末期的临床综合征,其患病率、病死率逐年升高,严重威胁人类健康。心肌细胞异常凋亡是CHF的发病机制之一,因细胞过度死亡,可使心脏功能下降,最终导致CHF[1]。TGF-β1/Smad3信号通路与CHF心肌纤维化(myocardial fibrosis,MF)密切相关,可促进心肌成纤维细胞增殖、分化,刺激胶原纤维合成[2-3]。TGF-β1/Smad3信号通路除与MF密切相关外,还与细胞凋亡有关。Heger等[4]研究发现,转化生长因子(TGF)-β能促进大鼠心肌细胞凋亡。Dubash等[5]研究发现,当发生CHF时,TGF-β1水平明显升高,并可刺激心肌细胞凋亡。CHF属中医学“水肿”“胸痹”等范畴,为本虚标实之证,本课题组根据其病机研制益气活血利水方剂益心泰。前期研究表明,益心泰治疗CHF可能与TGF-β信号通路及细胞凋亡有关,且能明显降低CHF兔心肌组织TGF-β蛋白表达[6]。本研究以阿霉素致CHF兔为模型[7],观察益心泰醇提物对TGF-β1/Smad3信号通路的影响,探讨其治疗CHF的作用机制。
1 材料与方法
1.1 实验动物
健康成年新西兰大白兔,120只,体质量1.5~2.0 kg,由湖南中医药大学提供,动物合格证号4308300000677,饲养于温度18~25 ℃、相对湿度55%~70%环境。本实验经湖南中医药大学动物实验伦理委员会审批(LL2018010801)。
1.2 药物及制备
益心泰由黄芪、丹参、红花、泽泻、猪苓按照3∶1.5∶1∶1∶1比例组成,饮片购自湖南中医药大学第一附属医院,加热回流提取2次,第一次加8倍量70%乙醇提取120 min,第二次加6倍量70%乙醇提取90 min,过滤,合并提取液,减压浓缩,105 ℃真空干燥3 h,制成含原药材3.67 g/g醇提物干粉,加蒸馏水溶解,配制成浓度分别为0.177、0.354、0.708 g/mL药液。注射用盐酸多柔比星(主要成分为盐酸阿霉素),湖北麦凯斯精化科技有限责任公司,批号130509-201603,生理盐水溶解,配制成浓度为1 mg/mL溶液。氯沙坦钾片,杭州默沙东制药有限公司,批号20171020,蒸馏水配制成0.273 mg/mL悬浊液。
1.3 主要试剂与仪器
N末端B型利钠肽原(NT-proBNP)ELISA检测试剂盒,上海酶联生物科技有限公司,货号ml027326;血管紧张素Ⅱ(AngⅡ)ELISA检测试剂盒,上海酶联生物科技有限公司,货号ml027730;GAPDH抗体,上海振誉生物科技有限公司,货号bs-075R-1;Bax抗体,美国CST,货号2772;Bcl-2抗体,美国CST,货号2762;TGF-β1抗体,英国Abcam,货号ab92486;Smad3抗体,英国Abcam,货号ab40854;CollagenⅠ抗体,上海博研生物科技有限公司,货号BYK-0578R;CollagenⅢ抗体,上海彩佑实业有限公司,货号ys-7322R;羊抗兔二抗,美国Thermo Fisher,货号G-21234;羊抗鼠二抗,美国Thermo Fisher,货号G-21040;TUNEL凋亡检测试剂盒,德国Merck,货号QIA33;抗荧光衰减封片剂(含DAPI),北京索莱宝科技有限公司,货号S2110;SlowFadTMGold Antifade Mountant,美国Thermo Fisher,货号S36936。Sequoia 512超声心动仪(德国西门子),MK3酶标仪(美国Thermo),DYY-7C型电泳仪(北京市六一仪器厂),SYSTEM GelDoc XR+凝胶成像系统(美国Bio-Rad),iQ5实时荧光定量PCR仪(美国Bio-Rad)。
1.4 造模、分组及给药
随机选取20只兔作为对照组,其余100只为造模组,耳缘静脉局部皮肤消毒后,注射阿霉素注射液(1 mg/kg),2次/d,连续8周。检测兔左室射血分数(LVEF)及血清NT-proBNP含量。LVEF显著降低(<0.01)、血清NT-proBNP含量显著增加(<0.01),提示造模成功。将90只成模兔(10只因腹泻死亡)随机分为模型组、氯沙坦组和益心泰醇提物低、中、高剂量组,每组18只。根据成人体表面积换算法[8],氯沙坦钾组予2.73 mg/kg氯沙坦钾悬浊液灌胃,益心泰醇提物低、中、高剂量组分别予1.77、3.54、7.08 g/kg益心泰药液灌胃,灌胃体积10 mL/kg,模型组和对照组予等体积蒸馏水,1次/d,连续4周。给药过程中,模型组兔死亡2只、益心泰醇提物低、中、高剂量组分别死亡1、2、1只,最终对照组、模型组、氯沙坦钾组和益心泰醇提物低、中、高剂量组兔分别为20、16、18、17、16、17只。
1.5 检测指标及方法
1.5.1 左室射血分数
给药结束后水合氯醛腹腔注射麻醉兔,进行心脏触诊,确定心尖搏动处,硫化钠脱毛暴露心前区,超声心动仪检测兔LVEF,测量3次,取平均值。
1.5.2 血清N末端B型利钠肽原、血管紧张素Ⅱ含量
给药结束后水合氯醛腹腔注射麻醉兔,腹主动脉采血,ELISA检测兔血清NT-proBNP、AngⅡ含量,严格按试剂盒说明书进行操作。
1.5.3 心肌细胞凋亡率
给药结束后水合氯醛腹腔注射麻醉兔,取心肌组织,常规固定,石蜡包埋,切片,TUNEL凋亡检测试剂盒检测心肌细胞凋亡率。荧光显微镜下观察并拍照,以细胞核被染成红色(细胞凋亡)为阳性结果,计算细胞凋亡率。细胞凋亡率(%)=凋亡细胞核÷总细胞核×100%。
1.5.4 心肌组织Bax、Bcl-2、转化生长因子-β1、Smad3、Ⅰ型胶原、Ⅲ型胶原蛋白表达
取心肌组织提取总蛋白,BCA法测定蛋白浓度,等量蛋白上样,60 V电泳至蛋白到达浓缩胶与分离胶分界处,将电压调整为100 V,电泳至蛋白到达分离胶底部,转膜,封闭,加入稀释的Bax(1∶1 000)、Bcl-2(1∶1 000)、TGF-β1(1∶1 000)、Smad3(1∶1 000)、CollagenⅠ(1∶1 000)、CollagenⅢ(1∶1 000)、GAPDH(1∶10 000)一抗,4 ℃孵育过夜;加二抗(1∶3 000)室温孵育45 min,Quantity One图像分析系统分析蛋白条带灰度值。以GAPDH为内参,计算各目的蛋白与GAPDH灰度值的比值。
1.6 统计学方法
2 结果
2.1 益心泰醇提物对模型兔左室射血分数的影响
与对照组比较,模型组兔LVEF显著降低(<0.01);与模型组比较,益心泰醇提物低、中、高剂量组和氯沙坦钾组兔LVEF明显升高,差异有统计学意义(<0.05)。见表1。

表1 各组兔LVEF比较(±s,%)
注:与对照组比较,##<0.01;与模型组比较,*<0.05
2.2 益心泰醇提物对模型兔血清N末端B型利钠肽原、血管紧张素Ⅱ含量的影响
与对照组比较,模型组兔血清NT-proBNP、AngⅡ含量明显增加(<0.01);与模型组比较,益心泰醇提物低、中、高剂量组和氯沙坦钾组兔血清NT-proBNP、AngⅡ含量明显减少(<0.05,<0.01)。见表2。

表2 各组兔血清NT-proBNP、AngⅡ含量比较(±s,pg/mL)
注:与对照组比较,##<0.01;与模型组比较,*<0.05,**<0.01
2.3 益心泰醇提物对模型兔心肌细胞凋亡率的影响
与对照组比较,模型组兔心肌细胞凋亡率明显升高(<0.01);与模型组比较,益心泰醇提物低、中、高剂量组和氯沙坦钾组兔心肌细胞凋亡率明显降低,差异有统计学意义(<0.05,<0.01)。见表3、图1。
2.4 益心泰醇提物对模型兔心肌组织Bax、Bcl-2、转化生长因子-β1、Smad3、Ⅰ型胶原、Ⅲ型胶原蛋白表达的影响
与对照组比较,模型组兔心肌组织Bax、TGF-β1、Smad3、CollagenⅠ、CollagenⅢ蛋白表达升高,Bcl-2蛋白表达明显降低(<0.01);与模型组比较,益心泰醇提物低、中、高剂量组和氯沙坦钾组兔心肌组织Bax、TGF-β1、Smad3、CollagenⅠ、CollagenⅢ蛋白表达降低,Bcl-2蛋白表达升高,除益心泰醇提物低剂量组CollagenⅠ、CollagenⅢ和益心泰醇提物中剂量组CollagenⅢ外,差异均有统计学意义(<0.05,<0.01)。见表4、图2。

表3 各组兔心肌细胞凋亡率比较(±s,%)
注:与对照组比较,##<0.01;与模型组比较,*<0.05,**<0.01
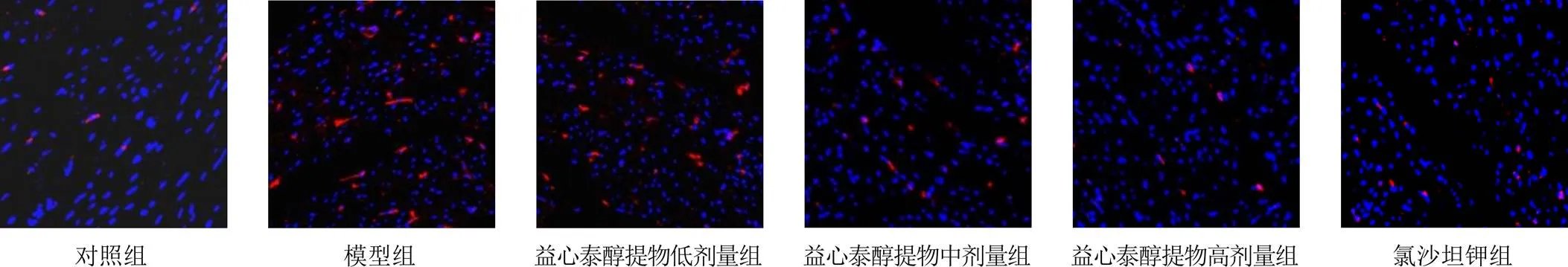
图1 各组兔心肌细胞凋亡阳性表达(TUNEL染色,×400)

表4 各组兔心肌组织Bax、Bcl-2、TGF-β1、Smad3、CollagenⅠ、CollagenⅢ蛋白表达比较(±s)
注:与对照组比较,##<0.01;与模型组比较,*<0.05,**<0.01

注:A.对照组;B.模型组;C.益心泰醇提物低剂量组;D.益心泰醇提物中剂量组;E.益心泰醇提物高剂量组;F.氯沙坦钾组
3 讨论
MF是CHF的主要病理机制,而TGF-β1/Smad3信号通路与MF密切相关。TGF-β有多种亚型,其中在心脏主要是TGF-β1亚型。TGF-β1是调控MF的关键细胞因子,在AngⅡ等刺激下,通过其下游信号分子Smad3进入细胞核发挥转录调控作用,使MF的主要效应细胞心肌成纤维细胞分化为肌成纤维细胞,从而介导CollagenⅠ、CollagenⅢ等细胞外基质合成增加[9]。AngⅡ通过作用于AngⅡ受体1(AT1)收缩血管、损伤内皮功能,导致血管重构而致MF,现已被用于诱导MF模型[10]。心肌胶原纤维蛋白主要由CollagenⅠ和CollagenⅢ组成,二者大量沉积可使纤维化疤痕形成,促使MF发生发展[11]。故AngⅡ、CollagenⅠ、CollagenⅢ是反映MF的重要指标。氯沙坦钾作为一种AT1受体拮抗剂,可通过调节心肌组织TGF-β1/Smads信号通路相关蛋白表达发挥抑制MF作用[12]。
细胞凋亡是机体自身的防御机制,早期可清除体内明显受损的细胞,后期因细胞过度死亡,导致细胞功能障碍。CHF的发生与细胞凋亡密切相关[13],TGF-β1/Smads信号通路除与MF有关,还参与CHF心肌细胞凋亡。当发生CHF时,TGF-β1/Smads信号通路激活,心肌细胞凋亡率及凋亡相关蛋白明显升高[14]。AngⅡ不仅可激活TGF-β1/Smad3信号通路,导致MF的发生发展,还可使血管收缩,导致心肌缺血而致心肌细胞凋亡[15]。而氯沙坦钾对AngⅡ具有明显拮抗作用,对AngⅡ诱导的凋亡有明显的抑制作用[16]。故本实验采用氯沙坦钾作为阳性对照组。
CHF发病机制复杂,同时伴有MF和心肌细胞凋亡的病理改变,且相互影响[17],但关于二者之间相互影响的具体机制目前研究较少。有研究表明,二者可能存在共同发病机制,如与炎症因子的过度表达有关[18]。本课题组研究认为,TGF-β1/Smads信号通路的激活与二者的发病机制密切相关。Bcl-2蛋白家族是介导细胞凋亡的重要调控因子,其中Bax、Bcl-2蛋白与细胞凋亡密切相关。本实验结果显示,与对照组比较,模型组兔LVEF降低,血清NT-proBNP、AngⅡ含量增加,心肌细胞凋亡率明显升高,心肌组织Bax、TGF-β1、Smad3、CollagenⅠ、CollagenⅢ蛋白表达升高,Bcl-2蛋白表达降低,提示CHF发生后,NT-proBNP、AngⅡ过度释放入血,TGF-β1/Smad3信号通路被激活,胶原蛋白合成增加,发生了MF病理改变,同时心肌细胞发生凋亡,从而导致心脏功能受损。与模型组比较,益心泰醇提物各剂量组与氯沙坦钾组兔LVEF升高,血清NT-proBNP、AngⅡ含量减少,心肌细胞凋亡率明显下降,心肌组织Bax、TGF-β1、Smad3、CollagenⅠ、CollagenⅢ蛋白表达降低,Bcl-2蛋白表达升高,提示益心泰和氯沙坦钾均可降低血清NT-proBNP、AngⅡ含量,抑制TGF-β1/ Smad3信号通路相关蛋白表达和胶原蛋白合成,改善MF和心肌细胞凋亡,保护心脏。
综上所述,益心泰醇提物通过抑制TGF-β1/ Smad3信号通路相关蛋白表达,降低CHF兔血清NT-proBNP、AngⅡ含量,提高LVEF,抑制胶原蛋白合成,改善MF和心肌细胞凋亡,保护心脏。
[1] BOEHM M, KOMAJDA M, BORER J S, et al. Duration of chronic heart failure affects outcomes with preserved effects of heart rate reduction with ivabradine:findings from SHIFT[J]. Eur J Heart Fail,2018,20(2):373-381.
[2] DIAO J, CHEN X, JIANG L, et al. Transforming growth factor-β1 suppress pentraxin-3 in human orbital fibroblasts[J]. Endocrine, 2020,70(1):78-84.
[3] MACIAS M J, MARTIN-MALPARTIDA P, MASSAGUE J. Structural determinants of Smad function in TGF-β signaling[J]. Trends in Biochemical Sciences,2015,40(6):296-308.
[4] HEGER J, WARGA B, MEYERING B, et al. TGFβ receptor activation enhances cardiac apoptosis via SMAD activation and concomitant NO release[J]. J Cell Physiol,2011,226(10):2683-2690.
[5] DUBASH A D, KAM C Y, AGUADO B A, et al. Plakophilin-2 loss promotes TGF-β1/p38 MAPK-dependent fibrotic gene expression in cardiomyocytes[J]. Journal of Cell Biology,2016,212(4):425-438.
[6] WEI J M, ZHU J P, ZHANG T Y, et al. Application of network pharmacology to explore the mechanism of Yi Xin Tai Formula in treating heart failure[J]. Digital Chinese Medicine,2019,2(4):237-256.
[7] 唐云,郭志华,李雅,等.益心泰颗粒对慢性心衰兔超声心动图指标及血清脑钠肽的影响[J].中成药,2015,37(7):1565-1567.
[8] 秦川.实验动物学[M].北京:人民卫生出版社,2010:420-421.
[9] 丛雯雯,冯晔囡,王帅星,等.PAX6抑制血管紧张素Ⅱ诱导的心脏成纤维细胞转分化[J].中国病理生理杂志,2021,37(1):27-33.
[10] 周文慧,汪波,夏圣.ISO和AngⅡ诱导小鼠心脏纤维化模型的表型及机制比较[J].中国细胞生物学学报,2020,42(1):110-117.
[11] 孙帅锋,刘巍.心肌纤维化病理机制及诊疗策略进展[J].国际心血管病杂志,2020,47(5):264-267.
[12] 程彦玲,谢世阳,王小晓,等.参附益心颗粒对心肌梗死后心力衰竭大鼠心肌纤维化的影响[J].中医杂志,2020,61(1):68-73.
[13] FARAH M, GULNARA A, ARZU D. Markers of apoptosis and oxidative stress in congestive heart failure[J]. The Moldovan Medical Journal,2017,60(1):22-25.
[14] 牛欢,陈曼丽,杨波,等.基于TGF-β1/Smad3 信号通路观察促血小板生成素对阿霉素致心力衰竭大鼠心肌细胞凋亡的影响[J].中国比较医学杂志,2020,30(3):63-70.
[15] 王新陆,崔琳,王幼平,等.基于AngⅡ诱导心肌细胞凋亡探讨中医药在离体实验中的研究方法[J].中华中医药杂志,2017,32(10):4699- 4704.
[16] ZHAO H Y, QI G H, HAN Y, et al. 20-Hydroxyeicosatetraenoic acid is a key mediator of angiotensin Ⅱ-induced apoptosis in cardiac myocytes[J]. Journal of Cardiovascular Pharmacology,2015,66(1):86-95.
[17] 魏玲,李慧萍,魏伟,等.慢性心衰大鼠心肌细胞凋亡、心肌纤维化及其相关性研究[J].西南国防医药,2018,28(1):35-38.
[18] 卢小伟,马珍珍.心力衰竭大鼠心肌细胞凋亡与心肌纤维化的相关性[J].中西医结合心脑血管病杂志,2020,18(14):2238-2241.
Effects ofAlcohol Extract on Expressions of TGF-β1/Smad3 Signaling Pathway Related Factors in Rabbits with Adriamycin-induced Chronic Heart Failure
LEI Yang1, LUO Li2, GUO Zhihua2, WEI Jiaming2, LIU Chengxin2, LONG Yun3, TANG Yun3
To explore the effects ofalcohol extract on expressions of TGF-β1/Smad3 signaling pathway related factors in rabbits with adriamycin-induced chronic heart failure (CHF); To discuss its mechanism of action.A rabbit model of CHF was established by intravenous injection of doxorubicin in the ear. The successful CHF model of rabbits were randomly divided into control group, model group, losartan group (2.73 mg/kg) andalcohol extract low-, medium-, high-dosagegroup (1.77, 3.54, 7.08 g/kg). The corresponding drugs were given by gavage, and the model group and the control group were given an equal volume of distilled water by gavage, once a day, for 4 consecutive weeks. Echocardiography was used to detect the LVEF; ELISA was used to detect the contents of NT-proBNP and Ang Ⅱ in serum; TUNEL staining was used to detect cardiomyocyte apoptosis; Western blot was used to detect proteins expression of Bax , Bcl-2 , TGF-β1, Smad3, Collagen Ⅰ and Collagen Ⅲ in myocardial tissue.Compared with the control group, the LVEF in the model group decreased (<0.01); the contents of NT-proBNP and Ang Ⅱ in serum increased (<0.01); the apoptosis rate of cardiomyocyte increased (<0.01); the proteins expression of Bax, TGF-β1, Smad3, Collagen Ⅰ and Collagen Ⅲ in myocardial tissue increased, while the protein expression of Bcl-2 decreased (<0.01). Compared with the model group, the LVEF in each dosage ofalcohol extract group increased (<0.05); the contents of NT-proBNP and Ang Ⅱ in serum reduced (<0.05,<0.01); the apoptosis rate of cardiomyocyte was significantly decreased (<0.05,<0.01); the proteins expression of Bax, TGF-β1, Smad3, Collagen Ⅰ and Collagen Ⅲ in myocardial tissue decreased, while the protein expression of Bcl-2 increased, and the difference inalcohol extract high-dosage group was stastically significant (<0.05,<0.01).alcohol extract could improve rabbit myocardial fibrosis and inhibit myocardial cell apoptosis by regulating the TGF-β1/Smad3 signaling pathway, so as to play a role in treating CHF.
alcohol extract; chronic heart failure; cardiomyocyte apoptosis; myocardial fibrosis; TGF-β1/Smad3; rabbits
R285.5
A
1005-5304(2021)12-0045-05
10.19879/j.cnki.1005-5304.202104257

国家自然科学基金(81673955);重大疑难疾病慢性心力衰竭中西医临床协作试点项目(2018年);湖南省卫生计生科研计划项目(20200592、C20180710);湖南中医药大学中医学国内一流建设学科(2018年);湖南省科技计划项目(2018JJ2304);湖南省中医药科研计划项目(2021064)
唐云,E-mail:tangyun109@163.com
(2021-04-14)
(修回日期:2021-05-07;编辑:郑宏)

