3种提取方法对郁金散有效成分提取效果的比较
薛 姣,文艳巧,董嘉琪,张旺东,张亚辉,肖 桐,曹玉霞,姚万玲,魏彦明
(甘肃农业大学动物医学院,甘肃兰州 730070)
郁金散出自明代喻本元和喻本亨的《元亨疗马集》,由郁金、诃子、黄芩、大黄、黄连、栀子、白芍、黄柏8味药组成[1]。郁金散具有清热解毒、散淤止泻的功效,临床主治马、牛、犬等的肠黄证,肠黄是湿热侵入肠道、阻滞气血,以致大肠传导失常,有脱水、腹痛、频繁排腥臭稀便甚至便血等症状[2],导致大肠出现炎性细胞浸润,大肠黏膜充血、糜烂甚至脱落等病理变化[3]。现代药理学研究表明,郁金散复方中的姜黄素、诃子酸、没食子酸、大黄素、黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、栀子苷、芍药苷、小檗碱和黄连碱等,均有抗炎、抗氧化的作用[4-5];大黄酚可抑制血管收缩、促进血液凝固[6-7];姜黄素、诃子酸、没食子酸、汉黄芩苷、小檗碱、黄连碱对小鼠的胃肠黏膜具有一定程度的保护作用[8-11]。因此,以上13种有效成分为治疗肠黄证的主要有效成分,故本试验选取上述13种成分作为评价提取郁金散方法的主要指标成分。
郁金散在临床上应用主要是散剂和水煎剂,其中水煎剂服用量大,且某些药物的有效成分不易煎出、易挥发、不适宜大规模生产、不利于保存等;散剂适口性差,药材不易辨认、药物挥发性成分易散失、操作工作量大、制作程序繁琐[11],因此对郁金散进行剂型改造非常有必要,如可将郁金散制成颗粒剂等。而颗粒剂需要以提取物作为原料,所以要制成郁金散颗粒剂首先要对郁金散进行提取[11]。目前对郁金散复方提取工艺的研究较少,随着中药提取方法的发展,超声辅助乙醇回流提取法为近年来应用较多且提取效率较高的一种中药提取方法,如尤思路等[12]比较了超声辅助-乙醇回流提取法与简单超声法提取小檗碱,证明小檗碱的最佳提取方法为超声辅助-乙醇回流提取法;李学玲等[13]采用水煎法、乙醇热回流法和乙醇超声提取法分别来提取牛蒡各部位绿原酸,并筛选出最佳提取工艺为乙醇超声提取法;罗傲雪等[14]研究不同提取方法对石斛多糖含量的影响,证明了超声辅助热回流提取法效果最佳。
本试验对郁金散进行了超声辅助-乙醇回流法、超声辅助-水回流法和水煎煮法3种方法的提取,并以HPLC法测定姜黄素、没食子酸、诃子酸、栀子苷、芍药苷、黄连碱、小檗碱、黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、大黄素、大黄酚的含量和干浸膏得率为衡量指标,对3种提取方法进行比较,以期为郁金散提取工艺的筛选提供参考,且为改变郁金散的剂型、开发郁金散的新药提供依据。
1 材料与方法
1.1 材料
1.1.1 试验药物 郁金散醇提物干浸膏、郁金散水提物干浸膏、水煎剂干浸膏均经甘肃农业大学动物医学院中兽医实验室制备。醇提物用超声辅助-乙醇回流法优化制得;水提物用超声辅助-水回流法制得,所用条件除提取溶剂外其他均与超声辅助-乙醇回流法一致;水煎剂的制备方法参考实验室以前的方法[15]。
1.1.2 主要试剂 姜黄素(批号:JHS060519,CAS号:458-37-7,质量分数:98%)、没食子酸(批号:YZ071519,CAS号:149-91-7,质量分数:98%)、诃子酸(批号:YZ1218211,CAS号:18942-26-2,质量分数:98%)、栀子苷(批号:YZ031221,CAS号:24512-63-8,质量分数:98%)、芍药苷(批号:YZ060421,CAS号:23180-57-6,质量分数:98%)、盐酸黄连碱(批号:YZ0310221,CAS号:6020-18-4,质量分数:98%)、盐酸小檗碱(批号:YZ110920,CAS号:2086-83-1,质量分数:98%)、黄芩苷(批号:YZ091420,CAS号:21967-41-9,质量分数:98%)、黄芩素(批号:YZ052421,CAS号:491-67-8,质量分数:98%)、汉黄芩苷(批号:YZ171009,CAS号:51059-44-0,质量分数:98%)、汉黄芩素(批号:YZ161221,CAS号:质量分数:98%)、大黄素(批号:YZDHF081020,CAS号:518-82-1,质量分数:98%)、大黄酚(批号:YZDHF081020,CAS号:481-74-3,质量分数:98%),均为南京源植生物科技有限公司产品;甲醇(色谱纯),美国Sigma-Aldrich公司产品;纯净水,娃哈哈股份有限公司产品。
1.1.3 主要仪器 Agilent 1260 Infinity 高效液相色谱仪,美国Agilent公司产品;THC-5B型超声波提取器,济宁天华超声电子仪器有限公司产品;RE-6000型旋转蒸发仪,上海亚荣生化仪器厂产品;YP2002N电子天平,上海精密科学仪器有限责任公司产品;FD-1A-5D型真空冷冻干燥仪,北京博医康仪器产品。
1.2 方法
1.2.1 色谱条件 色谱柱为ZORBAX SB-C18(250 mm×4.6 mm,5 μm);体积流量1.0 mL/min;柱温30 ℃;进样量20 μL;其中没食子酸、诃子酸、栀子苷、芍药苷、盐酸黄连碱、盐酸小檗碱、黄芩苷、黄芩素、汉黄芩苷、汉黄芩素10种成分的流动相1为乙腈-1 mL/L磷酸、检测波长为250 nm、梯度洗脱(1 min~2 min,95%~85%磷酸;2 min~13 min,85%~80%磷酸;13 min~20 min,80%~62%磷酸;20 min~30 min,62%~52%磷酸;30 min~35 min,52%~41%磷酸);姜黄素、大黄素、大黄酚这3种成分的流动相2为乙腈-100 mL/L冰醋酸;检测波长为425 nm;梯度洗脱(1 min~2 min,95%~85%冰醋酸;2 min~10 min,85%~70%冰醋酸;10 min~30 min,70%~40%冰醋酸;30 min~40 min,40%~40%冰醋酸)。
1.2.2 流动相1的制备 取磷酸1 mL,缓缓注入到纯净水中,待冷却至室温,加纯净水定容至1 000 mL,过滤膜,超声35 min,配制成乙腈-1 mL/L磷酸的流动相溶液1。
1.2.3 流动相2的制备 取冰醋酸100 mL,缓缓注入到纯净水中,待冷却至室温,加纯净水定容至1 000 mL,过滤膜,超声35 min,配制成乙腈-100 mL/L冰醋酸的流动相溶液2。
1.2.4 对照品贮备液制备 分别精密称取对照品姜黄素2.52 mg、没食子酸7.6 mg,诃子酸5 mg、栀子苷4.2 mg、芍药苷10 mg、黄连碱3 mg、盐酸小檗碱7 mg、黄芩苷5 mg、黄芩素2.5 mg、汉黄芩苷4 mg、汉黄芩素5.7 mg、大黄素7.8 mg、大黄酚4.8 mg,置10 mL容量瓶中,用700 mL/L甲醇溶解,超声2 min,配制成对照品贮备液。
1.2.5 混合对照液1的制备 分别精密吸取上述对照品贮备液,没食子酸1.8 mL、诃子酸2.8 mL、栀子苷6 mL、芍药苷4 mL、黄连碱1 mL、盐酸小檗碱1.3 mL、黄芩苷5 mL、黄芩素1 mL、汉黄芩苷1 mL、汉黄芩素1 mL,置25 mL容量瓶中,用700 mL/L甲醇精密定容,配制成各对照品母液1。
1.2.6 混合对照液2的制备 分别精密吸取上述对照品贮备液,姜黄素20 μL、大黄素10 mL、大黄酚3 mL,置25 mL容量瓶中,用700 mL/L甲醇精密定容,配制成各对照品母液2。
1.2.7 供试液的制备 分别取“1.1.1”中郁金散醇提物干浸膏、水提物干浸膏、水煎剂干浸膏0.1 g,置10 mL容量瓶中,用700 mL/L甲醇溶解,精密称定,超声溶解2 min后待冷却,用700 mL/L甲醇补足缺失的量,然后微孔滤膜(0.22 μm)过滤,待测,做3组平行试验。
1.2.8 方法学考察
1.2.8.1 检测波长的选择 在200 nm~480 nm波长范围内,分别对混合对照液1和混合对照液2进行紫外全波长扫描,确定其最大吸收波长。
1.2.8.2 系统适应性试验 按照“1.2.1”项的色谱条件,分别吸取混合对照品溶液和供试品溶液各20 μL,进样,测定各成分的峰面积。
1.2.8.3 混合对照液1的线性关系 分别精密吸取“1.2.5”项下混合对照液1,制成不同浓度的混合对照品溶液1,按“1.2.1”色谱条件依法测定,以浓度(x,μg/mL)对峰面积(y)进行线性回归。
1.2.8.4 混合对照液2的线性关系 分别精密吸取“1.2.6”项下混合对照液2,制成不同浓度的混合对照品溶液2,按“1.2.1”项的色谱条件依次测定,以浓度(x,μg/mL)对峰面积(y)进行线性回归。
1.2.8.5 精密度试验 取混合对照品溶液1和2,按“1.2.1”项的色谱条件,连续进样5次,记录峰面积,分别计算没食子酸、栀子苷、芍药苷、诃子酸、黄连碱、黄芩苷、小檗碱、汉黄芩苷、黄芩素、汉黄芩素、大黄素、大黄酚、姜黄素,这13种成分对应峰面积的RSD值。
1.2.8.6 稳定性试验 取同一份供试品溶液,分别在配置后0、2、4、8、12、24 h按“1.2.1”色谱条件依次进行检测,记录峰面积,计算没食子酸、栀子苷、芍药苷、诃子酸、黄连碱、黄芩苷、小檗碱、汉黄芩苷、黄芩素、汉黄芩素、大黄素、大黄酚、姜黄素13种成分峰面积的RSD值。
1.2.8.7 重复性试验 同时制备5份供试品溶液,按“1.2.1”项下色谱条件依次进行测定,记录13种成分峰面积,计算没食子酸、栀子苷、芍药苷、诃子酸、黄连碱、黄芩苷、小檗碱、汉黄芩苷、黄芩素、汉黄芩素、大黄素、大黄酚、姜黄素13种成分峰面积的RSD值。
1.2.8.8 加样回收率试验 取1份已知含量的供试品,每份称取0.1 g,置10 mL容量瓶中,精密称定,共称取9份,分为3组,每组3份,分别为低、中、高浓度,分别精密加入0.5、1、1.5 mL混合对照品,摇匀,取20 μL,按“1.2.1”项下色谱条件依次进行测定,记录峰面积,计算没食子酸、栀子苷、芍药苷、诃子酸、黄连碱、黄芩苷、小檗碱、汉黄芩苷、黄芩素、汉黄芩素、大黄素、大黄酚、姜黄素13种成分的平均回收率。
1.2.8.9 含量测定 计算3种提取物的干浸膏得率,并按照“1.2.1”项下色谱条件,分别吸取超声辅助-乙醇回流提取物、超声辅助-水回流提取物、水煎剂供试液各20 μL,进样,根据各自的标曲测定各成分含量,每种提取物的各成分均做3次平行试验。
1.2.8.10 统计分析 3种郁金散提取物中的13种有效成分含量、总干浸膏得率及各成分含量之和占各自提取物的百分比数据用平均值±标准差的形式来表示,所用统计分析软件为SPSS 26.0 (SPSS Inc.,Chicago,USA),用单因素方差分析法分析统计每种成分3种提取方法之间的差异显著性,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 检测波长的选择
在200 nm~480 nm波长范围内,分别对混合对照液1和2进行紫外全波长扫描,结果显示没食子酸、诃子酸、栀子苷、芍药苷、盐酸黄连碱、盐酸小檗碱、黄芩苷、黄芩素、汉黄芩苷、汉黄芩素在250 nm左右有最大吸收峰,姜黄素、大黄素、大黄酚在425 nm有最大吸收峰。
2.2 系统适应性试验
分别吸取混合对照品溶液和供试品溶液,各20 μL进样,测定各成分的峰面积,结果见图1,混合对照品溶液1和2中各成分对应色谱峰分离良好,基线平稳且各对照品峰与供试品峰时间对应良好。
2.3 线性关系考察
不同浓度的混合对照品溶液1和2,按“1.2.1”色谱条件依次测定,以浓度(x,μg/mL)对峰面积(y)进行线性回归,结果见表1,各成分的线性关系良好。
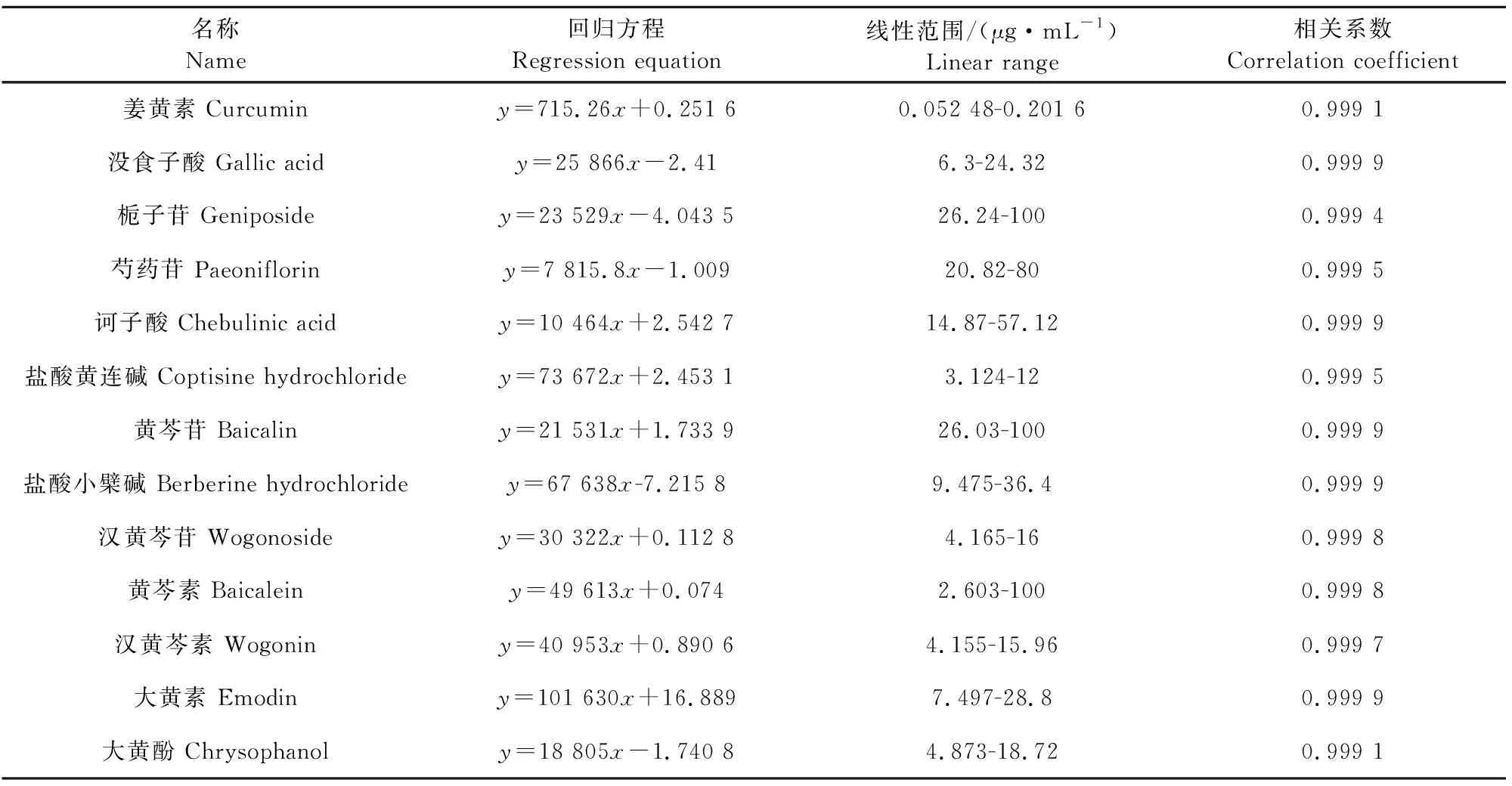
表1 郁金散中13种成分的回归方程、线性范围及相关系数

混合对照品1(A)、混合对照品2(B)、醇提物250 nm(C)、水提物250 nm(D)、水煎剂250 mm(E)、醇提物425 nm(F)、水提物425 nm(G)、水煎剂425 nm(H)的HPLC图;1-没食子酸、2-栀子苷、3-芍药苷、4-诃子酸.5-黄连碱、6-黄芩苷、7-盐酸小嬖碱、8-汉黄岑苷、9-黄苓素、10-汉黄芩素、11-姜黄素、12-大黄素、13-大黄酚
2.4 精密度试验
没食子酸、栀子苷、芍药苷、诃子酸、黄连碱、黄芩苷、小檗碱、汉黄芩苷、黄芩素、汉黄芩素、大黄素、大黄酚、姜黄素,这13种成分对应峰面积的RSD值分别为0.70%、0.65%、0.70%、0.36%、0.74%、0.57%、0.46%、0.81%、0.72%、0.63%、0.60%、0.73%、0.67%,均小于2%,说明该检测方法精密度良好。
2.5 稳定性试验
没食子酸、栀子苷、芍药苷、诃子酸、黄连碱、黄芩苷、小檗碱、汉黄芩苷、黄芩素、汉黄芩素、大黄素、大黄酚、姜黄素13种成分峰面积的RSD分别为0.94%、0.35%、0.58%、0.6%、0.43%、0.86%、0.93%、0.89%、0.74%、0.92%、0.48%、0.34%、0.63%,均小于2%,表明供试品溶液在24 h内稳定。
2.6 重复性试验
没食子酸、栀子苷、芍药苷、诃子酸、黄连碱、黄芩苷、小檗碱、汉黄芩苷、黄芩素、汉黄芩素、大黄素、大黄酚、姜黄素13种成分峰面积的RSD分别为0.60%、0.65%、0.79%、0.26%、0.84%、0.57%、0.41%、0.88%、0.72%、0.63%、0.61%、0.75%、0.65%,均小于2%,说明结果重复性良好。
2.7 加样回收率试验
没食子酸、栀子苷、芍药苷、诃子酸、黄连碱、黄芩苷、小檗碱、汉黄芩苷、黄芩素、汉黄芩素、大黄素、大黄酚、姜黄素13种成分的平均回收率分别为95.77%、92.6%、96.95%、99.42%、98.58%、99.1%、93.88%、95.3%、94.2%、96.44%、98.1%、93.86%、96.85%,相应峰面积的RSD值分别为0.82%、0.4%、0.37%、0.38%、0.43%、0.28%、0.06%、0.31%、0.81%、0.14%、0.77%、0.61%、0.61%,均小于2%,表明准确度良好,符合试验要求。
2.8 含量比较
由图1可知,此条件下,分离度均大于1.5,各个峰分离程度好,每种成分均清晰容易分辨,且每种成分的峰高均为超声辅助-乙醇回流提取物>水煎剂>超声辅助-水回流提取物;表2所示,超声辅助-水回流和乙醇回流及水煎煮3种郁金散提取物的干浸膏得率分别为20.10%、31.39%、21.13%,其13种有效成分之和占各自干浸膏的比例分别为30.947%、83.141%、46.69%,每种成分的含量均为超声辅助-乙醇回流提取物>水煎煮提取物>超声辅助-水回流提取物,差异均极显著(P<0.01)。
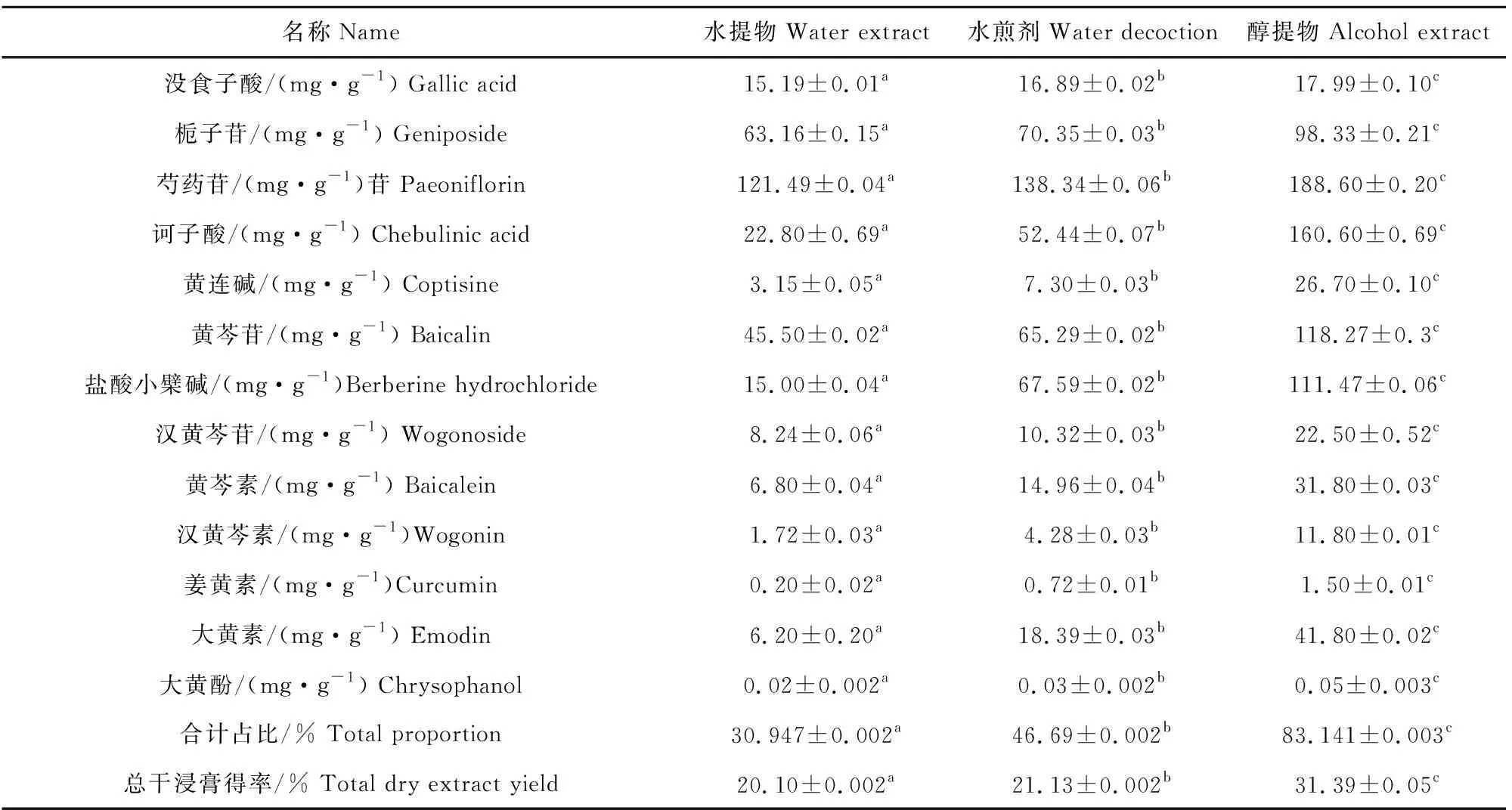
表2 3种郁金散提取物中13种有效成分的含量及总干浸膏得率
3 讨论
3.1 HPLC检测方法的建立
在HPLC检测郁金散3种提取物中13种有效成分含量的方法建立中,首先对洗脱梯度、标品及样品的溶解度、各种成分的流动相、检测波长等进行了探索,然后进行了系统适应性试验、线性关系考察、精密度试验、稳定性试验、重复性试验、加样回收率试验。
经查阅文献可得,大黄素、大黄酚、栀子苷等标品及样品均可采用700 mL/L的甲醇溶解样品[16-18],又经前期试验摸索,3种提取物和13种标准品在500、600、700、800、900、1 000 mL/L的甲醇中溶解度均良好,但由于HPLC检测,采用700 mL/L的甲醇溶解的样品与标准品的色谱峰更清晰、分离程度更好,所以本试验最终采用700 mL/L的甲醇溶解样品及标品;姜黄素、大黄素可采用乙腈-冰醋酸流动相[4,19],没食子酸[20]、诃子酸[20]、栀子苷[21]、芍药苷[22]、黄连碱[23]、盐酸小檗碱[24,25]、黄芩苷[24]、黄芩素、汉黄芩苷、汉黄芩素[26]均可采用乙腈-磷酸流动相,经前期试验摸索,1、2、4、6、10 mL/L的磷酸及98、100 mL/L的冰醋酸中,采用乙腈-1 mg/mL的磷酸及乙腈-10 mL/L的冰醋酸流动相的色谱峰更清晰,最终决定采用乙腈-1 mL/L的磷酸和乙腈-100 mL/L的冰醋酸流动相;没食子酸、栀子苷、芍药苷、诃子酸、黄连碱、黄芩苷、小檗碱、汉黄芩苷、黄芩素、汉黄芩素10种成分的波长有230 nm[26]、240 nm[27]、254 nm[28]、270 nm[29]、275 nm[30];大黄素、大黄酚、姜黄素3种成分的波长有420 nm[31]、425 nm[4,32]。所以,本试验在200 nm~480 nm波长范围内经全波长扫射,最终确定了最佳波长为250 nm、425 nm。通过查阅中国药典可知,为了判断相邻成分的分离情况,引入分离度R作为色谱柱的分离效能指标,分离度R等于相邻色谱峰保留时间之差与两色谱峰峰宽均值之比, R值越大,表明相邻两组峰分离越好,R>1.5说明峰与峰之间分离良好[33]。本试验中相邻最紧密两峰的R均大于1.5,说明本试验建立的高效液相色谱法检测方法准确,可行。
3.2 3种提取方法提取物中13种有效成分含量的比较
本试验结果表明,郁金散经超声辅助-乙醇回流、超声辅助-水回流和水煎煮法提取后,总的干浸膏得率和13种有效成分的含量均为超声辅助-乙醇回流提取物>水煎剂>超声辅助-水回流提取物,两者比较结果一致。因此,超声辅助-乙醇回流提取法效果最好,这可能由于一些有效成分易溶于有机溶剂,难溶于水,如姜黄素、黄芩素等黄酮类;小檗碱等生物碱类;栀子苷等环烯醚萜类物质,大黄素、大黄酚等蒽醌类;芍药苷等糖苷类,所以乙醇溶液提取会使醇溶和水溶的成分均可溶出,故提取率提高[34-36]。另外,超声波的空化、搅拌作用,可缩短提取时间,节约溶剂,还可增强乙醇溶液的穿透力,从而加速郁金散中的有效成分进入溶剂,可极大地提高提取率,同时避免高温对有效成分的影响[37]。而水煎剂的煎煮时间略长,且在高温条件和水的滚动作用下能使有效成分加速溶出,但由于一些成分对水的溶解度低和(或)受高温的影响有些成分被破坏,所以水煎剂提取法次之[38]。由于超声辅助-水回流提取法和水煎煮法相比提取温度不够高,与超声辅助-醇回流提取法相比水作为溶剂不能使有效成分更好地溶出,所以超声辅助-水回流提取法的提取率最低。
综上所述,本试验中所建立的HPLC法检测郁金散3种提取方法提取物中13种有效成分含量的方法稳定、高效、可行。3种提取方法中,超声辅助-乙醇回流提取方法对郁金散的提取效果最佳,对提高郁金散的利用率具有重要的意义,为郁金散新剂型的开发奠定了基础。

