血清7型副猪嗜血杆菌的分离鉴定及生物学特性研究
陶伟杰,段笑笑,赵 辉,刘佳卉,赵远,单 虎,张传美*
(1.青岛农业大学动物医学院,山东青岛 266109;2.青岛市动物疫病预防控制中心,山东青岛 266000;3.齐鲁动物保健品有限公司,山东济南 250100)
副猪嗜血杆菌(Haemophilusparasuis,HPS)属于巴斯德菌科嗜血杆菌属,是一种革兰氏阴性、具有多种不同形态的条件性致病菌,会引起纤维素性多发性浆膜炎、关节炎、脑膜炎、 心包炎为主要病理特征的格拉泽氏病(Glasser’s disease),主要引起2周龄到16周龄的猪发病。研究表明,副猪嗜血杆菌最易感染断奶仔猪,其次是育肥猪和母猪[1]。副猪嗜血杆菌有15个以上的血清型,各血清型之间的致病力存在很大差异,其中血清1型、5型、10型、12型、13型和14型具有高致病性,2型、4型、15型有中等毒力,8型为弱毒力型,3型、4型、7型、9型、11型被认为没有毒力[2-3],除此之外还有部分毒株为分子分型非典型(molecular serotyping non-typable,MSNT)分离株[4]。
研究表明,在2005年至2019年期间,中国HPS的总体流行率为27.8%,2011年至2015年的流行率最高,全国各地均有发生HPS感染现象,证明副猪嗜血杆菌感染在中国的猪群中普遍存在[5]。实际生产中副猪嗜血杆菌感染多呈慢性经过,且在发生发展过程中常伴随与猪繁殖与呼吸综合征病毒、猪圆环病毒2型等混合感染,给临床诊断和防治带来困难,对猪场生产造成严重的经济损失。有效的防控措施和合理的临床用药必须建立在准确诊断及药敏试验的基础上,因此本研究对1例疑似副猪嗜血杆菌感染的仔猪进行了细菌分离鉴定、药敏试验和致病性试验,为副猪嗜血杆菌病的临床诊治提供一定的参考。
1 材料与方法
1.1 材料
1.1.1 病料来源 2020年7月,山东某猪场部分仔猪和青年猪出现消瘦、呕吐、关节肿大,发病后,用磺胺类药物进行治疗,随后病猪出现腹泻并且有猪死亡,自开始死亡至今的病死率为12%,该场送检2头病猪到青岛农业大学教学动物医院进行诊断。该场发病仔猪未免疫接种任何疫苗。剖检发现,胸腔和腹腔有纤维素性渗出,肺脏实质性病变,喉头出血,心包积液,脾边缘出血,膀胱积尿,肾脏有出血斑,胃有出血点,胃底溃疡,回盲口溃疡,肠系膜淋巴结肿大,关节有积液。
采集剖检猪的肺脏、脾脏、淋巴结、扁桃体等部位的病变组织,采用国家标准的方法进行猪常见病毒病的PCR检测:流感病毒(GB/T 27521-2011)、猪瘟病毒(GB/T 16551-2008)、猪繁殖与呼吸综合征病毒(GB/T 18090-2008)、猪圆环病毒(GB/T 21674-2008)、伪狂犬病病毒(农业部1485号公告-2-2010)。结果显示,猪圆环病毒阳性,伪狂犬病病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒均阴性。
1.1.2 试剂 2×T5 Super PCR Mix(Colony),擎科生物公司产品;TIANamp Virus DNA/RNA提取试剂盒,天根生化科技公司产品;DNA标准DL 2 000,TaKaRa公司产品;GoldView Ⅰ型核酸染色剂、NAD,Solarbio公司产品;新生小牛血清,HyClone公司产品;胰蛋白胨大豆琼脂培养基、胰蛋白胨大豆肉汤培养基、革兰氏染色液试剂盒,海博生物技术有限公司产品;微生物药敏试纸(K-B法),温州市康泰生物科技有限公司产品。
1.1.3 仪器设备 显微镜,德国Leica公司产品;DHP-9272 电热恒温培养箱,上海齐欣科学仪器有限公司产品;ZQPW-70 全温振荡培养箱,天津市莱玻特瑞仪器设备有限公司产品;S0200-230V-EU 涡旋混合器,美国Labnet公司产品;HH-4 数显恒温水浴锅,常州国华电器有限公司产品;SIGMA 3K15 离心机,德国Sigma公司产品;BSC-1100-LIA2 生物安全柜,北京东联哈尔仪器制造有限公司产品;K8360 自动凝胶成像系统,北京科创锐新生物科技有限公司产品;T100 PCR 仪,美国Bio-Rad 公司产品;PowerPac Basic 电泳仪,北京六一生物科技有限公司产品。
1.2 方法
1.2.1 细菌分离 根据临床症状和剖检变化,选取病猪的肺、脾、膝关节内积液,于含有50 mL/L胎牛血清、10 mg/mL NAD的琼脂培养基上进行划线分离。于37 ℃、体积分数为5%的CO2条件下培养24 h,观察菌落形态特征。挑取单个菌落进行革兰氏染色,镜检观察细菌形态。
1.2.2 16S rRNA的PCR检测及测序分析 取单菌落接种于含50 mL/L胎牛血清、10 mg/mL NAD的肉汤培养基中37 ℃振荡培养(200 r/min)12 h,使用细菌核酸提取试剂盒提取细菌核酸,置-20 ℃保存备用,作为PCR扩增的DNA模板。
参考文献中的方法[6],扩增细菌16S rRNA,目的片段1 428 bp。PCR扩增体系25 μL:2×T5 DNA聚合酶12.5 μL,ddH2O 8 μL,上、下游引物各1 μL,DNA模板2.5 μL。扩增程序:98 ℃预变性3 min;98 ℃ 10 s,54 ℃ 10 s,72 ℃ 20 s,共35个循环;72 ℃终延伸2 min。PCR产物于10 g/L琼脂糖凝胶进行电泳鉴定,扩增产物由擎科生物公司测序。测序结果由NCBI网站在线Blast比对分析。
1.2.3 套式PCR 根据副猪嗜血杆菌国家标准检测方法(GB/T 34750-2017)进行特异性PCR检测,PCR扩增体系25 μL:2×T5 DNA聚合酶12.5 μL,ddH2O 8.5 μL,上、下游引物各1 μL,DNA模板2 μL。第一次扩增程序:94 ℃预变性5 min;94 ℃ 30 s,56 ℃ 10 s,72 ℃ 60 s,共35个循环;72 ℃终延伸5 min。第二次扩增程序退火温度为54 ℃,其他程序同第一次扩增程序。PCR产物于10 g/L琼脂糖凝胶电泳鉴定。
1.2.4 血清分型PCR 根据参考文献[7],由擎科生物公司合成14个HPS血清型基因引物(表1)。

表1 血清型基因引物
PCR扩增体系25 μL:2×T5 DNA聚合酶12.5 μL,ddH2O 10 μL,上、下游引物各0.25 μL,DNA模板2 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,58 ℃ 30 s,68 ℃ 60 s,共30个循环;68 ℃终延伸5 min。PCR产物经10 g/L琼脂糖凝胶电泳鉴定。
1.2.5 多位点序列分型(MLST) 参照Mullins M A等[8]建立的HPS MLST分型方法。由擎科生物公司合成7个HPS基因型引物(表2)。PCR扩增体系25 μL:2×T5 DNA聚合酶12.5 μL,ddH2O 10.25 μL,上、下游引物各0.5 μL,DNA模板1.25 μL。扩增程序:95 ℃预变性5 min;95℃ 60 s,45 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 10 min。PCR产物于10 g/L琼脂糖凝胶电泳鉴定,PCR产物由擎科生物公司测序。将菌株的7个基因位点的序列与HPS MLST 数据库(http://pubmlst.org/hparasuis)比对,获得该菌株的MLST序列类型编号(即 ST 型)。
表2 MLST基因型引物
1.2.6 药敏试验 无菌条件下,采用纸片扩散法检测分离菌株对12种药物的敏感性。取摇菌后12 h的菌液100 μL均匀涂布在琼脂培养基上,夹取12种药敏纸片放置于适当的位置,轻轻按压固定。倒置放于CO2、37 ℃培养箱中,培养24 h。反复3次测定抑菌环的直径取平均值,判断药物敏感性[2]。
1.2.7 动物致病性试验 参照文献[9],将20只SPF小鼠随机分为A、B、C、D共4组,每组5只,其中A、B、C组为感染组,D组为对照组。菌落计数后对3组感染组小鼠腹腔注射菌悬液(分别为A:1×108CFU/mL,B:1×109CFU/mL,C:1×1010CFU/mL),0.2 mL/只,D组腹腔注射等剂量PBS。自注射前1 d至注射后5 d内,观察小鼠的饮食情况、临床症状及体重,并对死亡小鼠进行剖检和细菌分离。
2 结果
2.1 细菌分离
接种膝关节内积液的培养基上观察到针尖大小的半透明且光滑湿润的菌落(图1A)。革兰氏染色镜检发现红色的革兰氏阴性细菌,呈球杆状(图1B)。
2.2 16S rRNA 基因的PCR检测及测序分析
PCR检测结果表明,得到1 428 bp的条带,与预期片段一致(图2)。测序结果经NCBI网站在线Blast比对分析,与其同源度最高的菌株登录号为CP049089.1,菌株为副猪嗜血杆菌。
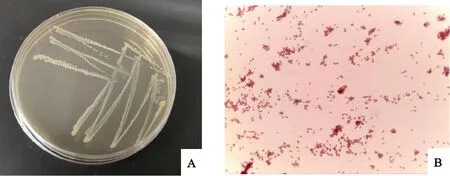
A.培养特征;B.革兰氏染色(1 000×)
2.3 套式PCR
特异性套式PCR产物分别为820 bp、312 bp,与预期片段一致,确定菌株为副猪嗜血杆菌(图3)。
2.4 血清分型PCR
HPS血清型的PCR扩增得到490 bp的条带,为血清型7型,其余均为阴性(图4)。
2.5 MLST
MLST结果表明,得到7条不同长度的条带,与预期片段一致(图5)。得到等位基因编号分别为7、2、61、3、81、3、21,其中mdh的基因编号61为新出现的等位基因编号。ST 型编号为400。
2.6 药敏试验
对分离菌株纸片扩散法药敏试验的结果表明,分离菌株对头孢曲松、阿莫西林/棒酸、庆大霉素、壮观霉素、多西环素、甲氧苄啶/磺胺甲恶唑、左氟沙星、环丙沙星、氟苯尼考、多黏菌素B敏感,对亚胺培南、林可霉素高度耐药(表3)。
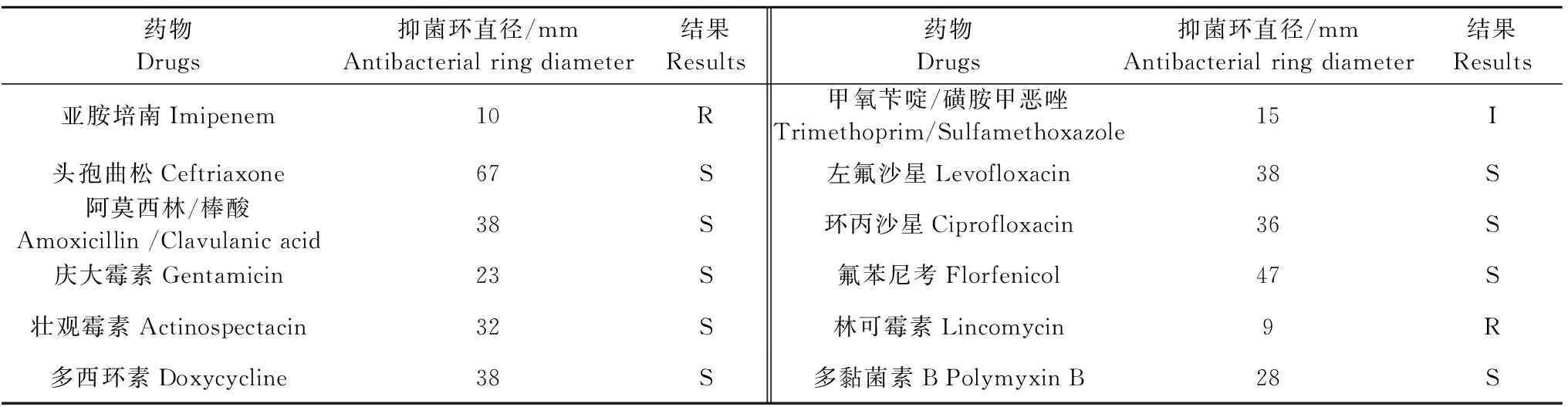
表3 药敏试验结果
2.7 动物致病性试验
各组小鼠均未出现死亡,感染组小鼠出现精神萎靡症状。注射细菌量为1×1010CFU/mL的感染组小鼠在1 d内出现体重的下降,在随后几天内逐渐恢复。在5 d时剖检了2只1×1010CFU/mL的感染组小鼠,剖检后发现有1只小鼠肺部出血,其他3只小鼠及对照组小鼠在5 d~6 d内体重均略微增长。

M.DNA 标准DL 1 000;1.菌株
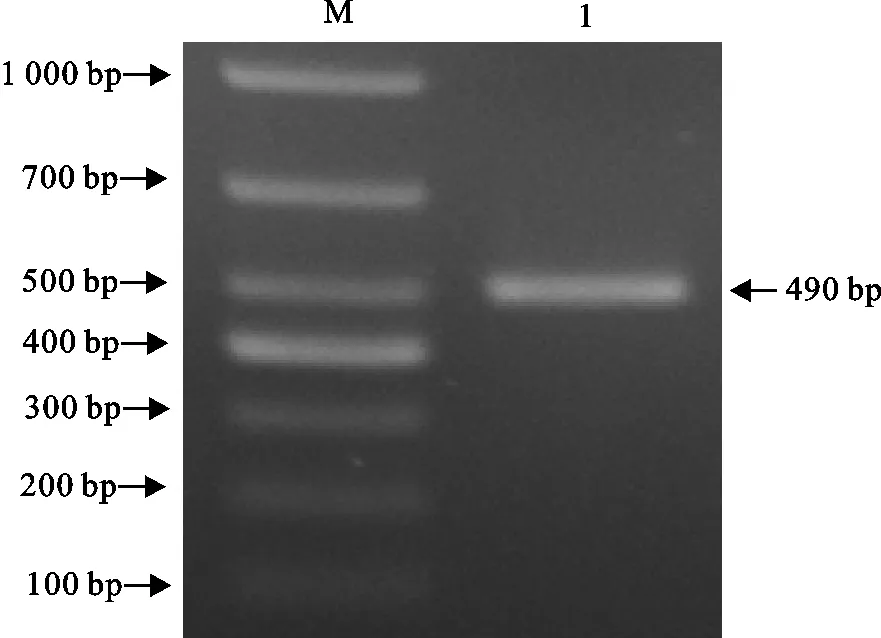
M.DNA 标准DL 1 000;1.fun Q(7型)基因
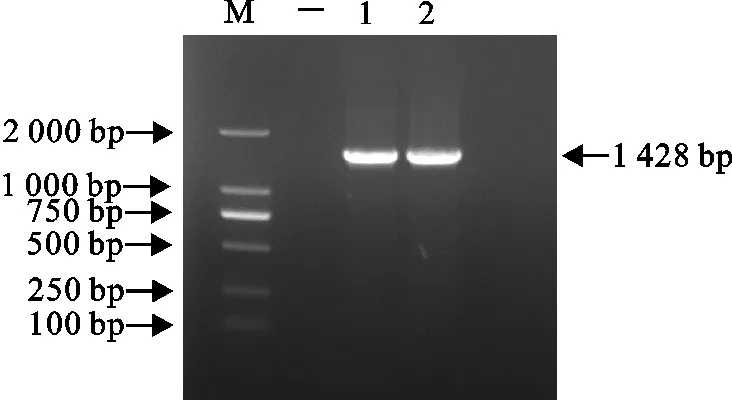
M.DNA 标准DL 2 000;-.阴性对照; 1、2.菌株
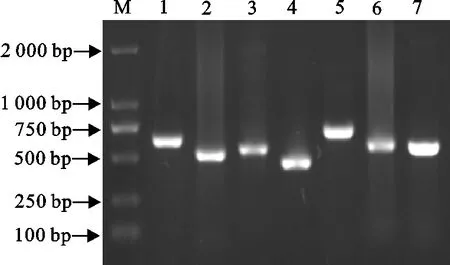
M.DNA 标准DL 2 000;1.atpD(614 bp); 2.infB(470 bp); 3.mdh(469 bp); 4.rpoB(425 bp); 5.6pgd基因(668 bp); 6.g3pd(537 bp); 7.frdB(553 bp)
3 讨论
副猪嗜血杆菌是在于猪上呼吸道的一种常见的条件致病菌,当猪群中存在猪繁殖与呼吸综合征病毒或猪圆环病毒时,更易发生副猪嗜血杆菌病。该病原呈世界性分布,在中国、澳大利亚、美国、英国等世界多国普遍流行,各地流行菌株血清型不一,主要引起猪的多发性浆膜炎、关节炎和脑膜炎,发病日龄主要集中在断奶和保育阶段的仔猪,对国内外养猪业造成巨大经济损失[10]。
本病例中仔猪发生了猪圆环病毒和副猪嗜血杆菌的混合感染,临床症状表现复杂,仅依靠临床和剖检诊断无法确诊,需要依靠实验室诊断。在实验室诊断中,PCR检测较血清学检测可以更快速、方便地检测副猪嗜血杆菌,本试验通过16S rRNA的PCR检测和套式PCR检测确诊仔猪感染副猪嗜血杆菌。除此之外,对于猪场或存在多种血清型的情况,PCR可以快速检测血清型,操作简单,容易普及推广,适用于临床快速检测诊断和流行病学调查[11]。目前,仍存在不能血清型分型的菌株,因此通过更精确的基因分型,更有助于分析病原的流行规律,其中,MLST可以通过管家基因间的基因变异来反映菌株之间的进化关系,提供更多的关于DNA方面的信息,有助于寻找基因型与毒力以及交叉免疫力之间的关系[7]。
近几年来,最常见的血清型为7型、5/12型、4型、13型[4,12-13]。在以前的研究中,认为血清型7型的菌株是无毒株,不产生临床症状和生产损害,在本次病例中,血清型7型的菌株表现出一定的毒力,表现出胸腔和腹腔有纤维素性渗出、消瘦、关节积液等临床症状。致病性试验中,菌株在较高的浓度下才对小鼠体重有一定影响,小鼠均未死亡,证明菌株的毒力很弱。据临床病料信息统计,副猪嗜血杆菌易与猪繁殖与呼吸综合征病毒和猪圆环病毒混合感染[14]。猪圆环病毒病是一种免疫抑制性疾病,感染后会降低机体的免疫力,因此在临床上极易导致与其他病原并发或继发感染,从而加重病情、提高死亡率。本次病例的病猪同时感染了猪圆环病毒并表现出临床症状,推测副猪嗜血杆菌在猪圆环病毒的影响下表现出更强的致病性。除了混合感染的影响外,因为副猪嗜血杆菌属于细菌性疾病,受饲养管理的影响比较大,所以饲养管理也是影响副猪嗜血杆菌表现出临床致病性的可能原因之一[10]。副猪嗜血杆菌慢性、持续性感染对猪组织器官产生损伤,增加猪群死淘率,降低生长速度和饲料报酬,对仔猪生产性能产生极显著的影响[15]。因此,本研究表明在一些特殊条件(饲养条件不良或者有混合感染)下,血清型7型可能会使猪群表现出相应的临床症状。
研究发现,副猪嗜血杆菌对林可霉素、青霉素等有较高耐药性[16],对头孢类敏感的菌株比较普遍[17]。本试验中的药敏结果与之一致,可选择头孢曲松、氟苯尼考等敏感的药物配合使用,能够很好的控制该病,降低耐药菌株产生的风险。除此之外,还要注意饲养环境的卫生、消毒和通风,增强防治措施,及时合理制定免疫程序。但是,如今市售的大多数疫苗都是灭活疫苗,具有血清型特异性,对病原血清型具有有限的交叉保护作用,需要进一步研究毒力因子和开发新的疫苗[18-19]。

