参芪扶正注射液对支气管扩张症伴铜绿假单胞菌感染患者Th17/Treg免疫失衡的影响
杨丽莉 ,王兆邦 ,陈芳 ,王婉华,廖雪
(东莞市滨海湾中心医院1.健康管理科;2.呼吸内科,广东东莞 523900;3.暨南大学第一临床医学院,广东广州 510630)
支气管扩张症作为一种气道慢性化脓性炎症引起的支气管树病理性、永久性扩张的肺疾病,频繁反复发作不仅会引起肺功能恶化,还可能出现慢性肺源性心脏病甚至呼吸衰竭,加重患者病情[1]。病原体、宿主微生物群和宿主炎症、免疫调节之间相互作用被证实为支气管扩张发生进展的重要病理基础[2],而革兰阴性菌作为支气管痰检阳性的主要致病菌,又以铜绿假单胞菌检出率最高[3]。中医认为治疗支气管扩张症应扶正驱邪、标本兼治[4],参芪扶正注射液作为临床上辅助调节癌症、肺炎、哮喘、慢性阻塞性肺病等调节免疫功能的药物[5-6],具有较好的应用前景。相关研究结果表明,中性粒细胞作为支气管扩张症最重要的炎症细胞,当患者处于急性加重或者细菌感染时水平显著升高[7],而辅助性T 细胞17(T helper cell 17,Th17)/调节性T 细胞(T rgulatory cells,Treg)作为机体重要的免疫细胞,可通过影响中性粒细胞进而调控细菌侵袭引起的炎症反应[8]。高迁移率族蛋白B1(high-mobilitygroup box1,HMGB1)作为关键的启动和维持炎症瀑布式反应的炎症分子,影响多种炎症疾病的进展[9];晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)作为免疫球蛋白超家族中第一个被鉴定出来HMGB1 受体,结合后可直接或间接的对Treg/Th17细胞产生影响[10],但在支气管扩张症疾病中的有关研究鲜少报道。本研究旨在探究参芪扶正注射液对铜绿假单胞菌感染支气管扩张症患者体内HMGB1/RAGE 通路表达及Th17/Treg免疫失衡的影响。现报道如下。
1 资料与方法
1.1 一般资料
选取东莞市滨海湾中心医院2018年5月7日-2021年5月8日期间收治的58例支气管扩张合并铜绿假单胞菌感染患者为研究组。纳入标准:(1)符合《成人支气管扩张症诊治专家共识》[11]中相关诊断标准;(2)连续2次痰培养铜绿假单胞菌阳性;(3)年龄20~80岁。排除标准:(1)临床资料不完整;(2)合并其他肺部疾病无法进行肺泡灌洗术或对相关用药不耐受者;(3)痰培养合并其他病原菌;(4)合并严重心、肝、肾功能不全者;(5)入院前1个月内接受过抗菌药或免疫抑制药物治疗;(6)合并自身免疫缺陷病或血液系统疾病;(7)合并恶性肿瘤。另按1∶1配对纳入58例体检科正常人为健康对照组,入选标准:每年体检,无肿瘤、糖尿病、冠心病、高血压病、心力衰竭、慢性肾功能不全、周围血管病、脑卒中等疾病。所有研究对象均对研究知情且自愿签署同意书,本研究经医院伦理委员会审核批准。
研究组随机数字表法分为A 组和B 组各29 例。A 组中男性10 例,女性19 例,年龄21~71 岁,平均(45.41±8.39)岁,体重指数平均(20.82±2.37)kg/m2;病程平均(7.32±3.19)年;FEV1占预计值(63.49±13.94)%,FVC占预计值(73.83±13.73)%;过去1年急性加重次数1次11例,2次及以上18例。B组中男性12例,女性17例,年龄20~74岁,平均(44.37±7.61)岁,体重指数平均(20.98±2.64)kg/m2;病程平均(7.83±3.52)年;FEV1占预计值(64.04±13.94)%,FVC 占预计值(73.57±12.98)%;过去1年急性加重次数1次12例,2次及以上17例。健康对照组中男性24例,女性34例,年龄20~73 岁,平均(45.04±8.39)岁,体重指数平均(20.33±2.45)kg/m2;FEV1 占预计值(83.49±8.94)%,FVC 占预计值(83.16±8.34)%。各组的性别、年龄、体重指数等比较差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 治疗方法 A 组与B 组患者均给予雾化吸入、普通吸痰管吸痰、经验性抗菌药物、水电解质平衡、营养支持及对症治疗等常规治疗方式。A 组患者在此基础上采取纤维支气管镜与肺泡灌洗术,术前4~6 h 禁食饮水,咽喉部局部麻醉后常规检测心电、呼吸、血氧饱和度检测,经鼻插入纤维支气管镜,吸除气道内分泌物,将预先加热至37 ℃的无菌生理盐水(20 mL)以一次性注射器由吸引孔缓慢推入至支气管内,操作中注意观察患者,避免呛咳情况,负压回收灌洗液,反复多次冲洗,直至液体清亮,收集灌洗液30~50 mL,将收回的液体经无菌纱布去除黏液,放至无菌容器中,用于Th17/Treg 细胞流式细胞术检测的样本于24 h 内检测,炎性因子检测的样本于-70 ℃保存。B组患者在A组基础上给予参芪扶正注射液(丽珠集团利民制药厂,国药准字Z19990065,规格:250 mL/瓶)辅助治疗(取250 mL参芪扶正注射液行静脉滴注,1 次/d)。灌洗术每周灌洗3次,两组共持续治疗14 d。
1.2.2 外周血样本采集及单个核细胞分离 取健康对照组及研究组患者治疗前、后空腹静脉血5 mL各2支,1支置于枸橼酸钠抗凝剂的无菌试管中;1支置于的普通无菌干燥试管中,离心,提取上清液,然后置于-80 ℃冰箱备用。采用Ficoll 密度梯度离心法[12]分离得到外周血单个核细胞(PBMCs)。
1.2.3 Western blot检测外周血及灌洗液中HMGB1、RAGE 蛋白表达 使用蛋白提取试剂盒(购自北京索莱宝科技有限公司)提取单个核细胞及肺泡灌洗液中的总蛋白,采用Bradford 法测定蛋白浓度并调整各组蛋白浓度一致,经SDS-PAGE凝胶电泳、电转膜至甲醛预处理过的PVDF 膜,密封2 h,加入兔抗人HMGB1、RAGE、GAPDH 一抗(1∶500)(均购自Thermo Fisher Scientific)4 ℃孵育过夜,TBST 漂洗40 min,加入HRP标记的二抗(1∶500)孵育1 h,TBST漂洗40 min,ECL试剂盒与DNR BioImaging System观察膜上蛋白条带,收集影像,采用凝胶图像处理系统软件分析各组条带灰度值,依据相对灰度值进行统计学分析。
1.2.4 流式细胞术检测外周血及肺泡灌洗液中Th17、Treg 细胞占比 采用美国BD 生物科技有限公司生产的试剂盒处理样品,流式细胞术检测Th17细胞和Treg细胞水平。具体步骤见试剂盒说明书。
1.2.5 ELISA 技术检测肺泡灌洗液及外周血中炎症细胞因子水平 根据酶联免疫吸附试剂盒相关说明,检测Th17、Treg 细胞占比及标志性促炎细胞因子[白细胞介素-17(IL-17)、白细胞介素-6(IL-6)],抗炎细胞因子[转化生长因子-β1(TGF-β1)、白细胞介素-10(IL-10)]水平。
1.3 观察指标
(1)健康对照组受试者及研究组患者单个核细胞及灌洗液中HMGB1、RAGE 蛋白表达水平;(2)健康对照组受试者及研究组患者单个核细胞及灌洗液中Th17、Treg 细胞占比及标志性炎性细胞因子[白细胞介素-17(Interleukin 17,IL-17)、IL-6、转化生长因子-β1(transforming growth factor-β,TGF-β1)、IL-10]水平;(3)A组和B组患者治疗前后单个核细胞及灌洗液中HMGB1、RAGE 蛋白表达水平;(4)A 组和B 组患者治疗前后单个核细胞及灌洗液中Th17、Treg细胞占比及IL-17、IL-6、TGF-β1、IL-10水平。
1.4 统计学分析
采用SPSS 20.0 统计学软件处理数据,计量资料符合正态分布采用均数±标准差()表示,组间比较采用t检验,P<0.05认为差异有统计学意义。
2 结果
2.1 研究组与健康对照组结果比较
2.1.1 外周血中HMGB1、RAGE 蛋白表达及Th17、Treg细胞占比比较 研究组患者外周血中HMGB1、RAGE 蛋白表达水平均高于健康对照组(P<0.01);Th17 细胞占比高于健康对照组(P<0.01),Treg 细胞占比低于健康对照组(P<0.01)。见表1。
表1 两组受试者单个核细胞中HMGB1、RAGE蛋白表达及外周血中Th17、Treg细胞占比比较Table 1 Comparison of HMGB1 and RAGE protein expression in mononuclear cells and Th17 and Treg cell levels in peripheral blood of two groups(,n=58)

表1 两组受试者单个核细胞中HMGB1、RAGE蛋白表达及外周血中Th17、Treg细胞占比比较Table 1 Comparison of HMGB1 and RAGE protein expression in mononuclear cells and Th17 and Treg cell levels in peripheral blood of two groups(,n=58)
与健康对照组比较:**P<0.01。
2.1.2 外周血炎性细胞因子水平比较 研究组患者外周血中IL-17、IL-6、TGF-β1、IL-10 水平高于健康对照组(P<0.01)。见表2。
表2 两组受试者外周血IL-17、IL-6、TGF-β1、IL-10水平比较Table 2 Comparison of peripheral blood IL-17,IL-6,TGF-β1 and IL-10 levels between the two groups(,n=58) ρ/(pg·mL-1)

表2 两组受试者外周血IL-17、IL-6、TGF-β1、IL-10水平比较Table 2 Comparison of peripheral blood IL-17,IL-6,TGF-β1 and IL-10 levels between the two groups(,n=58) ρ/(pg·mL-1)
与健康对照组比较:**P<0.01。
2.2 研究组A组和B组患者结果比较
2.2.1 外周血及肺泡灌洗液中HMGB1、RAGE 蛋白表达比较 与治疗前比较,两组患者治疗后外周血及肺泡灌洗液中HMGB1、RAGE 蛋白均降低(P<0.05),且B 组患者HMGB1、RAGE蛋白降低更显著(P<0.05)。见表3。
表3 研究组患者治疗前后外周血及肺泡灌洗液中HMGB1、RAGE蛋白表达比较Table 3 Comparison of HMGB1 and RAGE expression in peripheral blood and alveolar lavage fluid between the two groupsbefore and after treatment(,n=29)
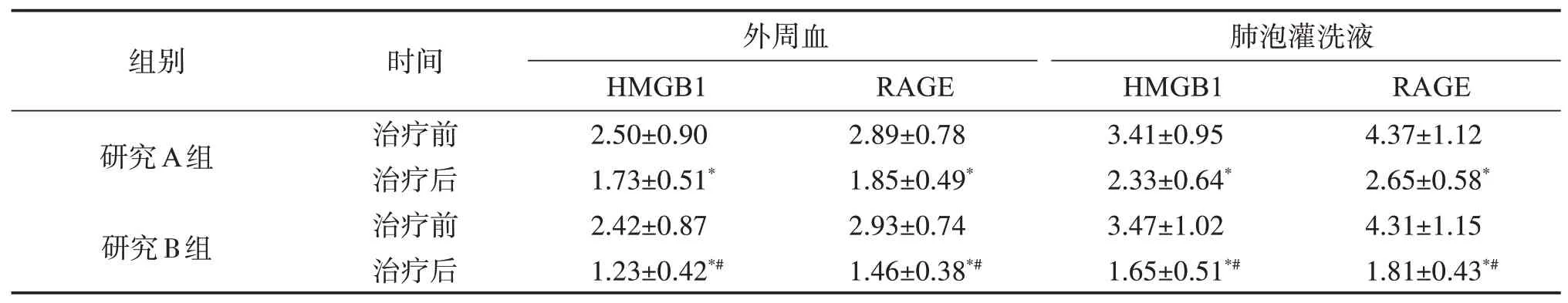
表3 研究组患者治疗前后外周血及肺泡灌洗液中HMGB1、RAGE蛋白表达比较Table 3 Comparison of HMGB1 and RAGE expression in peripheral blood and alveolar lavage fluid between the two groupsbefore and after treatment(,n=29)
与同组治疗前比较:*P<0.05;与A组同时间点比较:#P<0.05。
2.2.2 外周血及肺泡灌洗液中Th17、Treg细胞占比比较 与治疗前比较,两组患者治疗后外周血及肺泡灌洗液中Th17 细胞占比降低,Treg 细胞水平升高(P<0.05),且B 组患者Th17、Treg 细胞占比变化更显著(P<0.05)。见表4。
表4 研究组患者治疗前后外周血及肺泡灌洗液中Th17、Treg细胞占比比较Table 4 Comparison of Th17 and Treg cell levels in peripheral blood and alveolar lavage fluid between the two groups before and after treatment(,n=29)%
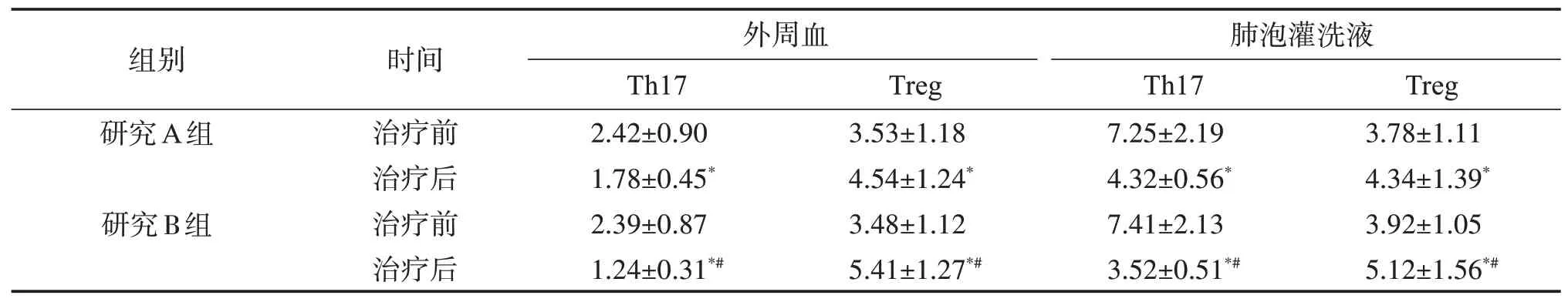
表4 研究组患者治疗前后外周血及肺泡灌洗液中Th17、Treg细胞占比比较Table 4 Comparison of Th17 and Treg cell levels in peripheral blood and alveolar lavage fluid between the two groups before and after treatment(,n=29)%
与同组治疗前比较:*P<0.05;与A组同时间点比较:#P<0.05。
2.2.3 外周血及肺泡灌洗液中炎性细胞因子水平比较 与治疗前比较,两组患者治疗后外周血及肺泡灌洗液中IL-17、IL-6 细胞水皮降低,TGF-β1、IL-10细胞水平升高(P<0.05),且B 组患者上述炎症细胞因子变化更显著(P<0.05)。见表5~表6。
表5 研究组患者治疗前后外周血中IL-17、IL-6、TGF-β1、IL-10水平比较Table 5 Comparison of peripheral blood IL-17,IL-6,TGF-β1 and IL-10 levels between the two groups before and after treatment(,n=29) ρ/(pg·mL-1)
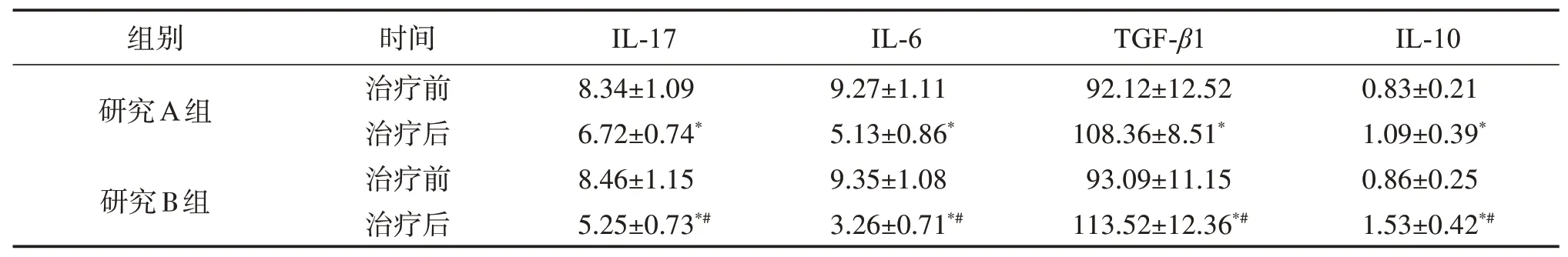
表5 研究组患者治疗前后外周血中IL-17、IL-6、TGF-β1、IL-10水平比较Table 5 Comparison of peripheral blood IL-17,IL-6,TGF-β1 and IL-10 levels between the two groups before and after treatment(,n=29) ρ/(pg·mL-1)
与同组治疗前比较:*P<0.05;与A组同时间点比较:#P<0.05。
表6 研究组患者治疗前后肺泡灌洗液中IL-17、IL-6、TGF-β1、IL-10水平比较Table 6 Comparison of IL-17,IL-6,TGF-β1 and IL-10 levels in alveolar lavage fluid between the two groups before and after treatment(,n=29) ρ/(pg·mL-1)

表6 研究组患者治疗前后肺泡灌洗液中IL-17、IL-6、TGF-β1、IL-10水平比较Table 6 Comparison of IL-17,IL-6,TGF-β1 and IL-10 levels in alveolar lavage fluid between the two groups before and after treatment(,n=29) ρ/(pg·mL-1)
与同组治疗前比较:*P<0.05;与A组同时间点比较:#P<0.05。
3 讨论
近侧支气管、管壁肌肉及弹性组织结构的完整性破损是支气管异常扩张的病理表现,而在感染及其他外在因素多次反复作用下,上述支气管结构的损伤逐渐加重,会进一步影响纤毛功能,气道内分泌物堵塞管腔,引流不畅又会加重感染[13-14]。一项Meta 观察性队列研究结果显示,合并铜绿假单胞菌感染的支气扩张患者,其病情严重度指标及生活质量均差于未合并感染者[15],这可能与铜绿假单胞菌感染导致的炎症反应有关。
本研究发现,支气管扩张患者合并铜绿假单胞菌感染患者外周血单个核细胞中HMGB1、RAGE蛋白水平高于健康对照组,提示HMGB1、RAGE 参与了炎症反应。据分析,铜绿假单胞菌持续定植引起支气管内皮细胞坏死,可能导致HMGB1活化,而RAGE 作为其受体,可以通过作用多种炎性细胞上核因子κB核转位,进一步促进炎性细胞因子的释放引起炎性器官损伤[16]。
支气管肺泡灌洗在对呼吸道分泌物清理以提高通畅程度的同时诱发咳嗽,促进痰液及炎性物质的吸收,有利于病灶的吸收[17-18]。本研究结果显示,研究组(A组和B组)患者经过灌洗治疗,患者的炎症反应得到改善,其外周血单个核细胞及肺泡灌洗液中HMGB1、RAGE 蛋白水平降低;外周血及肺泡灌洗液中Th17细胞占比降低,Treg细胞占比升高;外周血及肺泡灌洗液中IL-17、IL-6水平降低,TGF-β1、IL-10水平升高。B组患者在A组基础上给予参芪扶正注射液辅助治疗,其上述炎症细胞因子变化更显著。
上述结果表明,参芪扶正注射液可改善支气管扩张症伴铜绿假单胞菌感染患者炎症状况,可能与其影响HMGB1 通路、Th17/Treg 免疫平衡有关。在肺泡灌洗术治疗的基础上联合参芪扶正注射液治疗支气管扩张症伴铜绿假单胞菌感染,能取得更好效果,值得临床进一步探讨。

