改性果胶与白藜芦醇的相互作用机制及抗氧化能力
李琳 余安玲 吴轶 何东 邢新会 李冰,2† 张霞,2
(1.华南理工大学 食品科学与工程学院,广东 广州 510640;2.广东省天然产物绿色加工与产品安全重点实验室, 广东 广州 510640;3.东莞理工学院,广东 东莞 523000;4.广东工业大学 轻工与化工学院,广东 广州 510006; 5.清华大学 化学工程系生物化工研究所,北京 100084;6.清华大学 工业生物催化教育部重点实验室,北京100084)
白藜芦醇是一种芪类化合物,其化学名称为3,4′,5-三羟基- 1,2-二苯基乙烯。它可在葡萄皮中合成,是葡萄酒和葡萄汁中的重要生物活性成分[1],具有抗氧化、抗炎[2]、抗癌[3]及保护心血管等作用[4]。但是,白藜芦醇等芪类化合物在加热或紫外光照射下不稳定,容易被分解、转化或氧化[5- 6],这制约了该类化合物在功能食品中的应用。将白藜芦醇与其他天然产物相互作用,从而保护白藜芦醇的生物活性,是一种绿色、安全且有效的方法。
果胶是一种酸性杂多糖,广泛存在于高等植物细胞初生壁和细胞间层中,在紫外光照射和热加工条件下结构稳定[7- 8]。果胶分子链中的极性基团能够与白藜芦醇发生非共价结合,从而保护白藜芦醇的活性基团,进而保护白藜芦醇的生物活性[9- 12]。然而,天然果胶的相对分子质量大,大量极性基团包裹在分子结构内部,能够与白藜芦醇之间形成非共价作用的位点有限。因此,为了提高果胶与白藜芦醇的相互作用,有必要对果胶结构进行改造[10,13]。酶解-超声耦合改性采用了酶法与物理方法相结合的方式,是一种降低果胶相对分子质量同时增加极性基团暴露的有效方式[14- 15]。
有鉴于此,文中采用酶解-超声耦合方法改性果胶,然后将其与白藜芦醇相互结合,探讨了改性果胶与白藜芦醇的相互作用机制,并验证了这种相互作用对白藜芦醇经紫外光照射和加热后抗氧化能力的影响,以期为提高该类功能成分在食品应用中的稳定性提供新思路。
1 材料与方法
1.1 材料与试剂
柑橘果胶、果胶酶(EC 3.2.1.15)、白藜芦醇,北京索莱宝科技有限公司生产;甲醇、乙酸、异丙醇(色谱级),天津市康科德科技有限公司生产;重水(纯度99.9%):北京伊诺凯科技有限公司生产;2,2′-联氮双(3-乙基苯并噻唑啉- 6-磺酸)二铵盐(ABTS)、邻苯三酚、奎诺二甲基丙烯酸酯(Trolox),美国Sigma-Aldrich公司生产;乙酸钠、硫酸铜、硫酸亚铁、水杨酸、氢氧化钠等试剂均为国产分析纯。
1.2 仪器与设备
VCX 500超声波细胞粉碎机,美国Sonics公司生产;1525高效液相色谱泵、717 plus自动进样器、2414示差折光检测器,美国Waters公司生产;SinChrom ODS-BP C18色谱柱,大连伊力特分析仪器有限公司生产;VERTEX 70傅里叶变换红外光谱仪,德国Bruker公司生产;AVANCE Ⅲ HD 600核磁共振波谱仪,德国Bruker公司生产;EVO 18扫描电子显微镜,德国Zeiss公司生产;Microcal PEAQ-ITC微量热等温滴定量热仪,美国Malvern公司生产;Synergy NEO2全功能酶标仪,美国BioTek公司生产;WFH- 204B手提式紫外灯,上海精科实业有限公司生产。
1.3 试验方法
1.3.1 果胶酶解-超声耦合改性
将4%(质量分数,下同)果胶溶解于乙酸-乙酸钠缓冲溶液中,在pH=4、50 ℃的条件下,用适量果胶酶水解15、30、45 min。水解结束后,立即沸水浴10 min灭酶活。酶解后将15 mL果胶溶液置于玻璃反应器中,在300 W超声功率下进行 10 min 的脉冲超声处理(脉冲时间10 s,间歇时间10 s),超声过程中用冰袋防止样品升温。改性果胶依据酶解时间不同依次命名为PE15U、PE30U、PE45U,未改性果胶(P)作为对照。
1.3.2 果胶重均相对分子质量的测定
使用凝胶渗透色谱-示差检测器联用技术测定果胶的重均相对分子质量(Mw)。将果胶样品溶解于流动相,质量浓度为2~3 g/L。用0.45 μm的水系膜过滤,进样量为20 μL,运行时间为35 min。记录图谱,在Breeze数据处理软件中用由葡聚糖标品建立的标准曲线对样品进行积分,可得果胶的相对分子质量大小及分布。色谱条件:流动相为0.02 mol/L的KH2PO4缓冲溶液,凝胶柱为Ultrahydrogel 1000(7.8 mm×300 mm)和Ultrahydrogel 500(7.8 mm×300 mm)串联使用,流速0.8 mL/min,Waters 2414示差检测器,柱温35 ℃。
1.3.3 果胶甲酯化和乙酰化程度的测定
采用高效液相色谱技术测试果胶的甲酯化程度(DM)和乙酰化程度(DAc)。准确称量5 mg果胶样品于2 mL离心管,加入1.5 mL由2 mmol/L CuSO4、0.3 mol/L NaOH和4 mmol/L异丙醇配置的混合液。将悬浊液置于4 ℃下皂化30 min后,高速离心(5 000g,10 min)。取上清液,将溶液的pH值调节至2.0,并在高效液相色谱分析之前用0.45 μm 膜过滤。将23%(体积分数)甲醇、4%(体积分数)乙酸和4%(体积分数)异丙醇混匀用作标样。色谱条件:色谱仪为Waters 1525,色谱柱为C18柱(SinChrom ODS-BP、5 μm、250 mm×4.6 mm),柱温25 ℃,采用Waters 2414示差折光检测器进行检测,进样体积为20 μL,流动相为0.4 mmol/L H2SO4溶液,流速为0.8 mL/min,洗脱时间为20 min。以异丙醇(IPA)为内标,依据甲醇(MeOH)和乙酸(AcOH)的响应因子FR,分别计算果胶样品的甲酯化程度和乙酰化程度。
1.3.4 傅里叶变换红外光谱分析
取2 mg冻干果胶样品与干燥的KBr粉末混匀,在玛瑙研钵中研磨后,用压片机压片。在4 000~400 cm-1的波数范围内进行样品的红外光谱扫描,分辨率为4 cm-1。实验结果采用OMNIC软件进行处理与分析。
1.3.5 核磁共振谱图分析
将15 mg果胶完全溶于0.5 mL重水后置于核磁管中,在25 ℃下用Bruker AVANCE III HD 600核磁波谱仪测定样品的1H和13C核磁谱。所有化学位移均以DDS(δ1H 0.00和δ13C 0.00)为参照,所得谱图采用MestReNova 9.0.1软件进行分析。
1.3.6 果胶形貌观察
将果胶冻干后制成薄片,固定到粘有导电胶的载物台上。样品经过离子溅射仪表面镀金后,采用扫描电子显微镜观察其表面形貌。
1.3.7 等温滴定量热分析
采用等温滴定微量热仪(ITC)测定果胶-白藜芦醇结合过程中的热力学参数变化[16]。用含 2 mmol/L 乙酸的缓冲液配制0.5 g/L白藜芦醇与 5 g/L 果胶溶液,用0.22 μm膜过滤。取40 μL白藜芦醇溶液加入滴定针,250 μL果胶溶液加入样品池中,设定总滴数为20滴,每次进样量为2 μL,每隔120 s滴定一次,搅拌速度为500 r/min,DP(Differential Power)值设为10,样品池温度为25 ℃。实验中仪器自动记录滴定反应的热量-时间曲线,并将原始数据经积分后转变为焓变-摩尔曲线。
ITC测试中能够直接得到焓变ΔH、结合常数KD、结合位点数N,利用MicroCal PEAQ-ITC Ana-lysis软件进行数据分析,可得到结合自由能的变化ΔG和熵变ΔS。
1.3.8 果胶-白藜芦醇相互作用后的抗氧化能力分析
果胶-白藜芦醇复合物的制备:用30%乙醇溶液将白藜芦醇配制成浓度为200 μmol/L的溶液,加入到质量浓度为4 g/L的等量改性果胶样品溶液中,经两次30 s漩涡震荡后制备成果胶-白藜芦醇复合物。复合物的白藜芦醇终浓度为100 μmol/L,改性果胶的终质量浓度为2 g/L。
清除ABTS自由基能力分析:将7 mmol/L的ABTS与过硫酸钾溶液按1:1的体积比混合至ABTS终浓度为3.5 mmol/L,静置12~16 h,形成深绿色的ABTS自由基储备液。取适量的储备液,用PBS缓冲溶液稀释成在30 ℃孵育6 min、波长734 nm下吸光度为0.7±0.02的工作液。取10 μL样品滤液,加入200 μL的ABTS自由基工作液,在30 ℃孵育6 min、波长734 nm条件下,根据Trolox标准曲线计算出样品的清除ABTS自由基能力。ABTS自由基清除率S按下式计算:
(1)
式中,D表示吸光度。

(2)

(3)
除未处理样品外,白藜芦醇与改性果胶相互作用后的样品在365 nm的紫外光下照射30 min或在60 ℃水浴加热30 min后再进行抗氧化能力测试。样品的抗氧化能力用TEAC(Trolox-Equivalent Antioxidant Capacity)来表示。
1.4 数据分析
实验重复3次,实验结果以“平均值±标准差”的形式表示。显著性差异检验使用统计软件SPSS(版本22.0),当P<0.05时具有显著性差异。数据作图使用软件Origin 8。
2 结果与分析
2.1 酶解-超声耦合改性方法对果胶分子结构的影响
表1所示为改性果胶的重均相对分子质量(Mw)、甲酯化度(DM)、乙酰化度(DAc)变化。可以看出,Mw随酶解时间(15~45 min)的延长逐步降低,经15、30、45 min酶解后加超声处理的果胶的重均相对分子质量分别为原果胶的7%、3%、2%。酶解-超声耦合改性在较短时间内大幅降低了果胶的相对分子质量,说明酶解协同超声处理可明显影响果胶的相对分子质量。在相同的超声处理条件下,可以通过控制酶解时间得到不同相对分子质量分布的果胶水解物。果胶甲酯化度也随酶解时间的延长而逐步降低,但酶解30和45 min的样品的DM没有显著性差异(P>0.05)。以上结果表明,超声处理可有效降低果胶的相对分子质量和酯化度[17- 19]。超声波作用于果胶样品时,空化效应产生的剪切力可通过机械效应断裂甲氧基—OCH3中的C—O键[20];同时,活泼的羟自由基也会与甲氧基作用生成·OCH3,这两种效应共同作用可有效降低果胶的DM[21]。然而该类耦合改性方法并不能显著改变果胶的乙酰化度,从表1可见,酶解-超声耦合改性果胶的乙酰化度相比于原果胶没有显著性差异。
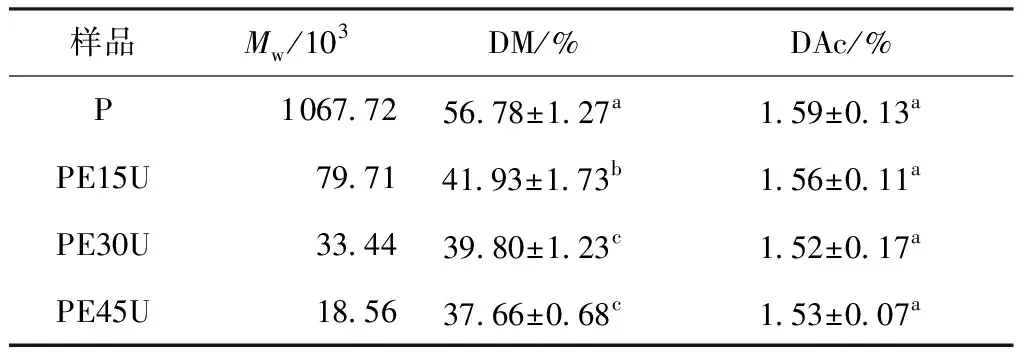
表1 改性果胶的Mw、DM和DAc变化1)

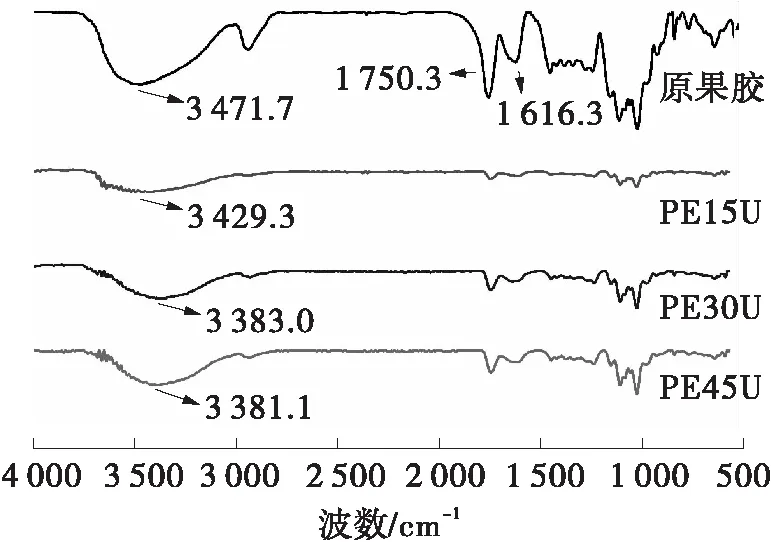
图1 果胶样品的傅里叶变换红外光谱
为增强样品的信号、降低信噪比,文中在配制核磁样品时尽量溶解更多的样品于重水中。由于果胶样品相对分子质量和溶解性的差异,最终样品的浓度并不相同(原果胶样品浓度<改性果胶PE45U样品浓度)。因此,文中的1H和13CNMR图谱均仅用于定性分析。如图2与表2所示,酶解时间最长的改性果胶PE45U与原果胶的1H与13C NMR化学位移几近相同,这表明酶解-超声耦合改性并没有改变PE45U果胶分子链糖单元中H原子与C原子的化学环境,该类改性方法只能够水解果胶糖单元之间的糖苷键结合,降低果胶的相对分子质量,并不能够改变糖单元的结构[18- 19,24]。另外,PE15U与PE30U的1H与13C NMR化学位移同样与原果胶几乎没有差别(篇幅所限,具体图谱与数据没有列出)。
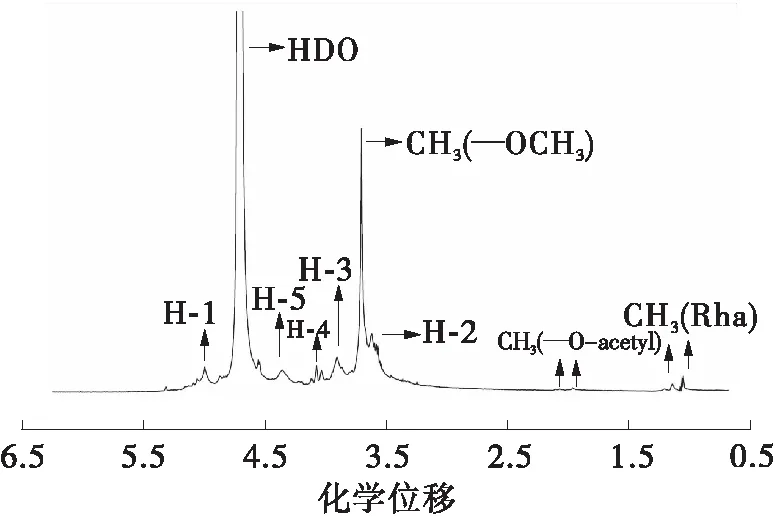
(a)原果胶, 1H NMR
(b)改性果胶PE45U, 1H NMR

(c)原果胶, 13C NMR
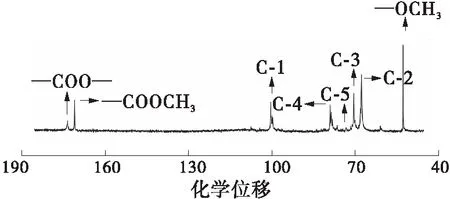
(d)改性果胶PE45U, 13C NMR

表2 果胶1H与13C NMR图谱中信号的化学位移
2.2 酶解-超声耦合改性对果胶形貌结构的影响
如图3(a)所示,原果胶的扫描电镜图片中有片层丝状结构存在,且该结构相对连续完整。经过45 min酶解-超声耦合改性以后,原果胶的丝状结构被打断,PE45U表现出更多不规整的“片段化”结构(见图3(b)、3(c)),这与果胶改性后重均相对分子质量大幅降低(Mw=18 560)的结果相吻合。原果胶结构“片段化”能够打破果胶内部的氢键结合,为果胶与白藜芦醇相互作用提供更多的作用位点。

(a)原果胶,1 000倍率

(b)改性果胶PE45U,1 000倍率

(c)改性果胶PE45U,5 000倍率
2.3 酶解-超声耦合改性果胶与白藜芦醇的相互作用
依据等温滴定量热曲线(见图4)计算出的果胶与白藜芦醇相互作用的结合常数KD与热力学参数如表3所示。果胶经45 min酶解-超声耦合改性后,其与白藜芦醇的结合位点数N是原果胶与白藜芦醇结合位点数的24倍,这是由于改性后果胶的相对分子质量减小,暴露出大量的—OH基团,提供了更多的结合位点。Cheng等[25]的研究也发现,果胶与其他分子相互作用的增强主要归功于极性基团的作用,而非相对分子质量的差异。PE45U与白藜芦醇的结合常数不到原果胶与白藜芦醇结合常数的20%,这表明果胶改性后与白藜芦醇的亲和能力大幅增强。白藜芦醇分子存在—OH基团,其与改性果胶主要通过极性基团之间形成氢键结合。根据焓变ΔH与吉布斯自由能ΔG数值同为负可知,果胶与白藜芦醇的相互作用为自发放热反应,改性后PE45U与白藜芦醇反应放热的焓变仅为原果胶与白藜芦醇反应焓变的8%。此外,PE45U与白藜芦醇相互作用的ΔG要低于原果胶与白藜芦醇相互作用的ΔG,该差异直接证明了改性果胶较原果胶更易与白藜芦醇发生相互作用[26]。相较于多酚,多糖对紫外光与加热的结构稳定性更强,改性果胶与白藜芦醇发生结合将有利于保护白藜芦醇在紫外光照射与热加工时的结构稳定性。
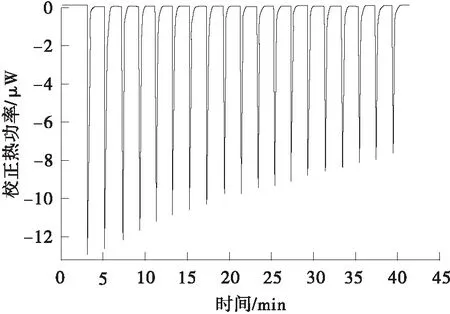
(a)原果胶的热力学分析图
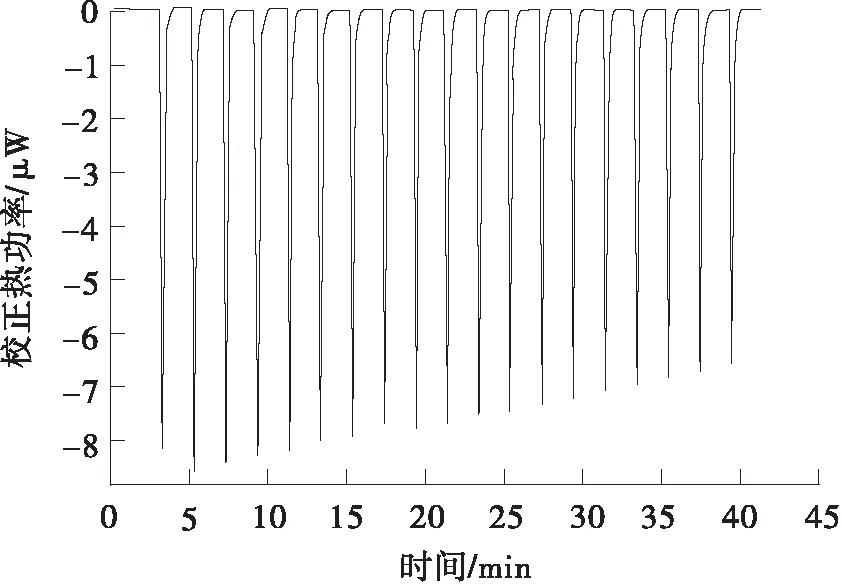
(b)改性果胶PE45U的热力学分析图
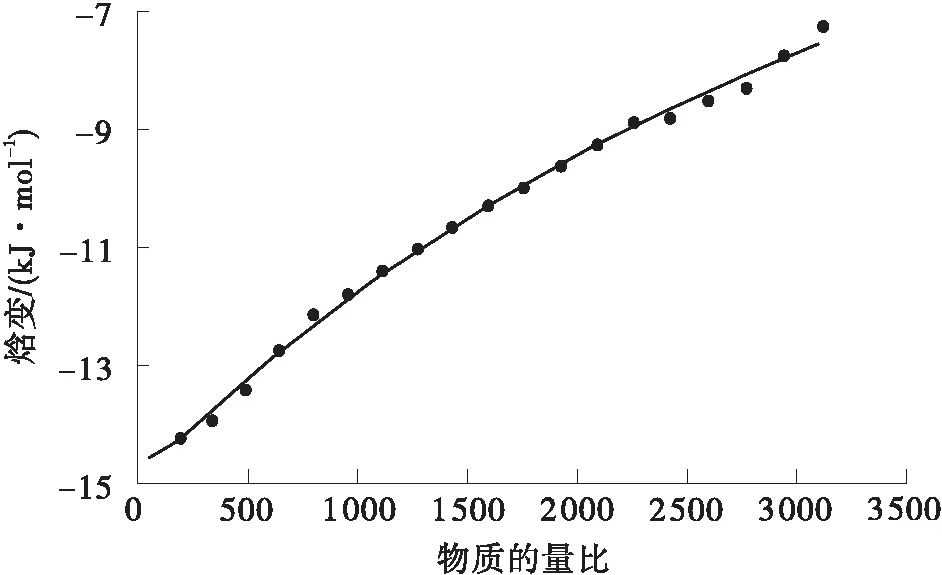
(c)原果胶的焓变

(d)改性果胶PE45U的焓变

表3 白藜芦醇与果胶相互作用的结合常数及热力学参数
2.4 改性果胶-白藜芦醇复合物的抗氧化活性
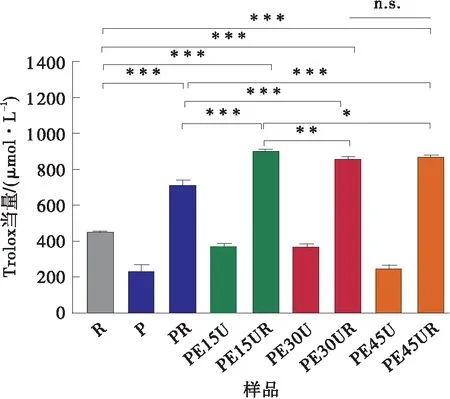
如图5(a)和5(b)所示,与白藜芦醇以及改性果胶相比,白藜芦醇与改性果胶相互作用后的复合物清除ABTS自由基和超氧自由基的能力均显著提高(P<0.05),这是因为改性果胶也具有一定的清除ABTS自由基和超氧自由基的能力,白藜芦醇与果胶的复合物能够提供更高的抗氧化性。由图5(c)可知,白藜芦醇与改性果胶相互作用后,清除羟基自由基的能力有所降低(P<0.05),这是由于白藜芦醇的抗氧化位点在相互作用过程中被果胶包埋,不利于其活性发挥,使其清除羟基自由基的能力下降。从图5亦可见,不同酶处理时间的改性果胶-白藜芦醇复合物(PE15UR、PE30UR和PE45UR)清除ABTS自由基、超氧自由基和羟基自由基的能力没有显著差异(P>0.05)。与改性果胶相比,白藜芦醇具有很高的抗氧化活性,而改性果胶-白藜芦醇复合物的抗氧化活性主要由白藜芦醇决定,所以,不同酶处理时间所制得的改性果胶对复合物的抗氧化性影响较小。
2.5 改性果胶-白藜芦醇复合物的紫外光稳定性
比较图5与图6可知,经365 nm紫外光照射后,白藜芦醇清除ABTS自由基、超氧自由基、羟基自由基的能力均显著降低,其中清除羟基自由基能力下降程度最为明显(见图6(c))。这是因为白藜芦醇光稳定性差,在紫外光照射过程中结构发生转化,进而失去抗氧化能力[6]。果胶相较于白藜芦醇具有更高的紫外光稳定性,果胶与白藜芦醇的相互作用有效保护了白藜芦醇的结构,且相较于原果胶-白藜芦醇复合物(PR),改性果胶明显提高了复合物经紫外光照射后的抗氧化能力。不同酶处理时间的改性果胶-白藜芦醇复合物的抗氧化能力存在差异,这是因为不同酶处理时间的改性果胶的性质不同,与白藜芦醇结合的程度不同,对白藜芦醇结构的保护程度也不同。
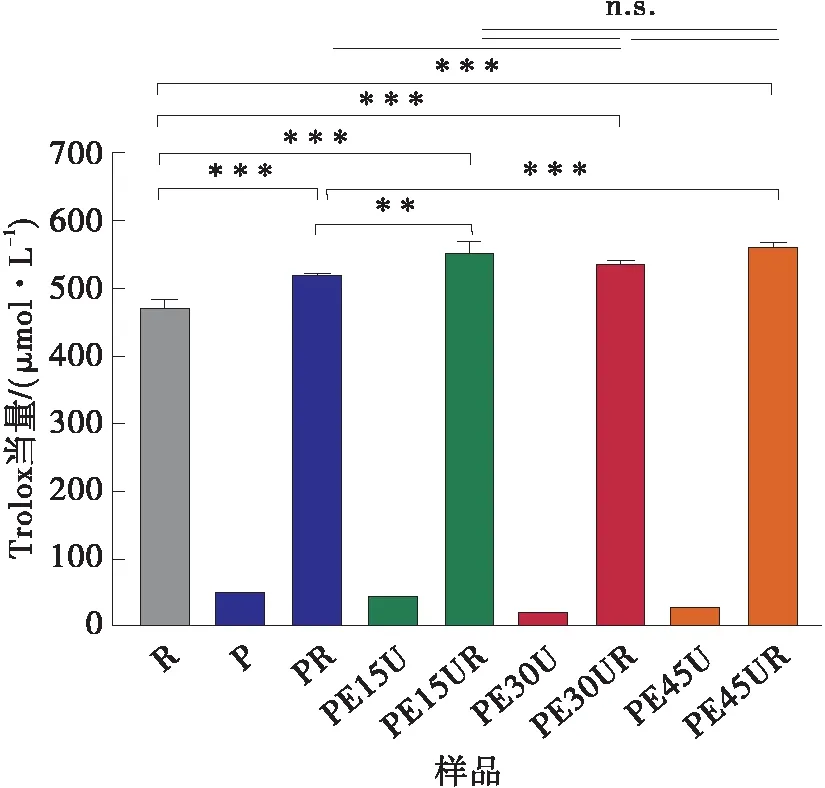
(a)ABTS自由基清除能力

(b)超氧自由基清除能力
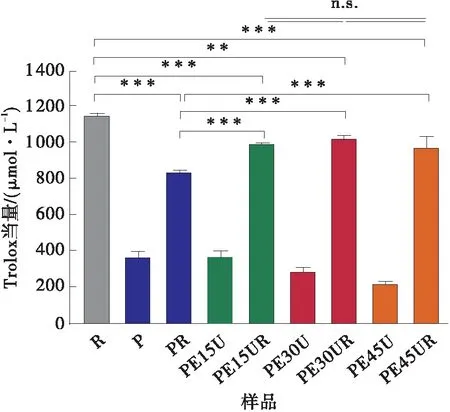
(c)羟基自由基清除能力
(a)ABTS自由基清除能力

(b)超氧自由基清除能力
(c)羟基自由基清除能力
2.6 改性果胶-白藜芦醇复合物的热稳定性
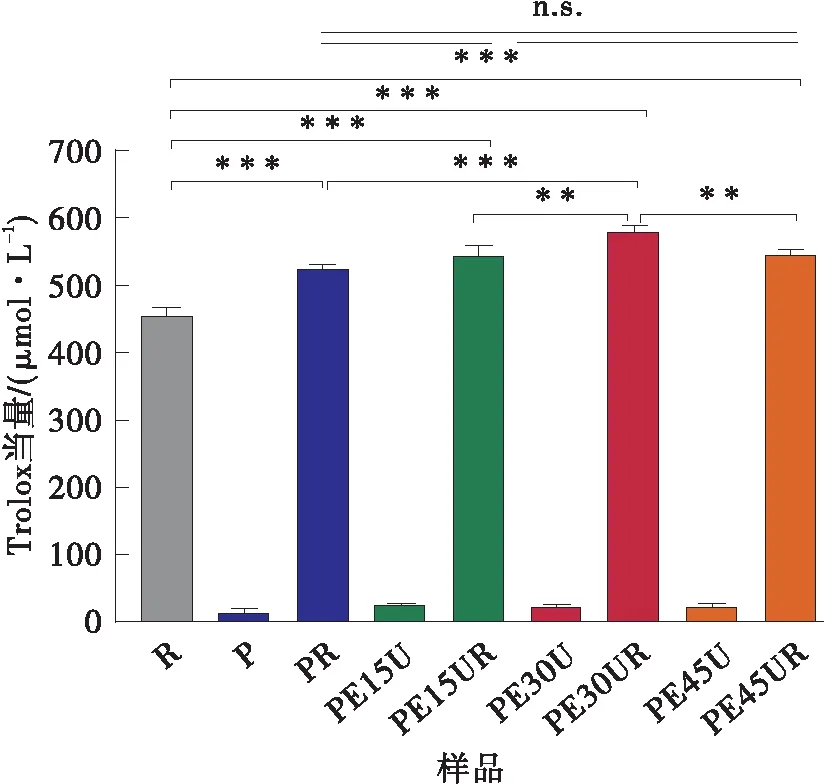
比较图5与图7可知,经60 ℃水浴加热30 min后,白藜芦醇清除ABTS自由基、超氧自由基的能力有所降低,其中清除羟基自由基能力下降幅度最大(见图7(c))。这是因为白藜芦醇的结构在加热过程中被氧化而失去抗氧化能力[6,27- 28]。相比于单独的白藜芦醇及原果胶-白藜芦醇复合物,它与改性果胶相互作用后能够明显提高其经过加热后的抗氧化能力。
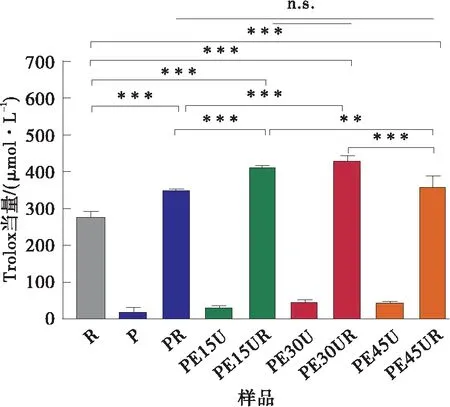
(a)ABTS自由基清除能力

(c)羟基自由基清除能力
3 结论
文中采用酶解-超声耦合法改造了果胶结构,减小了果胶的相对分子质量与甲酯化程度,使其暴露更多能够与白藜芦醇发生氢键结合的作用位点,增强了其与白藜芦醇相互作用的亲和能力。体外实验表明,改性果胶与白藜芦醇之间的相互作用能够保护白藜芦醇在紫外光照射和热加工条件下的结构,进而保护白藜芦醇的抗氧化能力。下一步的动物实验可对此作用进行进一步的验证。文中研究为解决白藜芦醇等芪类功效成分在食品配料应用中光稳定性与热稳定性差的问题提供了新思路。

