12家系视网膜母细胞瘤基因诊断的回顾性分析
白周现 张翠云 邵敬芝 刘莉娜 孔祥东
作者单位:1郑州大学第一附属医院妇产科 遗传与产前诊断中心 450000;2郑州大学附属肿瘤医院 河南省肿瘤医院分子病理科 450000;3郑州大学第一附属医院眼科 450000
视网膜母细胞瘤(Retinoblastoma,RB,OMIM#180200)是一种起源于视网膜的胚胎恶性肿瘤,遗传型RB几乎总是出现在儿童早期且常常是双眼发病。家族遗传性RB为常染色体显性遗传方式。RB最常见的首发症状为白瞳症和斜视,该恶性肿瘤在早期进行治疗是可以治愈的,但在遗传形式上仍然存在第二种非眼部原发性肿瘤的主要风险[1]。RB基因RB1是第一个被克隆的肿瘤抑制基因,它通过与转录因子E2F结合,抑制S期所需基因的转录,是细胞周期的负调控因子[2]。遗传性RB是由染色体13q14区域的RB1基因的一个等位基因的杂合胚系突变和另一个等位基因的体细胞突变引起的,这是经典的RB发病的“二次打击”假说[3-4]。我们收集到12个RB家系,为明确致病基因变异并进行遗传咨询和产前诊断,选取基因捕获二代测序方案进行测序分析。现将结果报告如下。
1 对象与方法
1.1 对象
纳入标准:①患者双眼(或单眼)视网膜母细胞瘤;②患者检出视网膜母细胞瘤致病基因RB1相关变异。以上2个条件符合其一或均符合。
2018年2月至2021年3月就诊本院遗传与产前诊断中心的12个RB家系(见图1)纳入研究,患者疾病表型通过门诊问询、病历及既往检查结果获得,具体见表1。
本研究严格遵守赫尔辛基宣言并通过郑州大学第一附属医院伦理委员会批准(批号:KS-2018-KY-36),受检者(或未成年受检者监护人)均知情并签署同意书。
12家系患者基本情况见表1:其中双眼RB 10个家系,单眼RB(均为右眼)2个家系(家系4、9);检出RB致病基因RB1相关变异的共有8个家系(家系1至8);行产前诊断的共有5个家系,家系2和6的孕妇在孕11 周超声下经腹抽取胎儿绒毛,家系3、5 和7 的孕妇在孕17 周超声下经腹抽取胎儿羊水。除家系8因患者(II1)已亡故使用患者摘除眼球组织石蜡切片(FFPE)样本作为检测材料外,其他11个家系(家系3的3位已故患者未做基因检测)均采集外周血进行检测。
1.2 方法

图1.视网膜母细胞瘤家系图(12个家系)Figure 1. Genealogical tree of 12 families with retinoblastoma.
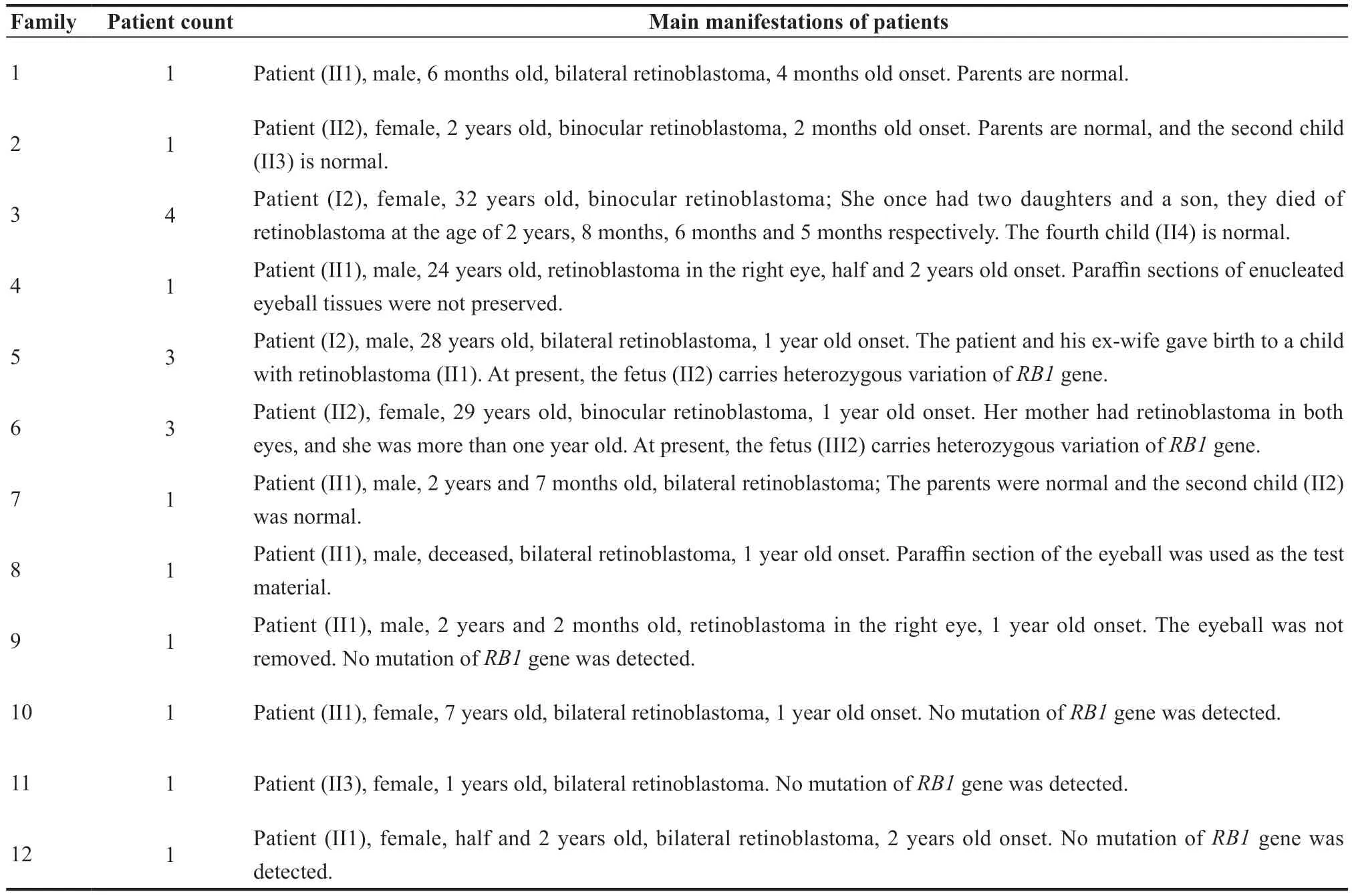
表1.视网膜母细胞瘤纳入家系的基本情况Table 1.Basic information of families with retinoblastoma according to the accepted standard
1.2.1 捕获测序 患者和相关家系成员使用EDTA抗凝管采集外周血4 ml。外周血基因组DNA使用Blood DNA Midi Kit D3494试剂盒(美国Omega biotek公司),通过epMotion全自动核酸提取纯化工作站(Eppendorf公司)抽提。家系8患者(II1)样本使用石蜡包埋组织DNA抽提试剂盒(FFPE DNA Kit,美国Omega公司)提取基因组DNA。利用Agilent Sure Select外显子靶向序列富集系统进行序列捕获并使用Illumina Next Seq 500(美国Illumina公司)测序。本实验目标序列测序深度平均100×。二代测序变异注释选择人类基因组参考序列GRCh37 版,筛选分析候选致病变异位点。
候选变异致病性分析通过人类基因变异数据库(Human gene mutation database,HGMD)、单核苷酸多态性数据库(Database of single nucleotide polymorphisms,dbSNP)工具对目标变异查询收录情况。变异的人群频率通过检索基因组整合数据库(gnomAD,)获取。候选变异的报道情况和致病性研究通过PubMed数据库查询。变异位点的氨基酸进行序列保守性由GERP++软件工具分析;利用SIFT、PolyPhen_2、MutationTaster蛋白功能分析软件预测目标变异的影响,判断其致病性。依据美国医学遗传学与基因组学学会遗传变异分类标准与指南对变异进行致病性分级和判定[5-6]。
1.2.2 Sanger测序 各家系的候选变异行Sanger测序法验证。使用试剂盒(QIAamp DNA Blood Mini Kit,德国QIAGEN公司)提取羊水细胞DNA,试剂盒(Qiagen 51304 QIAamp DNA Mini Kit,德国QIAGEN公司)提取胎儿绒毛DNA,对相应位点Sanger测序进行突变检测行产前诊断。使用TaqDNA聚合酶(立陶宛Fermentas公司)和特异引物(Gene Tool设计)对相关受检者基因组DNA目标序列进行扩增。其中2个新突变家系的引物设计见表2。
以条件(95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45s,循环32次;72 ℃终延伸10 min)进行PCR扩增,将纯化(乙醇/醋酸钠法按Big Dye V3.1操作)DNA片段产物变性后通过3 130 xl测序仪(美国ABI公司)用dGTP Big Dye®Terminator Sequencing Kit(美国ABI公司)进行检测(测序反应参数96 ℃预变性1 min;96 ℃10 s,50 ℃5 s,60 ℃ 4 min,循环25次)。
2 结果
2.1 二代测序筛查
经DNA靶向测序分析,纳入研究的12个RB家系中有8个家系患者分别检测到高度相关的已知或可疑致病RB1基因(转录本NM_000321)变异,见表3。家系8患者(II1)该变异位点全外显子组测序深度为87/21(Alt/Ref,变异序列/参考序列),家系8患者(II1)使用FFPE样本测序,结果反映体细胞变异比率约80.5%。本研究其他受检者均使用外周血样本,结果反映胚系变异情况。
2.2 RB1基因变异验证
对二代测序筛选得到的变异结果进行Sanger测序法验证,各个变异验证结果均与二代测序一致。8个家系各基因突变型和疾病表型全部共分离。8个家系受检者的相关突变携带情况见图1 家系图中标示。家系3和家系8患者检出的RB1基因新突变Sanger测序验证结果见图2—3。

表2.RB1基因新突变的Sanger测序验证引物Table 2.Sanger sequencing primers verified for novel mutations in RB1 gene
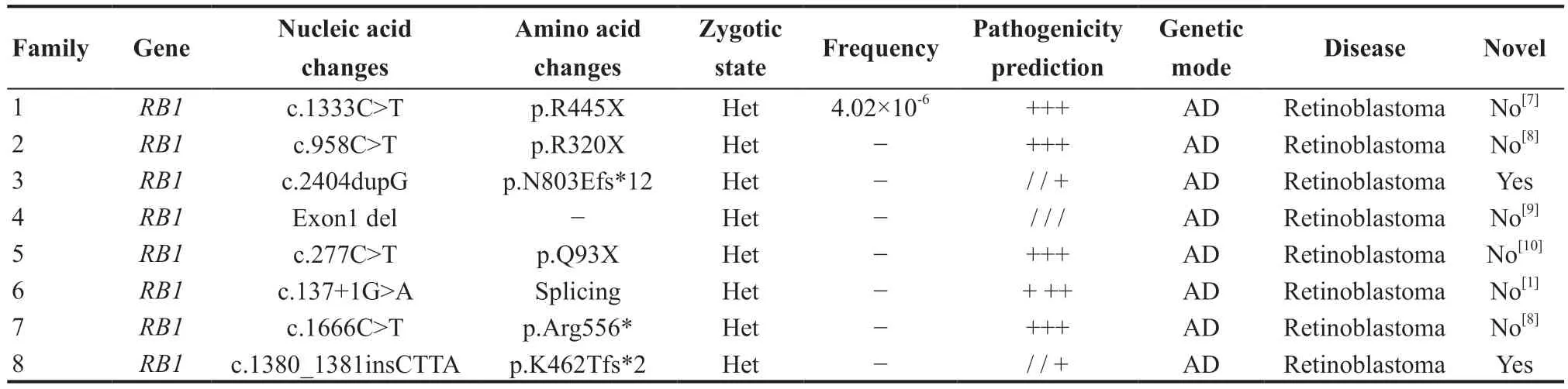
表3.视网膜母细胞瘤8家系基因变异概况Table 3.Survey of genetic variation in 8 families with retinoblastoma
2.3 变异致病性分析
本研究中无血缘关系的12个RB家系检出8个不同致病突变,检测阳性率67%。其中RB1基因c.2404dupG(p.N803Efs*12)、c.1380_1381insCTTA(p.K462Tfs*2)为新变异,致病意义未见报道(PubMed数据库和HGMD专业版)。其余6 个变异已有致病性研究或患者携带报道(见表3)。本研究检出的8个RB1基因变异类型包括无义突变、移码突变、外显子缺失和可变剪切,依据《遗传变异分类标准与指南》和2015年版《ACMG Standard and Guidelines》判断它们均为强致病性等级证据变异(等级PVS1),为导致基因功能丢失的突变。这8个位点在dbSNP数据库中均无记录编号,不属于多态性位点,人群发生频率极低。gnomAD数据库查询c.1333C>T(p.R445X)变异在人群中发生频率为4.02×10-6,其余7个变异频率无记录。
3 款蛋白功能分析软件(SIFT、Poly Phen 2和Mutation Taster)对这8 个突变进行预测,结果均为有害(详见表3)。RB1基因c.2404dupG(p.N803Efs*12)、c.1380_1381insCTTA(p.K462Tfs*2)位点氨基酸序列在物种间高度保守,发生突变有害的可能性大。家系3和家系8的RB1基因新突变c.2404dupG(p.N803Efs*12)和c.1380_1381insCTTA(p.K462Tfs*2)依据变异分类标准和指南为致病性变异,它们的联合标准依据表达式均为PVS1+PS2+PM2+PP4。
2.4 产前诊断和随访
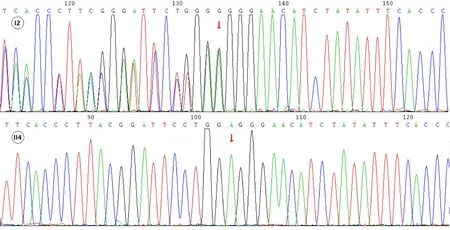
图2.家系3 RB1基因c.2404dupG杂合突变型(患者I2)与野生型(正常胎儿II4)Figure 2.RB1 gene c.2404dupG heterozygous mutation (Patient I2)and wild type (normal fetus II4) in Family 3.
家系2、3、5、6和7依据各自的先证者检出的视网膜母细胞瘤RB1基因致病突变进行产前诊断。产前样本Sanger测序结果为:家系2胎儿(II3)未检测到RB1基因c.958C>T变异,家系3胎儿(II4)未检测到RB1基因c.2404dupG变异,家系7胎儿(II2)未检测到RB1基因c.1666C>T变异;家系5胎儿(II2)检测到RB1基因c.277C>T杂合变异,家系6 胎儿(III2)检测到RB1基因c.137+1G>A杂合变异。家系10胎儿(II2)因先证者未检测到明确致病突变,无法进行RB1基因产前诊断。
产前诊断后,家系5 胎儿(II2)和家系6 胎儿(III2)选择终止妊娠。家系2胎儿(II3)、家系3胎儿(II4)、家系7胎儿(II2)和家系10胎儿(II2)均出生,电话随访时分别1 岁6 月龄、1 岁6 月龄、1 月龄和1岁5月龄,均未发生视网膜母细胞瘤。
3 讨论
本研究12 个RB家系包括10 个双眼RB患者家系,2个单眼RB患者家系;3个双眼RB家系为遗传病例,其余9 个家系为单个散发病例。本研究RB按家系RB1基因致病变异检出率为67%(8/12)。本次RB1突变检出类型包括:无义突变和移码突变,它们通常为完全显性;可变剪接突变和外显子缺失突变,报道显示它们可出现低外显率的情况[11-12]。但本研究中携带可变剪接突变的家系6在代际间表现为完全显性,携带RB1外显子1杂合缺失的家系4患者(II1)为散发病例。本研究检出RB1致病突变的8个家系中,7个家系为外周血样本,代表了这7个家系受检者胚系相关致病突变的携带情况;家系8 患者(II1)使用摘除眼球的石蜡切片组织提取基因组DNA进行检测,结果提示体细胞突变比率约80.5%,大于通常外周血检出杂合突变约50%的概率,这可能反映了在癌变组织中体细胞发生了“二次突变”,支持“二次打击”假说。
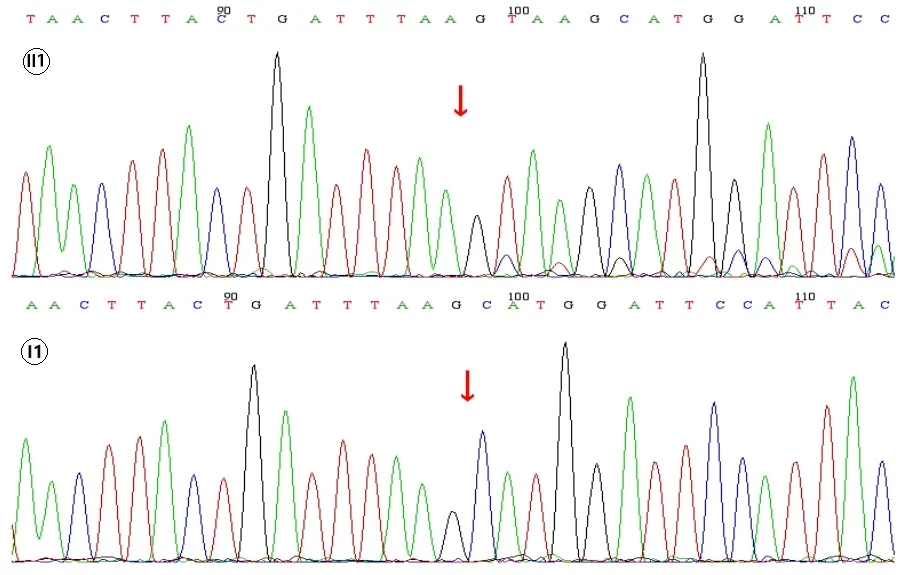
图3.家系8 RB1基因c.1380_1381insCTTA杂合突变型(患者II1)与野生型(正常父亲I1)Figure 3.RB1 gene c.1380_1381insCTTA heterozygous mutation(Patient II1) and wild type (normal father I1) in Family 8.
RB1基因由27 个外显子组成,序列总长约200 Kb。该基因缺陷是儿童RB的一个原因。RB1基因的编码蛋白可以维持组成型异染色质的稳定性以保持整体染色质结构,该蛋白以低磷酸化的活性形式结合转录因子E2F1。突变产生的异常pRB蛋白可导致与E2F1转录因子解离,增加转录活性、加快细胞周期进程和促进细胞增生进而发生视网膜母细胞瘤[13]。研究发现野生型p53通过RB1基因启动子区域的顺式作用元件抑制其转录过程[14]。pRB与MDM2(p53结合蛋白,原癌基因)的结合对于pRB克服MDM2 的抗凋亡功能和MDM2 依赖性p53 的降解是必不可少的,pRB在调控p53 凋亡功能方面发挥了作用[15]。视网膜母细胞瘤蛋白途径的失调被称为“癌症的标志”,在没有其他基因改变的情况下,该途径的失调会导致分化、增殖和凋亡的缺失;RB蛋白除了作为E2F依赖的转录抑制因子外,还需要细胞在响应非程序化增殖信号时保留G1检查点[2]。García-Cao等[16]报道视网膜母细胞瘤蛋白家族成员RB1、RBL1和RBL2之间存在一定联系,并且它们影响了端粒长度。特别是与野生型或RB1缺陷细胞相比,RBL1和RBL2双重缺陷或所有3个基因三重缺陷的小鼠胚胎成纤维细胞的端粒显著延长。Laurie等[17]实验发现视网膜发生过程中RB1功能缺失后,ARF、MDM2、MDMX和p53介导的肿瘤监测通路被激活。RB1缺陷的视网膜母细胞发生p53 介导的凋亡并退出细胞周期,p53 通路在视网膜母细胞瘤中失活;在肿瘤进展中MDMX基因的扩增和蛋白表达的增加作为一种机制,以抑制RB1缺陷视网膜细胞中p53反应。数据支持MDMX(p53结合蛋白基因)作为治疗视网膜母细胞瘤的特定化疗靶点。有丝分裂后的人类视锥前体细胞对RB1缺失特别敏感,Xu等[18]的研究表明RB1基因产物蛋白可以抑制人视锥细胞前体来源的RB母细胞瘤,这些发现为RB的视锥细胞前体起源理论提供了强有力的分子基础;细胞类型特异性的通路可以与起始致癌突变协同作用使肿瘤发生。
视网膜母细胞瘤的基因检测国内可见相关研究报道[12];家族性RB虽为常染色体显性遗传,但考虑到该肿瘤还有体细胞突变的类型,因此开展基因产前诊断较为审慎、报道较少[19];本研究在产前诊断方面做了有益的工作。我们报道的家系2双眼RB患者(II2)与孔京慧等[20]报道的一家系母子2 例左眼RB患者携带相同的杂合致病突变RB1c.958C>T,显示了相同突变导致疾病的临床表型异质性,该现象在单基因遗传病中常见。遗传性RB的平均外显率虽然高达90%以上[21],然而仍然存在不完全外显的现象。本研究的遗传性RB病例均为完全外显。具有不完全外显率的家族性的特征是特异性携带者没有临床疾病,或存在更具有散发性视网膜母细胞瘤特征的单灶性RB患儿。RB蛋白结构和功能的研究进展为低外显率视网膜母细胞瘤的分子基础提供了解释,低外显率RB突变通常导致正常pRB产生量的减少(第1类突变),或者导致pRB部分功能变异(第2类突变)[22]。本研究提供了一个较多RB家系的基因检测和诊断的临床和基因变异信息,并进行了有效的RB1基因产前诊断阻断了该病在家系内的传播。虽然视网膜母细胞瘤还受到体细胞突变和不完全外显现象的影响,但准确的RB1基因产前检测和对检测结果审慎的遗传咨询仍然能够对患者优生优育提供有意义的帮助。RB患者家系的基因诊断对患者及其家系的疾病监控、健康管理也具有一定的指导意义。
本研究回顾分析了12个不同家系的RB患者的致病基因变异,依据先证者基因诊断结果对相关家系进行了基因产前诊断,报道了导致RB的2 个新变异并分析了变异致病性。本研究的发现拓展了常染色体显性遗传的RB致病基因变异谱,丰富了RB的产前诊断实践。这将帮助人们进一步理解该病的致病机制和基因突变信息,为视网膜母细胞瘤的基因确诊、遗传咨询和产前诊断提供了理论依据。但由于视网膜母细胞瘤有常染色体显性遗传和体细胞突变2种遗传致病方式,一些病例未检出胚系致病变异;产前诊断是阻断该病在家系中传播的有效手段,对RB1基因突变的家系遗传咨询时需要谨慎小心并考虑到该病体细胞突变的可能。
利益冲突申明本研究无任何利益冲突
作者贡献声明白周现:酝酿和设计实验;采集数据;分析和解释数据;撰写论文;对编辑部的修改意见进行修改。张翠云:采集数据,参与资料的分析和解释;对编辑部的修改意见进行修改。邵敬芝:采集数据;分析和解释数据;支持性贡献。刘莉娜:采集数据;对文章的知识性内容作批评性审阅。孔祥东:全局指导;对文章的知识性内容作批评性审阅;行政、技术和材料支持;支持性贡献

