驼血多肽对运动训练大鼠骨骼肌线粒体能量代谢及肌组织自由基代谢的影响
王 艳,李 洁
西北师范大学体育学院,兰州 730070
目前国内外一些具有强大生物活性的多肽分子不断地被发现与鉴定,如脑肽与机体的学习记忆有密切关系,肌肽与抗氧化有关等。骆驼是我国新疆、青海、甘肃、宁夏、内蒙古等地区的特殊珍贵动物,恶劣的生存环境使骆驼血中的白蛋白不仅明显高于其他哺乳动物,且含有非常高的生理活性[1]。双峰驼的血清蛋白总量中白蛋白的含量达73.2%,显著高于牛、马、羊等其他类似动物。应用蛋白酶酶解技术从驼血中制备的驼血多肽,氨基酸(共18种)含量为88.25%,其中必需氨基酸44.82%,非必需氨基酸43.43%,支链氨基酸19.15%,必需氨基酸/总氨基酸50.79%,必需氨基酸/非必需氨基酸103.20%,支链氨基酸/必需氨基酸42.72%,支链氨基酸/总氨基酸21.7%[2],远超过WHO/FAO/UNU推荐的质量比较好的蛋白质的标准[3]。驼血多肽中44.82%的必需氨基酸还高于鱼皮低聚肽(24.43%)[4]和鹿血低聚肽(36.87%)[5]。驼血多肽不仅可作为生物活性肽加以开发和利用,还具有作为运动营养补剂的前景。另外,运动与营养健康效应的机制能通过线粒体结构与功能及代谢调节发挥作用。因此,本研究拟通过补充驼血多肽以及复合运动训练,探讨驼血多肽对大鼠骨骼肌线粒体三羧酸循环、呼吸链功能及骨骼肌自由基代谢的影响,为驼血多肽作为生物活性肽应用于运动营养补剂的研究提供参考。
1 材料与方法
1.1 实验对象及分组
健康雄性2月龄Wistar大鼠65只,体重200±20 g,由甘肃中医药大学实验动物中心提供[动物合格证书:SCXK(甘)2015-0002],国家标准啮齿类动物饲料常规饲养。经灌胃和跑台适应后,保留60只大鼠进行正式实验。将60只大鼠随机分为6组(n=10):对照组(control,C)、运动训练组(exercise training,E)、驼血多肽组(camel blood polypeptide,P)、驼血多肽+运动训练组(camel blood polypeptide + exercise training group,PE)、牛磺酸组(taurine group,T)、牛磺酸+运动训练组(taurine + exercise training group,TE),各组具体处理情况见表1。

表1 大鼠分组及处理情况Table 1 Grouping and treatment of rats
1.2 运动训练方案
参照文献[6],E组、PE和TE组大鼠进行递增负荷水平跑台运动。第1周:速度15 m/min,运动时间20 min/d;第2周:速度20 m/min,运动时间20 min/d;第3~4周:速度25 m/min,运动时间40 min/d;第5~6周:速度25 m/min,运动时间60 min/d。每周训练6天,共训练6周。
1.3 取材及线粒体的提取
运动训练计划结束后,空腹状态下,按1 mL/100 g剂量腹腔注射0.4%的戊巴比妥钠麻醉大鼠,腹主动脉取血,4 ℃、3 000 rpm离心10 min制备血清。同时在冰盘上迅速分离腓肠肌,去除脂肪、筋膜等结缔组织后,用冷生理盐水清洗,液氮冷冻数小时,-20 ℃低温保存待用。
将腓肠肌样本取出,0~4 ℃放置10 min左右融化,一部分腓肠肌按课题组前期文献匀浆组织、提取和悬浮线粒体。其余腓肠肌按试剂盒操作匀浆,用于测定肌组织中的指标。
1.4 测试指标及方法
大鼠力竭跑台运动速度27 m/min[7],力竭判断标准:动物跟不上预定的速度,随转动皮带后拖达30 s,连续给予声、光、机械刺激后,大鼠不能继续跑动,记录各组大鼠跑台至力竭的时间。血红蛋白采用血常规仪测定,血氨、血尿素氮、血乳酸均采用检测试剂盒进行测定。柠檬酸合酶(CS)、α-酮戊二酸脱氢酶(α-KGDHC)、酶复合体Ⅰ(CⅠ)、Ⅳ(CⅣ)和Ⅴ(CⅤ)的活性均用酶联免疫吸附检验法(ELISA法)进行测定。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量均采用检测试剂盒进行测定。活性氧自由基(ROS)荧光强度采用DCFH荧光法在激光共聚焦显微镜上检测。
1.5 主要仪器及试剂
跑台(DSPT-202,中国杭州钱江科工贸公司);紫外分光光度计(G1115A,日本);高速冷冻离心机(Allegra 64R,美国);酶标仪(680型,美国伯乐公司);激光共聚焦显微镜(OLMPUS,美国)。
驼血多肽(中国科学院兰州分院化学物理研究所);牛磺酸、牛血清白蛋白(Sigma公司);其余试剂均为国产分析纯。血清尿素氮、血氨、血清乳酸、ROS、SOD、MDA、考马斯亮蓝试剂盒(南京建成生物工程研究所);CS、α-KGDHC、CⅠ、CⅣ、CⅤ、GSH-Px、CAT检测试剂盒(上海樊克生物科技有限公司)。
1.6 统计学处理
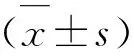
2 结果
2.1 各组大鼠体重、力竭时间及血液指标的比较
实验前各组大鼠体重均无显著性差异,6周后大鼠体重均有不同程度的增加,与C组相比,TE组显著下降10.48%(P﹤0.05),E、P、PE和T组分别下降3.82%、5.21%、8.59%、2.76%,但均无显著性差异。E、P、PE、T和TE组组间无显著性差异。6周后大鼠力竭时间、血红蛋白、血氨、血尿素氮及血清乳酸含量各组组间均无显著性差异,结果见表2。

表2 各组大鼠体重、力竭时间、血红蛋白、血尿素氮、血氨和血乳酸含量的比较Table 2 Comparison of body weight,exhaustion time,hemoglobin,blood urea nitrogen,blood ammonia,and blood lactate content of
2.2 各组大鼠腓肠肌线粒体三羧酸循环限速酶活性的比较
与C组相比,CS活性除P组降低(降低6.02%,无显著性差异)外,其余各组均升高,其中PE和TE组显著升高20.07%(P﹤0.01)和18.71%(P﹤0.05),E组升高13.63%,T组升高2.45%,但均无显著性差异;与E组相比,PE和TE组均无显著性差异;与P组相比,PE组显著升高27.76%(P﹤0.01),T组无显著性差异;与PE组相比,TE组无显著性差异,与T组相比,TE组无显著性差异,结果见表3。
与C组相比,各组α-KGDHC活性均升高,其中TE组显著升高15.32%(P﹤0.01),E、P、PE和T组分别升高8.18%、0.84%、9.39%和7.78%,但均无显著性差异。E、P、PE、T和TE组组间无显著性差异,结果见表3。

表3 各组大鼠腓肠肌线粒体CS和α-KGDHC活性的比较Table 3 Comparison of activities of citrate synthase (CS) and α-ketoglutarate dehydrogenase(α-KGDHC) in gastrocnemius mitochondrial of rats in each
2.3 各组大鼠腓肠肌线粒体呼吸链酶复合体活性的比较
与C组相比,各组CⅠ活性均升高,其中E和PE组显著升高(P﹤0.01),分别升高17.62%和20.97%,P、T和TE组分别升高5.76%、10.55%和11.62%,但均无显著性差异。E、P、PE、T和TE组组间无显著性差异。结果见表4。
与C组相比,E、P、PE、T和TE组CⅣ活性均显著升高,分别升高25.97%(P﹤0.01)、15.36%(P﹤0.05)、28.96%(P﹤0.01)、26.16%(P﹤0.01),和27.73%(P﹤0.01)。E、P、PE、T和TE组组间无显著性差异,结果见表4。
与C组相比,各组CⅤ活性除P组降低外,其余各组均升高,其中TE组显著升高22.17%(P﹤0.01),E、PE和T组分别升高2.27%、9.19%和8.97%,P组下降9.98%,但均无显著性差异。与E组相比,PE和TE组均升高,TE组显著升高19.46%(P﹤0.01),PE组升高6.76%,但无显著性差异;与P组相比,PE和T组均显著升高(P﹤0.01),分别升高21.3%和21.05%;与PE组相比,TE组显著升高11.89%(P﹤0.05),与T组相比,TE组显著(P﹤0.05)升高12.11%,结果见表4。

表4 各组大鼠腓肠肌线粒体酶复合体Ⅰ、Ⅳ和Ⅴ活性的比较Table 4 Comparison of activities of mitochondrial complex enzymes Ⅰ,Ⅳ and Ⅴ ingastrocnemius of rats in each
2.4 各组大鼠腓肠肌自由基代谢相关指标的比较
与C组相比,各组大鼠腓肠肌SOD活性均升高,其中PE组显著升高43.27%(P﹤0.01),E、P、T和TE组分别升高29.17%、25.89%、22.61%和23.02%,但均无显著性差异。E、P、PE、T和TE组组间无显著性差异,结果见表5。
与C组相比,各组大鼠腓肠肌GSH-Px活性均升高,其中PE、T和TE组显著升高(P﹤0.01),分别升高29.49%、16.7%和19.04%,E和P组分别升高8.99%,和2.56%,但均无显著性差异;与E组相比,PE组显著升高18.81%(P﹤0.01),TE组升高9.22%,但无显著性差异;与P组相比,PE和T组均显著升高(P﹤0.05),分别升高26.26%和13.79%;与PE组相比,TE组无显著性差异;与T组相比,TE组无显著性差异,结果见表5。

表5 各组大鼠腓肠肌SOD、GSH-Px和CAT活性的比较Table 5 Comparison of activities of SOD,GSH-Px and CAT in gastrocnemius of rats in each group
与C组相比,大鼠腓肠肌CAT活性除P组下降外,其余各组均升高,其中PE组显著升高21.8%(P﹤0.01),E、T和TE组分别升高13.58%、5.76%和15%,P组下降10.9%,但均无显著性差异;与E组相比,PE和TE组分别升高7.23%,和1.24%,但均无显著性差异;与P组相比,PE和T组均显著升高(P﹤0.05),分别升高36.7%和18.7%;与PE组相比,TE组下降5.59%,但无显著性差异,与T组相比,TE组上升8.73%,但无显著性差异,结果见表5。
与C组相比,各组腓肠肌ROS荧光强度均降低,除E组下降5.73%无显著性外,P、PE、T和TE组均显著下降,分别下降39.21%(P﹤0.05)、89.89%(P﹤0.01)、85.09%(P﹤0.01)和63.15%(P﹤0.01);与E组相比,PE和TE组均显著下降(P﹤0.01),分别下降89.27%和60.91%;与P组相比,PE和T组均显著下降(P﹤0.01),分别下降83.36%和75.47%;与PE组相比,TE组显著上升264.35%(P﹤0.05),与T组相比,TE组显著(P﹤0.05)升高147.08%,结果见表6和图1。

图1 大鼠腓肠肌ROS共聚焦显微镜照片Fig.1 ROS confocal microscope photomicrograph of rat gastrocnemius
与C组相比,各组腓肠肌MDA含量均降低,其中P、PE和T组显著下降(P﹤0.05),分别下降55.12%、57.6%和55.95%,E和TE组分别下降41.68%和46.85%,但均无显著性差异;E、P、PE、T和TE组组间无显著性差异,结果见表6。

表6 各组大鼠腓肠肌ROS荧光强度和MDA含量的比较Table 6 Comparison of Fluorescence Intensity of ROS and contents of MDA in gastrocnemius of rats in each
3 讨论与结论
3.1 驼血多肽及运动训练对大鼠体重的影响
已有研究表明,服用大豆多肽可促进中长跑运动员体重和瘦体重增加[8]。本研究结果显示,6周后各组大鼠体重均低于对照组,其中TE组具有显著性差异。各组大鼠体重由低到高顺序为:TE组﹤PE组﹤P组﹤E组﹤T组﹤C组,表明各干预手段均有控制体重的趋势,补剂结合运动训练较单纯补剂、单纯运动训练效果要好,且补剂和运动训练在控制体重方面有协同效应,其中牛磺酸结合运动训练效果最佳,其次为驼血多肽结合运动训练。与其他氨基酸及多肽结合运动训练对控制体重的研究结果不尽一致,其原因可能与氨基酸种类、运动水平和运动负荷有关。
3.2 驼血多肽及运动训练对大鼠力竭运动时间的影响
大鼠跑台力竭的时间是反映运动能力的最常用客观指标。本研究结果显示,6周的牛磺酸和驼血多肽灌胃补充有延长大鼠力竭运动时间趋势,这与罗非鱼鳞胶原多肽[9]和猪血多肽[10]能显著延长小鼠负重或力竭游泳时间的研究结果类似,提示驼血多肽补充可能对延缓运动型疲劳具有功效。驼血多肽或牛磺酸补充结合有氧运动对力竭运动时间虽有延长趋势,但效果不显著,可能由于跑台力竭运动不同于游泳运动研究,驼血多肽促进肌肉组织蛋白合成,大鼠体重虽未明显增加,但瘦体重可能增加,跑台运动下肢负荷过大,还需配合游泳运动训练评价驼血多肽的抗疲劳效果。
3.3 驼血多肽及运动训练对大鼠血液指标的影响
已有研究表明,补充大豆多肽对运动员血红蛋白含量无显著影响[8]。本研究结果相似,各组间血红蛋白含量均无显著性差异,各组血红蛋白含量由高到低顺序为:E组>TE组>PE组>P组>C组>T组。由此可以看出,单纯运动训练、牛磺酸结合运动训练、驼血多肽结合运动训练、单纯补充驼血多肽均有升高血红蛋白含量的趋势,其中单纯运动训练效果最好,单纯补充牛磺酸有降低血红蛋白的趋势。本研究中各干预手段均不能显著影响血红蛋白含量,可能与运动训练方案、血红蛋白的主要成分——亚铁离子等因素有关。
本研究结果显示,各组间血氨含量均无显著性差异,各组血氨含量由低到高顺序为:T组﹤TE组﹤P组﹤C组﹤E组﹤PE组,提示,牛磺酸结合运动训练、单纯补充牛磺酸、单纯补充驼血多肽有降低血氨的趋势,运动训练、驼血多肽结合运动训练有升高血氨的趋势,但各干预手段对大鼠安静状态时血氨含量无显著影响,提示各干预手段均不会对机体氨基酸代谢产生显著影响,机体氨的产生和消除之间仍保持动态平衡。
本研究结果显示,各组间血尿素氮含量均无显著性差异,各组血尿素氮含量由低到高顺序为:TE组﹤P组﹤T组﹤E组﹤PE组﹤C组,表明各干预手段使大鼠血尿素氮有下降趋势,但不会显著影响机体蛋白质代谢。已有类似的研究表明,补充大豆多肽可使运动员血尿素氮略有下降但不显著[8]。另有研究表明,补充牡蛎多肽缓解游泳力竭大鼠BUN的升高[11]。提示运动训练、驼血多肽、牛磺酸、驼血多肽结合运动训练、牛磺酸结合运动训练均不会显著增加机体蛋白质分解过程。
本研究结果显示,血清乳酸含量各组间均无显著性差异,各组血清乳酸含量由低到高顺序为:TE组﹤T组﹤C组﹤P组﹤E组﹤PE组。已有研究表明,补充牡蛎多肽缓解游泳力竭大鼠BLA的升高[11]。提示,牛磺酸结合运动训练和单纯补充牛磺酸有降低血清乳酸的趋势,运动训练、单纯补充驼血多肽和驼血多肽结合运动训练有升高血清乳酸的趋势,但各干预手段对大鼠安静状态时血清乳酸含量无显著影响,不会显著影响机体糖的无氧代谢。
以上研究结果表明,驼血多肽、牛磺酸、运动训练、驼血多肽结合运动训练、牛磺酸结合运动训练对机体安静时氨基酸代谢,蛋白质合成和分解,糖的无氧代谢均无显著性影响。
3.4 驼血多肽及运动训练对大鼠腓肠肌线粒体三羧酸循环功能的影响
已有研究表明,运动训练通过诱导骨骼肌适应,从而提高机体运动能力和健康水平。在此过程中,线粒体具有显著的可塑性,对骨骼肌收缩所引发的一系列信号刺激做出相应的应答反应,以适应骨骼肌对代谢的需求[12]。耐力训练可以显著提高田径运动员肌肉CS活性。13周65%VO2max持续中等强度训练显著提高股薄肌CS活性[13]。还有研究表明,多肽类制剂能够被机体快速吸收,且吸收效果比蛋白质好,加快葡萄糖、氨基酸和蛋白质的利用速率。本研究结果表明,运动训练、牛磺酸、驼血多肽结合运动训练、牛磺酸结合运动训练均能提高大鼠腓肠肌线粒体CS活性,其中驼血多肽结合运动训练、牛磺酸结合运动训练显著性提高,单纯补充驼血多肽使大鼠腓肠肌CS活性降低,但无显著性差异,各组CS活性由高到低顺序为:PE组>TE组>E组>T组>C组>P组。表明,补剂结合运动训练在改善三羧酸循环关键酶CS活性方面效果较佳,且驼血多肽要好于牛磺酸。这可能与驼血多肽中富含的氨基酸及支链氨基酸碳骨架被机体吸收作为能源底物,从而提高了三羧酸循环酶的活性,增加肌肉的产能速率,满足机体运动中对能量的需求有关。本研究结果还显示,在提高CS活性方面驼血多肽结合运动训练显著高于单纯补充驼血多肽,提示,拟通过相关补剂更好地提高三羧酸循环速率,结合运动训练是必要的。
已有研究表明,长期有氧运动有利于骨骼肌α-KGDHC活性和有氧工作能力的提高[14]。本研究结果显示,各组α-KGDHC活性均有所升高,其中只有牛磺酸结合运动训练具有显著性,且效果最佳,其次为驼血多肽结合运动训练。各组α-KGDHC活性由高到低顺序为TE组>PE组>E组>T组>P组>C组。提示,拟通过相关补剂更好地提高三羧酸循环速率,结合运动训练是必要的。另外,驼血多肽与牛磺酸对三羧酸循环关键酶活性的影响程度是有差异的。
3.5 驼血多肽及运动训练对大鼠腓肠肌线粒体呼吸链功能的影响
已有研究表明,大强度耐力运动能显著提高大鼠骨骼肌线粒体呼吸链CⅠ活性[15]。补充牡蛎多肽缓解游泳力竭大鼠骨骼肌呼吸链复合体CⅠ~Ⅳ活性的降低[11]。补充支链氨基酸(branched chain amino acid,BCAA)能减少游泳运动后大鼠骨骼肌线粒体K+、Ca2+和Mg2+含量的下降,改善运动后线粒体功能,有利于提高大鼠运动能力。本研究结果显示,各组CⅠ活性均有所升高,其中驼血多肽结合运动训练和单纯运动训练具有显著性,各组CⅠ活性由高到低顺序为PE组>E组>TE组>T组>P组>C组,表明,在提高大鼠腓肠肌线粒体呼吸链CⅠ活性方面,驼血多肽结合运动训练效果最佳。这可能与驼血多肽富含BCAA,为适应机体运动对能量的需求,增加了三羧酸循环速率,使呼吸链底物NADH增多,从而使CⅠ活性提高有关。
本课题组前期的研究发现[6],肉碱结合运动训练能显著提高大鼠骨骼肌线粒体呼吸链CⅣ活性。本研究结果显示,各组线粒体呼吸链CⅣ活性均显著升高,CⅣ活性由高到低顺序为PE组>TE组>T组>E组>P组>C组,表明各干预手段均可显著提高呼吸链CⅣ活性,其中驼血多肽结合运动训练效果最佳。已有研究表明,线粒体呼吸链超级复合体(mitochondrial respiratory chain supercomplex,mitoSC)mito SCI1+III2+IV1-4是哺乳动物线粒体中最丰富的,且肌肉组织中mitoSC具有特异性,CⅠ几乎全部存在于mitoSC中[16]。运动能促进mito SCI1+III2+IV1-4含量和活性的提高[17]。驼血多肽结合运动训练提高了CⅠ活性,由于骨骼肌线粒体呼吸链超级复合体的存在,从而促使CⅣ活性也得到提高。CⅠ与CⅣ活性的提高可能还与mito SCI1+III2+IV1-4的组装增多有关。
本研究结果显示,CⅤ活性除补充驼血多肽不及安静组(无显著性差异)外,其余各组CⅤ活性均升高,其中只有牛磺酸结合运动训练具有显著性差异,牛磺酸结合运动训练还显著高于驼血多肽结合运动训练和单纯运动训练,驼血多肽结合运动训练显著高于单纯补充驼血多肽,单纯补充牛磺酸显著高于单纯补充驼血多肽。各组CⅤ活性由高到低顺序为TE组>PE组>T组>E组>C组>P组,表明,补剂结合运动训练在提高呼吸链CⅤ方面要好于单纯补剂和单纯运动训练,且牛磺酸结合运动训练效果最佳,其次为驼血多肽结合运动训练。这可能与补剂结合运动训练提高了呼吸链CⅠ、CⅣ活性,在氧供充足的情况下,CⅣ不仅可促进下游的氧代谢,还能提高线粒体膜电位[18],进而激活CⅤ活性有关。以上研究表明,驼血多肽结合运动训练和牛磺酸结合运动训练在提高大鼠骨骼肌线粒体呼吸链功能方面,效果较好,拟通过相关补剂提高线粒体呼吸链功能,结合运动训练是必要的。
3.6 驼血多肽及运动训练对大鼠腓肠肌抗氧化酶活性的影响
已有研究表明,强度较低的有氧运动可提高机体的抗氧化能力,有氧运动可提高大鼠骨骼肌SOD和GSH-Px的活性,补充BCAA有利于抗氧化酶活性的提高以及机体运动后自由基的减少。本研究结果显示,各组腓肠肌SOD活性均升高,其中驼血多肽结合运动训练具有显著性差异。各组SOD活性由高到低顺序为:PE组>E组>P组>TE组>T组>C组,说明,各干预手段均可提高大鼠腓肠肌SOD活性,其中驼血多肽结合运动训练效果最佳。已有研究表明,BCAA能够抑制小鼠脂质过氧化反应,清除生成的过量自由基。本研究结果显示,各组大鼠腓肠肌GSH-Px活性均升高,其中驼血多肽结合运动训练、牛磺酸结合运动训练和单纯补充牛磺酸具有显著性差异,驼血多肽结合运动训练还显著高于单纯运动训练和单纯补充驼血多肽,单纯补充牛磺酸显著高于单纯补充驼血多肽,各组GSH-Px活性由高到低顺序为PE组>TE组>T组>E组>P组>C组,说明,各干预手段均可提高大鼠腓肠肌GSH-Px活性,补剂结合运动训练在提高骨骼肌GSH-Px活性方面要好于单纯补剂和单纯运动训练,且驼血多肽结合运动训练效果最佳。
已有研究表明,运动训练能够提高青年大鼠体内的CAT活性。本研究结果显示,除单纯补充驼血多肽CAT活性有所降低(无显著性差异)外,其余各组均升高,其中驼血多肽结合运动训练具有显著性差异,驼血多肽结合运动训练和单纯补充牛磺酸还显著高于单纯补充驼血多肽,CAT活性由高到低顺序为PE组>TE组>E组>T组>C组>P组。说明,补剂结合运动训练在提高骨骼肌CAT活性方面要好于单纯的运动训练和单纯的补剂,其中驼血多肽结合运动训练效果最佳。以上研究表明,在提高大鼠骨骼肌抗氧化能力方面,驼血多肽结合运动训练效果最佳。其机制可能与驼血多肽富含BCAA有关,这是因为已有研究认为,BCAA通过某些通路调节蛋白的合成,增加机体SOD等抗氧化酶的合成以消除运动产生的自由基。
3.7 驼血多肽及运动训练对氧自由基及脂质过氧化终产物的影响
已有研究表明,6周中等强度运动大鼠腓肠肌·OH生成率显著低于安静对照大鼠[19]。已知大豆多肽抗氧化能力强,作为营养补充剂缓解运动性疲劳[20]。本研究结果也显示,各干预手段均可降低大鼠腓肠肌ROS荧光强度。除单纯运动训练无显著性差异外,单纯补充驼血多肽和牛磺酸、补充驼血多肽结合运动训练和补充牛磺酸结合运动训练均具有显著性差异,补剂结合运动训练还显著低于单纯运动训练,补充驼血多肽结合运动训练和单纯补充牛磺酸显著低于单纯补充驼血多肽,补充牛磺酸结合运动训练显著高于单纯补充牛磺酸和驼血多肽结合运动训练。各组大鼠腓肠肌ROS荧光强度由低到高顺序为PE组﹤T组﹤TE组﹤P组﹤E组﹤C组,提示,在降低大鼠腓肠肌ROS方面,驼血多肽结合运动训练效果最佳。已有研究表明,有氧运动能降低机体或组织的MDA水平,牛磺酸具有抗疲劳功效,也可以降低机体MDA水平。服用支链氨基酸、牛磺酸和复合氨基酸可有效降低骨骼肌MDA含量。本研究结果显示,各干预手段均可降低大鼠腓肠肌MDA含量,其中补充驼血多肽结合运动训练、单纯补充驼血多肽和牛磺酸具有显著性差异,各组MDA含量由低到高顺序为:PE组﹤T组﹤P组﹤TE组﹤E组﹤C组。说明,在降低大鼠腓肠肌MDA含量方面,驼血多肽结合运动训练效果最佳。其机制可能与本研究结果显示的驼血多肽结合运动训练增强了腓肠肌抗氧化酶活性有关。以上研究表明,在减少大鼠腓肠肌氧自由基产生、降低脂质过氧化方面,驼血多肽结合运动训练效果最佳。
驼血多肽结合运动训练可提高骨骼肌线粒体三羧酸循环和呼吸链功能,提高骨骼肌抗氧化能力,减少自由基的产生和脂质过氧化损伤,且效果优于单纯补充驼血多肽或单纯运动训练。
致谢:感谢中国科学院兰州化学物理研究所邸多隆、刘永峰和李云春研究员为本研究提供的资源和技术帮助。

