黑水虻抗菌肽的研究进展
王 青,陈 俊,李潇潇,侯梅芳
上海应用技术大学,上海 201418
抗菌肽(antimicrobial peptides,AMPs)是昆虫在受到微生物感染或意外伤害时,由脂肪体内合成并释放到血淋巴中的一类小分子活性多肽,在体液免疫防御中发挥了重要作用。AMPs具有强碱性、热稳定性和广谱抗菌活性,并对真菌、病毒、寄生虫及癌细胞也具有一定的杀灭作用[1-2]。由于AMPs具有广泛的生物学活性,尤其是对某些耐药性病原菌也有一定的杀灭作用,因此被认为是理想的抗生素替代物,在畜牧业、食品医药和化妆品等领域都具有巨大应用价值和市场潜力[3]。
黑水虻,英文名black soldier fly,又称亮斑扁角水虻(HermetiaillucensL.),原产于美洲,目前是全世界广泛分布的双翅目水虻科昆虫,生命周期短,繁殖速度快。其幼虫主要靠取食腐烂有机物、动物粪便或餐厨垃圾等有机废弃物获取营养,并能够高效转化为昆虫蛋白,经黑水虻处理过的粪便可以成为优质有机肥[4]。由于黑水虻幼虫取食时机体暴露于高浓度有害物中,复杂的环境因子诱使其产生AMPs等免疫活性物质来抵抗病原微生物[5],但黑水虻虫体中几乎检测不出沙门氏菌等病原菌,因此还被作为饲料使用[6]。随着黑水虻养殖业的蓬勃发展,黑水虻体内强大的免疫系统引起了学术界的关注。
本文主要综述了近年来包括黑水虻在内的昆虫抗菌肽的种类、结构特征、抑菌活性及生产应用,分析了国内外在该领域取得的研究进展,为研究黑水虻抗菌肽的构效关系提供了思路,同时也为开发黑水虻抗菌肽产品提供了理论支持。
1 黑水虻抗菌肽的种类及结构特征
1974年,研究人员首次在接种了细菌的巨型蚕蛾蛹中观察到昆虫的抗菌活性,6年之后第一个昆虫AMP(cecropin)从盲蝽蛹中纯化出来,随后几十年的研究已经鉴定出多类型的AMPs[2],在AMPs数据库APD(http://aps.unmc.edu/AP)列出的3 087种AMPs中有305种来自昆虫[7]。昆虫抗菌肽是带有正电荷且具有两亲性的阳离子多肽,一般由几十个氨基酸残基组成,其空间结构为线性或带环状[8],二级结构主要由α-螺旋和β-折叠组成。根据其氨基酸序列和结构特征大致可以分为三类,分别为无半胱氨酸残基的线性α-螺旋肽(天蚕素类,cecropin and moricin),具有6~8个保守半胱氨酸残基、由3或4个二硫键桥的β-折叠结构多肽(防御素类,defensinh和drosomycin),富含脯氨酸和甘氨酸等特定氨基酸残基的抗菌肽(apidaecin、drosocin、lebocin、attacin和gloverin)[9]。在昆虫抗菌肽中,天蚕素、防御素、脯氨酸肽和攻击素是比较普遍的[2],常见的双翅目昆虫抗菌肽的名称和其抑菌范围见表1。

表1 双翅目昆虫抗菌肽的种类和抑菌作用[8]Table 1 Species and antimicrobial activity of antimicrobial peptides from Diptera [8]
近年来,越来越多的学者从事黑水虻幼虫抗菌肽的研究,并分离出多种AMPs,如天蚕素[10]、防御素[11]和攻击素[12],并验证了其抗菌活性。
1.1 天蚕素类抗菌肽
天蚕素最初是从大蚕蛾(cecropia moth)的血淋巴中分离出来的[13],是一类阳离子AMPs,一般含有31~39个氨基酸残基,不含半胱氨酸,所以不能形成分子内二硫键,大多数天蚕素在C端被酰胺化,酰胺化能促进天蚕素与脂质体的相互作用,酰胺化对其抗菌活性也具有重要作用[2]。其N端区域具有强碱性,且多含一个色氨酸残基,可形成双亲螺旋结构[8]。Park等[10]从黑水虻幼虫血淋巴中提取了天蚕素样肽(CLP1),纯化测定其分子量为4 840 Da。在NCBI BLAST比对中,发现CLP1的氨基酸序列与果蝇天蚕素C的同源性为60%,其特征为阳离子、线性、α-螺旋和两亲性多肽,并对革兰氏阴性菌有抑菌活性。Park等进一步采用RACE-PCR方法对N-末端氨基酸测序鉴定的新型CLPs的cDNA序列进行分析,获得了3个CLP基因(CLP1~3),将CLP1~3成熟肽的氨基酸序列与报道的双翅目昆虫天蚕素氨基酸序列比较显示,相似程度为60%~65%(见图1)。

图1 黑水虻天蚕素CLP1~3氨基酸序列与双翅目昆虫天蚕素的比对[10]Fig.1 Multiple alignment of amino acid sequences of H.illucens CLP1-3 with dipteran cecropins [10]注:*相同氨基酸;黑色:保守的氨基酸序列,下同。Note:*Consensus amino acids;Black box:Conserved amino acids,the same below.
1.2 防御素类抗菌肽
此类AMPs主要有防御素(defensins)和果蝇毒素(drosomycins)[8],昆虫防御素一般由29~34个氨基酸组成的富含二硫键的阳离子型多肽,氨基酸序列中都含有6个保守半胱氨酸和3个分子内二硫键,其中2个二硫键连接C端β-片层和α-螺旋,第3个二硫键连接N端和第二个β-片层形成回路,即单个α-螺旋和两个反向平行的β-片层结构域,构成稳定的发夹状结构[14]。Park等[11]通过注射金黄色葡萄球菌诱导黑水虻幼虫产生抗菌肽,提取血淋巴并使用固相萃取和反相色谱法纯化得到新型防御素样肽(defense-like peptide 4,DLP4),分子量为4 267 Da,DLP4对革兰氏阳性菌表现出较强的抗菌活性,对革兰氏阴性菌没有活性,新型防御素(DLP)是第一个从黑水虻体内分离出来的抗菌肽。为了分析N端氨基酸序列中新发现的DLP的cDNA序列,Park等采用RACE-PCR方法对黑水虻的AMP基因进行全序列分析,得到4个不同的DLP基因(DLP1-4),通过DLP1-3和DLP4相比较,ORF中成熟肽和碱性氨基酸数量存在显著性差异,该氨基酸被认为是AMP抗菌活性的关键氨基酸。进一步将DLP1-4成熟肽的氨基酸序列与报道的双翅目昆虫防御素氨基酸序列比较表明,相似程度为72.5%~75%(见图2),特别是半胱氨酸的位置与双翅目昆虫是相同的,N端回路、α-螺旋、β链的氨基酸的序列是相当保守的。

图2 黑水虻防御素DLP1-4的氨基酸序列与双翅目昆虫防御素比对[11]Fig.2 Multiple alignment of amino acid sequences of H.illucens DLP1-4 with dipteran defensins [11]
1.3 富含特殊氨基酸的抗菌肽
此类AMPs一般指富含脯氨酸和甘氨酸的抗菌肽,富含脯氨酸的抗菌肽主要包括蜜蜂抗菌肽(apidaecins),果蝇素(drosocins)和家蚕抗菌肽(lebocins)等,由14~39个氨基酸残基,根据分子大小可分为两个亚族:短链亚族(小于20个氨基酸残基)和长链亚族(大于20个氨基酸残基)[15],其中一个是高度保守的结构域,具有抗菌活性;另一个结构域有更多的变量,起到特异性靶向的作用[8],并且对革兰氏阴性菌有较强的抗菌活性[16]。此外,富含甘氨酸的抗菌肽,分子量大小在8~30 kDa,含14%~22%的甘氨酸残基,具有O-糖基化,如攻击素(attacins)、双翅肽(diptericins)、肉蝇毒素(sarcotoxins Ⅱ)、天蚕葛老素(gloverins)等都属于这一类[17,18]。Shin等[12]通过对黑水虻免疫脂肪体制备的cDNA文库进行筛选,获得编码类攻击素(attacin)蛋白的cDNA并进行克隆得到新型黑水虻攻击素(HI-attacin),预测由169个氨基酸组成,分子量为17.7 kDa。HI-attacin对大肠杆菌和耐甲氧西林金黄色葡萄球菌(MRSA)均具有抗菌活性。与其他双翅类attacins相比,HI-attacin的N端G1结构域短于其它双翅目昆虫,含46个氨基酸;而C端G2结构域较G1区保守,包含120个氨基酸(见图3)。

图3 黑水虻攻击素HI-attacin的氨基酸序列与双翅目昆虫攻击素比对[12]Fig.3 Multiple alignment of amino acid sequences of H.illucens attacin with dipteran defensins [12]
2 作用机制
AMPs作用机制是非常复杂的,可以通过多种机制杀死细菌,包括膜破坏,干扰细菌代谢以及靶向细胞质成分[19]。关于AMPs作用机制主要有离子通道学说、抑制细胞呼吸学说、抑制细菌细胞壁的形成学说、胞内损伤假说等几种观点来解释[20]。不同AMPs的作用机制可能不一致,尚有待进一步研究。
2.1 作用于细胞膜机制
由于AMPs带阳离子,Ongey等[21]认为AMPs可通过静电或疏水与微生物阴离子表面的相互作用和插入磷脂双分子层发挥作用,以改变膜的通透性。AMPs可以在细菌细胞质膜上穿孔而形成离子孔道,造成细菌细胞膜结构破坏引起胞内水溶性物质大量渗出,而最终导致细菌死亡。因此,AMPs与膜之间的相互作用与AMPs的抗菌活性直接相关。目前,主要有四种作用模型用于描述AMPs作用于细胞膜:桶形壁模型、地毯模型、环形孔模型和凝聚模型[22](图4)。例如,天蚕素和天蚕素样肽(cecropins)对G-抗菌活性要强于G+,它与细胞膜相接触是以其长轴α-螺旋结构域平行于脂质双分子层表面,极性残基与磷脂相互作用,非极性残基埋入膜的疏水核心。在高浓度时,cecropins形成地毯状结构破坏细胞膜,具有类似洗涤剂的特性。在低浓度时,cecropins形成孔隙影响细胞电解质平衡,并最终导致细菌死亡[7]。
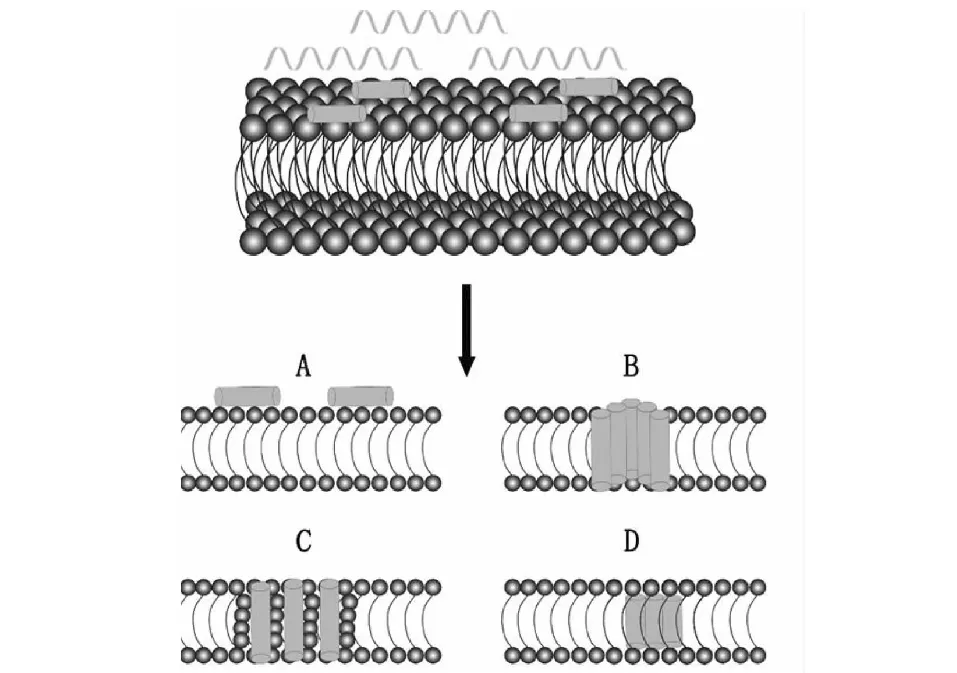
图4 抗菌肽作用细胞膜机制模型[22]Fig.4 Mechanism model of antibacterial peptide acting on cell membrane [22] 注:A.毯式模型;B.桶板模型;C.环孔模型;D.聚集模型。Note:A.The carpet model;B.The barrel-stave model;C.The toroidal pore model;D.The aggregate model.
2.2 细胞内杀伤机制
富含脯氨酸的抗菌肽(pyrrhocoricin、drosocin和apidaecin)与其他类型的抗菌肽不同,主要是抗G-。其作用方式不涉及膜的溶解,而是通过进入易感细胞在细胞内部产生功效。通过定位于细胞内相应位点阻碍或抑制细胞组分的合成,从而对细胞造成杀伤作用[23]。AMPs在细胞内部的靶点主要是70 kDa热休克蛋白DnaK[3]。它们还可以通过与核酸结合而干扰DNA和RNA的合成[24](图5),这一特性使它们成为一种新型潜在的细胞穿透肽。

图5 抗菌肽细胞内杀伤机制模型[23]Fig.5 Model of intracellular killing mechanism of antimicrobial peptides [23]
3 黑水虻抗菌肽的生产制备
目前AMPs主要通过3种途径获取,一是直接从昆虫体内分离纯化;二是化学合成;三是生物工程法[25]。根据近几年的研究报道,黑水虻抗菌肽主要采用从虫体直接分离提纯和异源表达。Park等[26]最初研究黑水虻抗菌肽时,直接将黑水虻幼虫冻干粉用甲醇萃取,再使用高效液相色谱法从幼虫提取物中分离出具有广谱抗菌活性的黑水虻抗菌肽并用Edman降解法鉴定防御素的氨基酸序列。由于直接提取分离得到的AMPs产量不高,而化学合成法的提取工艺复杂,且成本高、耗时长,因此这两种途径都不足以达到规模化工业生产,从而限制了AMPs的产业化应用[18]。近年来,国内外研究人员开始利用基因工程的方法生产制备黑水虻抗菌肽,通过AMPs基因克隆到细菌和真菌载体进行重组融合表达[27]。重组表达制备AMPs的工艺在不断优化,但仍远高于传统药物的制造成本。
3.1 黑水虻抗菌肽的重组表达
3.1.1 大肠杆菌表达系统生产抗菌肽
从20世纪80年代开始,人们就运用大肠杆菌表达系统表达AMPs,具有遗传背景清楚、成本低、表达量高和表达产物分离纯化相对简单等优点。在所有基因工程菌生产AMPs的方法中,大肠杆菌表达系统是最常见的。但是AMPs对宿主细胞的毒性抑制了其在大肠杆菌体内的表达量,因此多采用融合蛋白方式来降低昆虫抗菌肽对大肠杆菌菌株的毒性,表达后再经化学裂解或者酶解处理后得到有抗菌活性的表达产物[20]。Elhag等[28]从黑水虻中分离出189 bp新型AMPs基因stomoxynZH1,利用PCR技术克隆出AMPs基因并连接到表达载体pET32a,然后转入大肠杆菌BL21(DE3)中表达,结果表明基因工程菌株的表达产物重组肽(Trx-stomoxynZH1)对大肠杆菌和金黄色葡萄球菌均有抑制作用。
3.1.2 枯草芽孢杆菌表达系统生产抗菌肽
枯草芽孢杆菌是一种革兰氏阳性细菌,具有非致病性和分泌蛋白能力强的特性,是目前原核表达系统中表达和分泌外源蛋白的理想宿主,成为原核表达系统中的一种重要的模式菌株[29]。Xu[30]利用大肠杆菌-枯草芽孢杆菌穿梭载体PMA5质粒和PAX01质粒构建整合型大肠杆菌-枯草芽孢杆菌穿梭载体质粒PAX01-KANA,成功构建含有黑水虻幼虫抗菌肽 DLP4、沙蛾抗菌肽SMFP和天蚕素融合基因Cecropin AD三段抗菌肽基因的枯草芽孢杆菌工程菌。结果显示,工程菌株发酵液对大肠杆菌有明显的抑菌活性,工程菌在LB 液体培养基中生长良好。Ji等[31]将CAM-W、EDDIE和信号肽SacB融合基因转移到由启动子Pg/v控制的pDM03载体中,转化到枯草芽孢杆菌内,形成高效表达的重组枯草芽孢杆菌WB700表达系统,在上清发酵液中Cecropin A-melittin浓度高达159 mg/L。
以上两种表达系统是目前基因工程领域研究应用最广泛、遗传表达图谱最清楚的原核表达系统。虽然大肠杆菌表达系统应用较多,但表达的蛋白质以包含体形式存在,与大肠杆菌内毒素不易分离,缺少蛋白质翻译后修饰和加工过程,且杂蛋白多,纯化步骤复杂[30]。枯草芽孢杆菌的表达系统研究虽然起步较晚,但其本身具有一些独特的优势:安全无毒、较强的蛋白分泌能力和发酵工艺成熟[29],因此也受到研究人员的关注。此外,还有真核表达系统和杆状病毒表达系统等,随着研究的不断深入有望成为满足黑水虻抗菌肽工业化生产需求的表达系统[20]。
4 黑水虻抗菌肽的应用前景
昆虫抗菌肽具有抗菌活性、抗病毒活性、抗寄生虫活性、抗肿瘤细胞活性和抗炎活性等生物学活性[8],因此可以应用在农牧业、医药、食品、化妆品以及保健品等领域。目前,黑水虻幼虫主要集中用于畜禽粪便等有机垃圾的无公害处理[32],研究人员也在加强黑水虻抗菌肽及其他系列产品的开发。
4.1 在饲料添加剂领域的应用
黑水虻含有较丰富的粗蛋白质且氨基酸种类较齐全,不饱和脂肪酸、矿物质和类胡萝卜素等,还能提取几丁质、AMPs等生物活性物质,是一种优质蛋白质饲料原料[33]。Yu等[34]研究发现,添加黑水虻幼虫可以提高猪肉的品质。黑水虻幼虫抗菌肽可以作为饲料添加剂提高畜禽免疫力,提高畜禽生长性能。Ren等[35]报道,在饲料中添加500 mg/kg的AMPs可显著提高断奶仔猪血液中免疫球蛋白IgG、IgM、IgA与血清总补体CH50等免疫因子的含量。Dong等[36]研究在饲养鲤鱼时添加AMPs,可以降低血清中的甘油三酸酯水平,增强抗氧化性并提高鲤鱼的免疫力。结果表明,适当浓度的AMPs作为鲤鱼饲料中的补充剂可以提高生长性能。由于AMPs拥有良好的理化特性,所以在饲料加工过程中也不会丢失活性,还可以提高饲料的品质和延长保质期。
4.2 在生物医药领域的应用
目前很多企业已在AMPs药物方面做了大量的研究,并有一些含AMPs成分的产品上市。由于抗生素滥用导致多重耐药菌的产生,因此AMPs被认为是理想的抗生素替代品[27]。此外,AMPs的抗癌效果也被国内外学者所关注。Lee等[37]分离出黑水虻幼虫的血淋巴中的抗菌肽HP/F9,证实该肽在体外有效抑制肺炎克雷伯菌的生长,并有效保护小鼠免受肺炎克雷伯菌的感染,这项研究为HP/F9可用作新型抗菌物质,用于治疗细菌感染。夏嫱课题组对黑水虻幼虫抗菌肽的医用价值做了大量研究,发现其可以抑制鼻喉癌肿瘤细胞生长[38]。目前已有大量不同治疗目的肽类药物进入临床或批准上市,如GRN-1201、WT-2725、ITK-1等[39]。昆虫的抗菌肽的药用价值在我国中医药中很早就有记载,如将家蝇幼虫洗净晒干后与其他中药配制,用于治疗感染性疾病[40]。
4.3 在食品安全领域的应用
食品安全中最主要的问题就是微生物污染和化学防腐剂的添加,AMPs作为天然的防腐剂,具有广阔的应用前景[41]。AMPs在食品安全领域的应用包括两个方面,一是在食品原料控制环节应用,减少或替代抗生素的使用,提高食品加工原料的安全品质;二是在食品防腐保鲜环节,作为高效、安全生物防腐剂应用于食品加工、储运等诸多环节,解决食品防腐剂的残留问题,同时也减少环境耐药性菌株的产生,进而改善食品安全环境条件[42]。Secci等[43]用黑水虻幼虫粉替代大豆粉饲养母鸡,鸡蛋的质量明显提高,保障了食品原材料的安全。Choi等[44]从黑水虻幼虫中提取到抗菌肽ME,对导致食品污染的宋内志贺氏菌有较强的抑制活性。此外,不同种类的黑水虻抗菌肽还对导致食源性污染的大肠杆菌[10]、金黄色葡萄球菌[11]也有抑制作用。
4.4 在化妆品添加剂领域的应用
AMPs由于其独特的抗菌、无毒和无刺激性等优点,也被用于化妆品生产。昆虫抗菌肽不仅可作为营养成分,更主要的是其抗菌和美容作用具有独特的优势和广泛的市场潜力。Tonk等[45]提出将具有抗皮肤癌效果的AMPs和个人护理产品,可以在皮肤癌在症状变得明显之前通过消除新生癌细胞来预防和增强人体健康。已证实多种抗菌肽可以对抗痤疮丙酸杆菌而具有治疗痤疮的潜能[46,47]。黑水虻抗菌肽CLP1对铜绿假单胞菌有抑制作用[10],再加上AMPs的抗炎作用[48],也为开发黑水虻抗菌肽消炎祛痘的化妆品提供了新的思路。
5 总结
黑水虻作为一种新型“资源昆虫”,近年来备受国内外学者关注。黑水虻体内可生产抗菌肽等具有高附加值的产品,对黑水虻养殖业带来了新的发展。黑水虻抗菌肽不仅具有广谱抗菌效果,还具备抗病毒、抗寄生虫、抗肿瘤细胞和抗炎等活性,与传统抗生素相比有很大的优势,在饲料、食品、医药与化妆品领域具有广泛的应用前景,成为了目前生物活性肽的研究热点之一。但黑水虻抗菌肽天然提取难度较大,化学合成成本过高,基因工程表达表达量偏低,其制备技术制约了其大规模的生产,此外,黑水虻抗菌肽体内活性机制也有待进一步研究明确。随着基因工程技术和蛋白质组学技术的进步,我们相信黑水虻抗菌肽在不远的将来会实现产业化发展,并带来更大的经济效益和社会效益。

