88例重叠肌炎的临床及免疫学特征
肖云抒,朱冯赟智,罗 澜,邢晓燕,李玉慧△,张学武,沈丹华
(1.北京大学人民医院病理科,北京 100044;2.北京大学人民医院风湿免疫科,北京 100044)
特发性炎性肌病(idiopathic inflammatory myopathies,IIMs)是一组以特征性皮疹及四肢近端肌无力为主要表现的异质性自身免疫病,主要包括皮肌炎(dermatomyositis,DM)、多发性肌炎(polymyositis,PM)、免疫介导坏死性肌病(immune-mediated necrotizing myopathy,IMNM)等。IIMs可累及多系统,肺、心脏受累多见。重叠肌炎(overlap myositis,OM)为IIMs与一种及以上的其他结缔组织病(connective tissue disease,CTD)同时或先后出现,包括系统性红斑狼疮(systemic lupus erythematosus,SLE)、干燥综合征(Sjögren’s syndrome,SS)、类风湿关节炎(rheumatoid arthritis,RA)、系统性硬化症(systemic sclerosis,SSc)。OM兼有两种及以上CTD特征,肌肉外受累多见[1-2],虽然OM在IIMs中并不少见,但目前对其临床及免疫学特征研究少[2-3],本文重点对其临床及免疫学特征进行分析以提高对疾病的诊治水平。
1 资料与方法
1.1 研究对象
共纳入2004年1月至2020年8月于北京大学人民医院住院的368例IIMs患者,均符合2017年欧洲抗风湿病联盟(European League Against Rheumatism, EULAR)/美国风湿病学会(American College of Rheumatology,ACR)建议的IIMs分类标准[4]。OM患者符合IIMs和其他CTD的诊断[5],SSc患者符合2013年EULAR/ACR硬皮病分类标准[6],RA患者符合2010年EULAR/ACR分类标准[7],SS患者符合2002年欧美专家共识组(American-European Consensus Group,AECG)分类标准[8],SLE患者符合2019年ACR分类诊断标准[9]。抗合成酶综合征(anti-synthetase syndrome,ASS)患者符合2011年Sothemier标准[10],PM、IMNM、DM患者符合2017年国际肌病协作组建议的IIMs分类标准[4],排除肿瘤相关肌炎、包涵体肌炎和起病年龄<18岁的患者。
1.2 临床及实验室资料
临床资料包括患者人口学特征和临床表现(发热、Gottron征/疹、向阳疹、披肩征、V型疹、皮肤破溃、技工手、甲周红斑、皮肤钙质沉着、肌痛、肌无力、关节炎、雷诺现象、吞咽困难、间质性肺炎、心脏受累、肺动脉高压),间质性肺炎通过胸部高分辨CT确诊,肺动脉高压通过超声心动图估算静息状态下收缩期肺动脉压>30 mmHg确诊。实验室指标包括丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate amino transferase,AST)、乳酸脱氢酶(lactic dehydrogenase,LDH)、肌酸激酶(creatine kinase,CK)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C-reactive protein,CRP)和自身抗体。自身抗体包括抗核抗体(antinuclear antibodies,ANA)、类风湿因子(rheumatoid factors,RF)、肌炎相关性抗体(myositis-associated autoantibodies,MAAs)和肌炎特异性抗体(myositis-specific autoantibodies,MSAs)。MAAs包括抗Ku抗体、抗多肌炎/硬皮病(polymyositis/systemic scleroderma,PM/Scl)75/100抗体、抗Ro-52抗体。MSAs包括抗Mi-2、抗转录中介因子-1γ(transcription intermediary factor-1γ,TIF-1γ)抗体、抗黑色素瘤分化相关基因5(melanoma differentiation associated gene 5,MDA5)抗体、抗核基质蛋白2(nuclear matrix protein 2,NXP2)抗体、抗小泛素样修饰物活化酶(small ubiquitin-like modifier activation enzyme,SAE)抗体、抗SRP抗体和抗酰胺tRNA合成酶抗体(anti-aminoacyl-tRNA synthetase antibody,抗ARS抗体)。抗ARS抗体包括抗Jo-1抗体、抗苏氨酰tRNA合成酶(threonyl tRNA synthetase,PL-7)抗体、抗丙氨酰tRNA合成酶(alanyl tRNA synthetase,PL-12)抗体、抗甘氨酰tRNA合成酶(glycyl tRNA synthetase,EJ)抗体、抗异亮氨酰tRNA合成酶(isoleucyl tRNA synthetase,OJ)抗体。
1.3 统计学分析

2 结果
2.1 OM患者的临床特征
在纳入研究的368例IIMs患者中,23.9%(88/368)为OM患者,其中女性75例(85.2%),发病年龄(50.3±14.4)岁。OM患者和非OM患者相比,女性比例高(85.2%vs.72.1%,P=0.016),病程长[13.5(4.5,48.0)个月vs.4.0(2.0,12.0)个月,P<0.001)]。临床表现上,OM患者比非OM患者V型疹(25.0%vs.44.6%,P=0.001)、甲周红斑(8.0%vs.19.6%,P=0.013)发生率低,雷诺现象(14.8%vs.1.8%,P<0.001)、间质性肺炎(88.6%vs.72.1%,P=0.001)、肺动脉高压(22.7%vs.7.5%,P<0.001)、心脏受累(18.2%vs.9.3%,P=0.033)发生率高(表1)。

表1 OM患者临床特征Table 1 Clinical characteristics of patients with overlap myositis
2.2 OM患者免疫学特征
OM患者和非OM患者相比,AST升高少见(31.8%vs.45.0%,P=0.035),CRP升高多见(58.0%vs.44.6%,P=0.037)。OM患者和非OM患者相比,ANA(85.1%vs.63.4%,P=0.001)、RF(40.2%vs.17.8%,P<0.001)、抗Ro-52抗体(71.6%vs.56.1%,P=0.038)阳性率高(表2)。
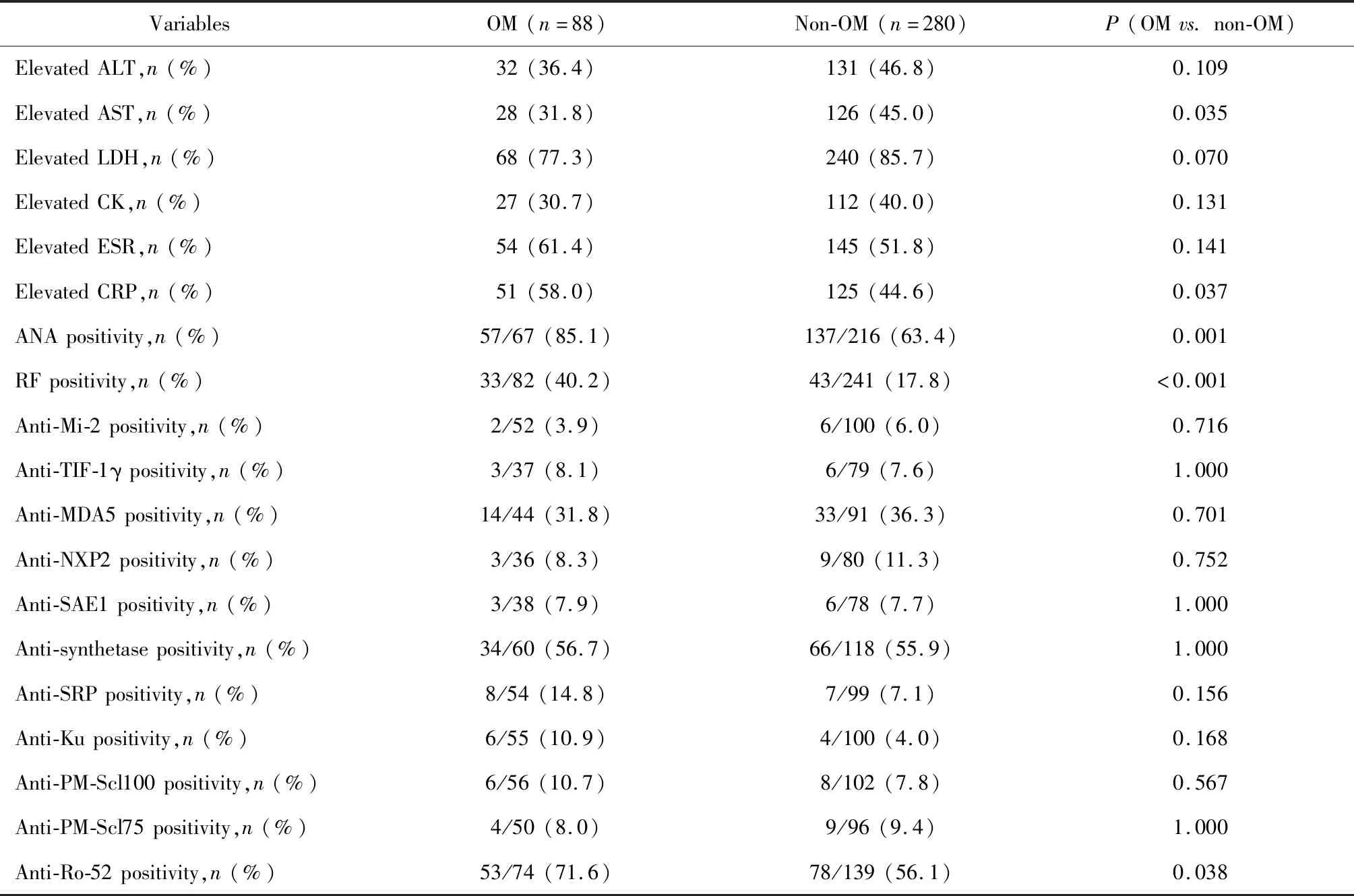
表2 OM患者的免疫学特征Table 2 Immunological characteristics of patients with overlap myositis
2.3 OM患者中肌炎及重叠结缔组织病分布情况
88例OM患者中肌炎亚型分布情况如下:60.2%(53/88)为CTD合并DM,34.1%(30/88)为CTD合并ASS,3.4%(3/88)为CTD合并PM,2.3%(2/88)为CTD合并IMNM。OM患者中合并2种及以上CTD的占17.0%(15/88),包括5例IIMs +SSc+SS,3例IIMs+SLE+SS,3例IIMs+RA+SS,2例IIMs+SSc+RA,1例IIMs+SLE+RA+SS,1例IIMs +SLE+SSc+SS;合并1种CTD的占83.0%(73/88),其中46.6%(34/73)合并SS,20.6%(15/73)合并RA,19.2%(14/73)合并SLE,13.7%(10/73)合并SSc。
2.4 OM患者生存状态分析
368例IIMs患者随访了340例(包括死亡31例),失访28例,随访时间0.3~16.0年,中位随访时间3.9(1.8,7.6)年。IIMs患者病死率为9.1%(31/340),其中OM、非OM患者病死率分别为4.6%(4/87)和10.7%(27/253)。OM与非OM患者的1年生存率和5年生存率差异无统计学意义(图1)。
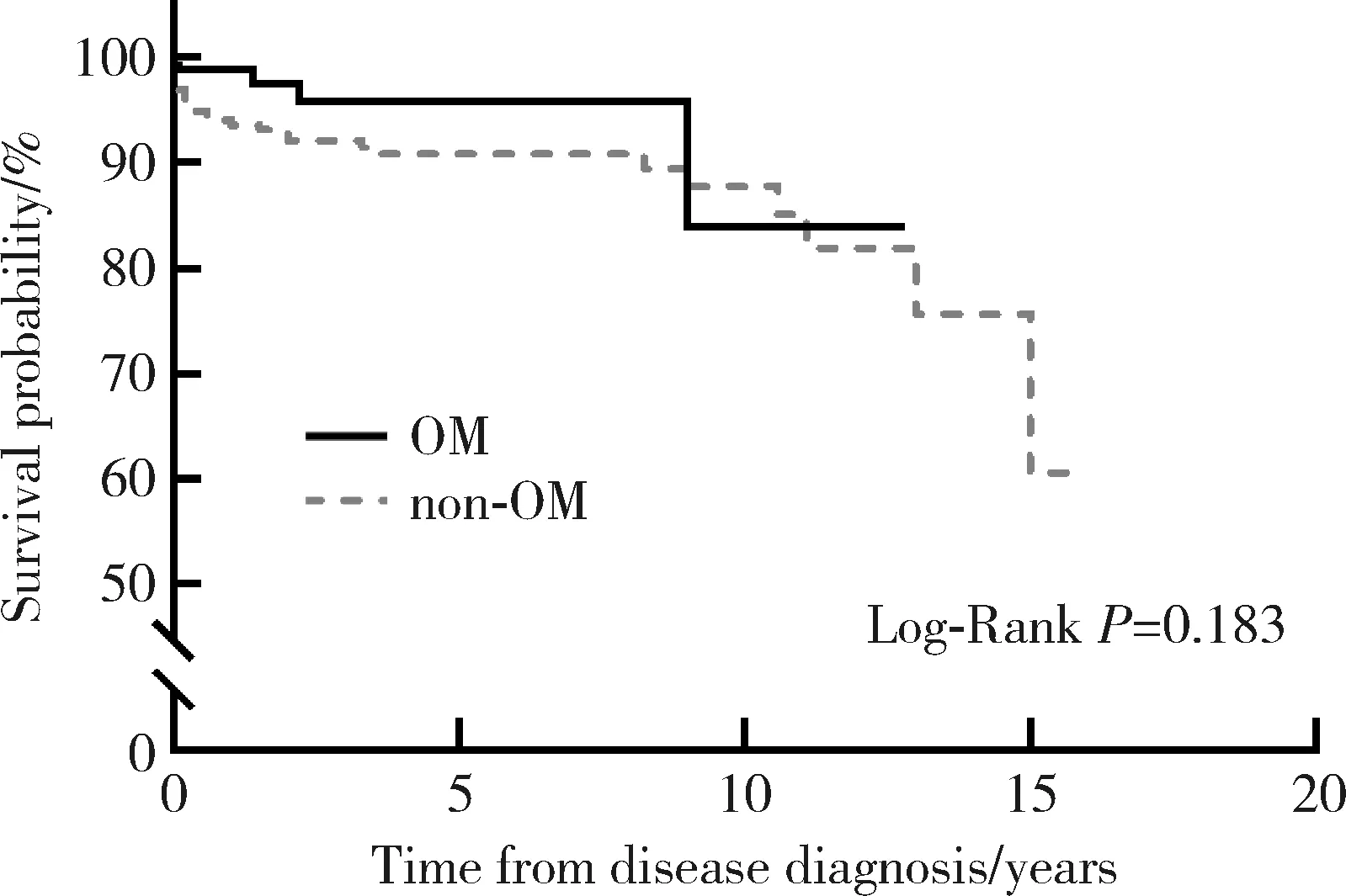
OM,overlap myositis.图1 OM患者及非OM患者的Kaplan-Meier生存曲线分析Figure 1 Kaplan-Meier survival analysis of OM and non-OM patients
3 讨论
OM是较少研究的IIMs亚型,本研究中OM患者占IIMs的23.9%,与既往文献报道OM占IIMs的13.1%[1]~39.4%[11]大致相符。Troyanov等[12]对100例IIMs患者进行平均8.7年随访发现OM患者的比例从24%上升至31%,对于IIMs患者,重叠CTD可以发生在诊断IIMs之后数月乃至数年,因此随访时间对OM的发病率有一定影响。
文献报道OM患者女性占79%~94.9%[2-4],本研究OM患者女性占85.2%,高于非OM患者,与文献报道[2-4]一致,说明女性IIMs患者更容易重叠CTD。Lilleker等[1]报道的OM患者中位病程11个月,长于其他亚型的IIMs患者,本研究的病程与其基本一致,提示临床上对于患有IIMs的女性,在随诊中应警惕重叠其他CTD的风险。
文献报道[2-4,11-12]与其他亚型的IIMs患者相比,OM患者的肌肉外受累发生率增加,包括关节炎(11.7%~66.0%)、雷诺现象(16.8%~65.3%)、间质性肺炎(32.0%~48.0%)、肺动脉高压(15.3%)、心脏受累(12.0%~26.5%),其中一些经常在重叠的CTD中发现,本研究发现OM患者较非OM患者雷诺现象、间质性肺炎、肺动脉高压、心脏受累发生率高,与上述报道[2-4,11-12]一致,提示临床上面对有明显肌肉外受累的IIMs患者应高度警惕是否合并其他CTD。
间质性肺炎是IIMs常见的肺部表现,其发生率约20%~78%[13],本研究结果与文献 [13]一致。抗ARS抗体、抗MDA5抗体、抗Ro-52抗体阳性与IIMs患者的间质性肺炎的发生相关[14],也间接证明了该研究结果。间质性肺炎在OM患者中比较常见且被认为是IIMs患者预后不良的因素[3],其诊断依赖于胸部高分辨CT,该研究结果提示OM患者随诊中应注意复查胸部高分辨CT,早期识别间质性肺炎,给予相应治疗。
IIMs患者肺动脉高压的发病情况和预后影响尚未被充分研究,特别是OM患者合并肺动脉高压的情况。Nuo-Nuo等[3]报道OM患者肺动脉高压的发生率为15.3%。在CTD合并肺动脉高压的研究中发现使用超声心动图评估肺动脉高压会高估其发生率[15-16],本研究评估肺动脉高压的方法是超声心动图,因此可能高估了IIMs患者肺动脉高压的发生率。文献报道[17-18]合并肺动脉高压的IIMs患者均合并间质性肺炎,本研究的结果与其一致,这提示IIMs患者发生肺动脉高压和间质性肺炎可能有较强的相关性。有研究报道[19-20]SLE、SSc患者合并肺动脉高压的比例高于DM/PM,肺动脉高压可能是IIMs患者重叠CTD的结果。Albrecht等[21]报道肺动脉高压是IIMs患者在整体健康状况方面预后不良的指征;Ruiz-Cano等[22]报道CTD相关肺动脉高压的预后差,其5年生存率仅42%,这提示对于合并肺动脉高压的OM患者,随诊中应注意关注其心肺功能,警惕呼吸循环功能障碍。
文献报道OM患者发生心脏受累的比例为12.0%~26.5%[3,12,23-24],发生比例高于无重叠CTD的IIMs患者[3-4],本研究的结果与其相似。心脏受累在IIMs中并不少见并且已被证明是IIMs预后不良的因素[25],但大多数心脏受累是亚临床表现,早期症状不明显,容易被忽视[26]。据报道,心脏受累的亚临床表现有心肌炎、心律失常、传导阻滞等[27],其中ST-T变化和传导阻滞最常见,发生率分别为12.5%~56.7%和25.0%~38.5%[27],主要致死的表现是充血性心力衰竭、心肌梗死、完全性传导阻滞[26],提示对于OM患者,应注意复查心电图。
文献报道[28]IIMs患者出现ANA阳性和RF阳性时重叠CTD的可能性提高,本研究结果与其基本一致。MSAs/MAAs在OM患者中的分布情况有较少的报道:Betteridge等[29]报道IIMs患者重叠CTD与抗PM-Scl抗体、抗Ku抗体相关;Rigolet等[30]报道抗Ku抗体阳性的IIMs患者重叠SSc的比例达45.5%;Maundrell等[31]报道抗PM-Scl抗体、抗Ro-52抗体阳性率在重叠SSc的IIM患者中升高。但本研究中除了抗Ro-52抗体以外的MSAs/MAAs,OM患者与非OM患者阳性率无明显差异,可能由于本研究是单中心回顾性研究,存在样本量不足、选择偏倚的问题。
据报道,OM患者重叠的CTD常见的是SSc、SLE,重叠RA、SS情况比较少[30],但也有研究发现IIMs患者随访过程中SS是最常见的合并自身免疫病[32],本研究中OM患者重叠的CTD最多见的是SS,造成OM患者重叠的CTD分布不同的原因可能是随访时间差异、人群差异、选择偏倚。
Danieli等[25]报道OM患者的预后较无重叠CTD的IIMs差,五年生存率(63.6%)和中位生存期(诊断后50个月)都较PM和DM患者显著降低,但尚未在一些长期随访研究中得到相似结论[33-34];Ng等[32]和Amaral等[34]报道IIMs患者癌症、心脏受累、肺受累和感染是主要死亡原因。本研究未发现OM患者较非OM患者预后之间的明显差异。可能的原因是排除了肿瘤相关肌炎的患者、住院率偏倚和随访时间不足。对于OM患者的长期生存情况仍需扩大样本和长期跟踪随访研究以充分明确。
本研究描述了OM以及非OM患者的免疫学特征和预后情况的差异,样本量较大,确定了OM患者病程长、肌肉外受累多见,包括肺动脉高压、心脏受累。本研究存在局限性,首先是回顾性研究,容易产生信息偏倚,并且部分患者的免疫学检查数据不完整,其次本研究为单中心研究,选择偏倚可能使入院的患者病情比一般患者更加复杂严重。未来有待进一步开展多中心大样本研究以更明确重叠肌炎患者的临床及免疫学特征。

