产β-葡萄糖苷酶微生物的筛选鉴定及其在人参皂苷Compound K转化中的应用
张庆锋,吕世鑫,江雨欣,王丹丹,王洪涛
(烟台大学生命科学学院,山东 烟台 264005)
西洋参(Panax quinquefolius)是五加科人参属多年生草本植物。2020年1月,西洋参被国家卫健委列入既是食品又是中药材的物质管理试点名单。西洋参作为药食同源植物具有极高的药用和经济价值。人参皂苷是西洋参的主要活性成分,以Rb1、Re和Rg1皂苷为主。在肠道菌和酶的作用下,主要皂苷转化为具有更高药理活性的稀有皂苷如C-K、Rh1苷元等被人体吸收后起药效。稀有皂苷C-K具有抗肿瘤、抗炎、改善记忆、缓解动脉硬化等多种药理活性[1]。但人参皂苷C-K在天然西洋参或人参中并不存在,是二醇类皂苷在人肠道内的代谢产物[2-4]。因此,如何有效获得大量和高纯度的稀有皂苷C-K成为研究的热点,也是西洋参产品和深加工行业升级的关键。
稀有人参皂苷C-K和主要皂苷Rb1在苷元结构上相同,侧链的糖基种类和数量不同,因此可以选择适当的方法水解皂苷Rb1上的特定糖基制备稀有人参皂苷C-K[5-7]。目前制备稀有皂苷的方法主要有化学转化法和生物转化法,其中生物转化法包括酶解法和微生物法。化学转化法反应条件要求高,副产物较多,所用试剂毒性较大[8,9];酶解法反应条件较为温和,具有高度专一性,但反应条件不易控制,酶易失活;微生物转化法具有发酵转化条件温和、酶系复杂、能转化多种底物的优势。Yoo等[10]利用从泡菜中分离出来的短乳杆菌FR-B发酵人参细根,5 d后产生大量的稀有人参皂苷C-K,由此表明短乳杆菌FR-B是较好的微生物转化食用菌。卲淇等[11]从市售的酸奶、酸菜、辣白菜分离出4株具有转化能力的乳酸菌,有两株可以把人参皂苷Rb1转化为稀有人参皂苷F2,另外两株把人参皂苷Rb1转化为稀有人参皂苷C-K,转化效果较好。Duan等[12]采用单变量试验设计和响应曲面法确定了蜗牛酶催化人参皂苷Rb1转化为人参皂苷C-K的最佳水解条件。本研究从西洋参的根际土壤中分离菌株,利用转化试验筛选出一株可以高效转化人参皂苷Rb1为人参皂苷C-K的菌株,并通过响应面试验优化皂苷的转化条件,以期为利用微生物转化Rb1为稀有皂苷C-K的工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
西洋参根际土壤,采自威海市文登区的西洋参种植园;人参皂苷Rb1(CAS号:41753-43-9)、人参皂苷Rd(CAS号:52705-93-8)、人参皂苷F2(CAS号:62025-49-4)、人参皂苷C-K(CAS号:39262-14-1)(纯度≥98%,贵州迪大科技有限责任公司);Silica gel 60 F254型薄层层析板(德国Merk公司);细菌基因组DNA快速提取试剂盒(山东思科捷生物技术有限公司);R2A琼脂培养基(北京奥博星生物技术有限责任公司);甲醇、乙腈为色谱纯,其他试剂为分析纯。
1.2 仪器与设备
BG-160型恒温培养箱(上海博迅医疗生物仪器股份有限公司);LDZX-50KBS型立式压力蒸汽灭菌锅(上海申安医疗器械厂);LC-20A型高效液相色谱仪(日本岛津制作所);DYY-10C型电泳仪(北京市六一仪器厂);Microchemi 4.2型紫外凝胶成像仪(以色列DNR成像系统有限公司)。
1.3 试验方法
1.3.1 微生物的分离纯化 称取西洋参根际土样10 g,溶解到盛有90 mL无菌水的烧杯中,制成10-1g/mL土壤浊液,然后依次梯度稀释,得到10-2~10-6g/mL的土壤浊液。在无菌条件下将不同浓度梯度的土壤稀释液分别涂布在R2A固体培养基上,于37℃培养箱倒置培养1~2 d。挑取形态不同的单菌落,利用单菌落划线法得到纯化的菌株,4℃保存备用。
1.3.2 产β-葡萄糖苷酶菌株的筛选 利用Esculin agar法[13,14]筛选产β-葡萄糖苷酶的菌株。将分离纯化得到的菌株划线到E-R2A培养基上,37℃培养1~2 d,观察培养基颜色变化,将菌落周围培养基变黑的菌株划线培养备用。
1.3.3 皂苷转化产物的检测 在1.5 mL的EP管中加入0.4 mg/mL的Rb1溶液400μL,用接种环取适量活化的菌株加入到EP管中,涡旋振荡使其混合均匀,置于37℃培养箱培养1周,加入200μL饱和正丁醇,振荡混匀,12 000 r/min离心10 min,吸取10μL上清液用于TLC分析;用同样的方法萃取3次,收集上清液,旋转蒸干,复溶于400μL甲醇,经0.45μm滤膜过滤后用于HPLC分析。TLC检测:采用Silica gel 60 F254型薄层层析板;展开剂为氯仿+甲醇+水(65∶35∶10,体积比,下层)[15,16];显色剂为10%硫酸溶液。110℃烘干5 min显色。HPLC检测[17]:色谱柱为BDS HYPERSIL C18柱(250 mm×4.6 mm);检测波长203 nm;进样量为20μL;体积流量1.0 mL/min;柱温45℃,流动相梯度见表1。

表1 高效液相色谱流动相梯度条件
1.3.4 皂苷转化率的测定 用分析天平准确称取10 mg人参皂苷C-K粉末溶解于10 mL色谱级甲醇溶液中,配制成1 mg/mL的溶液,再依次稀释为0.40、0.30、0.20、0.10、0.05 mg/mL;用0.45μm滤膜过滤后采用1.3.3的检测条件进行HPLC分析,平行试验3组取平均值;以峰面积为纵坐标,以人参皂苷C-K的浓度为横坐标,得到标准曲线方程Y=4834.7X-54432,R2=0.9996。根据标准曲线方程计算转化生成的皂苷C-K的浓度。皂苷转化率(%)=转化生成的C-K的量/初始加入的Rb1的量×100。
1.3.5 菌株的分子生物学鉴定 按照细菌基因组DNA快速提取试剂盒说明书提取待测菌株的基因组DNA,使用通用引物b27F(5′-AGAGTTTGATCCTGGTCAGAACGAACGCT-3′)和b1492R(5′-TACGGGCTACCTTGTTACGACTTCACCCC-3′)对菌株的16S rDNA进行扩增[18-20]。PCR反应体系(20μL):基因组DNA 1μL,上游和下游引物各2μL(0.5μmol/L),2×Taq Plus PCR预混液10μL,加超纯水补齐至20 μL。PCR反应程序:94℃预变性4 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,30个循环;72℃延伸7 min。PCR扩增产物用1%琼脂糖凝胶电泳检测,电泳条件为130 V、250 mA、25 min,使用凝胶成像系统观察结果。纯化后的PCR产物送至北京六合华大基因科技有限公司测序。所得菌株的DNA序列信息通过NCBI Blast与Gen-Bank中的核酸数据进行比对分析。
1.3.6 单因素试验 取一定量的菌液于1.5 mL的EP管中,加入柠檬酸-磷酸氢二钠缓冲溶液调节pH,再加入1 mg/mL的人参皂苷Rb1溶液200μL,涡旋振荡混匀,以人参皂苷C-K的转化率为试验指标,分别考察反应温度(20、25、30、37、45℃)、菌液浓度(1.5×108、3.0×108、4.5×108、6.0×108、7.5×108、9.0×108、10.5×108cfu/mL)、pH值(4.0、5.0、6.0、7.0、8.0)、转化时间(1、2、3、4、5、6、7、8 d)4个因素对人参皂苷C-K转化率的影响,试验均进行3次重复。
1.3.7 响应面试验 根据单因素试验结果,确定以菌液浓度(A)、转化pH值(B)、转化时间(C)3个因素进行响应面优化试验。在单因素试验的基础上,以C-K的含量为响应值,根据Box-Behnken中心组合设计试验因素与水平(表2),进行3因素3水平的响应面试验优化人参皂苷CK的转化条件。
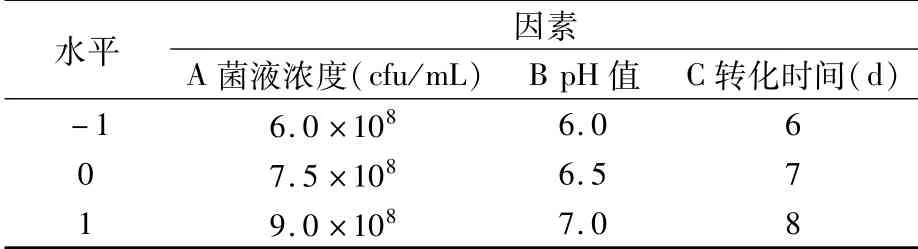
表2 Box-Behnken试验因素与水平
1.3.8 转化路径分析 取一定量的菌液于1.5mL的EP管中,加入pH 6.0的柠檬酸-磷酸氢二钠缓冲溶液200μL,再加入1 mg/mL的人参皂苷Rb1溶液200μL,涡旋振荡混匀,在37℃保温箱分别转化6、12、24、48 h。以转化0 h的样品为对照组,经萃取、旋蒸、复溶和过滤后进行HPLC检测。
1.4 数据处理
采用MEGA 6.0软件中的Neighbor-joining方法构建系统发育树,数据以平均值±标准差表示,用SPSS 20.0统计分析数据,采用Design Expert 10进行多元回归拟合及响应面分析。
2 结果与分析
2.1 转化人参皂苷Rb1为C-K的菌株筛选
将纯化后的菌株在七叶苷培养基上培养2 d后,观察培养基颜色变化,挑选产黑色水解斑的菌株进行下一步皂苷转化试验。TLC分析检测结果(图1)显示,在挑选出的一系列菌株中,菌株S’4可以将人参皂苷Rb1转化为稀有人参皂苷CK。
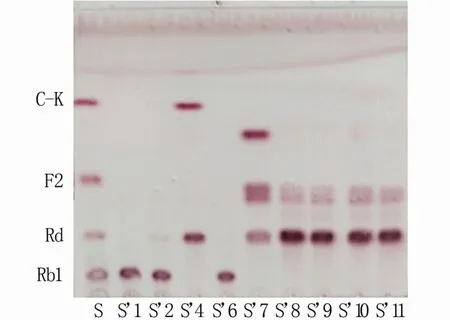
图1 转化Rb1菌株的薄层层析结果
2.2 菌株的分子鉴定
将测序结果在GenBank中进行同源性分析,结果表明菌株S’4与Cohnella thermotolerans CCUG 47242同源性为99.72%。系统发育分析结果(图2)表明,该菌株与Cohnella thermotolerans CCUG 47242处于同一分支。确定S’4菌株为耐热科恩氏菌。

图2 根据16SrDNA序列构建的S’4菌株系统发育树
2.3 转化条件的优化
2.3.1 温度对转化率的影响 随着转化温度的升高,皂苷C-K的转化率呈先上升后下降趋势,37℃时转化率最高(图3)。温度是影响微生物生长繁殖最重要的因素之一,随着反应温度的升高,酶的催化活性也逐渐升高,微生物的生长繁殖速度加快;超过37℃时,皂苷转化率下降,可能由于温度过高导致酶的催化活性下降。因此确定37℃为C-K的最佳转化温度。

图3 不同温度对转化率的影响
2.3.2 pH值对转化率的影响 随着pH值的升高,皂苷C-K的转化率呈先上升后下降趋势,当pH为6.0时转化率最高(图4)。微生物的生长及C-K的合成都有其最适pH范围,在中强酸或偏碱性的条件下微生物的生长及C-K的合成受到显著抑制。

图4 不同pH值对转化率的影响
2.3.3 菌液浓度对转化率的影响 如图5所示,随着菌液浓度的提高,皂苷C-K转化率逐渐升高,当菌液浓度达到9.0×108cfu/mL时转化率最高;菌液浓度进一步升高,转化率反而下降,可能的原因是菌液浓度过高,导致转化出的人参皂苷C-K又被累积的次级代谢产物转化为其它类型的皂苷。

图5 不同菌液浓度对转化率的影响
2.3.4 转化时间对转化率的影响 随着转化时间的增加,皂苷C-K的转化率不断升高,在4~6d转化率快速增加,这是由于微生物分泌的酶量逐渐增加从而提高了转化率。6 d后转化率增长较为平缓,这是因为底物皂苷Rb1被消耗殆尽导致转化率增长缓慢(图6)。

图6 不同转化时间对转化率的影响
2.3.5 响应面试验结果与方差分析 根据Box-Behnken试验设计原理,综合单因素试验结果,进行3因素3水平响应面试验,结果见表3。对响应面试验结果进行多元回归拟合,回归方程为Y(皂苷C-K含量)=0.220+0.012A-0.019B+4.500×10-3C+6.750×10-3AB-2.500×10-3AC-8.500×10-3BC-4.825×10-3A2-0.031B2-5.575×10-3C2,R2=0.9551。
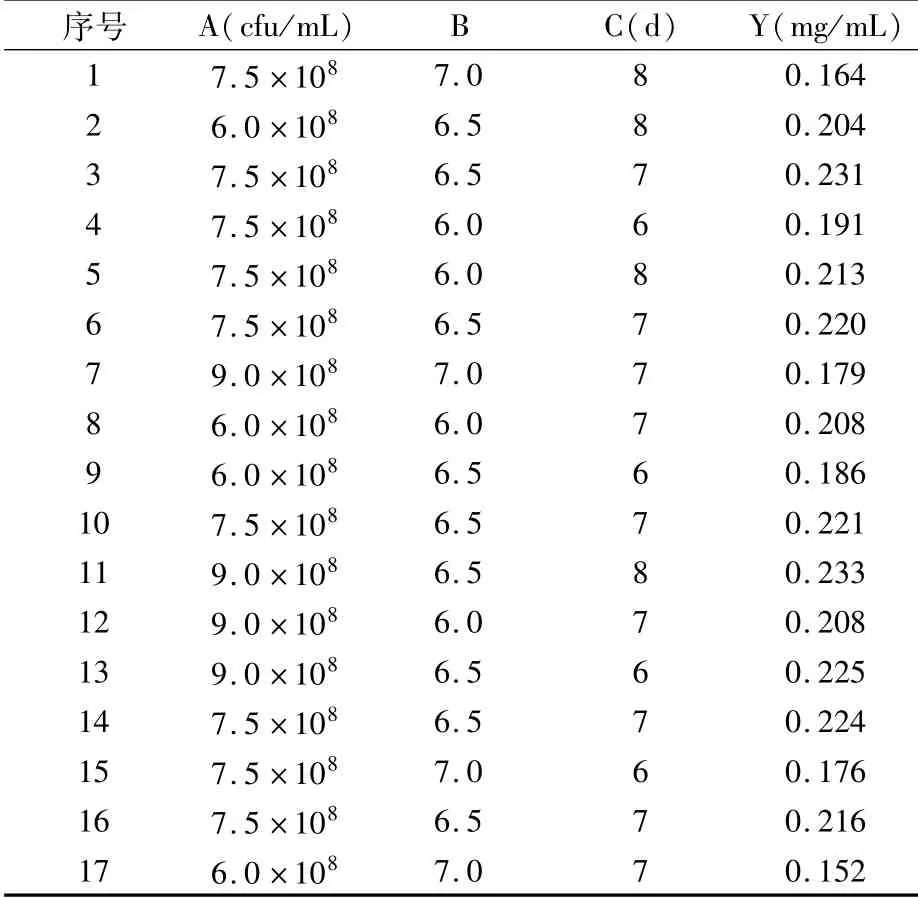
表3 响应面试验设计及结果
回归模型的方差分析结果如表4所示。整体模型的P值为0.0006,表明二次回归方程模型具有统计学意义。本模型失拟项P值为0.1474,说明无失拟因素存在。该模型决定系数R2为0.9551,表明该模型的拟合程度良好,试验可信度较高,自变量与响应值之间线性关系显著,可用该回归方程对人参皂苷C-K含量进行预测分析。影响人参皂苷C-K含量的主次因素为pH值(B)>菌液浓度(A)>转化时间(C),其中A、B、B2的P值均小于0.01,说明其对人参皂苷C-K含量的影响极显著。

表4 方差分析结果
对菌液浓度(A)、pH值(B)及转化时间(C)3个因素进行交互作用分析,得到交互因素的响应面(图7)。在3个因素中,因素B和因素C形成的响应曲面坡度最为陡峭,交互作用最大;其次为因素A和因素B之间的交互作用;因素C与因素A之间的交互作用最小。但3个因素中任意两因素的交互作用对皂苷C-K含量的影响均不显著(P>0.05)。通过Design Expert 10软件进行数据分析确定人参皂苷C-K转化的最佳反应条件为菌液浓度8.94×108cfu/mL、pH值6.38、转化时间7.38 d,该条件下人参皂苷C-K的含量为0.231 mg/mL。考虑实际操作的可行性,将优化的反应条件调整为菌液浓度9.0×108cfu/mL、pH值6.4、转化时间7.5 d。为检验模型的准确性,在优化后的最佳转化条件下进行3次重复试验验证,得到人参皂苷C-K的含量为(0.220±0.02)mg/mL,转化率为78.36%。表明该回归模型优化的反应条件可以较好地应用于人参皂苷C-K的微生物转化。

图7 因素间交互作用的响应曲面图
2.4 人参皂苷Rb1的转化路径
如图8所示,0 h只检测出人参皂苷Rb1,6 h后Rb1开始转化生成人参皂苷Rd,转化12 h后有少量人参皂苷F2生成。转化24 h后,Rb1的含量明显减少,并生成少量人参皂苷C-K。随着转化时间的延长,在转化48 h后已检测不出人参皂苷Rb1,人参皂苷C-K的含量则不断增加。因此,确定该菌株转化人参皂苷Rb1为C-K的基本路径为Rb1→Rd→F2→C-K。
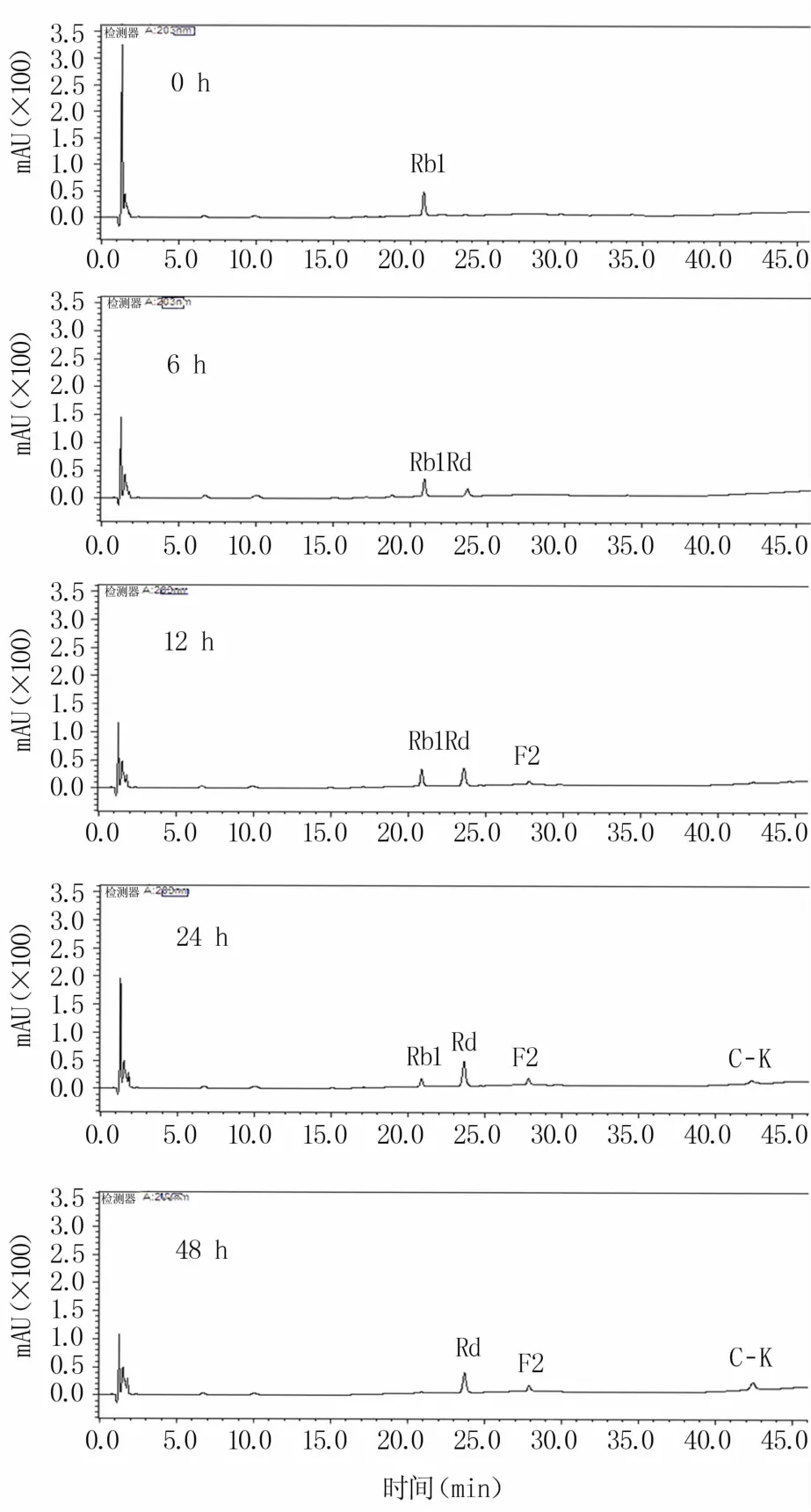
图8 人参皂苷Rb1转化为C-K的路径分析
3 讨论与结论
人参皂苷作为西洋参中重要的药用成分,因其糖链部分糖基数目不同而显示出不同的药理活性。C-K不是西洋参中天然存在的化合物,因此将西洋参中的主要皂苷Rb1转化为稀有皂苷C-K具有重要的实用价值。本研究从威海市文登区西洋参种植园采集的西洋参根际土壤中分离菌株,发现其中有13株菌可以分泌β-葡萄糖苷酶,通过对这些菌株进行人参皂苷Rb1的转化试验,并通过TLC检测发现S’4菌株可以将人参皂苷Rb1转化为稀有皂苷C-K。其它菌株不能将人参皂苷Rb1转化为稀有皂苷C-K,可能因为菌株分泌的β-葡萄糖苷酶不能转化人参皂苷Rb1;此外,还有可能因为有些菌株分泌到细胞外的β-葡萄糖苷酶含量较少,七叶苷培养基比较灵敏可以检测出来,而大量的β-葡萄糖苷酶留在了细胞内,需要通过机械破碎等方式释放出来。通过对S’4菌株的16SrDNA测序及构建的系统发育树分析,确定该菌株为耐热科恩氏菌。通过Box-Behnken试验设计优化该菌株转化生成人参皂苷C-K的工艺条件,确定最优转化条件为菌液浓度9.0×108cfu/mL、pH 6.4、转化时间7.5 d。在该条件下人参皂苷C-K的转化率达78.36%。该菌株将人参皂苷Rb1转化为C-K的途径为Rb1→Rd→F2→C-K。
本研究首次报道耐热科恩氏菌可应用于人参皂苷的生物转化。本试验筛选的耐热科恩氏菌可在温和的反应条件下高效地将Rb1转化为稀有皂苷C-K。因此,本研究为稀有皂苷C-K的微生物转化提供了新的菌种来源,也为C-K的工业化生产提供了理论依据。

