岭南铁角蕨镇咳活性成分分析
李君 梁晓
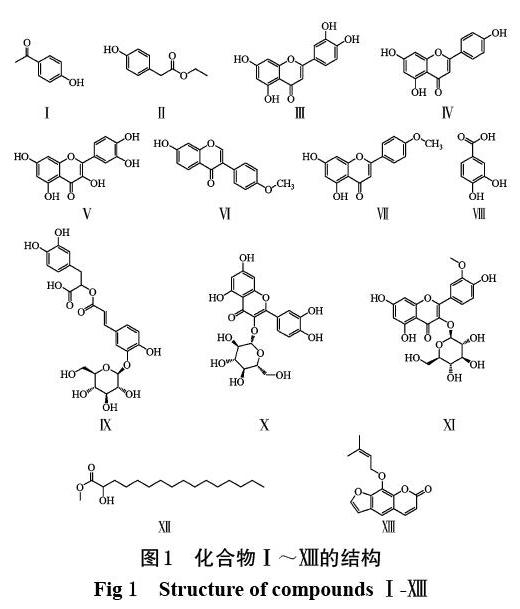
摘 要 目的:研究岭南铁角蕨的化学成分并初步探讨其镇咳作用。方法:以硅胶柱色谱对岭南铁角蕨75%乙醇提取物进行分离纯化,根据理化性质和波谱(质谱、氢谱、碳谱)数据分析鉴定所得化合物的结构。将昆明种小鼠随机分为阴性对照组、测试组(分离所得7种单体化合物的剂量均为0.12 g/kg)和阳性对照组(同剂量磷酸苯丙哌林),每组10只;采用浓氨水引咳法评价各化合物的镇咳效果。结果:从岭南铁角蕨75%乙醇提取物的乙酸乙酯部位和石油醚部位中共分离和鉴定出13个化合物,分别为4-羟基-苯乙酮(Ⅰ)、4-羟基-苯乙酸乙酯(Ⅱ)、木犀草素(Ⅲ)、芹菜素(Ⅳ)、槲皮素(Ⅴ)、芒柄花素(Ⅵ)、刺槐黄素(Ⅶ)、原儿茶酸(Ⅷ)、异迷迭香酸苷(Ⅸ)、槲皮素-3-O-β-D-吡喃葡萄糖苷(Ⅹ)、异鼠李素-3-O-β-D-吡喃葡萄糖苷(Ⅺ)、棕榈酸甲酯(Ⅻ)和欧前胡素()。其中木犀草素可显著延长小鼠的咳嗽潜伏期并减少小鼠的咳嗽次数(P<0.05)。结论:13种化合物均为首次从该植物中分离得到;木犀草素具有一定的镇咳作用,可能是该植物的镇咳活性成分。
关键词 岭南铁角蕨;化学成分;结构鉴定;镇咳作用
ABSTRACT OBJECTIVE: To study chemical constituents of Asplenium sampsoni, and to investigate its antitussive effects preliminarily. METHODS: The 75% ethanol extract was isolated from A. sampsoni and purified by silica gel column chromatography. The structures of the compounds were identified by physicochemical properties and spectral data (mass spectrum, hydrogen spectrum and carbon spectrum). Kunming mice were randomly divided into negative control group, test group (the doses of 7 monomers were 0.12 g/kg), and positive control group (same dose of benproperine phosphate), with 10 mice in each group. The antitussive effect of each compound was evaluated by the method of inducing cough with concentrated ammonia water. RESULTS: Totally 13 compounds were isolated and identified from ethyl acetate and petroleum ether parts of 75% ethanol extract of A. sampsoni, i.e. 4-hydroxy-acetophenone (Ⅰ), 4-hydroxy-ethyl phenylacetate (Ⅱ), luteolin (Ⅲ), apigenin (Ⅳ), quercetin (Ⅴ), formononetin (Ⅵ), acacetin (Ⅶ), protocatechuic acid (Ⅷ), isorosmarinoside (Ⅸ), quercetin-3-O-β-D-glucopyranoside (Ⅹ), isorhamnetin-3-O-β-D-glucopyranoside (Ⅺ), methyl palmitate (Ⅻ) and imperatorin (). Luteolin could significantly prolong the cough latency and reduce the times of cough in mice (P<0.05). CONCLUSIONS: Thirteen compounds are isolated from this plant for the first time; luteolin has certain antitussive effect, and may be the antitussive active component of the plant.
KEYWORDS Asplenium sampsoni; Chemical constituents; Structure identification; Antitussive effect
岭南铁角蕨又名肥蕨,为铁角蕨科植物岭南铁角蕨Asplenium sampsoni Hance的全草,民间用药历史悠久,主要分布于我国广东、广西、湖南、云南、贵州等地[1]。《中华本草》记载,该药性凉、味微苦,具有清热解毒、止咳化痰、凉血止血之功效,可用于咳嗽、痢疾、外伤出血、小儿疳积等症的治疗[1]。但现有文献尚未见有关岭南铁角蕨化学成分的研究报道。为探索其有效成分及药理作用的物质基础,本研究采用硅胶柱色谱、重结晶等方法对岭南铁角蕨75%乙醇提取物(经前期预实验证实,以75%乙醇作为溶剂所得成分较多)进行分离、纯化,并对所得化学单体进行结构鉴定和初步药理活性评价,以期为该药材的进一步开发利用提供依据。
1 材料
1.1 主要儀器
本研究所用主要仪器包括Photolysis-TOF MS型高质量质谱仪(英国Kore公司)、DPX-400型核磁共振仪(瑞典Bruker公司)、X6型熔点测定仪(深圳科联电子科技有限公司)、RE-52A型旋转蒸发仪(上海亚荣生化仪器有限公司)、BPG-9030BH型电热恒温鼓风干燥箱(上海和呈仪器制造有限公司)、SHB-Ⅲ型台式循环水式多用真空泵(巩义市奥凯有限责任公司)、HH-2型数显恒温水浴锅(常州澳华仪器有限公司)等。
1.2 主要药品与试剂
本研究所用岭南铁角蕨药材采自广东省肇庆市鼎湖区,经湖南中医药大学药学院刘塔斯教授鉴定为铁角蕨植物岭南铁角蕨A. sampsoni Hance的全株;其标本保存于湘潭医卫职业技术学院中药标本馆。
木犀草素对照品(编号111520,纯度>98%)、芹菜素对照品(编号111901,纯度>98%)、槲皮素对照品(编号100081,纯度>98%)、芒柄花素對照品(编号111703,纯度>98%)、刺槐黄素对照品(编号111708,纯度>98%)、原儿茶酸对照品(编号159677,纯度>98%)、欧前胡素对照品(编号110826,纯度>98%)均购自中国食品药品检验研究院;柱色谱用硅胶(100~300目)购自青岛海洋化工厂;磷酸苯丙哌林口服溶液(批号181002,规格80 mL ∶ 80 mg)购自江西杏林白马药业股份有限公司;羧甲基纤维素钠(批号121015)购自东营市临广化工有限公司;所用分析纯化学试剂均购自天津市化学试剂三厂;水为蒸馏水。
1.3 实验动物
本研究所用动物为清洁级别昆明种小鼠,共90只,雌雄各半,体质量(180±10) g,由中南大学湘雅二医院医学实验动物中心提供,实验动物使用许可证为SYXK(湘)2017-0002。所有小鼠均饲养于实验动物房,其室温控制在(22±4) ℃,湿度控制在(60±10)%。小鼠均自由摄食、饮水,适应性饲养3 d后开始后续实验。
2 提取与分离
取岭南铁角蕨干燥全草10.0 kg,加入75%乙醇100 L连续回流提取3次,滤过,合并滤液,浓缩至稠膏且无乙醇味,得提取物浸膏660.4 g。将此浸膏以水10 L分散后,依次以石油醚(60~90 ℃)5 L、乙酸乙酯8 L各萃取3次;回收溶剂后,得到石油醚部位64.5 g、乙酸乙酯部位398.2 g。
取岭南铁角蕨乙酸乙酯部位100.0 g,经硅胶柱层析,以氯仿-甲醇混合溶液(体积比95 ∶ 5→5 ∶ 95)依次梯度洗脱,收集洗脱液。以薄层色谱法(TLC)检测后,合并洗脱液,经反复重结晶纯化得到11个单体化合物。其中,以体积比95 ∶ 5的氯仿-甲醇混合溶液洗脱得到化合物Ⅰ(18 mg),以体积比90 ∶ 10的氯仿-甲醇混合溶液洗脱得到化合物Ⅱ(14 mg),以体积比80 ∶ 20的氯仿-甲醇混合溶液洗脱得到化合物Ⅲ(75 mg),以体积比75 ∶ 25的氯仿-甲醇混合溶液洗脱到化合物Ⅳ(28 mg)和化合物Ⅴ(19 mg),以体积比55 ∶ 45的氯仿-甲醇混合溶液洗脱得到化合物Ⅵ(42 mg)和化合物Ⅶ(22 mg),以体积比40 ∶ 60的氯仿-甲醇混合溶液洗脱得到化合物Ⅷ(16 mg),以体积比30 ∶ 70的氯仿-甲醇混合溶液洗脱得到化合物Ⅸ(72 mg),以体积比20 ∶ 80的氯仿-甲醇混合溶液洗脱得到化合物Ⅹ(25 mg),以体积比5 ∶ 95的氯仿-甲醇混合溶液洗脱得到化合物Ⅺ(33 mg)。
取岭南铁角蕨石油醚部位50.0 g,经硅胶柱层析,以石油醚-丙酮混合溶液(体积比4 ∶ 1→0.5 ∶ 1)依次梯度洗脱,收集洗脱液。以TLC检测后,合并洗脱液,经反复重结晶纯化得到2个单体化合物。其中,以体积比2 ∶ 1的石油醚-丙酮混合溶液洗脱得到化合物Ⅻ(26 mg),以体积比0.5 ∶ 1的石油醚-丙酮混合溶液洗脱得到化合物(14 mg)。
3 结构鉴定
化合物Ⅰ:无色针晶,易溶于丙酮,熔点107.2~111.3 ℃;氯化铁(FeCl3)反应为阳性。电子轰击-质谱(EI-MS):m/z 137.2[M+H]+,分子式为C8H8O2。1H-NMR(500 MHz,CD3OD)δ:10.31(s,1H,4-OH),7.79(d,J=9.0 Hz,2H,H-2、H-6),6.93(d,J=9.0 Hz,2H,H-3、H-5),2.48(s,3H,H-8)。13C-NMR(125 MHz,CD3OD)δ:199.3(C-7),131.5(C-6),131.3(C-2),128.8(C-1),115.5(C-3),26.2(C-8)。以上数据与文献[2]报道基本一致,故鉴定化合物Ⅰ为4-羟基-苯乙酮。
化合物Ⅱ:淡黄色粉末,熔点36.2~38.4 ℃;FeCl3反应为阳性。EI-MS:m/z 181.5[M+H]+,分子式为C10H12O3。1H-NMR(500 MHz,DMSO-d6)δ:7.47(d,J=8.3 Hz,2H,H-2、H-6),6.86(d,J=8.3 Hz,2H,H-3、H-5),3.98(q,J=7.1 Hz,2H,H-1′),3.62(s,2H,H-7),1.14(t,J=7.1 Hz,3H,H-2′)。13C-NMR(125 MHz,DMSO-d6)δ:162.6(C-8),151.8(C-4),132.1(C-6),131.8(C-2),123.6(C-1),115.8(C-3),115.6(C-5),60.8(C-1′),56.3(C-7),14.1(C-2′)。以上数据与文献[3]报道基本一致,故鉴定化合物Ⅱ为4-羟基-苯乙酸乙酯。
化合物Ⅲ:淡黄色粉末,熔点326.8~329.7 ℃;盐酸-镁粉(HCl-Mg)反应为阳性。EI-MS:m/z 287.5[M+H]+,分子式为C15H10O6。1H-NMR(500 MHz,DMSO-d6)δ:12.84(s,1H,5-OH),7.42(d,J=2.5 Hz,1H,H-2′),7.41(d,J=2.1 Hz,1H,H-6′),6.95(d,J=8.5 Hz,1H,H-5′),6.61(s,1H,H-3),6.36(s,1H,H-8),6.14(s,1H,H-6)。13C-NMR(125 MHz,DMSO-d6)δ:173.6(C-4),165.9(C-7),161.1(C-2),156.2(C-5),149.3(C-9),147.2(C-4′),146.6(C-3′),135.9(C-1′),124.4(C-6′),120.1(C-5′),114.6(C-2′),105.5(C-10),104.8(C-3),98.5(C-6),94.7(C-8)。以上数据与文献[4]报道基本一致,故鉴定化合物Ⅲ为木犀草素。
化合物Ⅳ:黄色粉末,熔点346.7~357.9 ℃;HCl-Mg反应为阳性。EI-MS:m/z 271.4[M+1]+,分子式为C15H10O5。1H-NMR(500 MHz,DMSO-d6)δ:12.96(s,1H,5-OH),10.78(s,1H,7-OH),10.32(s,1H,4′-OH),7.94(d,J=8.5 Hz,2H,H-2′、H-6′),6.88(d,J=8.5 Hz,2H,H-3′、H-5′),6.78(s,1H,H-3),6.50(d,J=2.5 Hz,1H,H-8),6.16(d,J=2.5 Hz,1H,H-6)。13C-NMR(125 MHz,DMSO-d6)δ:181.3(C-4),164.9(C-7),163.9(C-2),160.3(C-5),158.0(C-9),159.9(C-4′),137.0(C-3),127.7(C-2′、C-6′),126.5(C-1),123.6(C-1′),115.9(C-3′、C-5′),104.1(C-10),98.8(C-6),95.3(C-8)。以上數据与文献[5]报道基本一致,故鉴定化合物Ⅳ为芹菜素。
化合物Ⅴ:黄色晶体(甲醇),熔点312~314 ℃; FeCl3反应为阳性,HCl-Mg反应为阳性。EI-MS:m/z 303.2[M+H]+,分子式为C15H10O7。1H-NMR(500 MHz,CDCl3)δ:12.09(s,1H,5-OH),7.86(d,J=2.5 Hz,1H,H-2′),7.59(dd,J=7.0、8.5 Hz,1H,H-6′),6.90(d,J=8.5 Hz,1H,H-5′),6.43(d,J=2.4 Hz,1H,H-8),6.18(d,J=2.4 Hz,1H,H-6)。13C-NMR(125 MHz,CDCl3)δ:176.3(C-4),164.9(C-7),164.0(C-9),156.3(C-5),146.5(C-3′、C-4′),145.5(C-2),137.0(C-3),126.5(C-1),123.6(C-1′),121.2(C-6′),115.9(C-5′),114.7(C-2′),104.1(C-10),98.8(C-6),95.3(C-8)。以上数据与文献[6]报道基本一致,故鉴定化合物Ⅴ为槲皮素。
化合物Ⅵ:淡黄色粉末,熔点254.5~256.3 ℃;FeCl3反应为阳性。EI-MS:m/z 269.3[M+H]+,分子式为C16H12O4。1H-NMR(500 MHz,DMSO-d6)δ:8.28(s,1H,H-2),7.79(d,J=8.4 Hz,1H,H-5),6.91(dd,J=2.5、3.5 Hz,1H,H-6),6.74(d,J=2.5 Hz,1H,H-8)。13C-NMR(125 MHz,DMSO-d6)δ:174.9(C-4),162.8(C-7),159.1(C-9),158.3(C-4′),153.1(C-2),130.2(C-6′),130.1(C-10),129.2(C-2′),125.4(C-3),122.8(C-1′),115.9(C-5),114.8(C-6),113.1(C-3′),112.9(C-5′),103.3(C-8),54.7(4′-OCH3)。以上数据与文献[7]报道基本一致,故鉴定化合物Ⅵ为芒柄花素。
化合物Ⅶ:黄色结晶,熔点252.8~254.6 ℃。EI-MS:m/z 285.3[M+H]+,分子式为C16H12O5。1H-NMR(500 MHz,DMSO-d6)δ:12.92(s,1H,5-OH),10.65(s,1H,7-OH),7.89(d,J=8.6 Hz,2H,H-2′、H-6′),7.06(d,J=8.9 Hz,2H,H-3′、H-5′),6.79(s,1H,H-3),6.55(d,J=1.8 Hz,1H,H-8),6.15(d,J=1.8 Hz,1H,H-6),3.81(s,3H,4′-OCH3)。13C-NMR(125 MHz,DMSO-d6)δ:182.2(C-4),163.9(C-2),162.9(C-7),162.5(C-4′),160.9(C-5),157.8(C-9),127.8(C-6′),127.6(C-2′),123.4(C-1′),114.6(C-5′),114.3(C-3′),104.3(C-10),104.1(C-3),99.3(C-6),93.6(C-8),55.5(4′-OCH3),55.5(C-11)。以上数据与文献[8]报道基本一致,故鉴定化合物Ⅶ为刺槐黄素。
化合物Ⅷ:褐色结晶性粉末,熔点198.5~201.1 ℃。EI-MS:m/z 155.3[M+H]+,分子式为C7H6O4。1H-NMR(500 MHz,DMSO-d6)δ:7.31(d,J=2.0 Hz,1H,H-2),7.26(d,J=8.4 Hz,1H,H-6),6.75(d,J=8.4 Hz,1H,H-5)。13C-NMR(125 MHz,DMSO-d6)δ:169.8(-COOH),150.5(C-4),147.9(C-3),124.1(C-6),122.2(C-1),116.7(C-2),115.2(C-5)。以上数据与文献[9]报道基本一致,故鉴定化合物Ⅷ为原儿茶酸。
化合物Ⅸ:棕黄色粉末,熔点171.2~175.1 ℃。EI-MS:m/z 523.6[M+H]+,分子式为C24H26O13。1H-NMR(500 MHz,DMSO-d6)δ:12.93(s,1H,8′-COOH),9.23(s,1H,4-OH),8.65(s,2H,3′-OH、4′-OH),7.54(d,J=1.6 Hz,1H,H-2),7.42(d,J=15.9 Hz,1H,H-7),7.29(dd,J=8.3、9.5 Hz,1H,H-6),6.91(d,J=8.2 Hz,1H,H-5),6.62(d,J=8.1 Hz,1H,H-5′),6.58(dd,J=8.1、9.3 Hz,1H,H-6′),6.42(d,J=15.9 Hz,1H,H-8),5.05~5.22(m,1H,H-8′),4.89(d,J=7.2 Hz,1H,H-1″)。13C-NMR(125 MHz,DMSO-d6)δ:173.7(C-9′),168.6(C-9),148.9(C-4),147.8(C-7),146.5(C-3),146.3(C-3′),145.5(C-4′),129.4(C-1′),127.6(C-1),123.2(C-6),122.2(C-6′),117.8(C-2′),116.3(C-5),115.4(C-2),114.6(C-8),106.6(C-5′),102.2(C-1″),79.1(C-5″),77.2(C-3″),75.7(C-2″),74.7(C-8′),71.6(C-4″),60.9(C-6″),37.9(C-7′)。以上数据与文献[10]报道基本一致,故鉴定化合物Ⅸ为异迷迭香酸苷。
化合物Ⅹ:黄色粉末,熔点181.6~185.3 ℃;在紫外灯下显黄色荧光,浓硫酸-α-萘酚(Molish反应)及HCl-Mg反应均为阳性。EI-MS:m/z 465.2[M+H]+,分子式为C21H20O12。1H-NMR(500 MHz,DMSO-d6)δ:12.66(s,1H,5-OH),7.56(dd,J=8.4、9.5 Hz,1H,H-2′),7.51(d,J=2.4 Hz,1H,H-6′),6.88(d,J=8.8 Hz,1H,H-3′),6.38(d,J=2.0 Hz,1H,H-8),6.18(d,J=2.0 Hz,1H,H-6),5.49(d,J=7.1 Hz,1H,Glc-1)。13C-NMR(125 MHz,DMSO-d6)δ:177.4(C-4),164.6(C-7),161.4(C-5),156.3(C-2),155.9(C-9),148.9(C-4′),144.5(C-3′),133.1(C-3),121.8(C-6′),120.9(C-1′),116.6(C-5′),115.4(C-2′),104.2(C-10),100.5(Glc-1″),98.8(C-6),93.7(C-8),77.8(Glc-3″),76.8(Glc-5″),74.3(Glc-2″),70.4(Glc-4″),60.6(Glc-6″)。以上数据与文献[11]报道基本一致,故鉴定化合物Ⅹ为槲皮素-3-O-β-D-吡喃葡萄糖苷。
化合物Ⅺ:黄色粉末(甲醇),Molish反应及HCl-Mg反应均为阳性。EI-MS:m/z 479.4[M+H]+,分子式为C22H22O12。1H-NMR(500 MHz,DMSO-d6)δ:12.40(s,1H,5-OH),7.69(s,1H,H-2′),7.60(d,J=7.6 Hz,1H,H-6′),6.93(d,J=7.6 Hz,1H,H-5′),6.47(s,1H,H-8),6.11(s,1H,H-6),5.52(d,J=7.2 Hz,1H,H-1″),3.85(s,3H,3′-OCH3)。13C-NMR(125 MHz,DMSO-d6)δ:178.2(C-4),164.9(C-7),161.8(C-5),156.8(C-2),156.2(C-9),150.3(C-4′),133.6(C-3),147.1(C-3′),122.6(C-1′),121.9(C-6′),115.4(C-5′),113.7(C-2′),103.5(C-10),101.1(C-1″),99.3(C-6),94.4(C-8),78.2(C-5″),76.5(C-3″),74.5(C-2″),70.4(C-4″),61.4(C-6″),56.5(3′-OCH3)。以上数据与文献[12]报道基本一致,故鉴定化合物Ⅺ为异鼠李素-3-O-β-D-吡喃葡萄糖苷。
化合物Ⅻ:白色粉末;EI-MS:m/z 271.2[M+H]+,分子式为C17H34O2。1H-NMR(500 MHz,CDCl3)δ:3.38(s,3H,H-1),2.25(t,J=4.8 Hz,2H,H-2),1.24~1.62(brs,26H,H-15、H-14、H-13、H-12、H-10、H-8、H-6、H-3),0.86(s,3H,H-16)。13C-NMR(125 MHz,CDCl3)δ:173.6(C-1),51.3(C-1′),33.7(C-2′),31.4(C-14),29.3(C-7),29.2(C-13),29.1(C-6),28.9(C-12),28.8(C-5),28.5(C-4),24.3(C-3),22.3(C-15),13.5(C-16)。以上数据与文献[13-14]报道基本一致,故鉴定化合物Ⅻ为棕榈酸甲酯。
化合物:无色晶体,熔点98.5~101.2 ℃;异羟肟酸铁反应为阳性。EI-MS:m/z 271.3[M+H]+,分子式为C16H14O4。1H-NMR(500 MHz,CDCl3)δ:7.81(d,J=9.6 Hz,1H,H-4),7.64(d,J=2.0 Hz,1H,H-2′),7.36(s,1H,H-5),6.72(d,J=2.0 Hz,1H,H-3′),6.32(d,J=9.6 Hz,1H,H-3),5.56(t,J=7.2 Hz,1H,H-2″),4.98(d,J=7.2 Hz,1H,H-1″),1.70(s,1H,H-5″),1.66(s,1H,H-4″)。13C-NMR(125 MHz,CDCl3)δ:159.9(C-2),146.9(C-7),145.8(C-2′),139.1(C-3″),138.2(C-4),130.9(C-8),125.6(C-6),119.2(C-2″),113.7(C-3),113.1(C-5),112.4(C-1),106.1(C-3′),69.8(C-1″),25.2(C-4″),17.3(C-5″)。以上數据与文献[15]报道基本一致,故鉴定化合物为欧前胡素。
化合物Ⅰ~结构见图1。
4 活性评价
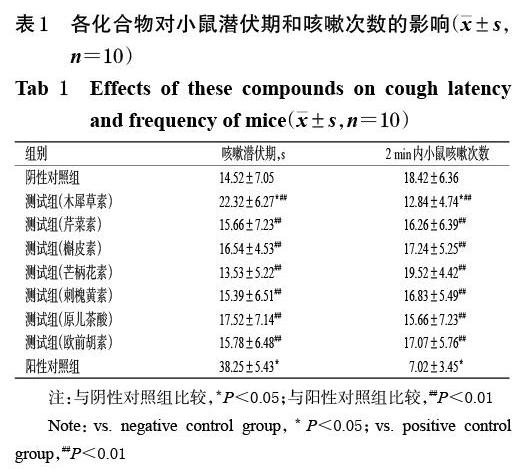
有文献指出,木犀草素、芹菜素、槲皮素、芒柄花素、刺槐黄素、原儿茶酸、欧前胡素等7种成分具有一定的镇咳作用,而其余6种化合物为该属植物的共性成分,并未见明显的镇咳活性[16-21]。基于此,本研究以小鼠为对象,以木犀草素等7种成分为干预物,以临床常用镇咳药磷酸苯丙哌林口服液为阳性对照药[22],进行镇咳试验。具体操作如下:将昆明种小鼠随机分为测试组、阴性对照组和阳性对照组,其中测试组小鼠分别选用化合物Ⅲ(木犀草素)、Ⅳ(芹菜素)、Ⅴ(槲皮素)、Ⅵ(芒柄花素)、Ⅶ(刺槐黄素)、Ⅷ(原儿茶酸)、(欧前胡素)进行镇咳实验,每组10只。测试组和阳性对照组小鼠均灌胃相应药液0.12 g/kg(均以0.3%羧甲基纤维素钠溶液为溶剂,给药剂量依据前期预实验结果设置),阴性对照组小鼠灌胃等体积的0.3%羧甲基纤维素钠溶液,灌胃体积均为0.02 mL/g,每天2次,连续给药3 d。末次给药0.5 h后,将所有小鼠放入喷雾引咳装置中,喷入浓氨水0.5 mL,以小鼠张大口、腹肌收缩记为咳嗽发生1次[23],观察并记录2 min内小鼠咳嗽潜伏期及咳嗽次数。采用SPSS 21.0软件对数据(结果以x±s表示)进行方差分析。检验水准α=0.05。
药理实验结果显示,与阴性对照组比较,化合物Ⅲ能够显著延长小鼠咳嗽潜伏期,显著减少其因氨水刺激所致咳嗽的次数(P<0.05);而其余化合物均无明显延长小鼠咳嗽潜伏期及减少小鼠咳嗽次数的作用(P>0.05)。此外,各测试组化合物在延长小鼠咳嗽潜伏期和减少咳嗽次数方面的作用均显著弱于阳性对照组(P<0.01),详见表1。
5 讨论
本研究对岭南铁角蕨75%乙醇提取物的化学成分进行了分析,共分离得到13个化合物,分别鉴定为4-羟基-苯乙酮(Ⅰ)、4-羟基-苯乙酸乙酯(Ⅱ)、木犀草素(Ⅲ)、芹菜素(Ⅳ)、槲皮素(Ⅴ)、芒柄花素(Ⅵ)、刺槐黄素(Ⅶ)、原儿茶酸(Ⅷ)、异迷迭香酸苷(Ⅸ)、槲皮素-3-O-β-D-吡喃葡萄糖苷(Ⅹ)、异鼠李素-3-O-β-D-吡喃葡萄糖苷(Ⅺ)、棕榈酸甲酯(Ⅻ)和欧前胡素()。上述成分分别属于芳香族类、黄酮类、木脂素类等,与该属植物化学成分的基本特征相符[24]。这些化合物均为首次从岭南铁角蕨中分离获得。
药理实验中采用浓氨水致小鼠咳嗽法,选择木犀草素、芹菜素、槲皮素、刺槐黄素、芒柄花素、原儿茶酸、欧前胡素等7个化合物进行镇咳活性的初步评价。结果发现,木犀草素能够延长小鼠咳嗽潜伏期及减少小鼠咳嗽次数,从而缓解咳喘,可能为岭南铁角蕨镇咳作用的活性成分,这与以往研究相一致[25]。而其余成分均未见明显的止咳作用,具体原因还有待于进一步研究。
综上所述,本研究中分离并评价镇咳活性的这些化合物初步揭示了岭南铁角蕨的药效物质基础,其中木犀素具有明确的镇咳效应。
参考文献
[ 1 ] 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:172.
[ 2 ] 王勇,陈硕卢,端萍,等.金线莲化学成分的研究[J].中草药,2017,48(13):2619-2624.
[ 3 ] 马晓玲,张雪琼,李心愿,等.蒲公英乙酸乙酯部位化学成分研究[J].中国医院药学杂志,2017,11(37):2139-2141.
[ 4 ] 蔡鲁,李彬,肖艳华,等.醉鱼草茎叶的化学成分研究[J].国际药学研究杂志,2015,42(5):634-636.
[ 5 ] 张成刚,卢叶,王峥涛,等.阔刺兔唇花全草的化学成分研究[J].中草药,2014,45(22):3224-3229.
[ 6 ] 柴玲,林霄,梁柏照,等. 拟草果化学成分研究[J].中草药,2018,49(14):3217-3221.
[ 7 ] 杜琳,常波,张琦,等.光果甘草根中黄酮类化学成分研究[J].中草药,2018,49(20):4780-4784.
[ 8 ] 冯卫生,陈文静,郑晓珂,等.怀菊花中黄酮类化学成分研究[J].中国药学杂志,2017,52(17):1497-1502.
[ 9 ] 梁爽,马雯芳,梁可文,等.瑶药糯米风醇提物的化学成分研究[J].中国药房,2019,30(20):2835-2839.
[10] 冯春特.富含迷迭香酸药用植物筛选及目标成分分离[D].哈尔滨:东北林业大学,2020.
[11] 白杰,马秀琴,陈卓尔,等.恰麻古化学成分的研究[J].华西药学杂志,2016,31(3):221-223.
[12] 唐雨,刘艳霞,张宏伟.狗舌草的化学成分研究[J].中国药业,2017,26(11):16-18.
[13] 许莉,王江瑞,郭力,等.金钗石斛化学成分的研究[J].中成药,2018,40(5):1110-1112.
[14] 林子君,刘晓秋,韩娜,等.板蓝根的化学成分研究[J].现代药物与临床,2011,26(5):381-383.
[15] 王琳,孙琳,刘慧颖,等.钩吻的化学成分研究[J].中草药,2017,48(10):2028-2032.
[16] 罗诚浩,宋旭艳,魏敏,等.黄芩苷木犀草素混合物镇咳祛痰平喘作用的实验研究[J].世界中西医结合杂志,2012,7(3):212-214.
[17] 王笃军,康立欣,赵力,等.桑葉经霜对其传统功效清肺润燥作用的影响[J].天然产物研究与开发,2017,29(9):1546-1550,1601.
[18] 邢志华.芹菜素及其衍生物药理作用研究新进展[J].中国药学杂志,2018,53(15):1241-1247.
[19] 骆明旭,罗丹,赵万红.槲皮素药理作用研究进展[J].中国民族民间医药,2014,9(17):12-14.
[20] 马纳,李亚静,范吉平.金合欢素药理研究进展[J].中国现代应用药学,2018,35(10):1591-1595.
[21] 王健,孙瑜,陈磊,等.芒柄花素的现代研究进展[J].山西中医学院学报,2017,18(5):74-76.
[22] 覃容贵,龙庆德,范菊娣,等.炮制对虎耳草中岩白菜素及其止咳抗炎作用的影响[J].中成药,2013,35(5):1027- 1030.
[23] 娜迪热·伊卜拉伊木,刘长江,金小越.阿那其根醇提取物对咳嗽变异性哮喘模型大鼠的改善作用研究[J].中国药房,2019,30(10):1371-1374.
[24] 沈伟,宋磊,李赫宇.蕨类植物黄酮类化学成分及生物活性研究进展[J].食品开发与研究,2015,36(17):186-188,200.
[25] 黄龙岳,宁洪鑫,姚薛超,等.木犀草素提取和纯化工艺的研究进展[J].中草药,2021,52(4):1185-1192.
(收稿日期:2021-01-28 修回日期:2021-06-27)
(编辑:张元媛)

