洋甘菊总黄酮对高脂血症模型小鼠脂质代谢的影响及机制


中圖分类号 R965 文献标志码 A 文章编号 1001-0408(2021)22-2706-07
DOI 10.6039/j.issn.1001-0408.2021.22.04
摘 要 目的:研究洋甘菊总黄酮对高脂血症模型小鼠脂质代谢的影响及潜在机制。方法:将30只雄性载脂蛋白E基因缺陷(C57BL/6J-ApoE-/-)小鼠随机分成模型组、阳性对照组(非诺贝特30 mg/kg)和洋甘菊总黄酮低、中、高剂量组(88、176、352 mg/kg),每组6只;另取6只雄性C57BL/6J小鼠作为正常对照组。正常对照组小鼠用普通饲料喂养,其余各组小鼠均用高脂饲料喂养8周以复制高脂血症模型。造模同时,各给药组小鼠灌胃相应药液(均以1%羧甲基纤维素钠溶液为溶剂),正常对照组和模型组小鼠灌胃1%羧甲基纤维素钠溶液,每次灌胃200 μL,每天1次,连续8周。分别于给药前和给药8周后称定各组小鼠的体质量,测定末次给药后小鼠血清中总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)含量,肝组织中超氧化物歧化酶(SOD)、丙二醛(MDA)含量以及过氧化物酶体增殖物激活受体α(PPARα)、肉毒碱棕榈酰基转移酶1A(CPT1A)、过氧化物酶酰基辅酶A氧化酶1(ACOX1)蛋白的表达水平,并观察肝组织的病理改变。结果:与给药前比较,各组小鼠给药8周后的体质量均有升高趋势。与正常对照组比较,模型组小鼠给药8周后的体质量和血清中TC、TG、LDL-C、AST、ALT含量以及肝组织中MDA含量均显著升高(P<0.05或P<0.01),血清中HDL-C含量和肝组织中SOD含量以及PPARα、CPT1A、ACOX1蛋白的表达水平均显著降低(P<0.05或P<0.01),肝组织结构紊乱并可见大小不一的圆形脂肪空泡,细胞质中可见大小不等的脂滴。与模型组比较,洋甘菊总黄酮各剂量组和阳性对照组小鼠给药8周后的体质量(除洋甘菊总黄酮低剂量组外)和血清中TC、TG、LDL-C、AST、ALT含量以及肝组织中MDA(除洋甘菊总黄酮低、中剂量组外)含量均显著降低(P<0.05或P<0.01),血清中HDL-C含量和肝组织中SOD含量以及PPARα、CPT1A(除洋甘菊总黄酮低、中剂量组外)、ACOX1蛋白的表达水平均显著升高(P<0.05或P<0.01),肝组织结构较清晰,肝脏脂肪空泡有不同程度的改善,脂滴变少,其中洋甘菊总黄酮高剂量组小鼠上述指标的改善效果最好。结论:洋甘菊总黄酮可预防C57BL/6J-ApoE-/-小鼠高脂血症的发生,其机制可能与上调PPARα表达、改善肝损伤和氧化应激损伤有关。
关键词 洋甘菊总黄酮;高脂血症;载脂蛋白E基因缺陷小鼠;脂质代谢;作用机制
Effects of Total Flavonoids from Chamomile on Lipid Metabolism of Hyperlipidemia Model Mice and Its Mechanism
LAN Wei(College of Traditional Chinese Medicine,Xinjiang Medical University,Urumqi 830017, China)
ABSTRACT OBJECTIVE: To study the effects of total flavonoids from chamomile on lipid metabolism of hyperlipidemia model mice and its potential mechanism. METHODS: Thirty male C57BL/6J-ApoE-/- mice were randomly divided into model group, positive control group (fenofibrate 30 mg/kg) and chamomile total flavonoids low-dose, medium-dose and high-dose groups (88, 176, 352 mg/kg), with 6 mice in each group. In addition, 6 male C57BL/6J mice were used as normal control group. Mice in normal control group were fed with ordinary diet, and mice in other groups were fed with high-fat diet for 8 weeks to replicate hyperlipidemia model. At the time of making model, administration groups were given relevant liquid (using 1% sodium carboxymethyl cellulose as solvent); normal control group and model group were given 1% sodium carboxymethyl cellulose intragastrically, 200 mL per gavage, once a day, for consecutive 8 weeks. The body weight of mice in each group was weighed before medication and 8 weeks after medication. The serum contents of total cholesterol (TC), triacylglycerol (TG), low-density lipoprotein cholesterol (LDL-C), high-density lipoprotein cholesterol (HDL-C), aspartate aminotransferase (AST) and alanine aminotransferase (ALT) in mice were detected after last administration; the contents of superoxide dismutase (SOD) and malondialdehyde (MDA) as well as the protein expressions of peroxisome proliferator-activated receptor α (PPARα), carnitine palmityl transferase 1A (CPT1A) and peroxase acyl-CoA oxidase 1 (ACOX1) in liver tissue were determined. The pathological changes in liver tissue were observed. RESULTS: Compared with before medication, the body weight of each group showed an increasing trend after 8 weeks of medication. Compared with normal control group, body weight, the contents of TC, TG, LDL-C, AST and ALT in serum and MDA content in liver tissue of mice in model group were significantly increased after 8 weeks of medication (P<0.05 or P<0.01). The content of HDL-C in serum and the content of SOD in liver tissue, as well as the protein expressions of PPARα, CPT1A and ACOX1 were significantly decreased (P<0.05 or P<0.01), and the structure of liver tissue was disorganized, with circular fat vacuoles of different sizes and lipid droplets of different sizes in the cytoplasm. Compared with model group, body weight (except for chamomile total flavonoids low-dose group) of mice, serum contents of TC, TG, LDL-C, AST and ALT, content of MDA in liver tissue (except for chamomile total flavonoids low-dose and medium-dose groups) were significantly decreased (P<0.05 or P<0.01). Serum content of HDL-C, content of SOD in liver tissue, protein expressions of PPARα, CPT1A (except for chamomile total flavonoids low-dose and medium-dose groups) and ACOX1 were significantly increased (P<0.05 or P<0.01); liver tissue structure was clear, and liver fat vacuoles were improved to varying degrees, and less lipid droplets. The improvement effect of the above indexes was the best in the chamomile total flavonoids high-dose group. CONCLUSIONS: Chamomile total flavonoids can prevent the occurrence of hyperlipidemia in C57BL/6J-ApoE-/- mice, the mechanism of which may be associated with up-regulation of PPARα expression, the improvement of liver injury and oxidant stress injury.
KEYWORDS Total flavonoids from chamomile; Hyperlipidemia; C57BL/6J-ApoE-/- mice; Lipid metabolism; Mechanism of action
高脂血症是由血液中的脂质成分代谢异常或者转运异常所引起的一种全身性疾病,也被称为血脂异常,主要表现为总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)的升高以及高密度脂蛋白胆固醇(HDL-C)的降低[1]。随着人们生活水平的提高和生活方式的改变,高脂血症的发病率逐年升高[2],其相关心血管疾病的发病率也逐年升高,且发病年龄逐渐趋于年轻化[3]。目前,临床应用最普遍的降脂药分别为他汀类、贝特类、烟酸类等[4],其中贝特类最为常用,也是典型的过氧化物酶体增殖物激活受体α(PPARα)激动剂,可促进肝脏对脂肪酸的摄取,从而减少TG的合成[5-6]。但这些药物在降血脂的同时,会引起高血糖、恶心、腹胀、腹泻及肝功能损伤等不良反应,不能满足长期用药调节血脂的临床需要[7-8]。
有研究表明,中药具有较好的降血脂作用,且有多途径、多靶点、广谱降血脂、副作用少等優势[9]。洋甘菊为菊科母菊属植物洋甘菊Matricaria chamomilia L.的全草,主产于我国新疆地区[10]。现代药理学研究表明,洋甘菊中的黄酮类成分具有抗菌、消炎、抗氧化等作用[11-13]。本课题组前期研究发现,洋甘菊总黄酮具有降血脂的作用,但其具体机制尚不明确[14]。本研究在前期研究的基础上,以高脂饲料喂养复制高脂血症小鼠模型,初步探讨洋甘菊总黄酮对模型小鼠脂质代谢的影响及潜在机制,旨在为洋甘菊的药效研究提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器包括Multiskan GO型酶标仪(美国Thermo Fisher Scientific公司),Powerpac型电泳仪、Gel Doc XR型凝胶成像分析仪(美国Bio-Rad公司),5424R型低温高速离心机(德国Eppendorf公司),Mini-6KC型低速离心机(杭州奥盛仪器有限公司),IX71-12F型倒置显微镜(美国Roper Scientific公司)等。
1.2 主要药品与试剂
洋甘菊药材粉末(批号20190522)购自新疆维吾尔药业有限公司,经新疆医科大学姚蓝副教授鉴定为母菊属一年生草本植物洋甘菊M. chamomilia L.的全草;非诺贝特胶囊(批号20181239,规格200 mg)购自美国Abbott Laboratories公司;TG测定试剂盒[单试剂甘油磷酸氧化酶(GPO)-过氧化物酶(PAP)法]、TC测定试剂盒(单试剂GPO-PAP法)、HDL-C测定试剂盒(双试剂直接法)、LDL-C测定试剂盒(双试剂直接法)、天冬氨酸转氨酶(AST)测试盒(微板法)、丙氨酸转氨酶(ALT)测试盒(赖氏法)、超氧化物歧化酶(SOD)测定试剂盒[水溶性四氮唑1(WST-1)法]、丙二醛(MDA)测定试剂盒[硫代巴比妥酸(TBA法)](批号分别为A110-1-1、A111-1-1、A113-1-1、A112-1-1、C010-2-2、C009-2-1、A001-3、A003-1)均购自南京建成生物工程研究所;兔源PPARα多克隆抗体、兔源肉毒碱棕榈酰基转移酶1A(CPT1A)多克隆抗体、兔源过氧化物酶酰基辅酶A氧化酶1(ACOX1)多克隆抗体、兔源β-肌动蛋白(β-actin)多克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(批号分别为AI10115187、AI11285608、AC11134512、AI09236261、BJ11195904)均购自北京博奥森生物技术有限公司;D-101大孔吸附树脂(粒径0.30~1.25 mm)、RIPA裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒、4×loading buffer蛋白上样缓冲液、苏木精-伊红(HE)染液(批号分别为1021Q011、R0020、20190708、P1016SDS-PAGE、G1003)均购自北京索莱宝科技有限公司;脱脂奶粉(批号EZ4567B114)购自德国Biofroxx公司;BCA蛋白浓度测定试剂盒(批号UI289374)购自美国Thermo Fisher Scientific公司;聚偏二氟乙烯(PVDF)膜(批号42931900)购自瑞士Roche公司;ECL化学发光底物试剂盒(批号BL520A)购自上海桥星贸易有限公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 实验动物
本研究所用实验动物为SPF级雄性载脂蛋白E基因缺陷(C57BL/6J-ApoE-/-,以下简称“ApoE-/-”)小鼠30只和雄性C57BL/6J小鼠6只,体质量均为(18±2) g,由北京维通利华实验动物技术有限公司提供,实验动物生产许可证号为SCXK(京)2016-0011。所有小鼠均在温度20~25 ℃、相对湿度40%~70%、每12 h昼夜交替的环境下饲养,并自由饮水、进食。普通饲料和高脂饲料(包括蛋白质20%、碳水化合物35%、脂肪45%)均由新疆医科大学动物实验中心提供。本实验所有操作均符合动物实验伦理要求。
2 方法
2.1 洋甘菊总黄酮的制备
参考本课题组前期研究所确定的最优提取及纯化工艺进行操作[15]:称取洋甘菊药材粉末适量,加12倍量(mL/g)的70%乙醇,加热回流提取3次,每次2 h,合并提取液,浓缩;浓缩液经D-101大孔吸附树脂柱,以70%乙醇进行洗脱,收集洗脱液,于60 ℃下旋转蒸发以挥尽乙醇,干燥即得洋甘菊总黄酮(以芦丁计含量为56.20%,每1 g总黄酮相当于生药8.62 g)。
2.2 分组、造模与给药
将30只ApoE-/-小鼠随机分成模型组、阳性对照组(非诺贝特30 mg/kg,给药剂量按人临床常用剂量换算)和洋甘菊总黄酮低、中、高剂量组(88、176、352 mg/kg,给药剂量按人临床常用剂量的0.5、1、2倍换算),每组6只;另取6只C57BL/6J小鼠作为正常对照组。正常对照组小鼠用普通饲料喂养,其余各组小鼠均用高脂饲料喂养8周以复制高脂血症模型;造模同时,各给药组小鼠灌胃相应药液(均以1%羧甲基纤维素钠溶液为溶剂),正常对照组和模型组小鼠灌胃1%羧甲基纤维素钠溶液,每次灌胃200 μL,每天1次,连续8周。
2.3 小鼠体质量的称定
分别于给药前和给药8周后称定各组小鼠的体质量,观察其变化趋势。
2.4 小鼠血清中血脂和肝功能指标的测定
末次给药后,各组小鼠禁食不禁水,于次日经眼眶采血0.1 mL,血样于室温下放置30 min后,在4 ℃下以3 000 r/min离心10 min,分离血清,按照试剂盒说明书方法操作,用酶标仪测定各组小鼠血清中TG、TC、HDL-C、LDL-C、AST和ALT的含量。
2.5 小鼠肝组织中氧化应激指标的测定
采血后,处死各组小鼠,分离其肝脏,取肝组织于液氮中冻存。取冻存的肝组织适量,按照试剂盒说明书方法操作,用酶标仪测定各组小鼠肝组织中SOD、MDA的含量。
2.6 小鼠肝组织的病理观察
取各组小鼠冻存的肝组织适量,用4%多聚甲醛溶液固定7 d,经脱水、石蜡包埋后切片(厚度约5 μm),以HE染色,并使用倒置显微镜观察各组小鼠肝组织的病理变化。
2.7 小鼠肝组织中PPARα、CPT1A、ACOX1蛋白表达的测定
采用Western blot法进行测定。取各组小鼠冻存的肝组织适量,置于研钵加液氮研磨,取研磨充分的肝组织100 mg,加RIPA裂解液1 mL,于冰上匀浆,再于4 ℃下以12 000 r/min离心15 min,取上清液,即得肝组织蛋白。采用BCA法测定肝组织的蛋白浓度,加入4×loading buffer蛋白上样缓冲液,于100 ℃加热10 min使蛋白变性。取变性后的蛋白样品进行SDS-PAGE分离,采用湿转法转移至PVDF膜上,用5%脱脂奶粉于室温下封閉1.5 h;用1×TBST缓冲液清洗10 min×3次,分别加入PPARα、CPT1A、ACOX1、β-actin一抗(稀释比例均为1 ∶ 1 000),于4 ℃下孵育过夜;用1×TBST缓冲液清洗10 min×3次,加入HRP标记的山羊抗兔IgG二抗(稀释比例为1 ∶ 5 000),于室温下避光孵育1 h;用1×TBST缓冲液清洗10 min×3次,加入ECL发光液显影并置于凝胶成像分析仪上成像。采用Image J v1.8.0和Graphpad prism 7.0软件进行分析、作图,以目标蛋白与内参蛋白(β-actin)的灰度值比值作为目标蛋白的表达水平。
2.8 统计学方法
采用SPSS 21.0软件对数据进行统计分析。实验数据均以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。检验水准α=0.05。
3 结果
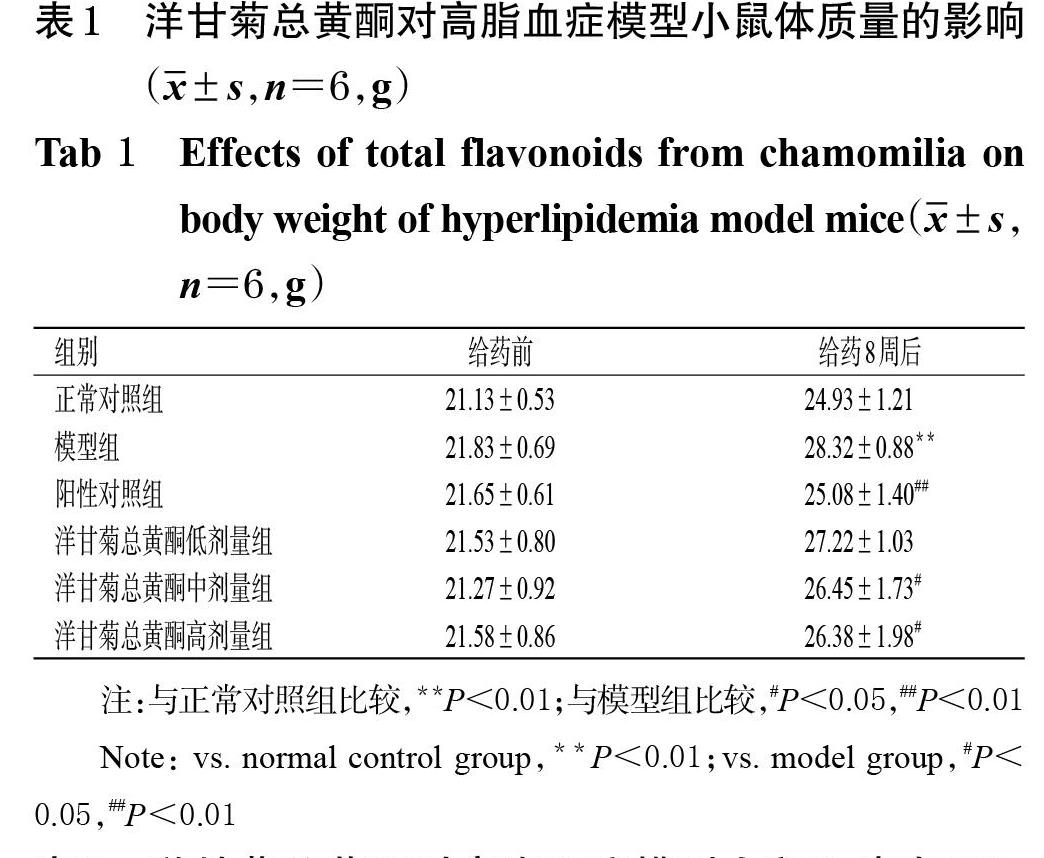
3.1 洋甘菊总黄酮对高脂血症模型小鼠体质量的影响
与给药前比较,各组小鼠给药8周后的体质量均有升高趋势。与正常对照组比较,模型组小鼠给药8周后的体质量显著升高(P<0.01)。与模型组比较,洋甘菊总黄酮中、高剂量组和阳性对照组小鼠给药8周后的体质量均显著降低(P<0.05或P<0.01)。结果见表1。
3.2 洋甘菊总黄酮对高脂血症模型小鼠血脂指标含量的影响
与正常对照组比较,模型组小鼠血清中TC、TG、LDL-C含量均显著升高(P<0.01),HDL-C含量显著降低(P<0.01)。与模型组比较,洋甘菊总黄酮各剂量组和阳性对照组小鼠血清中TC、TG、LDL-C含量均显著降低(P<0.01),HDL-C含量均显著升高(P<0.01)。与洋甘菊总黄酮高剂量组比较,洋甘菊总黄酮低剂量组小鼠血清中TC、TG含量以及洋甘菊总黄酮中剂量组小鼠血清中TC含量均显著升高(P<0.05)。结果见表2。
3.3 洋甘菊总黄酮对高脂血症模型小鼠肝功能指标含量的影响
与正常对照组比较,模型组小鼠血清中AST、ALT含量均显著升高(P<0.01)。与模型组比较,洋甘菊总黄酮各剂量组和阳性对照组小鼠血清中AST、ALT含量均显著降低(P<0.01)。与洋甘菊总黄酮高剂量组比较,洋甘菊总黄酮低剂量组小鼠血清中ALT含量显著升高(P<0.05)。结果见表3。
3.4 洋甘菊总黄酮对高脂血症模型小鼠肝组织中氧化应激指标含量的影响
与正常对照组比较,模型组小鼠肝组织中MDA含量显著升高(P<0.01),SOD含量显著降低(P<0.05)。与模型组比较,洋甘菊总黄酮各剂量组和阳性对照组小鼠肝组织中MDA(除洋甘菊总黄酮低、中剂量组外)含量均显著降低(P<0.05),SOD含量均显著升高(P<0.05或P<0.01)。结果见表4。
3.5 洋甘菊总黄酮对高脂血症模型小鼠肝组织病理变化的影响
正常对照组小鼠肝组织形态正常,组织结构完整且清晰,无明显的脂肪空泡。模型组小鼠肝组织结构紊乱,可见大小不一的圆形脂肪空泡,细胞质中可见大小不等的脂滴,细胞肿大且细胞核发生偏移。与模型组比较,洋甘菊总黄酮各剂量组和阳性对照组小鼠肝组织结构较清晰,肝脏脂肪空泡有不同程度的改善,脂滴变少,肝细胞排列稍整齐,形态较正常。结果见图1。
3.6 洋甘菊总黄酮对高脂血症模型小鼠肝组织中PPARα、CPT1A、ACOX1蛋白表达的影响
与正常对照组比较,模型组小鼠肝组织中PPARα、CPT1A、ACOX1蛋白的表达水平均显著降低(P<0.05或P<0.01)。与模型组比较,洋甘菊总黄酮各剂量组和阳性对照组小鼠肝组织中PPARα、CPT1A(除洋甘菊总黄酮低、中剂量组外)、ACOX1蛋白的表达水平均显著升高(P<0.05或P<0.01)。与洋甘菊总黄酮高剂量组比较,洋甘菊总黄酮低、中剂量组小鼠肝组织中ACOX1蛋白的表达水平均显著降低(P<0.05或P<0.01)。结果见图2、图3。
4 讨论
载脂蛋白E(ApoE)是调节脂质代谢的重要蛋白,主要在肝脏和脑中合成,大部分存在于乳糜微粒、极低密度脂蛋白和中间密度脂蛋白中,是肝脏和外周组织中低密度脂蛋白受体及其相关蛋白受体清除脂质的重要配体。以往研究表明,ApoE基因与多种疾病密切相关,尤其是Ⅲ型家族性高胆固醇血症,这类患者通常携带了ApoE2/2基因[16]。大量研究表明,ApoE-/-小鼠已成为研发降脂药和保护血管药物的重要动物模型之一[17-18]。因此,本研究以ApoE-/-小鼠作为实验动物。本研究结果显示,与正常对照组比较,模型组小鼠给药8周后的体质量显著升高,肝组织结构紊乱,可见大小不一的圆形脂肪空泡,细胞质中可见大小不等的脂滴,细胞肿大且细胞核偏移,说明脂肪变性比较严重。与模型组比较,洋甘菊总黄酮各剂量组小鼠体质量(除低剂量组外)均显著降低,肝组织结构较清晰,肝脏脂肪变性有不同程度的改善,脂滴变少,肝细胞排列稍整齐,形态较正常,说明洋甘菊总黄酮可以有效改善肝细胞的脂肪变性。
肝脏富含多种与脂质代谢相关的酶,在调节全身能量平衡和脂质稳态方面起着重要的作用[19]。AST和ALT主要分布在肝细胞内,一小部分存在于肌肉细胞内。如果肝脏受损,肝细胞中的转氨酶便进入到血液中,故血清ALT和AST含量的升高可以作为肝脏受损和肝脏疾病的提示信号[20]。MDA和SOD是公认的氧化应激预测指标。肝组织中MDA含量的升高或者SOD含量的降低,提示着肝组织存在严重的氧化应激损伤[21]。本研究结果显示,与正常对照组比较,模型组小鼠血清中TC、TG、LDL-C含量均显著升高,HDL-C含量显著降低,表现出典型的高脂血症症状。与模型组比较,洋甘菊总黄酮各剂量组小鼠血清中TC、TG、LDL-C含量均显著降低,HDL-C含量均显著升高,提示洋甘菊总黄酮可预防ApoE-/-小鼠高脂血症的发生。另外,模型组小鼠血清中ALT、AST含量和肝组织中MDA含量均显著高于正常对照组,肝组织中SOD含量显著低于正常对照组,表明高脂血症模型小鼠存在一定程度的肝损伤和氧化应激损伤。与模型组比较,洋甘菊总黄酮各剂量组小鼠的上述指标均有不同程度的改善,其中洋甘菊总黄酮高剂量组小鼠的改善效果最好,表明洋甘菊总黄酮可预防高脂血症模型小鼠的肝损伤和氧化应激损伤。
PPARα是脂肪酸氧化代谢的关键酶,可以调节肝脏脂肪酸的氧化代谢,维持肝脏脂质和能量的平衡[22-23]。PPARα的主要作用是降低血清TG含量,升高血清HDL-C含量,增加脂肪酸的摄取和氧化分解[24]。CPT1A和ACOX1为PPARα的下游因子,是脂肪酸代谢的限速酶[25]。有研究证实,当肝脏中PPARα的表达降低时,其靶因子CPT1A的转录会受阻,从而导致过量的脂肪酸在肝脏中积累[26]。Garbacz等[27]研究发现,PPARα基因缺陷小鼠会出现严重的肝脏脂肪变性。Batatinha等[28]研究发现,PPARα基因缺陷可使小鼠的心脏和肝脏发生脂肪化,并可使游离脂肪酸的水平显著升高,从而导致严重的脂质沉积。Huang等[29]研究发现,ACOX1基因敲除小鼠表现出严重的脂肪性肝炎。非诺贝特是临床常用的降脂药,也是典型的PPARα激动剂。本实验主要研究洋甘菊总黄酮的降血脂作用机制是否跟PPARα信号通路有关,故选用非诺贝特作为阳性对照药物。本研究结果显示,模型组小鼠肝组织中PPARα、CPT1A、ACOX1蛋白的表达水平均显著低于正常对照组;与模型组比较,洋甘菊总黄酮各剂量组和阳性对照组小鼠的上述指标均有不同程度的改善,其中洋甘菊总黄酮高剂量组小鼠的改善效果最好,表明洋甘菊总黄酮可通过上调PPARα蛋白的表达来促进脂肪酸的氧化,进而减少肝组织中的脂质沉积。
综上所述,洋甘菊总黄酮可预防ApoE-/-小鼠高脂血症的发生,其机制可能与上调PPARα表达、改善肝损伤和氧化应激损伤有关。本课题组下一步会就洋甘菊总黄酮的活性单体成分开展研究,挖掘洋甘菊提取物降血脂的有效单体成分及作用機制。
参考文献
[ 1 ] 陈华,陈淋,张男,等.脂质组学在高脂血症的研究进展[J].药物分析杂志,2016,36(8):1324-1329.
[ 2 ] XU Y,NIU Y,GAO Y,et al. Borapetoside E,a clerodane diterpenoid extracted from tinospora crispa,improves hyperglycemia and hyperlipidemia in high-fat-diet-induced type 2 diabetes mice[J]. J Nat Prod,2017,80(8):2319- 2327.
[ 3 ] DANESE M D,SIDELNIKOV E,KUTIKOVA L. The prevalence,low-density lipoprotein cholesterol levels,and treatment of patients at very high risk of cardiovascular events in the United Kingdom:a cross-sectional study[J].Curr Med Res Opin,2018,34(8):1441-1447.
[ 4 ] PIEPOLI M,HOES A,AGEWALL S,et al. 2016 European guidelines on cardiovascular disease prevention in clinical practice[J/OL]. Eur Heart J,2016:1-78[2021-07-10]. http://
doi.org/10.1093/eurheartj/ehw106.
[ 5 ] SAHEBKAR A,SERBAN M C,MIKHAILIDIS D P,et al. Head-to-head comparison of statins versus fibrates in reducing plasma fibrinogen concentrations:a systema- tic review and meta-analysis[J]. Pharmacol Res,2016,103:236-252.
[ 6 ] 闫冬梅.非诺贝特作用机制的进展[J].中国医药指南,2012,10(21):467-469.
[ 7 ] 张小谦,赵国君.调血脂药的研究进展[J].包头医学院学报,2014,30(6):160-162.
[ 8 ] 刘晓嘉.他汀类药物所致不良反应及其相关影响因素的研究进展[J].北方药学,2019,16(2):157-196.
[ 9 ] 齐军,李俊利,常福厚.中药降血脂作用的研究进展[J].内蒙古中医药,2007(1):59-60.
[10] 赵鑫.德国母菊[J].国外医药:植物药分册,2008,23(2):92.
[11] AL-DABBAGH B,ELHATY I A,ELHAW M,et al. Antioxidant and anticancer activities of chamomile(Matricaria recutita L.)[J]. BMC Res Notes,2019,12(1):3.
[12] TAGHIZADEH M S,NIAZI A,MOGHADAM A,et al.The potential application of the protein hydrolysates of three medicinal plants:cytotoxicity and functional properties[J]. Food Sci,2020,85(10):3160-3167.
[13] ZHAO Y F,ZHANG D,LIANG C X,et al. Chemical constituents from Matricaria chamomilla L.:Ⅰ[J]. J Chin Pharm Sci,2018,27(5):324-331.
[14] 兰卫,王莹,郝宇薇,等.德国洋甘菊对实验性高血脂症大鼠的降脂作用[J].新疆医科大学学报,2018,41(2):208-210,215.
[15] 兰卫,郭玉婷,胡江兰,等.大孔树脂分离纯化维药洋甘菊中黄酮工艺研究[J].时珍国医国药,2017,28(3):575-578.
[16] GUAN H,LIN Y,BAI L,et al. Dietary cocoa powder improves hyperlipidemia and reduces atherosclerosis in apoe deficient mice through the inhibition of hepatic endoplasmic reticulum stress[J/OL]. Mediators Inflamm,2016:1937572[2021-07-10]. http://doi.org/10.1155/2016/1937572.
[17] WANG Y Y,LI H,WANG X H,et al. Probucol inhibits MMP-9 expression through regulating miR-497 in HUVECs and ApoE knockout mice[J]. Thromb Res,2016,140:51- 58.
[18] GAO B,LI L,ZHU P,et al. Chronic administration of methamphetamine promotes atherosclerosis formation in ApoE-/- knockout mice fed normal diet[J]. Atherosclerosis,2015,243(1):268-277.
[19] 苑陽阳.姜黄素化合物对急性高脂血症大鼠肝脏脂代谢的影响及其作用机制[D].石家庄:河北医科大学,2016.
[20] 郑红琴,魏慧聪.血清ALT、AST和GGT水平检测在肝脏疾病诊断中的应用价值[J].河南医学研究,2018,27(24):4467-4468.
[21] 孟庆华,于晓霞,张海凤,等.天然黄酮类化合物清除自由基机理及其应用进展[J].云南民族大学学报(自然科学版),2012,21(2):79-83.
[22] 钱毅,彭孟云,张玉容,等.祛痰活血方对非酒精性脂肪性肝病大鼠PPARα/CPT-1通路及胰岛素抵抗的影响[J].湖北中医杂志,2021,43(5):10-15.
[23] FERDINANDUSSE S,DENIS S,ROERMUND C,et al. A novel case of ACOX2 deficiency leads to recognition of a third human peroxisomal acyl-CoA oxidase[J]. Biochim Biophys Acta Mol Basis Dis,2018,1864(3):952-958.
[24] 张岩. PPARα/γ信号通路在高脂性脂肪性肝炎发病机制中的作用研究[D].苏州:苏州大学,2015.
[25] YUAN R,SUN G,GAO J,et al. Schisandra fruit vinegar lowers lipid profile in high-fat diet rats[J/OL]. Evid Based Complement Alternat Med,2020:7083415[2021-07-10].http://doi.org/10.1155/2020/7083415.
[26] SOUZA-MELLO V. Peroxisome proliferator-activated receptors as targets to treat non-alcoholic fatty liver di- sease[J]. World J Hepatol,2015,7(8):1012-1019.
[27] GARBACZ W G,HUANG J T,HIGGINS L G,et al. PPARα is required for PPARδ action in regulation of body weight and hepatic steatosis in mice[J/OL]. PPAR Res,2015:927057[2021-07-10]. http://doi.org/10.1155/2015/927057.
[28] BATATINHA H A,LIMA E A,TEIXEIRA A A,et al. Association between aerobic exercise and rosiglitazone avoided the NAFLD and liver inflammation exacerbated in PPAR-α knockout mice[J]. J Cell Physiol,2017,232(5):1008-1019.
[29] HUANG J,JIA Y,FU T,et al. Sustained activation of PPARα by endogenous ligands increases hepatic fatty acid oxidation and prevents obesity in ob/ob mice[J]. FASEB J,2012,26(2):628-638.
(收稿日期:2021-08-26 修回日期:2021-09-16)
(編辑:邹丽娟)

