基于网络药理学消岩汤中夏枯草与白花蛇舌草治疗非小细胞肺癌作用机制的研究
魏传宇, 于晓宇, 申倩, 李俊辰, 肖贤, 贾英杰
1.天津中医药大学第一附属医院、国家中医针灸临床医学研究中心,天津 300112;2.天津中医药大学,天津 301617
肺癌作为临床常见的恶性肿瘤,其全球发病率一直居于首位,死亡率同样位于前列[1]。非小细胞肺癌约占所有肺癌的80%,约75%的患者发现时已处于中晚期,五年生存率很低。非小细胞型肺癌包括鳞状细胞癌(鳞癌)、腺癌、大细胞癌,与小细胞癌相比其癌细胞生长分裂较慢,扩散转移相对较晚。中医称肺癌为“肺积”,根据辨证将其分为气滞血瘀型、痰热阻肺型、肺阴虚型、气血两虚型。
消岩汤系天津中医药大学第一附属医院肿瘤科贾英杰教授治疗恶性肿瘤之经验方,基于肿瘤病机“正气内虚,毒瘀并存”,以“扶正固本,解毒祛瘀”为治法,结合多年临证经验总结拟成“消岩汤”[2]。该方由夏枯草、生牡蛎、白花蛇舌草、黄芪、太子参、姜黄、郁金7味中药组成,经过多例非小细胞肺癌患者的临床治疗,效果较满意。
中医药具有整体观、辨证论治、方剂干预等鲜明特色,但中医药独特的理论体系与哲学思想很难被各国医患者理解与接受。因其药效物质基础与作用机制不明确、缺乏安全性评价系统等,使其从整体到分子水平都很难进行全面系统研究,极大阻碍中医药现代化与国际化的发展进程。英国药理学家HOPKINS[3]于2007年提出“网络药理学”(network pharmacology,NP)的概念,定义其为一门运用生物分子网络方法分析药物与疾病和靶点之间“多成分、多靶点、多途径”协同作用关系的药理学分支学科。网络药理学系统综合地研究药物对疾病网络的干预和影响,这一特点与中医药对复杂疾病的诊治原则一致。借助网络药理学、系统生物学、计算机技术等现代科学手段,中医药将加快推进现代化进程[4]。
“中药网络药理学”这一新领域的研究旨在从系统层次和分子水平揭示中药方剂的奥秘,促进中药研究从当前的“单一靶标,单一药物”模式转向“网络靶标,多成分药物”的新模式,近年来,中药网络药理学的一系列方法得以创建,包括基于网络的疾病基因预测、中药成分的靶标谱和药理活性预测、药物一基因一疾病的共模块分析、中药方剂多成分协同作用的大规模筛选、中药方剂的配伍规律和网络调节机理分析等[5]。因此,利用网络药理学对中药复方治疗疾病的机制进行研究,能够明确药物的活性成分,并将药物的作用机制深入到分子生物学层面[6]。
基于贾英杰早期对于消岩汤剂拆方配伍对肺腺癌A549细胞体外生长抑制作用研究并根据功效将全方拆分为3组:清热解毒组(夏枯草、生牡蛎、白花蛇舌草);益气扶正组(黄芪、太子参);活血祛瘀组(姜黄、郁金)。研究证实消岩汤剂及其拆方组均对人肺腺癌A549细胞有很强的抑制作用,具有扶正抑瘤的功效。消岩汤全方组当浓度达到50 g/L时达到最大抑制率85.60%,其中清热解毒组中药为全方体外抑瘤作用的最重要组分[2]。因此,我们认为消岩汤中清热解毒组为该方核心组分。
故本研究运用网络药理学探讨消岩汤中抑瘤作用最重要的组分,清热解毒组中的2味中草药(夏枯草、白花蛇舌草)对非小细胞肺癌的多成分、多靶点治疗,旨在为揭示该2味中草药在消岩汤中的作用机制的科学内涵提供参考。
1 方法
1.1 夏枯草和白花蛇舌草化合物及作用靶点的筛选
釆用TCMSP(http://lsp.nwsuaf.edu.cn/tcmsp.php),以夏枯草、白花蛇舌草为关键词,OB≥30%且DL≥0.18为标准,收集并筛选出其中全部化合物及其作用靶点。
1.2 疾病靶点的确定
利用OMIM(https://omim.org/)、Genecards(https://www.genecards.org/)、 PharmGkb(https://www.pharmgkb.org/)以及TTD(http://bidd.nus.edu.sg/group/cjttd/)疾病数据库,以非小细胞肺癌为关键词,高关联度为标准,得到疾病的高相关性靶点。
1.3 疾病-化合物共同靶点的筛选
利用VennPainter软件,将药物有效成分的作用靶点与筛选出的疾病靶点取交集,得到两者共同的作用靶点。
1.4 药物-共同靶点-疾病网络的构建
将药物中的化合物、非小细胞肺癌以及两者的共同靶点蛋白上传至Cytoscape软件(http://www.cytoscape.org/)生成体现药物与共同靶点以及疾病之间相互作用的网络图,以探究消岩汤中夏枯草、白花蛇舌草的药理学作用机制。
1.5 PPI网络的构建
利用String(https://string-db.org/)蛋白互作数据库及Cytoscape软件挖掘共同靶点蛋白之间的相互作用,并运用R语言对其计数。
1.6 GO富集
使用Cytoscape软件对共同靶点蛋白进行GO功能富集分析,以了解共同靶点的功能,通过Omicshare软件(http://www.omicshare.com/tools/index,php/)对结果进行可视化处理。
1.7 KEGG富集
应用 David(https://david.ncifcrf.gov/)数据库及Cytoscape软件对共同靶点进行KEGG通路富集分析,并做分析注释,得到消岩汤中夏枯草和白花蛇舌草治疗非小细胞肺癌的信号通路,通过Omicshare软件对结果进行可视化处理。
2 结果
2.1 药物化合物及作用靶点的筛选
利用TCMSP分别查找夏枯草和白花蛇舌草的化合物及作用靶点,经过整理,药物活性化合物共有15种,其中夏枯草11种、白花蛇舌草7种(夏枯草、白花蛇舌草都含有β-谷甾醇、豆甾醇和槲皮素),见表1。查找消岩汤中夏枯草与白花蛇舌草化合物的靶点,通过筛选,共有160个化合物作用靶点。

表1 方中二味药材的15个候选化合物的基本信息Table 1 Essential information of15 alternative chemical compound in herbs
2.2 疾病靶点及药物-疾病共同靶点的确定
利用OMIM、Genecard、PharmGkb以及TTD疾病数据库,筛选出2513个高相关性疾病靶点。结合160个化合物的靶点,利用VennPainter软件,分析得出消岩汤中夏枯草和白花蛇舌草与非小细胞肺癌的共同靶点有112个,靶点交集率达:70.0%。
2.3 药物-共同靶点-疾病网络的构建与分析
利用Cytoscape软件构建药物-共同靶点-疾病的网络图,见图1。图中一共有77个节点,包括1个非小细胞肺癌节点(粉色)、2个中药节点(绿色)、13个化合物节点(黄色)、112个共同靶点的节点(蓝色)。消岩汤中夏枯草和白花蛇舌草所有化合物中有2个化合物与药物-疾病共同靶点没有联系,未参与网络的构建。在13种化合物中,包括夏枯草的11种化合物、白花蛇蛇草的5种化合物,其中夏枯草和白花蛇舌草共同包含的化合物是豆甾醇、槲皮素和β-谷甾醇,现代药理学证明,豆甾醇在体外能显著降低肿瘤坏死因子-α(TNF-α)的转录水平,在体内能破坏肿瘤血管的生成,抑制肿瘤的生长[7],槲皮素通过减少基质金属蛋白酶(Matrix metalloproteinase,MMP)的分泌,阻断STAT3信号通路,从而抑制癌细胞的上皮-间质转化(EMT)、侵袭和转移[8],β-谷甾醇能渗入细胞膜中并改变膜流动性,诱导癌细胞凋亡且提高凋亡速率[9]。也进一步说明这3种化合物在消岩汤药物组成中占到重要地位。调控的靶点数目排前5位的化合物是槲皮素、β-谷甾醇、豆甾醇、木犀草素、山奈酚,说明这些化合物在消岩汤治疗非小细胞肺癌中起主要作用。化合物调控的靶点数目 前 5 位 是 PTGS1、 NCOA2、 BCL2、 PPARG、CASP9,是消岩汤治疗非小细胞肺癌的主要靶点。
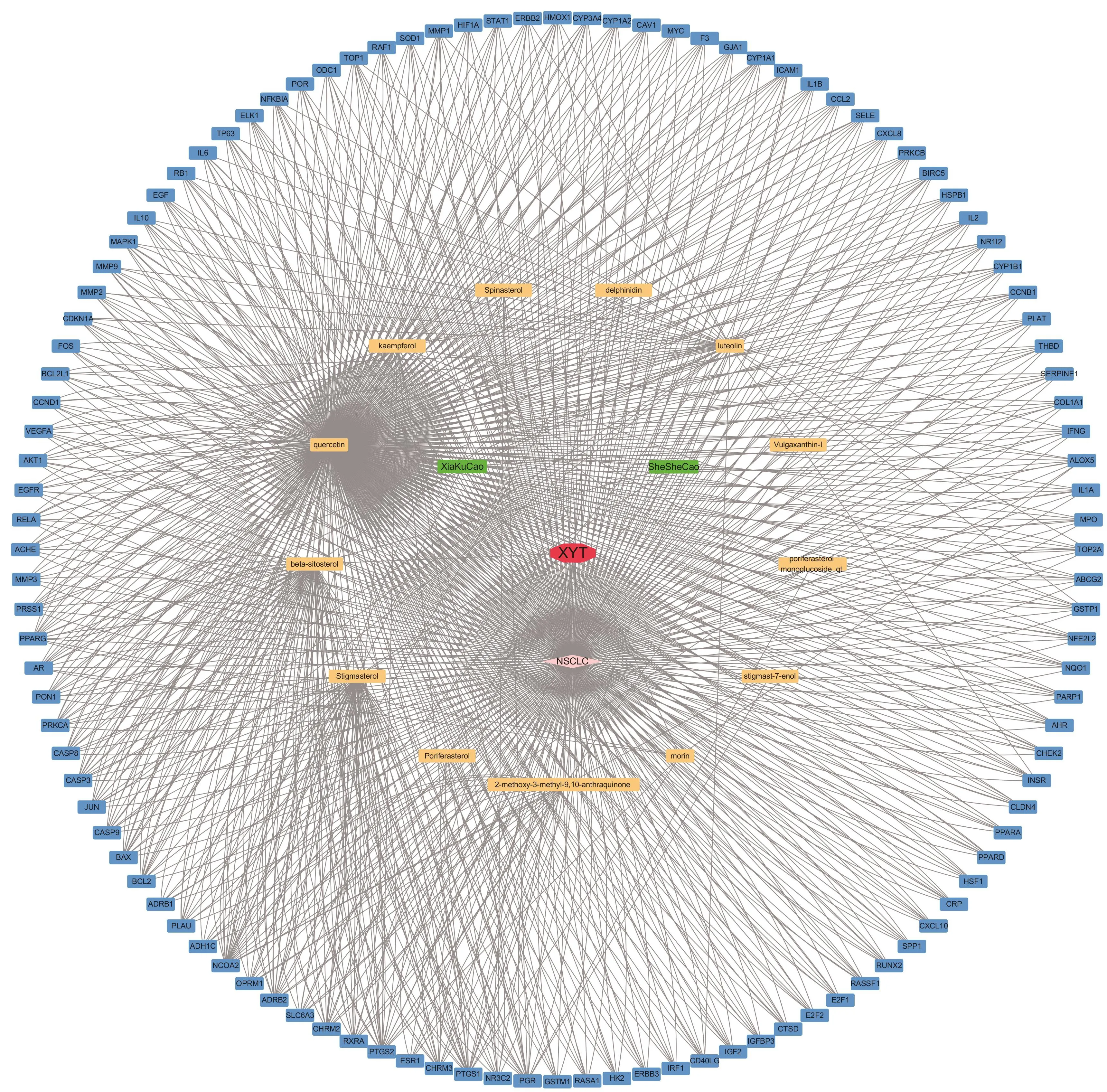
图1 药物-共同靶点-疾病网络Figure 1 Herb-collective Target-disease
2.4 PPI网络的构建与分析
利用String蛋白互作数据库和Cytoscape软件分析共同靶点蛋白之间的相互关系,见图2。PPI计数排名前3位的靶点是AKT1、IL-6、VEGFA,见图3,相互作用关系越多,说明该靶点在消岩汤治疗非小细胞肺癌中起更为重要的作用。

图2 PPI网络Figure 2 Network of PPI
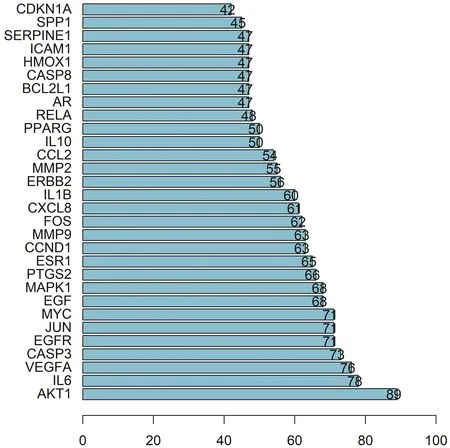
图3 PPI计数Figure 3 Count of PPI
2.5 GO功能富集分析
对消岩汤中夏枯草和白花蛇舌草的化合物和非小细胞肺癌的共同靶点进行GO功能富集分析,以错误发现率(false discovery rate,FDR)<0.05为标准,确认了1 466条结果,利用Omicshare软件对结果进行可视化处理,展示前20个共同的基因功能,见图4。排名前5位的分别是对氧化应激的反应、对类固醇激素的反应、对细菌起源的分子的反应、对脂多糖的反应、营养水平的反应。

图4 GO功能富集Figure 4 GO enrichment analysis
2.6 KEGG通路富集分析
对消岩汤中夏枯草、白花蛇舌草的化合物与非小细胞肺癌的共同靶点利用DAVID数据库进行KEGG通路富集分析,以P值<0.01,FDR<0.05进行筛选,并将结果利用Omicshare软件可视化,见图5。此外,对KEGG结果进行预读后发现,与非小细胞肺癌密切相关的通路有糖尿病并发症中的AGE-RAGE信号通路、IL-17信号通路、TNF信号通路,运用R语言软件加载Bioconductor包对以上通路进行靶点-通路机制分析,以红色标记代表夏枯草、白花蛇舌草可能干预的潜在靶点,结果见图6~图8。
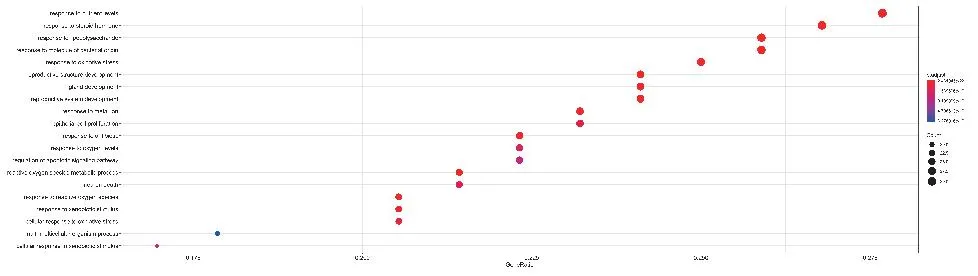
图5 KEGG通路富集分析Figure 5 KEGG signal pathway enrichment
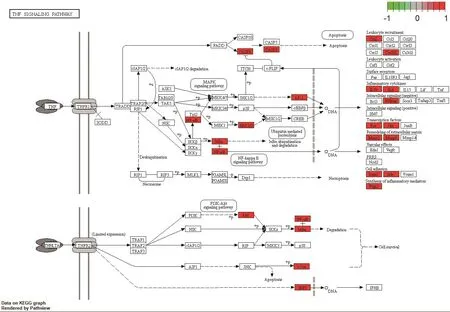
图6 TNF信号通路Figure 6 TNF signal pathway
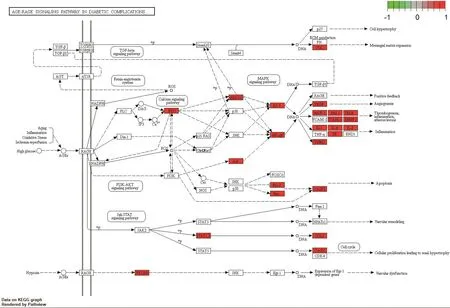
图7 糖尿病并发症中的晚期糖基化终末产物(AGEs)-晚期糖基化终末产物受体(RAGE)信号通路Figure 7 AGE-RAGE signal pathway in diabetic complications
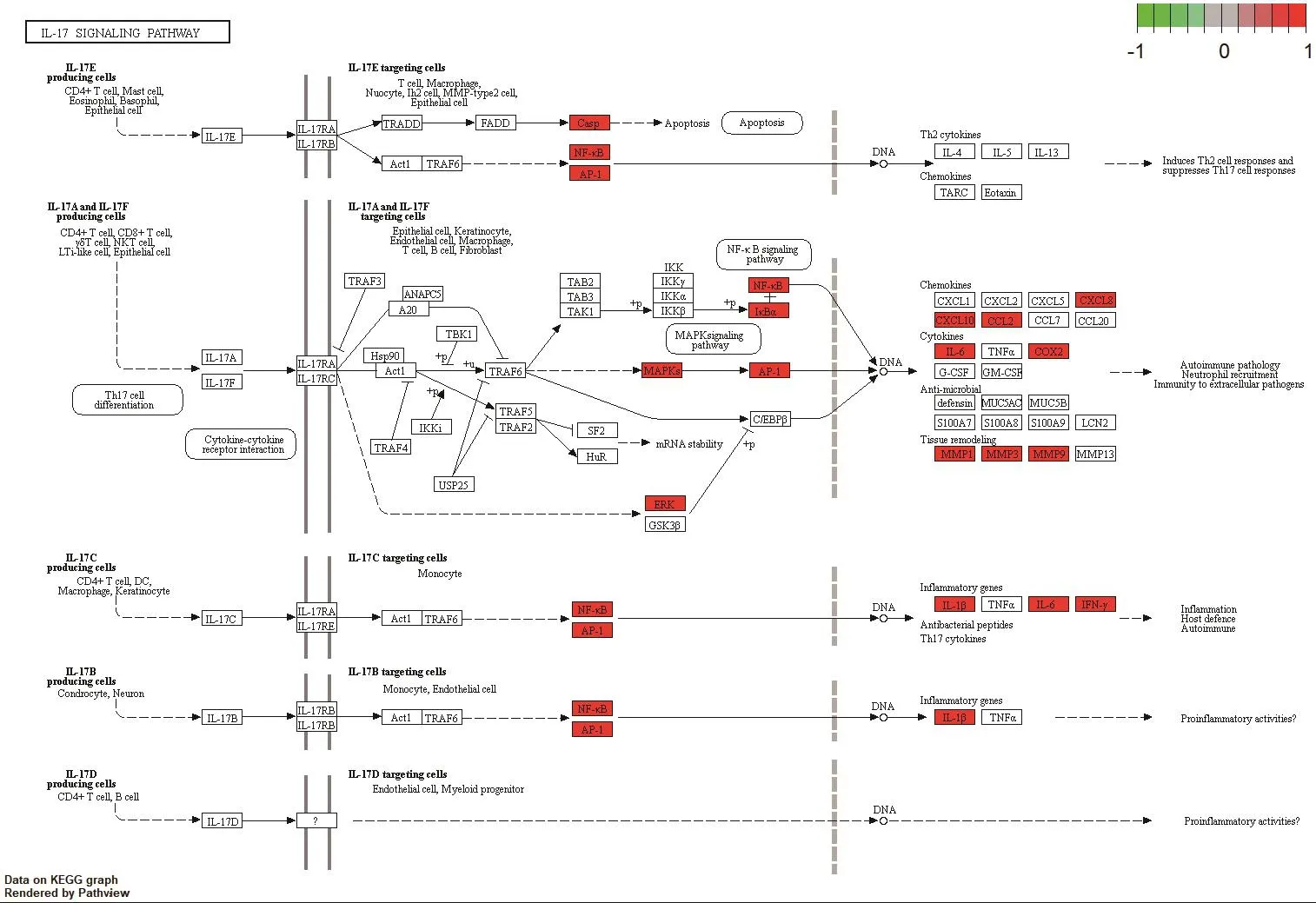
图8 IL-17信号通路Figure 8 IL-17 signal pathway
3 讨论
千百年的临床实践证明中药的疗效是相对有效且稳定的,但中药的药效机制研究一直是个难点,这与中医药的整体观以及辨证论治的灵活性有关[10]。中医药具有复杂性科学的理念,具有非线性、动态发展、整体大于部分之和、整体并不等于宏观等特点,这对我们研究中药的药效机制造成了困难[11]。
中药有多靶点、多途径调节的特点,虽然提高了临床疗效,但也给实验研究带来了很多困难。网络药理学是一门运用网络分析药物与疾病靶点之间“多成分、多靶点、多途径”协同作用关系的药理学分支学科[5]。利用网络药理学,可以弥补以往中药研究单一靶点的不足,提高实验研究的成功率。实际上,临床上的多种慢性病如肿瘤、心脑血管疾病、糖尿病等都是多基因、多因素作用的疾病,仅根据单一作用靶点难以达到良好治疗的效果。中医古籍并没有肺癌的病名,但类似的记载多见于“肺积”“息贲”“积聚”等的论述,《难经》记载“肺之积,名曰息贲,在右肋下,覆大如杯,久不已,令人洒淅寒热,喘咳,发肺壅”,一般认为,肺癌多由于久病伤正,年老体衰、感受六淫邪毒、饮食损伤、情志怫郁、宿有旧疾等因素,导致脏腑功能失调,气血津液运行失常,产生气质、血瘀、湿浊、痰凝、热毒等病理变化,蕴结于肺脏,邪毒积聚而为癌病[12]。
该方以黄芪、太子参共为君药,滋阴益气、扶正抗癌;以夏枯草、生牡蛎、白花蛇舌草配合使用,清热解毒、软坚散结,共为臣药;佐以姜黄、郁金共奏行气散结、活血祛瘀之功;全方具有解毒祛瘀,扶正抗癌之功效,诸药合用,共奏益气滋阴、活血祛瘀、清热解毒、扶正驱邪之功[13-16]。本文旨在利用网络药理学,预测消岩汤中夏枯草与白花蛇舌草治疗非小细胞肺癌的作用机制,为临床应用和实验研究提供参考。
本研究以药物-共同靶点-疾病网络筛选共得到2味中草药作用于非小细胞肺癌的13个核心成分化合物,对应112个核心调控靶点。其中最关键成分化合物包括槲皮素、β-谷甾醇、豆甾醇、木樨草素、山柰酚。其中夏枯草和白花蛇舌草共同包含的化合物是槲皮素、β-谷甾醇和豆甾醇,且调控的疾病靶点最多。槲皮素是调控靶点最多的化合物。研究者发现,槲皮素可显著降低STAT3和p-STAT3的表达,槲皮素可能通过抑制STAT3信号通路,进而抑制肺癌A549细胞的迁移和侵袭能力[17]。STAT3是人类恶性肿瘤中非常常见且极易被激活的STAT家族成员中十分重要的信号转导因子,主要介导细胞间或细胞外信号向细胞内的转导,在肿瘤发生和恶变中有重要的作用,STAT3是公认的癌基因,也是JAK/STAT信号通路中一种关键性的转录因子,是多种致癌信号通路的汇聚点,已成为潜在的肿瘤治疗靶点[18]。而β-谷甾醇不仅能促使肿瘤细胞发生细胞周期阻滞,亦能诱导细胞程序性死亡,即细胞凋亡(Apoptosis,APO),它是多细胞生物体维持组织完整性和功能,以及消除受损或不需要细胞的一个关键作用机制[19]。研究发现,β-谷甾醇处理Hela细胞使癌细胞生长受到抑制,是药物干预microRNA的表达,从而影响SKT4/MSTl通路,诱导细胞凋亡[20]。癌细胞凋亡作为一种潜在的治疗靶点近年来受到关注,癌细胞逃避细胞凋亡的过程中,细胞增殖率增加,最终导致肿瘤形成,凋亡失调与肿瘤的
发生密切相关,在调亡机制上50%的肿瘤细胞存在缺陷,细胞凋亡在肿瘤发生、发展过程中主要起着负反馈调节作用,可以阻碍肿瘤细胞的迅速生长,豆甾醇作为一种天然活性物质,具有营养价值高、生理活性强等特点,它的主要生理功能有抗肿瘤功效、降低人体血脂浓度、防治心血管疾病[21]。豆甾醇以及其11个衍生物都表现出一定的抗肿瘤特异性,即它们对这些肿瘤细胞的抑制效果不是由其细胞毒性所致的[22]。
药物-共同靶点-疾病网络显示,化合物调控的靶点数目前5位是PTGS1、BCL2、NCOA2、PPARG、CASP9,是消岩汤治疗非小细胞肺癌的主要靶点。
PTGS1是被药物调控最多的作用靶点,BCL2次之。PTGS1又叫作环氧合酶(Cyclooxygenase,COX)-1,PTGS1存在于许多疾病的病理过程中,如炎症、血栓、内皮功能紊乱、动脉粥样硬化、癌症等[23]。因此,抑制PTGS1可以在一定程度上抑制癌症患者疾病进展中的炎性表现。B细胞淋巴瘤/白血病(B-cell lymphoma,Bcl)-2基因是一种癌基因,它具有明显抑制细胞凋亡的作用。BCL2在肺癌组织中过度表达,抑制细胞凋亡,导致肿瘤细胞异常增殖[24]。
利用共同靶点构建PPI网络,分析得出消岩汤中夏枯草和白花蛇舌草治疗非小细胞肺癌的关键靶点包括AKT1、IL-6、VEGFA、CASP3、EGFR等。AKT1作为一种癌基因,在非小细胞肺癌中表达上调,研究发现AKT1蛋白的表达与肺癌分化程度、淋巴结转移以及TNM分期相关,其表达越高提示肺癌分化程度越低、恶性程度越高、预后越差,提示AKT1在非小细胞肺癌发生过程中起促癌作用[25]。
对共同靶点进行GO功能富集分析和KEGG通路富集分析,进一步明确共同靶点在基因功能和信号通路中的作用。GO功能富集分析显示共同靶点的基因功能主要集中在氧化应激反应相关通路,为明确具体的信号通路,在KEGG信号通路分析中发现,共同靶点的作用通路主要集中在TNF、AGE-RAGE、HIF-1信号通路。
肿瘤坏死因子(TNF、cachectin、TNF-a)是一种中枢促炎细胞因子,参与多种炎症状态,包括自身免疫。TNF可影响免疫监视的多种效应因子,并表现出增强自然杀伤细胞(Natural killer cell,NK)和细胞毒性T淋细胞(Cytotoxic T lymphocyte,CTL)TNF还可以直接影响肿瘤,驱动细胞对凋亡/坏死或存活、炎症和生长促进的反应[26]。TNFR1和TNFR2与多种细胞内信号通路相连,TNFR1可以通过激活激酶信号来诱导炎症、生存和增殖相关基因的表达,最终激活核因子NF-kB[27]。
晚期糖基化终产物(Advanced glycation end products,AGEs)是蛋白质、脂类和核苷酸的异质糖基化产物,AGEs的主要受体,称为晚期糖基化终产物受体(Receptor for advanced glycation end products,RAGE),是免疫球蛋白超家族的多配体跨膜受体,有研究表明,RAGE在各种类型的癌症如胰腺癌、胃癌、乳腺癌、肺癌和淋巴瘤内过表达[28]。AGE-RAGE信号在肺组织中激活NF-κB[29]。RAGE在正常肺组织中高度表达,主要集中在I型肺泡上皮细胞中,提示该受体在维持肺内环境稳定可能发挥重要作用,且研究发现RAGE在NSCLC中表达减少[30,31]。正常肺组织中高表达的RAGE在细胞外基质和周围基质中具有很强的黏附性,因此,NSCLC中肺组织细胞黏附减弱,导致肿瘤细胞浸润和转移增多[32]。
在肿瘤生长过程中,肿瘤细胞增生迅速,造成肿瘤微环境始终处于相对缺氧状态。缺氧诱导因子(Hypoxia inducible factor,HIF)-1是真核细胞中低氧反应的关键转录介质,调节着众多与氧气运输,葡萄糖摄取,糖酵解和血管生成有关的基因的表达,在许多人类癌症中,HIF-1活性的失调通常发生在HIF-1α亚基水平上,HIF-1受多种机制调节,包括转录,翻译后翻译修饰,蛋白质-蛋白质相互作用和降解,近年来,对调节HIF-1的关键信号通路的理解有了显著进展,并突出了靶向HIF-1通路作为开发新的癌症疗法的基础的潜力[33]。因此HIF-1对肿瘤的生长、浸润与转移等生物学特性非常重要,HIF-1在肿瘤生长中的作用机制主要是,缺氧条件下细胞核产生HIF-1与基因缺氧反应元件(HRE)中的HIF-l结合点结合,促进其转录,引起一系列细胞对缺氧的反应,激活下游因子和靶基因[34]。
肿瘤中低氧微环境是广泛存在,PI3K-Akt信号通路、Hsp90通路、MAPK信号通路等都与HIF-1信号通路密切相关。研究发现HIF-l的上游通路磷脂酰肌醇3-激酶(PI3K)/Akt信号通路参与了低氧的条件下对于一般肿瘤细胞的血管生成、增殖、侵袭、转移及凋亡的调控,故与肿瘤患者的预后的状况关系十分密切[35]。Hsp90通路是HIF-1的协同通路,有学者认为,缺氧条件下Hsp90与HIF-1α的bHLH-PAS结构域的结合可激活HIF-1α,说明Hsp90活性对HIF-1α具有激活作用[36]。MAPK途径包括几个关键的信号传导成分和磷酸化事件,它们在肿瘤发生中起作用,这些活化的激酶传递调节细胞生长,分化,增殖,凋亡和迁移功能的细胞外信号,由于受体酪氨酸激酶的异常激活或主要在RAS或RAF基因中的功能获得突变,导致人类癌症中RAS-RAF-MEK-ERK-MAPK(RAS-MAPK)途径的改变[37]。细胞外调节蛋白激酶(Extracellular regulated protein kinase,ERK)转导通路是MAPK信号通路中的主要转导通路,其下游亦可调控HIF-1,ERK主要是由异常活化的Ras激活靶标Raf,进而激活下游的丝裂原细胞外激酶(mitogen extracellular kinase,MEK)的磷酸化,最终使ERK活化,当受到例如丝裂原受体、细胞因子和生长因子等的刺激时,ERK被磷酸化,然后转入细胞核,通过转录调节诱发等方式使多种癌基因接连激活[38]。
综上所述,本研究基于网络药理学分析,探讨了消岩汤中夏枯草和白花蛇舌草对非小细胞肺癌的多成分、多靶点治疗途径,明确了方中两味中草药核心药物成分组成,也借鉴中医以方论证的方法,通过方中两味中草药推导非小细胞肺癌的发病机制,得出消岩汤中夏枯草和白花蛇舌草治疗非小细胞肺癌的机制与HIF-1信号通路以及对氧化应激反应相关通路有紧密联系,为后续进一步提高消岩汤的安全性、有效性提供了科学依据,推动了中医药现代化的研究发展。

