贵州岩溶山区多花木蓝根瘤菌及高效菌株筛选
韦兴迪, 曾庆飞, 韦 鑫, 李亚娇, 欧二绫, 刘正书
(贵州省农业科学院草业研究所, 贵州 贵阳 550006)
贵州省位于云贵高原东部,是我国唯一一个没有平原支撑的内陆高原山区省,也是喀斯特地貌发育最强烈、分布面积最大的典型区域[1]。在喀斯特地区石漠化生态修复过程中,豆科灌木具有植株高大、耐贫瘠、营养丰富、抗逆性和适应性强等特点,能明显改善土壤微环境,为其他植物的迁移、定居、生长创造条件,从而促进退化生态系统植被演替与恢复[2],已经成为岩溶山区农牧业生产和生态治理的宝贵植物资源[3]。多花木蓝(Indigoferaamblyantha)作为一种优质豆科饲用灌木和抗逆先锋植物,由于其具有耐干旱、耐贫瘠、耐践踏、耐刈割、适口性好、粗蛋白质含量高、青绿期长等特点,被评价为改良干旱、半干旱地区退化草地和建植人工放牧草地的优良饲用灌木,也是喀斯特山区石漠化治理的重要先锋植物之一[4-5]。本课题组在云贵高原天然豆科牧草根瘤菌资源调查过程中发现,贵州岩溶山区野生多花木蓝分布广泛,共生结瘤能力强,在干燥贫瘠的坡地以及石芽石缝中也能顽强生长,推测其根系定殖着丰富的、适应石漠化生境的共生根瘤菌[6]。因此,挖掘利用野生多花木蓝共生微生物资源,对于推动地区农业及草地生态畜牧业的可持续发展具有重要意义。
国内外有关多花木蓝的研究报道大多与其营养价值、栽培利用、生产表现,以及多花木蓝根系丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)的调查、分析等有关[7-8],但针对环境特殊的贵州岩溶山区多花木蓝根瘤菌的资源研究还较为缺乏。本研究除了调查贵州岩溶山区野生多花木蓝根瘤菌的资源蕴藏状况并揭示其区系分布特征以外,还将从采自贵州省不同喀斯特地貌区域的野生多花木蓝分离鉴定的多花木蓝根瘤菌中,筛选出适应本地喀斯特环境、能在豆科作物根系内定殖共生并高效固氮促生的根瘤菌株。根瘤菌侵染豆科植物形成根瘤是一个十分复杂的过程,这一共生固氮系统的有效建立,首先需要根瘤菌与豆科植物的识别匹配[9],不同种类的根瘤菌与豆科植物之间相互存在着一个识别选择范围[10]。除此之外,生态地理环境对豆科植物根瘤菌的多样性也存在着重要影响,根瘤菌与豆科植物共生关系的建立是细菌、植物及环境三个因素相互作用的结果[11-12],根瘤菌与豆科植物的共生关系会因生态环境的差异而呈现出种类的多样性[13]。根瘤菌对共生宿主植物的识别选择具有一个相对的种类专一性范围,一般而言,从特定种类豆科植物根瘤中分离出的根瘤菌都能与该种植物识别共生。为了获得共生匹配范围较广的优良根瘤菌株,本研究没有选用多花木蓝,而是选择了豆科牧草百脉根(LotuscorniculatusL.)作为回接宿主植物。百脉根作为豆科百脉根属多年生丛生草本植物,由于营养丰富、干物质消化率高、适口性好、根系强大等特点,既是一种优良的豆科牧草和饲用植物,又是一种具有良好水土保持性能的抗逆先锋植物[14-17]。因此,选择来自不同地域的不同种类的多花木蓝根瘤菌与百脉根进行盆栽植物回接试验,结合菌株固氮酶活性的测定,筛选出结瘤固氮能力强、植物促生效果好的优良菌株,可进一步探明野生多花木兰根瘤菌资源,利用丰富的豆科牧草共生资源积极推动“绿色整治、生态修复”发展草地生态畜牧业,对于贵州岩溶地区农业及草地生态畜牧业的可持续发展和喀斯特生态环境修复提供可利用的微生物资源和研究基础,具有重要而深远的现实意义[18]。
1 材料与方法
1.1 试验材料
1.1.1根瘤样品 按照《贵州省生态功能区划》[19]发布的标准,本试验选择了5个不同的生态功能区为采样区(涉及22个县),具体为:(1)北部湿润亚热带常绿阔叶林生态区,属亚热带季风气候;(2)南部干热河谷南亚热带季雨林生态区,位于贵州南部,属典型的亚热带温暖温润的季风气候;(3)中部湿润亚热带喀斯特脆弱生态区,位于贵州中西部,属典型的高原型湿润亚热带季风气候;(4)东部湿润亚热带常绿阔叶林生态区,位于贵州省东北部,属中亚热带季风湿润气候区;(5)西部半湿润亚热带针阔混交林、草山喀斯特脆弱环境生态区,位于贵州高原西南部,属亚热带季风湿润气候。共采集野生多花木蓝根瘤样品44份,具体采集地点及根瘤样品编号见图1。
1.1.2牧草种子 盆栽回接试验用百脉根种子(品种名:‘歌德’)购于贵阳霖卉园林绿化有限公司。
1.2 根瘤菌株的分离纯化
将采集到的多花木蓝根段及根瘤表层泥土冲净,吸水纸吸干表面水分,将干燥的根瘤在无菌水中浸泡至吸胀,挑取10~20颗硕大饱满的单个根瘤放入无菌小烧杯中,在超净工作台内用95%的乙醇浸泡5 min,接着换用0.1%的HgCl2浸泡5 min,无菌水洗涤5~l0次后转至无菌研钵中,加入1000 μL无菌水研磨成悬浊液,用移液枪将悬浊液转至加有刚果红的酵母甘露醇琼脂(Yeast mannitol agar,YMA)培养基上,均匀涂布,28℃培养箱内恒温倒置培养3~7 d。每天观察1次,挑取不吸色、菌落圆形、边缘整齐、表面光滑而隆起、湿润黏稠、略透明或半透明的典型单菌落,用平板划线法接种于另一新的YMA平板上,倒置于28℃培养箱内恒温培养。长出菌落后挑取单菌落进行革兰氏染色,镜检,若不纯,进一步纯化,直至获得纯化菌株。将纯化菌株接种至YMA液体培养基中,28℃振荡培养7 d后用30%甘油保种,—70℃超低温冰箱中冻存。
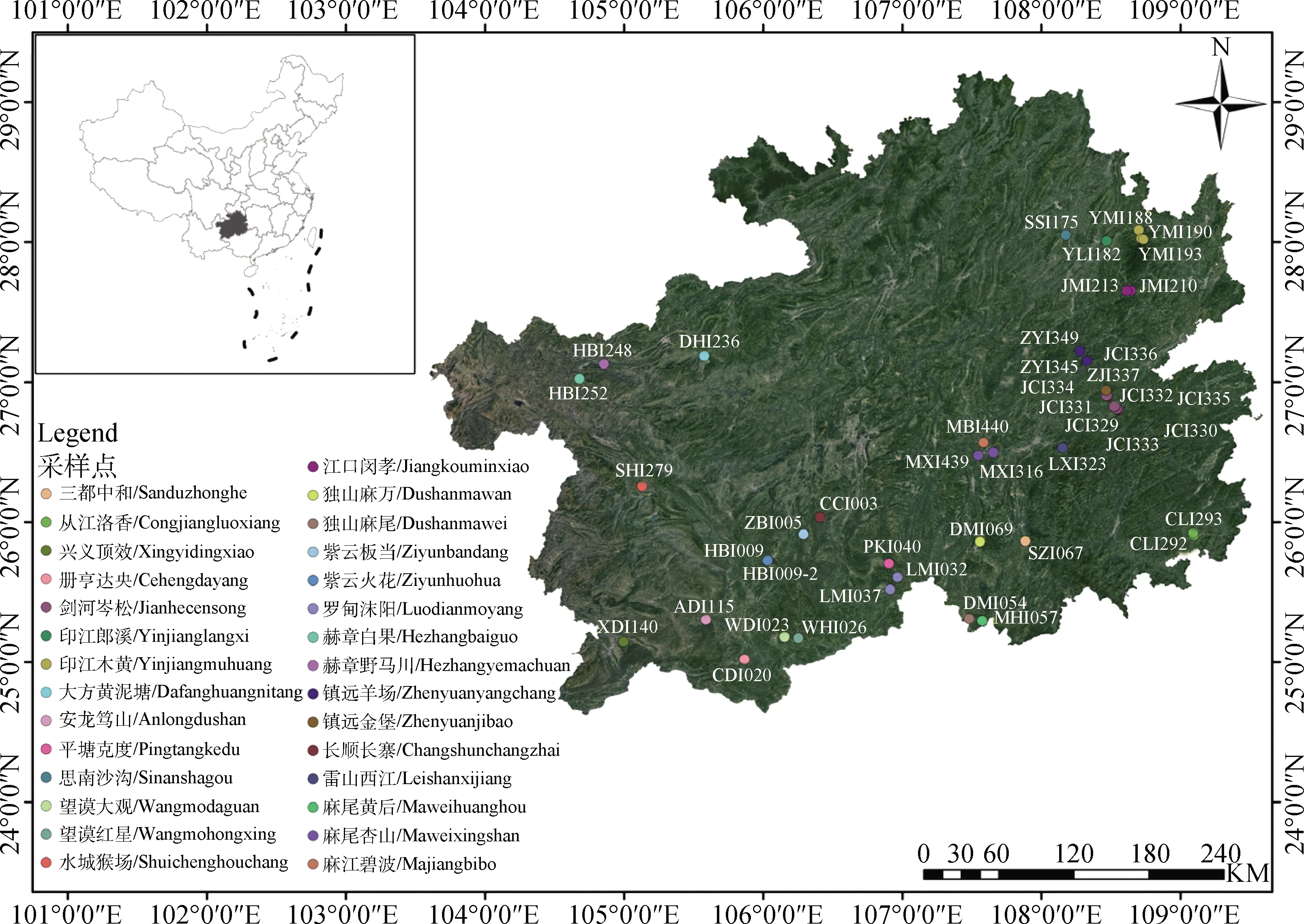
图1 野生多花木蓝根瘤样品编号及采集地点Fig.1 Root nodule sample numbers of wild Indigofera amblyantha and their sampling sites注:审图号GS(2021)5448号Note:Drawing No. GS(2021)5448
1.3 根瘤菌株的鉴定与区系分析
1.3.1根瘤菌株的形态学鉴定 参照一般细菌常用鉴定方法[20],对纯化后革兰氏染色镜检为红色的G-菌株,进一步观察菌体形态特征。
1.3.2根瘤菌株的16S rRNA基因系统发育分析 利用细菌基因组DNA抽提试剂盒(北京百泰克生物技术有限公司)提取分离纯化获得的各菌株的总DNA,选用P1—P6通用引物对扩增各菌株的16S rDNA片段,PCR产物经纯化回收后与质粒PMD18-T载体连接,转化大肠杆菌DH5α;筛选得到转化子,提取质粒DNA并经酶切验证后,送北京擎科新业生物技术有限公司昆明分公司测序。将测得的菌株序列使用NCBI(www.ncbi.nlm.nih.gov)中的Blast软件在线比对,并从GenBank数据库中下载与待分析序列相近的已知种模式菌株的16S rDNA序列,用DNAMAN进行多重比对,确定各菌株的种属分类地位。
1.3.3根瘤菌株的区系分析 根据分离菌株的系统发育分析结果,统计所有种类根瘤菌在研究区中的种属组成、分离频度,对其优势种及生境分布多样性进行分析。分布频率采用相对频率分别计算,计算公式:
分离频度(%)=
(某个种出现的样品数/总样品数)×100%
1.4 优良根瘤菌株的盆栽回接筛选
1.4.1供试菌株 基于菌株盆栽回接筛选试验的工作量大,同一地域同一宿主植物的同种根瘤菌株的生理代谢与固氮促生功能的相似性,不同地理生态环境、不同种类的根瘤菌株之间的代谢功能特性的差异性等特点,本试验从已纯化的根瘤菌菌株种优先选择其不同地域、不同种类的具有代表性的多花木蓝根瘤菌作为盆栽筛选试验供试菌株。
1.4.2盆栽播种 选取发芽率正常的百脉根种子,先用75%的乙醇浸泡2 min,无菌水清洗2~3次,再用3%的次氯酸钠消毒10 min,无菌水清洗5~6次后,播种于基质为灭菌珍珠石的花钵中。将花盆置于室温25℃、每天光照16 h的人工气候室中培养。待种子发芽长出幼苗后,喷施Hoagland全营养液(上海国药),生长26 d后每盆保留生长一致的幼苗10株用于菌液回接处理。
1.4.3菌液培养 从—70℃超低温冰箱中取出用于筛选试验的保种根瘤菌株,无菌接种环蘸取划线接种于YMA平板上,28℃恒温倒置活化培养后,挑取单菌落接种于500 mL YMA液体培养基中,28℃,200 r·min-1振荡培养5~7 d。
1.4.4盆栽回接筛选 每个菌株回接3个百脉根花盆(3次重复),并以浇灌无菌YMA液体培养基作为空白对照(CK),每个花盆回接菌液或培养基的体积为50 mL。每天浇灌少量Hoagland营养液保持基质湿润。菌液回接68 d、盆栽生长94 d后,将盆内植株取出,冲净后用吸水纸吸取根表面的水分,首先统计各处理植株的根瘤数,再在每一处理的每个重复中随机选取3个百脉根植株,另外再选择1个长势适中的植株,共10个植株,取出冲洗干净后统计根瘤数,计算单株根瘤数的平均值;然后将地上、地下部分分离,于105℃杀青30 min,在85℃下烘干12 h至恒重后,采用万分之一电子天平称重,测定各处理植株的地上生物量和地下生物量。
1.5 菌株的固氮酶活性测定
将所有待测菌株接种于CCM培养平板上划线,28℃培养5~7 d,采用固氮酶(NITS)酶联免疫分析试剂盒(青岛科创质量检测有限公司)测定固氮酶活性。以OD值为横坐标,标准物的浓度为纵坐标,绘出标准曲线,通过标准曲线计算样品中固氮酶(NITS)活性浓度,其中回归方程为Y=95.842 0x-3.958 5,R2=0.997 2。根据结瘤数、促生效应及固氮酶活性筛选出高效菌株。
1.6 数据统计分析
采用Excel 2010整理数据,将获得数据用LSD法进行多重比较,同时使用SPSS 18.0软件进行统计学分析。
2 结果与分析
2.1 分离获得的根瘤菌菌株及其形态特征
利用加有刚果红的YMA平板分离和纯化培养,共得到77个纯化菌株。纯化的菌株经革兰氏染色鉴定,获得53个革兰氏阴性(G-)保存菌株。对经分离纯化和革兰氏染色鉴定呈G-的53个菌株进行菌体形态观察,菌体细胞均呈杆状,长短不一,有荚膜或无荚膜,菌体表面均着生鞭毛,鞭毛端生、侧生或周生,符合根瘤菌的基本形态特征(表1)。

表1 多花木蓝根瘤菌菌株的形态特征Table 1 Morphological characteristics of Indigofera amblyantha rhizobial strains
2.2 根瘤菌株的种类鉴定与区系分析结果
利用细菌基因组DNA抽提试剂盒提取53个G-保存菌株的总DNA,经琼脂糖凝胶电泳检测,均形成23 kb左右的条带。利用P1—P6通用引物对,所有待测菌株均PCR扩增出约1.5 kb的序列片段。按照1.3.2 的方法进行菌株的种属鉴定和分类,33个根瘤菌株的分子鉴定结果见表2。根据测定比对结果,结合菌体的形态结构特征,53个G-菌株中有共生根瘤菌33株,其余20个菌株属于根瘤内生细菌。
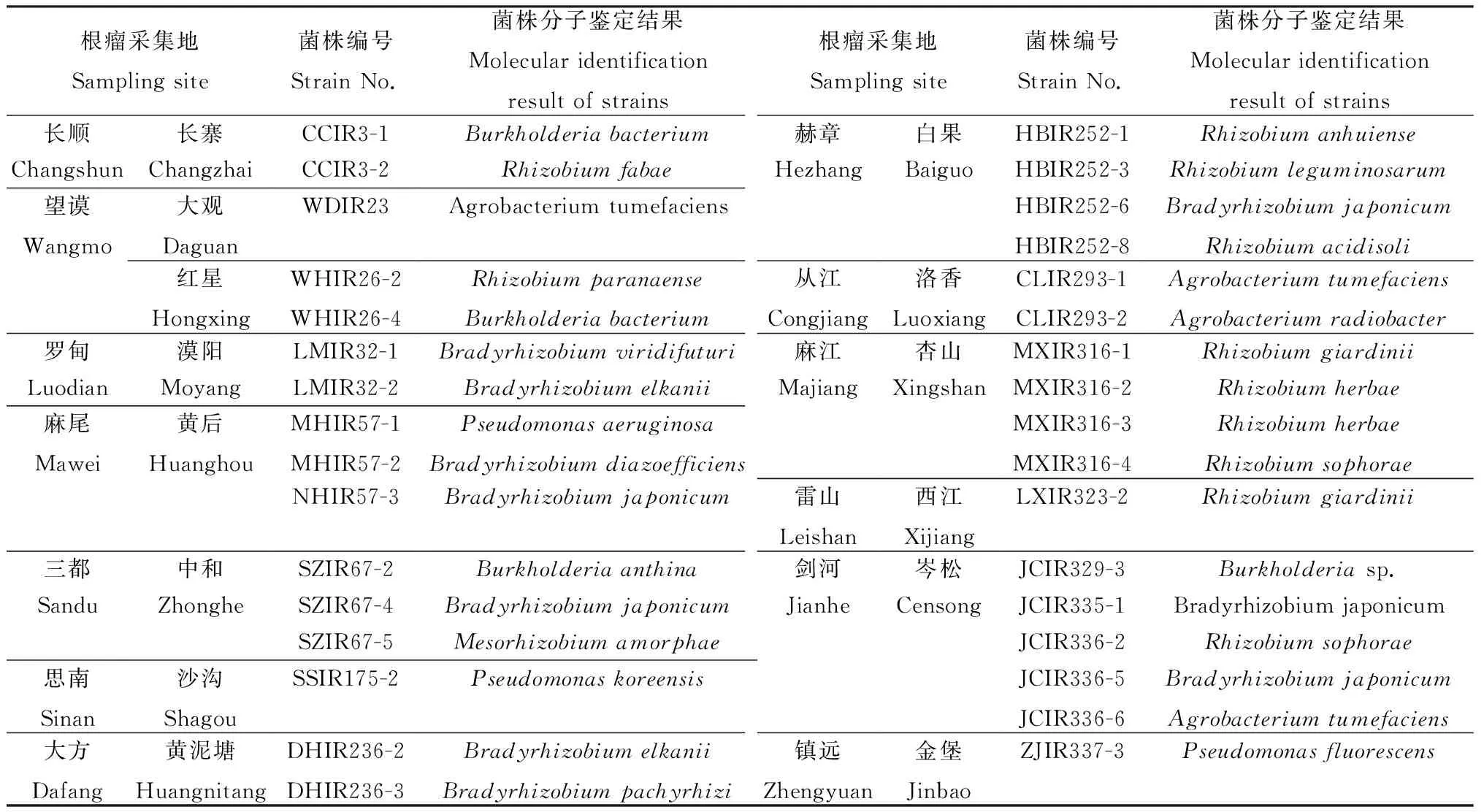
表2 基于16S rDNA序列比对的多花木蓝根瘤菌株分子鉴定结果Table 2 Taxonomic identification results of rhizobial strains of Indigofera amblyantha based on 16S rDNA sequence alignment
表3显示野生多花木蓝根瘤菌种类和区系分布,共6属22种根瘤菌。6个属分别是:根瘤菌属(Rhizobium)、慢生根瘤菌属(Bradyrhizobium)、伯克氏菌属(Burkholderia)、土壤杆菌属(Agrobacterium)、假单胞菌属(Pseudomonas)、中慢生根瘤菌属(Mesorhizobium),其中根瘤菌属的分布频率最高,达33.33%,慢生根瘤菌属其次,达30.30%,为优势属;慢生大豆根瘤菌(Bradyrhizobiumjaponicum)的分布频率最高,达到15.15%,为优势种。
5个生态功能区多花木蓝根瘤菌的分类、种属分布如表4。在北部湿润亚热带常绿阔叶林生态区只鉴定出Rhizobium和Bradyrhizobium2个属的4个种;在南部干热河谷南亚热带季雨林生态区鉴定出Rhizobium,Bradyrhizobium,Burkholderia,Pseudomonas和Agrobacterium5个属的8个种;在中部湿润亚热带喀斯特脆弱生态区只鉴定出Rhizobium和Burkholderia2个属的5个种;在东部湿润亚热带常绿阔叶林生态区鉴定出Rhizobium,Bradyrhizobium,Mesorhizobium,Burkholderia,Pseudomonas和Agrobacterium6个属的8个种;在西部半湿润亚热带针阔混交林、草山喀斯特脆弱环境生态区仅鉴定出Bradyrhizobium1个属的3个种。5个生态功能区多花木蓝根瘤菌的种属分布存在着明显的差异,如:Mesorhizobium只在东部湿润亚热带常绿阔叶林生态区被分离得到,西部半湿润亚热带针阔混交林、草山喀斯特脆弱环境生态区仅鉴定出Bradyrhizobium,中部湿润亚热带喀斯特脆弱生态区鉴定出属于Rhizobium属的种类分布最为丰富。
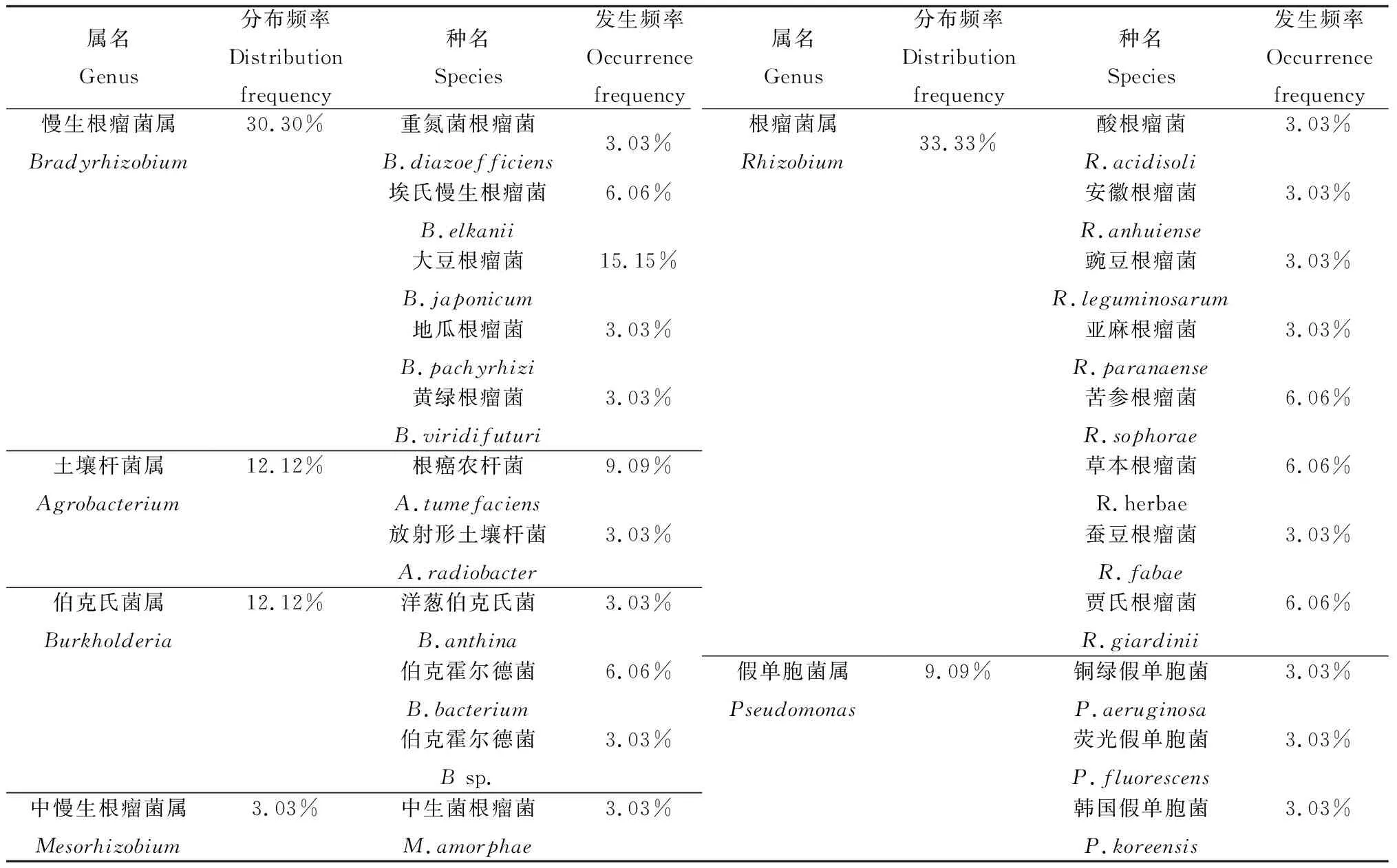
表3 多花木蓝根瘤菌株区系分析结果Table 3 The result of floristic analysis of rhizobial strains of Indigofera amblyantha

表4 研究区多花木蓝根瘤菌的种属分布特征Table 4 Species distribution characteristics of Indigofera amblyantha rhizobia in the study area
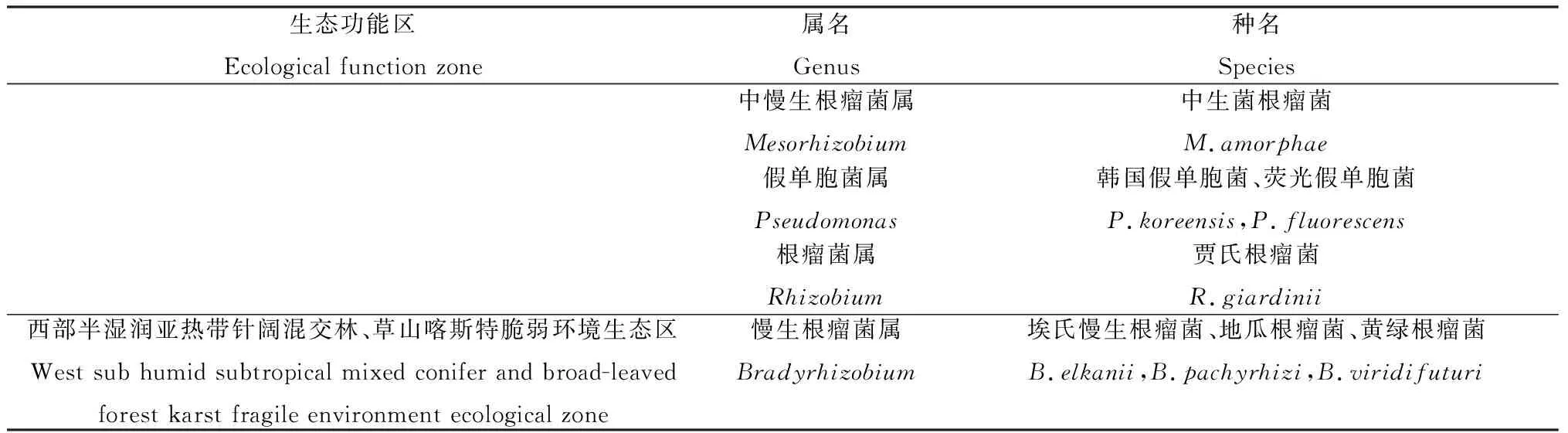
续表4
2.3 共生结瘤固氮高效根瘤菌株的筛选
选择来自不同地域、不同种类的13个根瘤菌株(CCIR3-1,WHIR26-2,LMIR32-1,MHIR57-2,SZIR67-2,SZIR67-5,DHIR236-3,HBIR252-6,MXIR316-1,LXIR323-2,JCIR335-1,JCIR336-2,JCIR336-6)回接百脉根幼苗进行筛选试验。
菌液回接68 d、盆栽生长94 d后,经根瘤菌接种处理的百脉根长势较好、植株较高、叶片颜色较深,未经根瘤菌接种处理的对照组(CK)长势较差、植株弱小、叶片较小且颜色较浅,处理组与对照组相比表观差异明显(图2)。
根瘤平均数、地上部干重、地下部干重的测定结果见表5。与对照组(CK)相比,试验组中的13个菌株的共生结瘤和促生作用均有所提高,每盆平均结瘤数在6~50之间。综合根瘤数、地上部干重和地下部干重3项测定指标,发现其中6个菌株(CCIR3-1,LMIR32-1,SZIR67-5,HBIR252-6,MXIR316-1和JCIR335-1)的结瘤促生效果十分明显,与对照差异显著(P<0.05);其中,菌株LMIR32-1的根瘤数、地上地下部干重与其余12个供试菌株的差异显著(P<0.05)。

图2 百脉根盆栽回接筛选部分处理图片Fig.2 Partial treatment pictures of Lotus corniculatus potted back inoculation screening experiment

表5 百脉根盆栽回接筛选试验测定结果Table 5 The determination results of the potted back inoculation and screening test of Lotus corniculatus
2.5 供试菌株固氮酶的活性
13个供试根瘤菌株均具有固氮酶活力(37.33~263.05 IU·L-1)(表6)。不同菌株的固氮酶活性存在差异;其中促生效果较好的6个菌株的固氮酶活性也相对较高,活性大小顺序为:LMIR32-1>MXIR316-1>SZIR67-5>JCIR335-1>CCIR3-1>HBIR252-6,与其余7个菌株间都呈现出显著差异(P<0.05)。

表6 供试根瘤菌株固氮酶活性测定结果Table 6 Measured result of nitrogenase activity of the experimental rhizobium strains 单位:IU·L-1
综合促生效果与结瘤固氮能力分析,在13个供试菌株中,分离自罗甸县沫阳镇野生多花木蓝根瘤样品的菌株LMIR32-1具有最高的固氮酶活性以及最强的结瘤促生能力,属于供试菌株中的最优固氮根瘤菌株;另外,分别分离自长顺长寨、三都中和、赫章白果、麻江杏山和剑河岑松多花木蓝根瘤样品的5个菌株CCIR3-1,SZIR67-5,HBIR252-6,MXIR316-1和JCIR335-1,与除最优根瘤菌株LMIR32-1以外的其余7个菌株的促生效果和结瘤固氮能力均呈现显著或极显著的差异,属于筛选出的优良根瘤菌株。
3 讨论
能与多花木蓝识别共生的根瘤菌的种类范围在国内尚无文献报道,本研究在贵州5个不同生态功能区的野生多花木蓝根瘤样品中,共分离鉴定出6个属22个种的根瘤菌,其中东部湿润亚热带常绿阔叶林生态区和南部干热河谷南亚热带季雨林生态区被分离鉴定出的多花木蓝根瘤菌的种属数量最多,中部湿润亚热带喀斯特脆弱生态区和北部湿润亚热带常绿阔叶林生态区的种属数次之,西部半湿润亚热带针阔混交林、草山喀斯特脆弱环境生态区的最少,只有1个属的3个种。这说明,在5个不同气候类型的生态功能区域中,因为不同的温度、光照、土壤类型及水分条件,最终形成了多花木蓝根瘤菌不同的区系分布特征,共生根瘤的形成直接受到细菌、植物及生态地理环境三个因素的共同影响,这一结果与陈文新等[13]的研究结论是一致的。
本研究在对多花木蓝根瘤样品进行菌株分离时,最初采用的是常规使用的根瘤压破划线法[21],但随即发现这一方法分离效率极低,原因可能是每一次都是野外连续几天的调查采样,当天采集的新鲜根瘤样品不能得到及时的分离,待到分离时根瘤已经处于干燥状态,即使用无菌水浸泡吸胀后,压破的根瘤中的汁液依然很少。后来采用无菌水研磨根瘤涂布平板法,发现分离效果得到了明显的提高。但总体而言,从44份野生多花木蓝根瘤样品中分离得到53个革兰氏阴性菌株,经鉴定其中只有33个属于共生根瘤菌,另有20个菌株属于在根瘤内与根瘤菌一起共生的根瘤内生细菌,说明改进后的分离方法对于根瘤菌株的分离也未达到理想的效果,根瘤菌的分离手段尚需进一步的改良优化。尽管如此,本试验所采用的改进后的研磨涂布平板法分离得到的菌株仍然能在一定程度上反映出不同生态功能区域多花木蓝根瘤菌区系分布的差异性特征。
本研究在百脉根盆栽回接筛选试验中,根据共生结瘤数、对共生宿主植物的促生效果以及菌株本身的固氮酶活性三项指标,筛选获得了6株促生固氮效果良好的根瘤菌,结瘤促生效果和固氮酶活性与其余7个供试菌株都呈现出显著或极显著的差异,其中分离自罗甸县沫阳镇野生多花木蓝根瘤样品的菌株LMIR32-1被鉴定为优良菌株中的最优固氮根瘤菌株。由于根瘤菌的固氮促生机理十分复杂,其中根瘤内生细菌也具有不可忽视的协同作用,因此,根瘤菌的促生固氮能力不完全取决于菌株的固氮酶活性,但是固氮酶活力较高的菌株,其共生固氮能力一定较强[22]。
4 结论
从分离自贵州岩溶山区5个不同生态功能区的多花木蓝根瘤菌中,优先选择13个来自不同地域和不同种类的菌株作为筛选对象,其中6个菌株(LMIR32-1,MXIR316-1,SZIR67-5,JCIR335-1,CCIR3-1和HBIR252-6)对水土保持性能良好的抗逆先锋植物百脉根具有良好的共生结瘤和固氮促生效果,具有开发应用潜力。筛选出的6个高效根瘤菌株及其与多花木蓝和百脉根建立的优势共生体系,将为地区草地生态畜牧业的可持续发展和喀斯特环境的修复与治理提供有效的物质和技术支持。

