消化系统肿瘤恶病质患者主观全面营养评估简略表评分与营养代谢指标的相关性分析*
殷瑞康,符伶俐,付振明
(武汉大学人民医院肿瘤中心,武汉 430060)
恶病质为一种特殊类型的营养不良,根据欧洲临床营养和代谢学会(ESPEN)的定义,是指伴有炎症的慢性疾病相关性营养不良[1]。其病理生理特征为摄食减少,代谢异常等因素综合作用引起的蛋白质及能量负平衡[2]。营养不良、恶病质、肌肉减少症等是肿瘤患者常见的营养相关状况,发生于晚期胃肠道恶性肿瘤可伴有厌食、炎症、水肿和多脏器衰竭等症状[3]。恶病质可导致肿瘤患者生活质量下降和医疗费用增加,也是肿瘤患者死亡的重要因素之一,研究表明,20%的肿瘤患者死于营养不良[4]。胃肠道肿瘤患者因营养不良死亡比例高达30%~50%,占所有肿瘤患者死亡的40%以上[5-6]。
当前,国际上尚无营养诊断金标准。在诸多营养筛查工具中,患者主观全面营养评估法(patient-generated subjective global assessment,PG-SGA)对于肿瘤患者营养评估具有较高的灵敏度和特异度[7]。PG-SGA对一般人群及消化系统恶性肿瘤患者的灵敏度优于过去最常用的营养风险筛查表法(nutritional risk screening 2002,NRS 2002)[8-11]。患者主观全面营养评估简略表(patient-generated subjective global assessment short form,PG-SGA SF)能够反映所评估患者80%~90%的PG-SGA评分,已被验证为营养不良及其风险因素的独立筛查工具[12]。本研究探讨PG-SGA SF评分与消化系统肿瘤恶病质患者营养代谢指标的相关性及其对恶病质分期的预测效能。
1 资料与方法
1.1 一般资料
选取2019年11月至2020年12月本院收治的83例消化系统肿瘤恶病质患者为研究对象,肿瘤类型包括胃癌38例、肝胆管癌24例、结直肠癌21例,年龄30~80岁。纳入标准:所有肿瘤患者均经临床病理学明确诊断,且符合《欧洲肿瘤恶病质临床分期》恶病质诊断国际共识[13];年龄大于或等于18岁;有完整的病史资料,包括身高、体重、BMI、卡氏评分等一般情况,以及清蛋白、C-反应蛋白(C-reactive protein,CRP)、血糖等营养代谢实验室数据;无长期使用激素;无交流障碍,能准确回答问题。排除标准:合并甲状腺功能亢进、心力衰竭失代偿及传染病史;既往有精神病、糖尿病、严重冠心病、脑梗死及血栓等疾病。本研究为回顾性研究,患者知情同意。
1.2 方法
选取符合标准的入院患者于48 h内完成床旁营养问卷调查,并查阅其病历,获取相关检验、检查等完整资料。每次调查均由同一调查人员完成,以减少调查人员抽样误差。调查人员提前接受本项目操作培训,且有调查经历。根据患者PG-SGA SF评分将患者分为4类:0~1分,无营养不良;2~3分,可疑或轻度营养不良;4~8分,中度营养不良;≥9分,重度营养不良。根据国内的快速诊断恶病质的分期评分表(cachexia staging score,CSS)[14],对入选患者进行分期,恶病质前期组32例,恶病质期组51例。
1.3 统计学处理
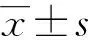
2 结 果
2.1 基本情况
消化系统肿瘤恶病质患者性别、年龄、卡氏评分、肿瘤类型不影响恶病质分期(P>0.05);恶病质期组41.2%为胃癌患者,高于肝胆管癌(31.4%)和结直肠癌(27.4%),但差异无统计学意义(P>0.05)。BMI和PG-SGA SF评分对于恶病质分期有较明显的影响(P<0.05),见表1。
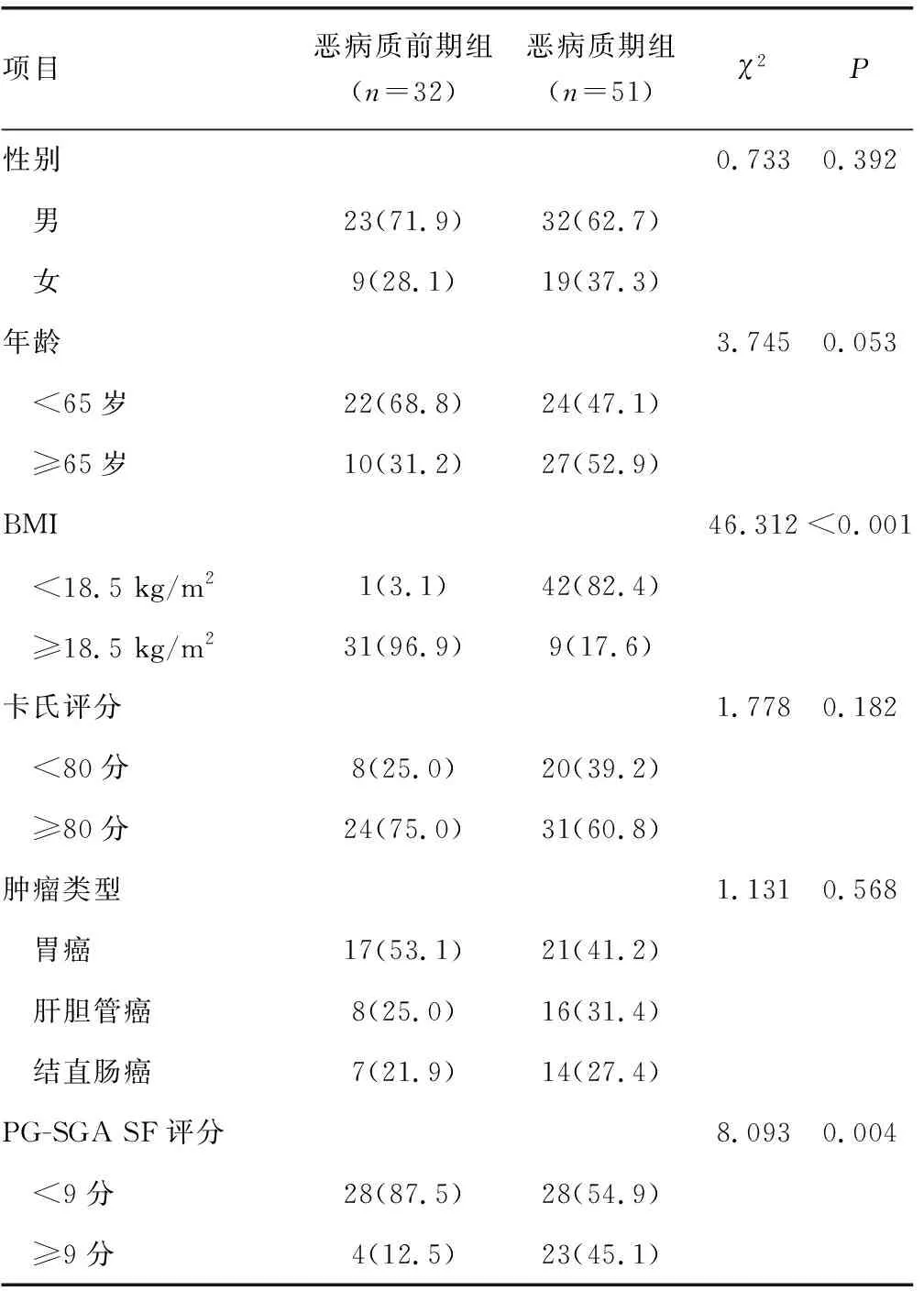
表1 不同恶病质分期患者基线资料比较[ n(%)]
2.2 不同评分患者营养代谢指标比较
PG-SGA SF评分<9分、≥9分血清总蛋白、清蛋白、血红蛋白、CRP水平比较,差异均有统计学意义(P<0.05),但血糖比较差异无统计学意义(P=0.316),见表2。
2.3 PG-SGA SF评分对恶病质分期预测诊断分析
ROC曲线下面积为0.753,P<0.001,当 PG-SGA SF评分临界值为7.5分时(≥7.5分时诊断为恶病质期),此时预测诊断的灵敏度62.7%,特异度75.0%,准确度67.5%,见图1。
2.4 PG-SGA SF评分与营养代谢指标的相关性分析
PG-SGA SF评分与总蛋白(r=-0.554,P<0.001)、清蛋白(r=-0.437,P<0.001)、血红蛋白(r=-0.555,P<0.001)存在明显的负相关,与CRP(r=0.799,P<0.001)存在明显的正相关,见图2。而PG-SGA SF评分与血糖(r=-0.016,P=0.884)之间无关,散点图亦无明显相关趋势,见图3。
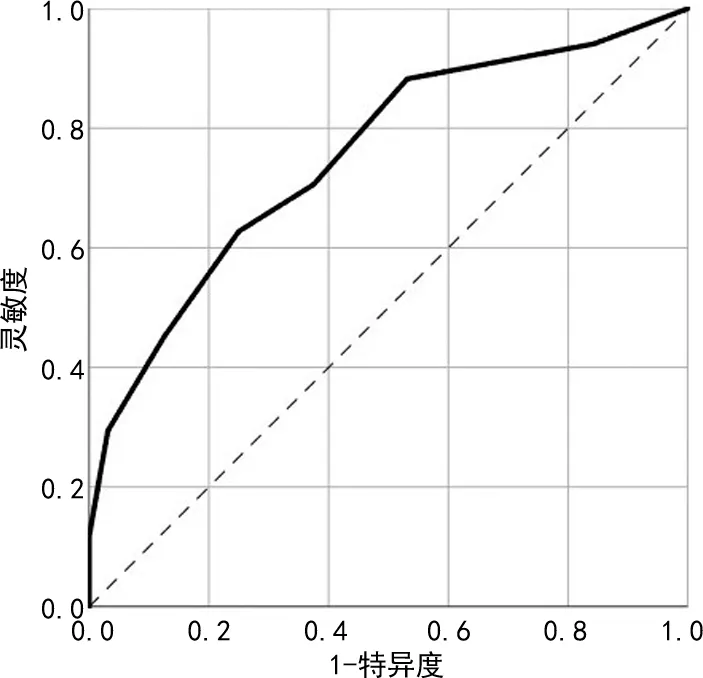
图1 PG-SGA SF评分对恶病质分期的ROC曲线
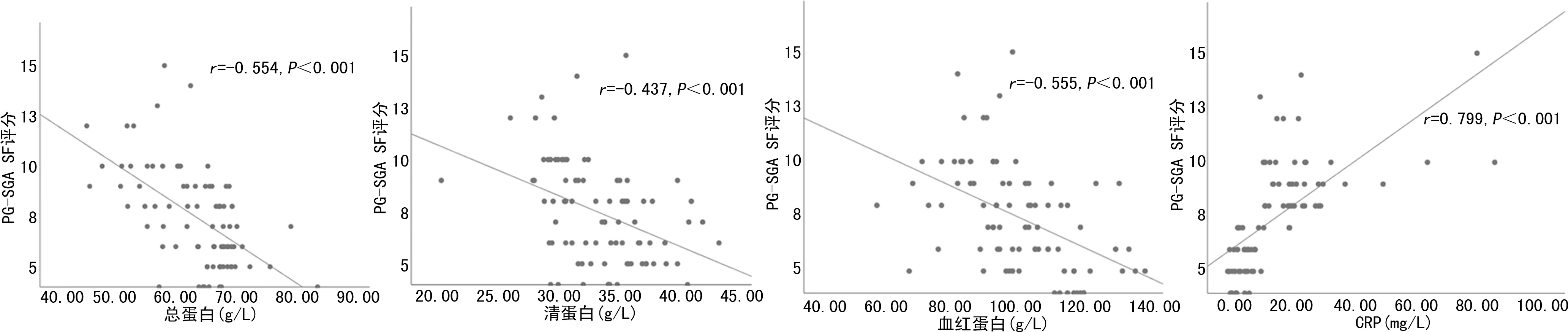
图2 PG-SGA SF评分与总蛋白、清蛋白、血红蛋白、CRP水平相关性散点图
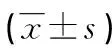
表2 不同评分患者营养代谢指标比较
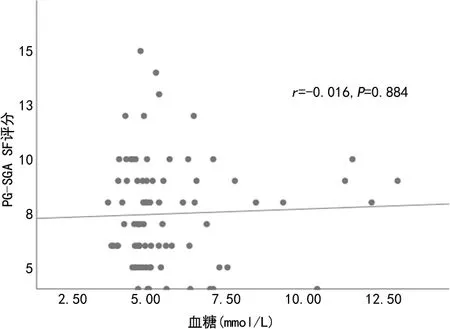
图3 PG-SGA SF评分与血糖水平相关性散点图
3 讨 论
累及消化道的肿瘤恶病质患者易出现恶心、呕吐、腹痛、腹胀等不适症状,导致患者蛋白质能量摄入不足,同时由于肿瘤消耗和化疗药物副作用等因素,营养不良的风险更高[15]。具体累及的消化道部位不同,相应的恶病质症状也有所区别。一项调查显示进展期胃癌恶病质发生率高达76.5%[16]。体重下降在这些患者中最为常见,这归因于消化器官功能缺失,无法得到足够的食物摄入[17]。肝癌恶病质则特殊在脂解作用增强、骨骼肌分解代谢增加而蛋白合成代谢减少伴有腹水[18]。而结直肠癌恶病质可导致消化道梗阻、消化功能及神经内分泌功能紊乱,进而产生一系列相关症状[19]。肿瘤恶病质患者大多还伴有贫血,这与肿瘤可促使红细胞寿命缩短,而化疗也会对红细胞造成损伤等有关[20]。
现阶段根据体重减轻和肌肉质量将恶病质分为恶病质前期、恶病质期、恶病质难治期3个阶段[13,21]。以往,恶病质仅根据体重在一定时间内下降超过10%来诊断[22]。近来腹部CT测量第3腰椎平面骨骼肌和脂肪面积的方法得到应用,但有研究表明肌肉减少症与癌症患者术后并发症或生存预后无关[23]。其他常用的评估指标,如人体测量指标、血清生化指标,筛查恶病质和预测肿瘤患者的预后敏感性尚可,但晚期肿瘤患者常存在水肿、肥胖、合并肝脏疾病或肿瘤生长增重来干扰恶病质的识别[24]。因此,即使恶病质的营养支持技术不断得以完善,现存的各种诊断指标仍缺乏准确性,目前尚无金标准[25]。
作为PG-SGA的简略版,PG-SGA SF得到验证后,近年来在肿瘤患者中逐渐开展使用[26-28]。一项研究表明,PG-SGA对诊断头颈、腹部肿瘤患者的恶病质具有良好的灵敏度(89.5%)和准确度(72.0%),并且对死亡也具有一定的特异度和准确度[29]。最新的研究支持肿瘤晚期患者营养状态与生活质量之间的相关性,以及由PG-SGA SF评估的营养风险更好地反映了躯体、情绪、症状负担和总体生活质量水平,优于恶病质诊断国际共识的营养风险评估[30]。因此,可以推测PG-SGA SF比恶病质诊断国际共识可能更有助于识别晚期肿瘤恶病质患者,这侧面支持了本研究的结果:PG-SGA SF评分对于恶病质分期有较好的预测诊断价值,当评分≥7.5分时,可初步诊断为恶病质期。
本研究表明,PG-SGA SF评分与总蛋白、清蛋白、血红蛋白水平呈明显负相关,与CRP水平呈明显正相关。PG-SGA SF通过体重、摄食情况、症状、活动和身体功能4个主观部分进行营养评估,虽然诊断效能得到验证,但与恶病质客观营养指标的相关性鲜少被探索。有研究显示,晚期恶性肿瘤患者中较高的PG-SGA SF评分与较高的白细胞计数、较低的血红蛋白、较高的CRP、较低的人体测量和身体指标(如BMI、脂肪量、握力)[31]明显相关(P<0.001)。有研究表明,鉴于PG-SGA SF的易用性及与肿瘤恶病质的各种特征的相关性,它有潜力作为预测肿瘤恶病质及预后的工具。一项葡萄牙的研究显示,在胃造瘘的肿瘤患者中,清蛋白、转铁蛋白水平与PG-SGA评分相关,这些指标可以作为营养不良标志物[32]。恶病质通常伴有炎症的发生,因此非特异的炎症标志物CRP水平常常升高。一项白血病患者营养状况与预后相关性的研究显示,营养不良程度与CRP呈正相关(P=0.026),与本研究一致[33]。另外,营养不良通常会伴糖类或其他元素的缺失,因此血糖水平被纳入本研究。一项有关营养不良与代谢的研究显示,乳糖代谢通路的激活能够促进全身代谢,降低营养不良发生率,提高结直肠癌患者的生存时间[34]。这说明糖代谢加速所致的血糖水平升高与较低的营养不良程度相关。但本研究结果显示血糖水平与恶病质患者PG-SGA SF评分无明显相关性,有待进一步探索。
目前,营养治疗日益规范化,但目前肿瘤恶病质的诊断标准仍存在争议。本研究显示PG-SGA SF有助于更加准确地诊断消化系统肿瘤恶病质,能否与客观营养指标共同指导恶病质的诊疗需要进一步研究。

