酒庄生产废水灌溉对绿化带土壤微生物群落的影响
李明 郑兰香
摘要:为制定酒庄生产废水灌溉的可行性、安全性标准提供理论依据,以宁夏回族志辉源石(ZHYS)、银色高地(YSGD)、沃尔丰(WEF)、米擒(MQ)4个酒庄生产废水灌溉区绿化带土壤为研究对象,以清水灌溉区为对照,分析酒庄生产废水灌溉对绿化带土壤微生物群落与土壤理化性质的影响,以及废水灌溉区土壤理化性质和微生物群落之间的关系。废水灌溉后,4个酒庄土壤的pH值均升高,部分酒庄绿化带土壤全盐、有机质含量较对照组升高,而全磷、速效钾、速效磷含量降低。对土壤微生物群落结构的分析表明:废水灌溉使米擒和志辉源石酒庄土壤的香农(Shannon)和Chao1指数降低。2种水质灌溉下,优势种群均为变形菌门(Proteobacteria),其次是酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria),其含量分别为26.34%~39.77%、18.77%~31.24%、4.45%~13.13%;废水灌溉抑制了土壤中变形菌门、酸杆菌门、放线菌门微生物的生长,促进了土壤中拟杆菌门(Bacteroidetes)微生物的生长。从属水平变化来看,废水灌溉降低了Gp4、Gp6在米擒和志辉源石酒庄的相对丰度,分别降低14.65%、19.69%和17.54%、10.99%。废水灌溉降低了芽单胞菌属(Gemmatimonas)在沃尔丰、银色高地、志辉源石酒庄绿化带土壤的相对丰度,分别降低23.95%、7.63%、29.67%;提高了Aridibacter的相对丰度,分别提高30.33%、13.44%、6.58%和24.24%。废水灌溉提高了米擒、沃尔丰、银色高地酒庄绿化带土壤中Gp7的相对丰度,分别提高5.56%、24.32%、61.54%。碱解氮含量、电导率、速效钾含量、全磷含量、pH值是影響绿化带土壤微生物群落的主要环境因子。在严格把控废水水质指标的情况下,用酒庄生产废水灌溉绿化带土壤是可行的。
关键词:土壤微生物;生产废水;酒庄;绿化带;群落;理化性质
中图分类号: S154.3;X703 文献标志码: A
文章编号:1002-1302(2021)22-0228-08
收稿日期:2021-03-15
基金项目:宁夏回族自治区重点研发计划(编号:2019BBF02024);西夏区科技局科研项目。
作者简介:李 明(1980—),女,宁夏中卫人,博士,副研究员,主要从事土壤修复相关研究。E-mail:lm_y096@126.com。
通信作者:郑兰香,博士,教授,硕士生导师,主要从事污水处理与节水灌溉技术相关研究。E-mail:zhenglx@nxu.edu.cn。
我国2018年年用水总量为6 015.5亿m3,其中农业用水量占61.4%[1],淡水资源短缺,环境问题日益严重,减少农业用水量势在必行。工农业生产用水紧张,我国北方地区分布较多干旱区域,水资源短缺成为限制农业发展的主要因素,通常采用污水灌溉、节水措施来补充农田灌溉用水不足的问题[2]。废水灌溉是目前的研究热点和难点,污水处理技术日益成熟,处理后的污水达到国家灌溉水质要求后可用于灌溉农田、草地园林等。污水灌溉既是污水的资源化利用,也是缓解水资源匮乏的有效措施[3]。化学需氧量(COD)在10 000 mg/L以上的葡萄酒废水,属于高浓度有机废水,采用单一的工艺无法使出水达标,国内外一般采用组合工艺处理葡萄酒废水[4]。
目前,相关研究多集中在城市生活污水、农产品加工废水、农村生活用水、养殖废水、农业生产废水对土壤养分、微生物群落的影响等方面,这类污水的氨氮和COD含量较高,多环芳烃、重金属等有毒有害物质在水中含量较少,适用于农业灌溉[4-8]。但是,关于酒庄废水灌溉后对土壤各项指标的影响,尤其是对土壤微生物群落影响的相关研究较少。土壤微生物被认为是最有潜力的敏感性生物指标之一[9]。土壤综合肥力指数随着微生物多样性指数的升高呈上升趋势。因此,研究酒庄生产废水灌溉对绿化带土壤微生物群落结构与土壤理化性质的影响具有重要意义。污水灌溉不仅会造成土壤污染,且污水中含有的N、P等营养元素,回灌后也会影响土壤养分含量,对土壤微生物及土壤酶活性产生一定的刺激作用。焦志华等研究发现,再生水灌溉会使大豆根际土壤中有机质、有效磷含量增加,使土壤酶活性发生改变,同时再生水也会对大豆根际土壤中细菌及真菌数量造成一定的影响[4]。
宁夏回族自治区作为我国葡萄酒生产核心地区之一,优质水资源稀缺,而每年灌溉葡萄以及葡萄酒生产榨季的需水量很大。酒庄生产废水的大量排放不仅造成区域环境污染,而且造成大量水资源的浪费。酒庄生产废水对环境有2个方面的效应:一方面,废水中含有大量的营养元素,这些元素是植物生长所必需的,如果根据相关水质要求对酒庄生产废水进行处理,合理灌溉不仅能够改善土壤环境、提高土壤肥力,而且还可以通过促进土壤微生物的繁殖来影响植物的生长;另一方面,由于葡萄酒生产废水含有高浓度的有机污染物,未经处理而直接排放会对环境造成严重的污染,废水散发臭味且高色度,须经过一定处理达到国家排放的标准后方才可以排放。本研究采用经过处理后的废水灌溉绿化带土壤,测定并分析土壤的细菌群落和土壤理化性质的变化规律,从而探究酒庄废水处理后灌溉绿化带对土壤质量的影响,以期为酒庄生产废水再利用安全风险评估指标提供理论支撑。
1 材料与方法
1.1 研究区域概况
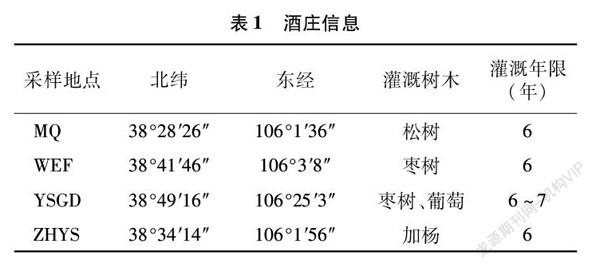
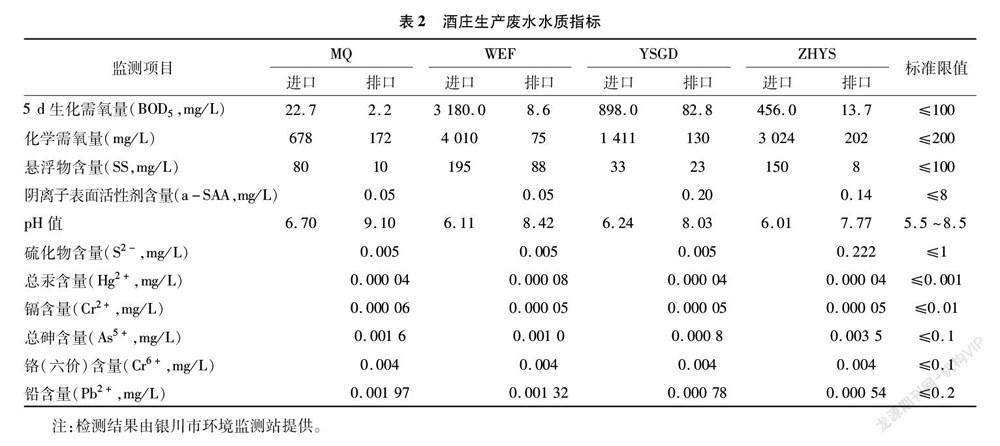
研究区域属于温带大陆性气候,处于银川平原西部边缘。土壤以砾石土为主,还有风沙土、灌淤土以及未被开垦的戈壁荒滩,土壤贫瘠,有机质含量低,透水性较强,土壤持水量低,降水量为150~240 mm。本研究以宁夏贺兰山东麓米擒(MQ)、沃尔丰(WEF)、银色高地(YSGD)、志辉源石(ZHYS)4个酒庄绿化带土壤为研究对象,同时以酒庄生产废水灌溉区和清水灌溉绿化带土壤为对照,分析生产废水灌溉对绿化带土壤各项指标的影响。绿化带灌溉为滴灌,酒庄生产废水经一定措施处理后进行灌溉,对照灌溉区则一直采用清水进行灌溉。酒庄基本信息及其生产废水水质指标如表1、表2所示。宁夏米擒、沃尔丰、银色高地、志辉源石4个酒庄总排口废水监测到的各项指标均符合GB 5084—2021《农田灌溉水质标准》的要求。因此,酒庄总排口废水水质适于灌溉。
1.2 土壤样品采集及预处理
2019年9月分别采集4个酒庄的生产废水灌溉区和正常灌溉区的土壤,采样之前铲除土壤表面的杂草和草根,每块采样地选取有代表性的样点采集10~30 cm深度的土壤。在同一酒庄进行多点采样后充分混合,分成2个部分装入无菌密封袋中,一部分土样保存于4 ℃冰箱中用于测定土壤微生物多样性,另一部分在室内进行风干处理,拣去土样中的杂物,用0.25 mm和1 mm的筛网分离土壤,装入密封袋用于土壤理化性质的测定。
1.3 土壤理化性质测定
土壤pH值采用pH计测定(土水比为 1 g ∶2.5 mL),全盐含量采用电导率测定,碱解氮含量采用碱解扩散法测定,重铬酸钾容量法(外加热法)测定有机质含量,凯氏定氮法测定全氮含量,用HClO4-H2SO4钼锑抗比色法测定全磷含量,NaHCO3浸提法测定速效磷含量,乙酸铵浸提法测定速效钾含量[10-11]。
1.4 土壤DNA提取
采用的是DNA试剂盒(MoBio PowerSoil DNA Isolation Kit)提取土壤样品总DNA。DNA片段大小用浓度为1.0%的琼脂糖凝胶电泳进行检测[11-13]。
1.5 Illumina HiSeq测序及数据分析
本研究选取细菌的16S rRNA V4区基因片段进行检测,引物为515F/806R(5′-GTGCCAGCMGCCGCGGTAA-3′/5′-GGACTACHVGGGTWTCTAAT-3′)。聚合酶链式反应(PCR)体系如下:15 μL 高保真聚合酶(New England Biolabs生产)、0.2 μmol/L正反引物、10 ng DNA模板[11,13]。PCR产物检测回收后进行后续分析。
高通量测序由上海生工Illumina HiSeq 2500平台运行,所测目标片段长度为250~300 bp[11-13]。原始数据(Tags数据)经所测得原始序列截去条形码序列和引物序列后,经FLASH(V1.2.7)拼接获得。通过软件QIIME处理过滤原始数据获得高质量Tags数据,并与数据库进行比对检测嵌合体序列,获得有效数据。对有效序列进行聚类分析,利用RDP classifier(v2.2)软件[12-16]与Greengenes数据库进行物种注释,以获得土壤样品中细菌群落的多样性信息。
土壤微生物主要进行的是定性分析,即土壤微生物多样性指数分析、微生物群落在门水平的变化分析、微生物群落在属水平的变化分析、聚类分析、微生物群落在门水平相对丰度与土壤环境因子的冗余度排序分析(RDA)。微生物多样性指数分析用来反映微生物群落的多样性,指数越大表明群落的复杂程度也越高;可从门、属水平来分析微生物群落构成差异。经过RDA可以检测土壤环境、样品、群落结构之间的关系。
1.6 数据处理
采用SPSS 25.0软件进行差异显著性分析;微生物群落在门、属水平用物种丰度柱形堆积图来表示,用R的gplots package软件进行分析;微生物群落在门水平相对丰度与环境因子相关性分析,采用RDA法,所用软件同上。
2 结果与分析
2.1 土壤理化性质
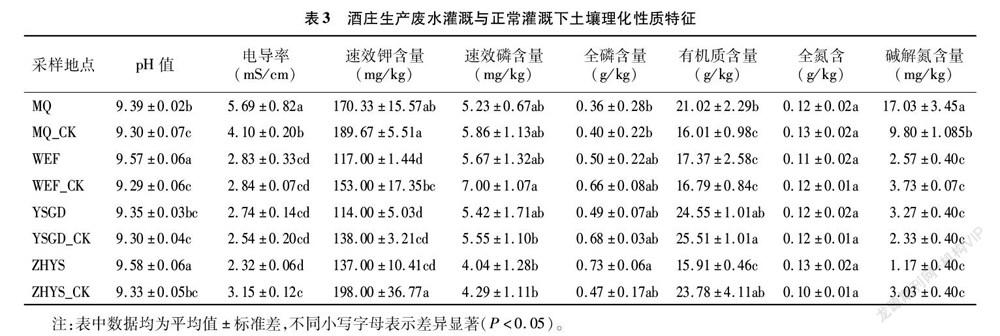
如表3所示,4个酒庄的土壤pH值为9.30~9.58,属于典型的碱性土壤。各酒庄生产废水灌溉土壤的pH值均略高于清水灌溉。除了银色高地酒庄(YSGD)之外,其他3个酒庄废水灌溉土壤与清水灌溉土壤pH值差异显著(P<0.05)。除志辉源石酒庄(ZHYS)和沃尔丰(WEF)之外,其他2个采样地废水灌溉土壤电导率高于清水灌溉;其中,米擒(MQ)、银色高地(YSGD)废水灌溉区土壤电导率分别比清水灌溉高38.78%和7.87%。速效钾含量在废水灌溉土壤中均明显低于清水灌溉区;其中,沃尔丰(WEF)、志辉源石(ZHYS)废水灌溉土壤速效钾含量分别显著低于清水灌溉区23.53%和30.81%(P<0.05)。廢水灌溉区土壤速效磷含量均低于清水灌溉区;其中,沃尔丰(WEF)与志辉源石(ZHYS)废水灌溉区速效磷含量分别低于对照组19.0%和5.8%。废水灌溉的大部分土壤中全磷含量均低于清水灌溉区,其中志辉源石酒庄(ZHYS)废水处理土壤全磷含量高于清水灌溉55.32%。米擒酒庄(MQ)与沃尔丰(WEF)酒庄废水灌溉土壤有机质含量高于清水灌溉土壤31.29%和3.45%(P<0.05);在银色高地(YSGD)和志辉源石(ZHYS)废水灌溉土壤有机质含低于清水灌溉区,其中志辉源石酒庄(ZHYS)与CK土壤有机质含量差异显著。米擒酒庄(MQ)废水灌溉土壤碱解氮含量最高,为17.03 mg/kg,高于对照组73.78%,其他3个酒庄土壤碱解氮含量差异不显著。
2.2 土壤细菌多样本聚类分析
在聚类分析中,样本之间的距离以树枝长度表示,当样本聚集到一起时其相似度越高。如图1所示,将相似性标准值定位0.8,样本可分成2类:一类是米擒酒庄(MQ、MQ_CK),另一类是志辉源石、沃尔丰、银色高地酒庄(ZHYS_CK、ZHYS、WEF_CK、WEF、YSGD_CK、YSGD)。废水灌溉与清水灌溉使得银色高地酒庄(YSGD、YSGD_CK)土壤细菌群落结构的差异较大,其他酒庄的2种水灌溉对土壤细菌群落影响较小。
2.3 土壤微生物多样性指数
微生物群落多样性指标包括香农指数(Shannon)、Chaol、辛普森指数(Simpson)及分类操作单元(OTU),常被用于评价土壤微生物功能多样性,它们的指数越高,表明样品中的物种多样性程度越高。如表4所示,OTU数目在米擒酒庄(MQ)废水灌溉处理中最低;在志辉源石酒庄(ZHYS)废水灌溉的土壤中OTU数目显著少于清水灌溉处理。在米擒(MQ)和志辉源石酒庄(ZHYS)土壤废水灌溉处理中Shannon指数低于清水灌溉,且在米擒酒庄(MQ)废水灌溉的土壤细菌群落多样性最低。在米擒(MQ)和志辉源石(ZHYS)酒庄土壤废水灌溉处理中Chao1指数低于清水灌溉,且在米擒酒庄(MQ)用废水灌溉的土壤细菌群落多样性最低;Simpson指数在米擒酒庄(MQ)废水灌溉土壤中达到最大值,在WEF、YSGT采样地Simpson指数与CK没有显著差异。
2.4 土壤微生物群落门相对丰度分析
由图2可知,4个酒庄废水灌溉和正常水灌溉土壤中的细菌群落结构由变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)等42个微生物群落构成。
变形菌门的相对丰度最高,占26.34%~39.77%,其次是酸杆菌门和放线菌门,分别占18.77%~31.24%、4.45%~13.13%。与对照相比,废水浇灌处理使得变形菌门的相对丰度在沃尔丰(WEF)和志辉源石(ZHYS)酒庄土样中分别增加21.65%、8.82%。酸杆菌门相对丰度在米擒(MQ)、银色高地(YSGD)、志辉源石(ZHYS)酒庄废水灌溉土样中较对照组分别降低13.48%、9.03%、9.18%。放线菌门的相对丰度在米擒(MQ)、沃尔丰(WEF)、银色高地(YSGD)酒庄废水灌溉土样中较对照组分别降低31.75%、5.26%、33.37%。废水灌溉下,拟杆菌门的相对丰度在米擒(MQ)、沃尔丰(WEF)、银色高地(YSGD)酒庄相对于清水灌溉增加45.07%、4.40%、9.38%。
2.5 土壤微生物群落属相对丰度分析
由图3可知,与对照相比,废水灌溉降低了Gp4在米擒(MQ)、志辉源石(ZHYS)酒庄的相对丰度,分别降低14.65%、19.69%;废水灌溉降低了Gp6在米擒(MQ)、银色高地(YSGD)、志辉源石(ZHYS)酒庄的丰度,分别降低了17.54%、37.28%、10.99%。废水灌溉提高了鞘氨醇单胞菌属(Sphingomonas)在米擒(MQ)和志辉源石(ZHYS)酒庄的相对丰度,分别提高173.76%和3.06%。废水降低了芽单胞菌属(Gemmatimonas)在沃尔丰(WEF)、银色高地(YSGD)、志辉源石(ZHYS)酒庄的相对丰度,分别降低23.95%、 7.63%、 29.67%。废水灌溉提高了
Aridibacter在4个酒庄土壤的相对丰度,分别提高30.33%、13.44%、6.58%和24.24%。废水灌溉提高了Gp7在米擒(MQ)、沃尔丰(WEF)、银色高地(YSGD)酒庄土壤中的相对丰度,分别提高5.56%、24.32%、61.54%,未鉴别的属相对丰度差异不大。
2.6 冗余度分析
如图4所示,在志辉源石(ZHYS)酒庄,土壤pH值(P=0.02)、全氮含量(P=0.04)显著(P≤0.05)影响废水灌溉土壤微生物群落结构,土壤碱解氮(AN,P=0.05)、有机碳含量(SOC,P=0.01)、电导率(EC,P=0.002)显著影响清水灌溉土壤微生物群落结构(图4-A);在米擒酒庄(MQ),土壤碱解氮含量(P=0.05)、有机碳含量(P=0.04)、pH值(P=0.05)显著影响废水灌溉土壤微生物群落结构,土壤速效钾含量(AK,P=0.001)显著影响清水灌溉土壤微生物群落结构(图4-B);在银色高地(YSGD)酒庄,土壤碱解氮含量(P=0.01)显著影响废水灌溉土壤微生物群落结构,全磷(TP,P=0.02)、速效钾(P=0.008)、有机碳含量(P=0.05)显著影响土壤微生物群落结构(图4-C);在沃尔丰酒庄(WEF),土壤pH值(P=0.006)显著影响废水浇灌土壤微生物多样性,电导率(EC,P=0.001)、速效钾(AK,P=0.01)、全氮含量(TN,P=0.05)显著影响清水灌溉土壤微生物群落结构(图 4-D)。废水灌溉和清水灌溉下,土壤碱解氮(P=0.002)、速效钾(P=0.01)、全磷(P=0.03)含量、电导率(P=0.001)、pH值(P=0.03)对细菌群落结构产生的影响较大(图4-E)。
3 讨论
土壤理化性质是评价土壤肥力的重要指标。pH值是土壤重要的基本性质,会影响土壤的肥力状况,并且对土壤微生物的活动也有显著的响应。本研究表明,废水灌溉后土壤的pH值升高。已有的研究通过用再生水灌溉草坪进行不同时间长短的比较试验,结果表明:长期灌溉二級水和三级水,在一定程度上会引起土壤pH值的升高[13]。也有研究发现再生水灌溉园林绿化灌木,证实土壤pH值在灌溉处理前后变化并不显著[14]。这表明,不同水质标准、不同试验植物品种、不同灌溉时间等对土壤pH值的影响变化程度不一定相同[15]。本研究发现,除了米擒和志辉原石酒庄以外,其他酒庄废水灌溉对土壤电导率的影响不显著。Beltrao等研究表明,再生水灌溉的时间越长,土壤的电导率或全盐量逐渐积累最终必然会导致盐化产生[16]。因此,在盐渍化土壤广泛分布地区,如果长期采用废水灌溉应该防止土壤盐分积累的现象发生。
土壤氮素和磷素含量在不同的灌溉区均表现出不同的趋势。也有研究显示,土壤全氮和全磷含量在各处理间无显著差异,分析原因可能是不同地区废水中氮、磷元素的残余量存在差异[16]。本研究中,废水灌溉区土壤速效钾、速效磷、全磷(除ZHYS外)含量均低于清水灌溉区,这与以往研究不同,大量研究结果表明,再生水灌溉后可以增加土壤的养分含量,再生水灌溉可为绿地土壤提供持久的、低剂量的速效养分[13];这可能是与该地区污水处理工艺有关,在今后利用酒庄废水灌溉中应注意对再生水氮、磷、钾元素及土壤速效养分的监测。
在本研究中土壤有机质含量在部分酒庄土壤中有积累的现象,这与已有的研究结果相似,长期污水灌溉可显著提高土壤耕层的有机碳含量[17]。本研究中酒庄土壤有机质含量变化无规律可循,这可能是由于废水灌溉时间较短引起的。
在研究废水灌溉对绿化带土壤微生物群落结构的影响中,微生物多样性各指数表现出不同的特征,在所有采样地中废水灌溉使得WEF和YSGD的Shannon、Chaol指数增加,使MQ和ZHYS的Simpson指数增加。赵加瑞研究表明,农村混合污水灌溉处理使土壤细菌和真菌的 Shannon指数、Chaol指数、ACE和Coverage指数增加,Simpson指数降低,污水灌溉可增加土壤细菌整体活性[18],这与本研究得出结论不同,可能有以下原因:一是本次研究区域使用废水灌溉6年左右,有学者研究了30年灌溉周期对土壤的影响[19],本次研究所选取的试验地灌溉周期较短,应对水质和土壤同时进行长期监测;二是灌溉方式、土壤质量不同。研究证实微生物丰富度及多样性与土壤综合肥力指数具有极显著相关性[20],土壤肥力随微生物多样性提高而提高[21],因此推测本研究中的废水与清水相比较,缺乏植物和土壤微生物生长所需的营养元素,应注意补充。
在2种水灌溉下,优势种群均为变形菌门,其次是酸杆菌门和放线菌门,分别占26.34%~39.77%、 18.77%~31.24%、4.45%~13.13%,尽管采样的地点不同,但各样点间相距不远,因此处于相同生态环境中的微生物类群具有相似性。李桥的研究中,变形菌门、拟杆菌门、放线菌门、酸杆菌门的序列总和占全部序列的67.28%,这些微生物为优势菌种[22]。研究表明,土壤微生物群落结构对废水再利用的响应不仅只基于个别微生物种群的响应,同时也基于种群间的群体响应[23]。
在本研究中废水灌溉使得变形菌门的相对丰度在沃尔丰(WEF)和志辉源石(ZHYS)酒庄土壤中增加,这说明废水灌溉通过增加有益菌属的相对丰度,促进土壤中氮元素转化的有关过程。同时,土壤理化性质结果显示碱解氮含量在废水灌溉的沃尔丰(WEF)和志辉源石(ZHYS)酒庄土壤中较清水灌溉土壤中含量低。酸杆菌门可以降解植物残体、单碳化合物,增加土壤肥力[24],酸杆菌门的活性受到污水抑制,碳循环过程受到抑制,其中在米擒(MQ)、银色高地(YSGD)、志辉源石(ZHYS)酒庄对其抑制作用较强;在本研究中放线菌门的相对丰度在米擒(MQ)、沃尔丰(WEF)、银色高地(YSGD)酒庄废水灌溉土壤中较对照组分别降低,因此放线菌门生长受到抑制,从而有机物矿化受到抑制,降低土壤营养元素,这与以往的研究结果[25]一致,志辉源石(ZHYS)酒庄的废水灌溉能促进土壤放线菌生长。
从细菌群落在门水平相对丰度与环境因子的分析表明,细菌群落受到电导率、速效钾含量、碱解氮含量的显著影响。RDA显示代表盐分的电导率是影响微生物群落重要的土壤因素。盐分增加并不利于微生物生存,土壤含盐量增加使土壤酶、土壤生物活性指标明显降低,并导致土壤生物功能结构发生显著变化,土壤生物功能多样性指数下降。因此,酒庄生产废水灌溉绿化带植物是可行的,但要做好废水水质的监测,要做到使植物正常生长的同时又能高效安全利用地表废水资源。
4 结论
(1)酒庄废水灌溉土壤的pH值和部分土壤电导率都比清水灌溉区高,因此本研究中土壤盐碱成分的含量增大,分析其可能的原因是清洗发酵罐时会加入大量的碱,推测废水中的碱残留是导致废水灌溉土壤 pH值升高的原因,因此酒庄生产废水灌溉土壤要重点防止发生土壤次生盐碱化。
(2)废水灌溉区土壤速效钾、速效磷、全磷含量(除ZHYS外)均低于清水灌溉区,酒庄废水灌溉后土壤综合肥力呈现了小幅度下降。
(3)废水灌溉使得微生物多样性的Shannon指数在2个酒庄的样品中降低。2种水质灌溉下,优势种群均为变形菌门、酸杆菌门和放线菌门。废水灌溉在一定程度上抑制了细菌群落多样性。相同的采样地中的微生物群落相似性较高。酒庄废水灌溉改变了绿化带土壤中细菌在属水平上各物种的相对丰度。
(4)碱解氮含量、电导率、速效钾含量、pH值、全磷含量是影响土壤微生物群落结构的主要环境因子。
参考文献:
[1]中华人民共和国水利部. 2018年中国水资源公报[R/OL]. (2019-07-13)[2020-12-12].http://www.gov.cn/shuju/2019-07/13/content_5408959.htm.
[2]刘润堂,许建中. 我国污水灌溉现状、问题及其对策[J]. 中国水利,2002(10):123-125.
[3]钱炬炬. 污水灌溉条件下作物生长及氮素运移试验研究[D]. 北京:中国农业科学院,2006:1-3.
[4]焦志华,黄占斌,李 勇,等. 再生水灌溉对土壤性能和土壤微生物的影响研究[J]. 农业环境科学学报,2010,29(2):319-323.
[5]何进勤,雷金银,赵 莹,等. 施肥对马铃薯淀粉废水灌溉农田的培肥效应[J]. 中国农学通报,2018,34(36):18-24.
[6]刘 辉,范东芳,黄引娣,等. 农村混合污水灌溉对小麦生长及其根际微环境的影响[J]. 水土保持学报,2019,33(2):336-341,349.
[7]李阿池. 养猪污水灌溉对森林土壤理化性质的影响[J]. 福建林业科技,2018,45(3):30-45,96.
[8]李飞跃,汪建飞,谢 越,等. 江苏句容水库农业流域农田土壤反硝化作用的研究[J]. 农业环境科学学报,2012,31(3):638-643.
[9]Katz B G,Griffin D W,Davis J H. Groundwater quality impacts from the land application of treated municipal wastewater in a large karstic spring basin:chemical and microbiological indicators[J]. Science of the Total Environment,2009,407(8):2872-2886.
[10]鲍士旦. 土壤農化分析[M]. 3版. 北京:中国农业出版社, 2008:39-89.
[11]李 明,张俊华. 不同施肥模式对盐碱化稻作土壤细菌群落的影响[J]. 干旱地区农业研究,2018,36(5):142-148.
[12]纳小凡,郑国琦,彭 励,等. 不同种植年限宁夏枸杞根际微生物多样性变化[J]. 土壤学报,2016,53(1):241-252.
[13]杨有俊. 兰州地区再生水灌溉对绿地植物及土壤的影响研究[D]. 兰州:兰州大学,2013:6.
[14]Gori R,Ferrine F,Nicese F P,et al. Effect of reclaimed wastewater on the growth and nutrient content of three landscape shrubs[J]. Journal of Environmental Horticulture,2000,18(2):108-114.
[15]Singh P K,Deshbhratar P B,Ramteke D S. Effects of sewage wastewater irrigation on soil properties,crop yield and environment[J]. Agricultural Water Management,2012,103:100-104.
[16]毛振强,宇振荣,马永良. 微咸水灌溉对土壤盐分及冬小麦和夏玉米产量的影响[J]. 中国农业大学学报,2003,8(增刊1):20-25.
[17]郑顺安,陈 春,郑向群,等. 再生水灌溉对土壤团聚体中有机碳、氮和磷的形态及分布的影响[J]. 中国环境科学,2012,32(11):2053-2059.
[18]赵加瑞. 灌溉水质对土壤质量的影响[D]. 杨凌:西北农林科技大学,2008:33-34.
[19]Dang Q L,Tan W B,Zhao X Y,et al. Linking the response of soil microbial community structure in soils to long-term wastewater irrigation community structure in soils to long-term wastewater irrigation and soil depth[J]. Science of the Total Environment,2019,688(10):26-36.
[20]吳晓斐,何 源,黄治平,等. 不同处理梯度污水对细菌群落和酶活性的影响[J]. 农业环境科学学报,2020,39(9):2026-2035.
[21]秦玮玺,斯贵才,雷天柱,等. 氮肥添加对土壤微生物生物量及酶活性的影响[J]. 江苏农业科学,2021,49(1):170-175.
[22]李 桥. 基于高通量测序技术下土壤微生物群落结构的研究[D]. 济南:山东师范大学,2014:54.
[23]郭逍宇,董 志,宫辉力. 再生水灌溉对草坪土壤微生物群落的影响[J]. 中国环境科学,2006,26(4):482-485.
[24]王光华,刘俊杰,于镇华,等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报,2016,283(2):20-26.
[25]Hni H,Siegenthaler A,Candinas T. Soil effects due to sewage sludge application in agriculture[J]. Fertilizer Research,1995,43(1/2/3):149-156.

