酶解鸡肉粉替代部分鱼粉对珍珠龙胆石斑鱼生长性能、营养物质表观消化率以及养殖水体水质的影响
宋紫菱 杨烜懿,2* 赵旭民 王光辉 迟淑艳,2,4**
(1.广东海洋大学水产学院,湛江 524088;2.南方海洋科学与工程广东省实验室(湛江),湛江 524013;3.宜昌华太生物科技有限公司,宜昌 443500;4.广东省水产动物精准营养高效饲料工程研究中心,湛江 524088)
中国是世界水产养殖业大国,2019年全国水产养殖产量近5 080万t,占水产品总产量的78%[1]。鱼粉因其蛋白质含量高、抗营养因子少、富含动物生长所必需的氨基酸且易被消化吸收,一直是水产养殖动物饲料中不可或缺的优质蛋白质源[2]。随着水产养殖业的迅速发展以及鱼粉资源量的限制,鱼粉价格不断攀升,给饲料生产企业和养殖业带来了沉重的成本压力[3]。非鱼粉蛋白质源的使用可降低鱼粉的压力,但同时也产生了消化利用率低的问题,豆粕、棉籽粕、菜籽粕、花生粕等植物蛋白质源在水产饲料中消化利用率相对偏低[4],抗营养因子、氨基酸组成不平衡和适口性差是导致水产养殖动物对植物蛋白质源消化利用率低的主要因素[5-6]。此外,鱼类对饲料中的蛋白质无法完全消化吸收,在一定程度上会造成氮的流失。饲料残饵的溶失、水产养殖动物的排泄物增大了水体中氮、磷含量,加速了养殖水体的恶化,影响养殖环境[7-8]。因而,缓解鱼粉资源短缺带来的成本压力,改善养殖水体污染,寻找符合水产养殖业绿色、健康可持续发展需求的新型蛋白质源迫在眉睫。
动物蛋白质来源广泛、抗营养因子少、蛋白质含量高、碳水化合物含量低且氨基酸含量丰富,是水产饲料的优质蛋白质源。其中,鸡肉粉蛋白质含量高,氨基酸组成平衡,利用率高[9]。适量鸡肉粉可替代一定比例的鱼粉而不影响卵形鲳鲹(Trachinotusovatus)[9-10]、异育银鲫(CarassiusauratusgibelioBloch)[11]、马拉巴石斑鱼(Epinephelusmalabricus)[12]、虹鳟(Oncorhynchusmykiss)[13-14]、尼罗罗非鱼(Oreochromisniloticus)[15]和北美鲳(Trachinotuscarolinus)[16]等的生长。与鸡肉粉相比,酶解鸡肉粉(enzyme-digested poultry by-product meal,EP)中富含小肽和游离氨基酸,可以直接被机体吸收利用,提高蛋白质的消化吸收效率,具有改善动物生长性能的作用[17-18]。
1 材料与方法
1.1 试验设计
在基础饲料配方的基础上降低鱼粉和豆粕的添加量,逐量添加酶解鸡肉粉,配制酶解鸡肉粉添加量分别为0(EP0组,作为对照组)、3%(EP3组)、6%(EP6组)、9%(EP9组)、12%(EP12组)、15%(EP15组)和18%(EP18组)的7种等氮等脂试验饲料(表1)。饲料原料经粉碎后过60目筛,按表1称取,经V型立式混合机(JS-14S型,浙江正泰电器股份有限公司)充分混匀,用双螺杆膨化机(TSE65型,北京现代洋工机械科技发展有限公司)加工成直径为3.00 mm的颗粒状饲料,晾干后于-20 ℃冰箱中储存备用。鱼粉和酶解鸡肉粉的常规养分含量见表2,酶解鸡肉粉的肽谱见图1。
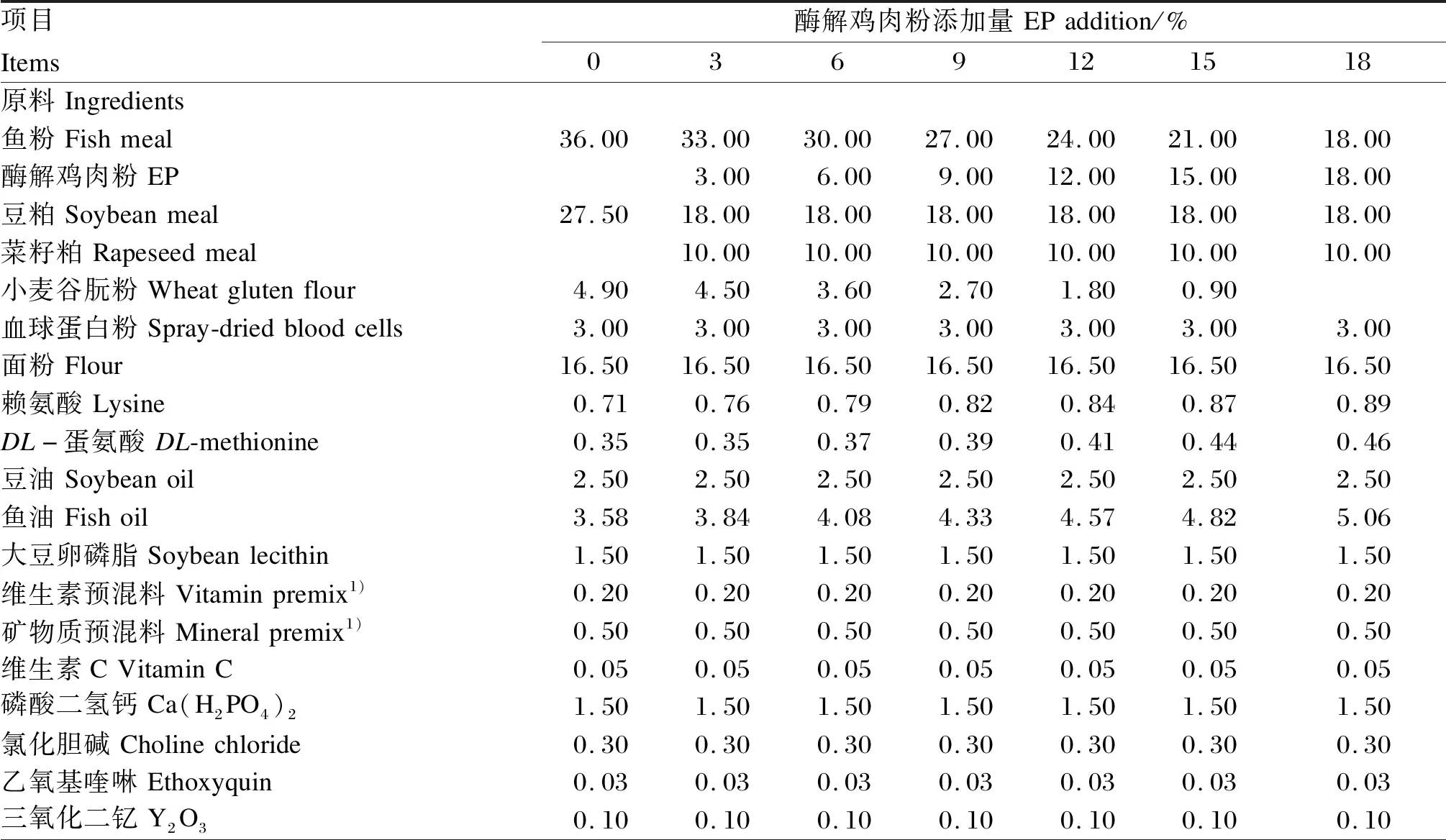
表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets (air-dry basis) %
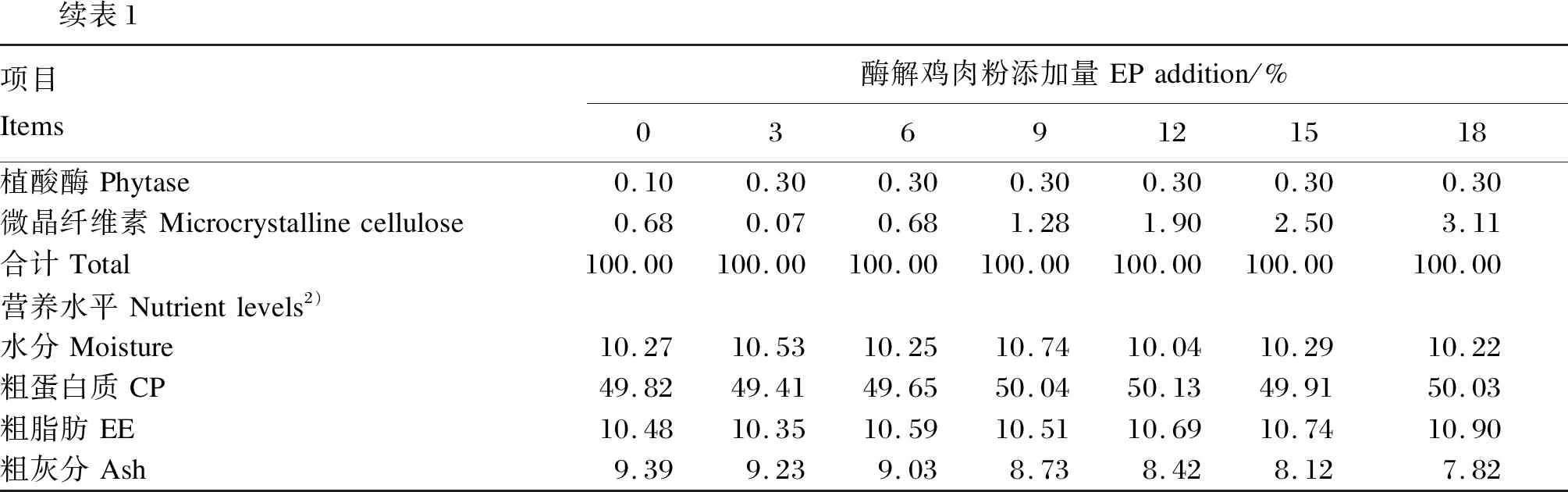
续表1项目Items酶解鸡肉粉添加量EPaddition/%0369121518植酸酶Phytase0.100.300.300.300.300.300.30微晶纤维素Microcrystallinecellulose0.680.070.681.281.902.503.11合计Total100.00100.00100.00100.00100.00100.00100.00营养水平Nutrientlevels2)水分Moisture10.2710.5310.2510.7410.0410.2910.22粗蛋白质CP49.8249.4149.6550.0450.1349.9150.03粗脂肪EE10.4810.3510.5910.5110.6910.7410.90粗灰分Ash9.399.239.038.738.428.127.82
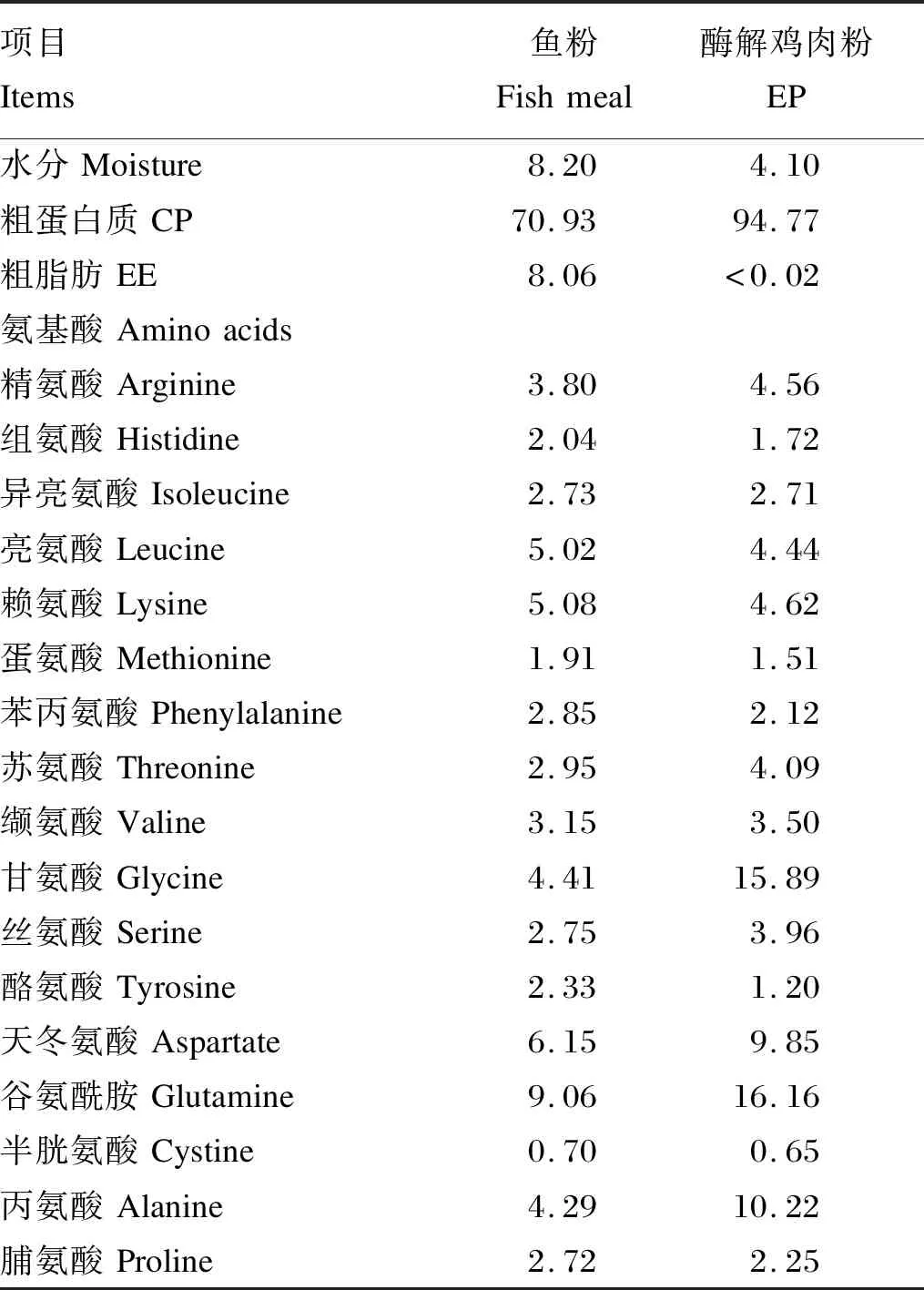
表2 鱼粉和酶解鸡肉粉常规养分含量(风干基础)Table 2 Proximate nutrient contents of fish meal and EP (air-dry basis) %
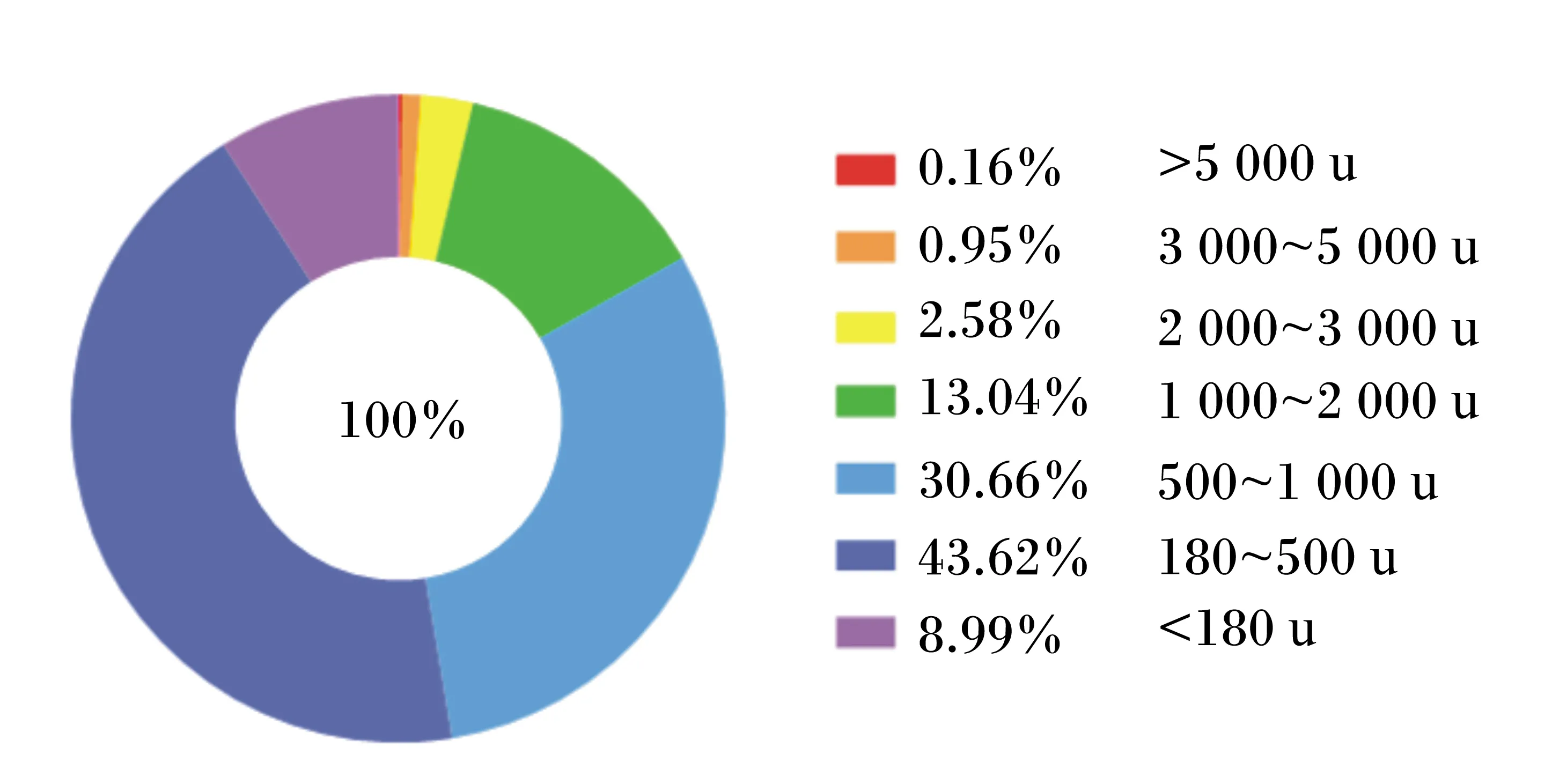
图1 酶解鸡肉粉的肽谱Fig.1 EP peptide mapping
1.2 试验动物与饲养管理
试验用珍珠龙胆石斑鱼购自广东湛江东南码头珍珠龙胆石斑鱼苗场,在湛江海洋高新科技园水泥池中暂养驯化2周,期间投喂商业饲料(广东粤海饲料集团股份有限公司产品,粗蛋白质含量为50.0%)。养殖试验在室内海水鱼静水养殖系统(300 L玻璃钢养殖桶)中进行。试验开始前禁饲24 h,之后挑选健康、规格一致的珍珠龙胆石斑鱼[初始体重为(7.51±0.02)g]630尾,随机分为7组,每组3个重复,每个重复30尾,以重复为单位放养于玻璃钢养殖桶中。每天08:00和17:00表观饱食投喂试验饲料,根据摄食情况适当调整投喂量,养殖期为8周。在试验期间,养殖水温为30~32 ℃,pH为6.8~7.2,氨氮含量不高于0.2 mg/L,溶解氧含量不低于5.0 mg/L。
1.3 样本采集与指标测定
1.3.1 营养成分含量测定
饲料原料、试验饲料和粪便中养分含量测定参照AOAC(1995)[20]的方法。其中,水分含量采用105 ℃烘干失重法测定,粗蛋白质含量采用凯氏定氮法(KjeltecTM8400,瑞典)测定,粗脂肪含量采用索氏抽提法测定,粗灰分含量采用箱式电阻炉550 ℃灼烧恒重法测定,钙和磷含量使用ICP-OES电感耦合等离子光谱仪(美国铂金埃尔默,Perkin Elmer Optima 8000)测定。
1.3.2 生长性能测定
养殖试验结束,禁饲24 h后称重、计数,用于计算成活率(SR)、增重率(WGR)、特定生长率(SGR)、饲料系数(FCR)、蛋白质效率(PER)和摄食率(FR)。
SR(%)=100×末尾数/初尾数;WGR(%)=100×(末均重-初均重)/初均重;SGR(%/d)=100×(ln末均重-ln初均重)/饲养天数;FCR=摄食饲料干重/(末均重-初均重);PER=(末均重-初均重)/(饲料摄食量×粗蛋白质含量);FR(%/d)=100×投饲总量/[(初均重+末均重)×饲养天数/2];
1.3.3 营养物质表观消化率测定
从养殖试验第4周开始收集粪便,直到养殖试验结束。投料前清理残饵及排泄物,在投料4 h后进行粪便收集。用镊子挑选新鲜、外表带有包膜的完整粪便,蒸馏水漂洗后用滤纸吸干水分,置于50 mL离心管中于-20 ℃冰箱保存备用。测定前使用冷冻干燥机(CHRIST,Alpha 2-4 LDplus,德国)将粪便干燥后粉碎过60目筛。委托上海微谱化工技术服务有限公司测定粪便中三氧化二钇(Y2O3)含量,以计算饲料干物质表观消化率(ADCDM)、粗蛋白质表观消化率(ADCCP)、钙表观消化率(ADCCa)和磷表观消化率(ADCP)。
ADCDM(%)=100×(1-饲料中Y2O3含量/粪便中Y2O3含量);某营养物质表观消化率(%)=100×(饲料中该营养物质的含量-粪便中该营养物质的含量)/饲料中该营养物质的含量。
1.3.4 养殖水体水质测定
在养殖试验第7周的第1天早晨各养殖桶换完水后,08:00投喂饲料,分别于投料后1、5、9、13、17和21 h采用虹吸法在养殖桶中采集水样进行温度及水质指标的测定,虹吸管用颜色标识,以便确保在同一深度处采集水样。采集完的水样装入500 mL白色聚乙烯瓶和250 mL棕色磨口玻璃瓶内,放置阴凉避光处密闭保存,参照GB 17378.42007《海洋监测规范第4部分海水分析》[21]在24 h内测定pH以及溶解氧、总氮、亚硝氮、氨氮、硝氮、总磷含量。
1.4 数据统计分析
采用SPSS 22.0统计软件对数据进行单因素方差分析(one-way ANOVA),若存在显著性差异,则采用Tukey氏法多重比较检验组间的差异显著性。试验数据用“平均值±标准误”表示。P<0.05表示差异显著。
2 结 果
2.1 酶解鸡肉粉替代部分鱼粉对珍珠龙胆石斑鱼生长性能的影响
由表3可见,珍珠龙胆石斑鱼的FBW、WGR、SGR随着酶解鸡肉粉添加量的增加呈现出先上升后下降的趋势。EP3组的FBW、WGR和SGR显著高于EP0、EP12、EP15和EP18组(P<0.05),且该组的PER、FCR和FR与EP0组相比差异不显著(P>0.05);EP18组的FBW、WGR和SGR显著低于其他组(P<0.05),且该组的PER显著低于EP0、EP3、EP6和EP9组(P<0.05),同时FR和FCR显著高于EP0、EP3和EP6组(P<0.05)。各组SR差异不显著(P>0.05)。
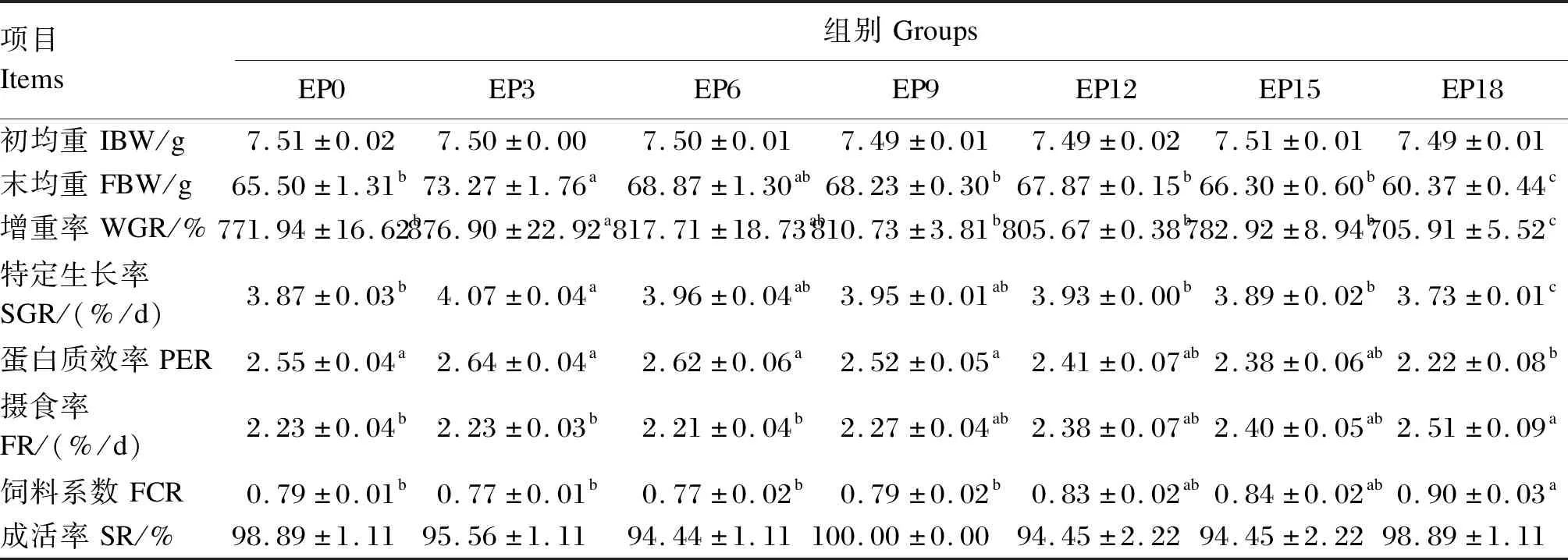
表3 珍珠龙胆石斑鱼的生长性能Table 3 Growth performance of hybrid grouper (n=3)
2.2 酶解鸡肉粉替代部分鱼粉对珍珠龙胆石斑鱼营养物质表观消化率的影响
由表4可知,EP0、EP3和EP6组的ADCDM和ADCCP无显著差异(P>0.05),但是均显著高于EP9、EP15和EP18组(P<0.05)。EP3和EP12组的ADCCa显著高于其他组(P<0.05)。EP12组的ADCP显著高于EP0、EP9和EP15组(P<0.05)。
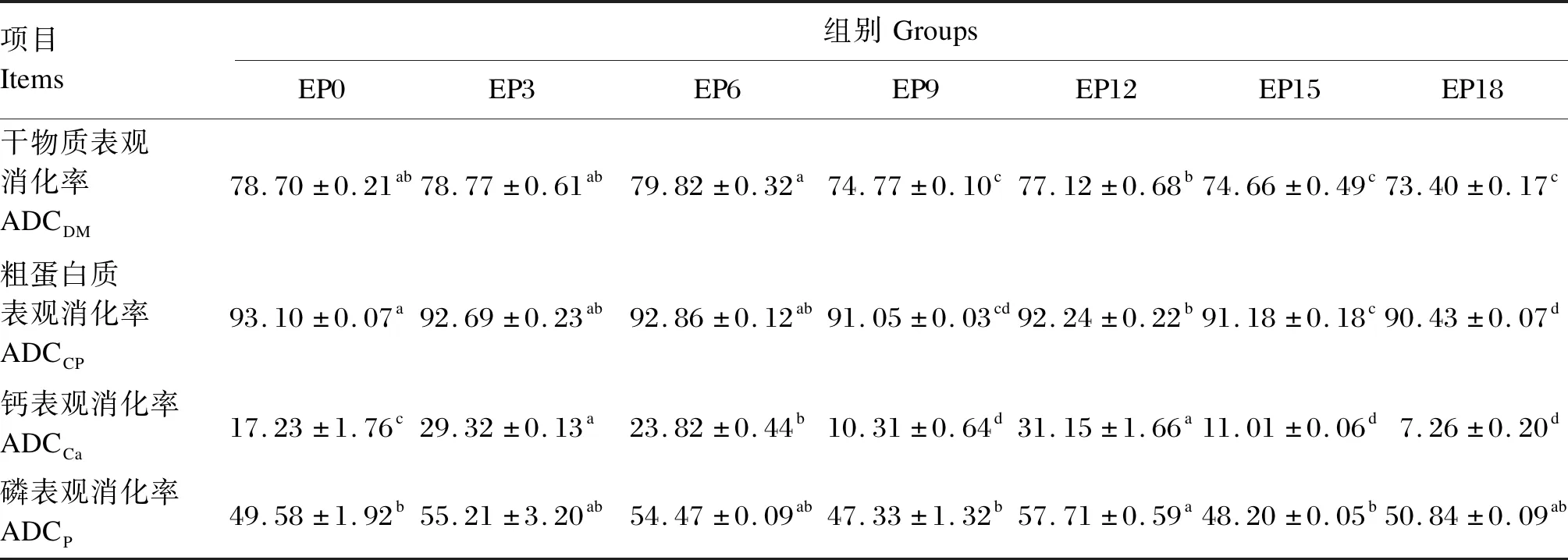
表4 珍珠龙胆石斑鱼的营养物质表观消化率Table 4 Apparent digestibility coefficients of nutrients of hybrid grouper (n=3) %
2.3 酶解鸡肉粉替代部分鱼粉对养殖水体水质的影响
2.3.1 养殖水体温度
由表5可知,各组养殖水体温度变化范围为30.83~31.77 ℃。各组养殖水体温度随时间的推移均呈现出先上升后下降的趋势(图2)。在摄食后9~13 h,各组养殖水体温度均达到最高。EP3和EP6组养殖水体温度在各时间点均与EP0组差异不显著(P>0.05)。在摄食后5~9 h,EP0组养殖水体温度显著高于EP9、EP12、EP15和EP18组(P<0.05)。
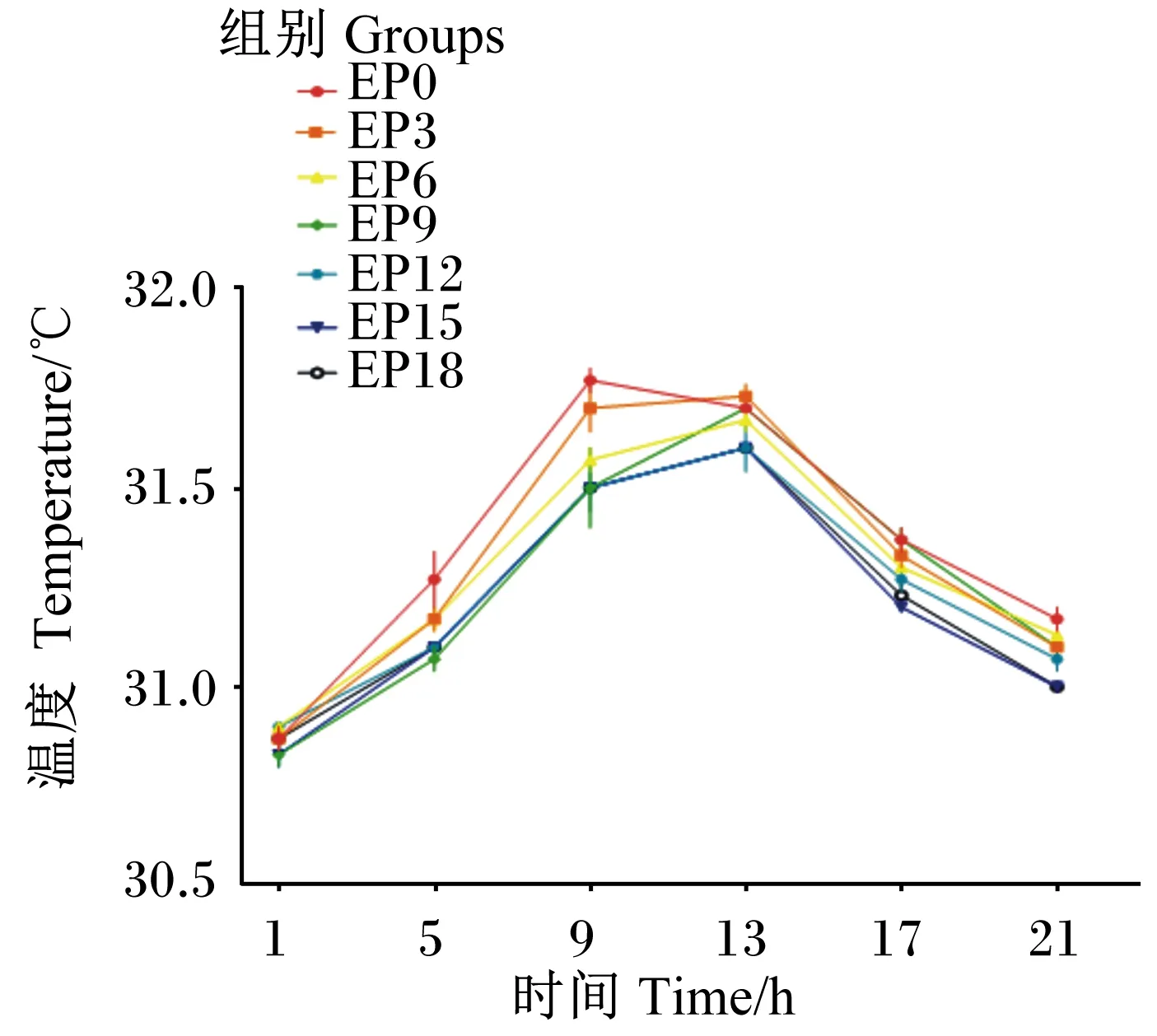
图2 养殖水体温度随时间的变化Fig.2 Cultured water temperature changes with time

表5 养殖水体温度随时间的变化Table 5 Changes of cultured water temperature with time (n=3) ℃
2.3.2 养殖水体pH
由图3可知,各组养殖水体pH随时间的推移均呈现出先降低后升高的趋势,变化范围为6.82~7.16。表6显示,EP0组养殖水体pH除在摄食后5和13 h显著高于EP3和EP6组外(P<0.05),其余各时间点均与EP3和EP6组差异不显著(P>0.05)。在摄食后1 h,各组养殖水体pH相对集中且均达到最高,在摄食后13~17 h各组水体pH达到最低。

图3 养殖水体pH随时间的变化Fig.3 Changes of cultured water pH with time
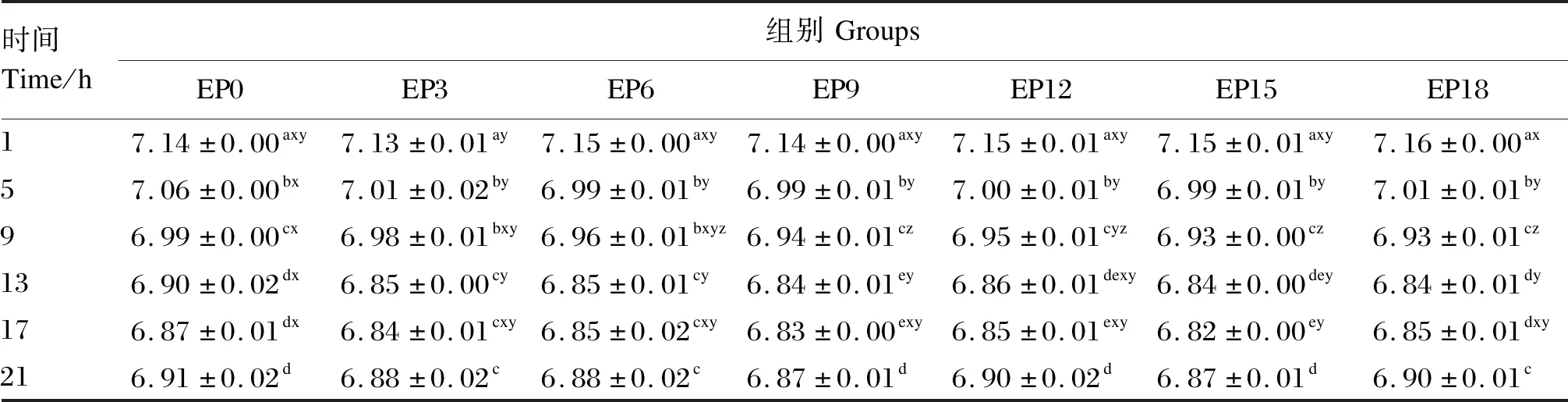
表6 养殖水体pH随时间的变化Table 6 Changes of cultured water pH with time (n=3)
2.3.3 养殖水体溶解氧含量
由表7和图4可知,各组养殖水体溶解氧含量在6.52~7.62 mg/L内波动,无显著差异(P>0.05),处于相对稳定状态。
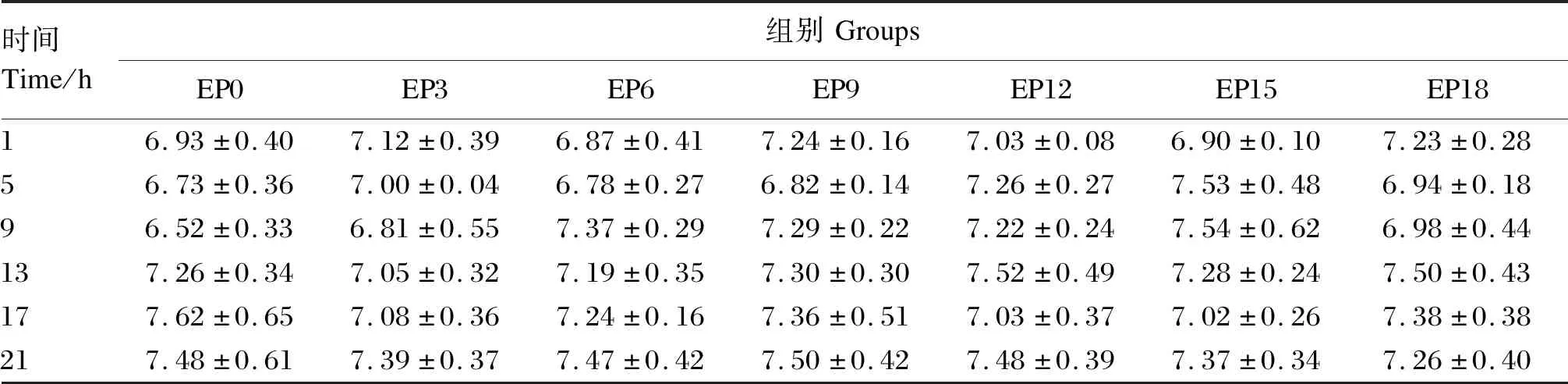
表7 养殖水体溶解氧含量随时间的变化Table 7 Changes of dissolved oxygen content in cultured water with time (n=3) mg/L
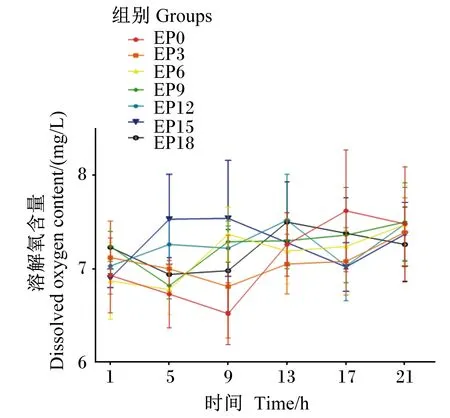
图4 养殖水体溶解氧含量随时间的变化Fig.4 Changes of dissolved oxygen content in cultured water with time
2.3.4 养殖水体氮、磷含量
由表8和图5-A可知,随着时间的推移,各组养殖水体总氮含量整体呈上升趋势,在摄食后1~17 h,各组养殖水体总氮含量差异不显著(P>0.05)。在摄食后21 h,各组养殖水体总氮含量均达到最高,EP0、EP3、EP12、EP15和EP18组之间差异不显著(P>0.05),而EP6和EP9组显著高于EP0和EP18组(P<0.05)。

表8 养殖水体总氮含量随时间的变化Table 8 Changes of total nitrogen content in cultured water with time (n=3) mg/L
由表9和图5-B可知,随着时间的推移,各组养殖水体总磷含量变化相对稳定,变化范围为0.068 7~0.183 3 mg/L。在摄食后1~21 h,EP3和EP0组养殖水体总磷含量均差异不显著(P>0.05),在摄食后1~17 h,EP3组养殖水体总磷含量相较于EP0组降低了1.9%~27.1%。EP18组养殖水体总磷含量除在摄食后9和17 h显著低于EP0组(P<0.05)外,其余各时间点与EP0组均差异不显著(P>0.05)
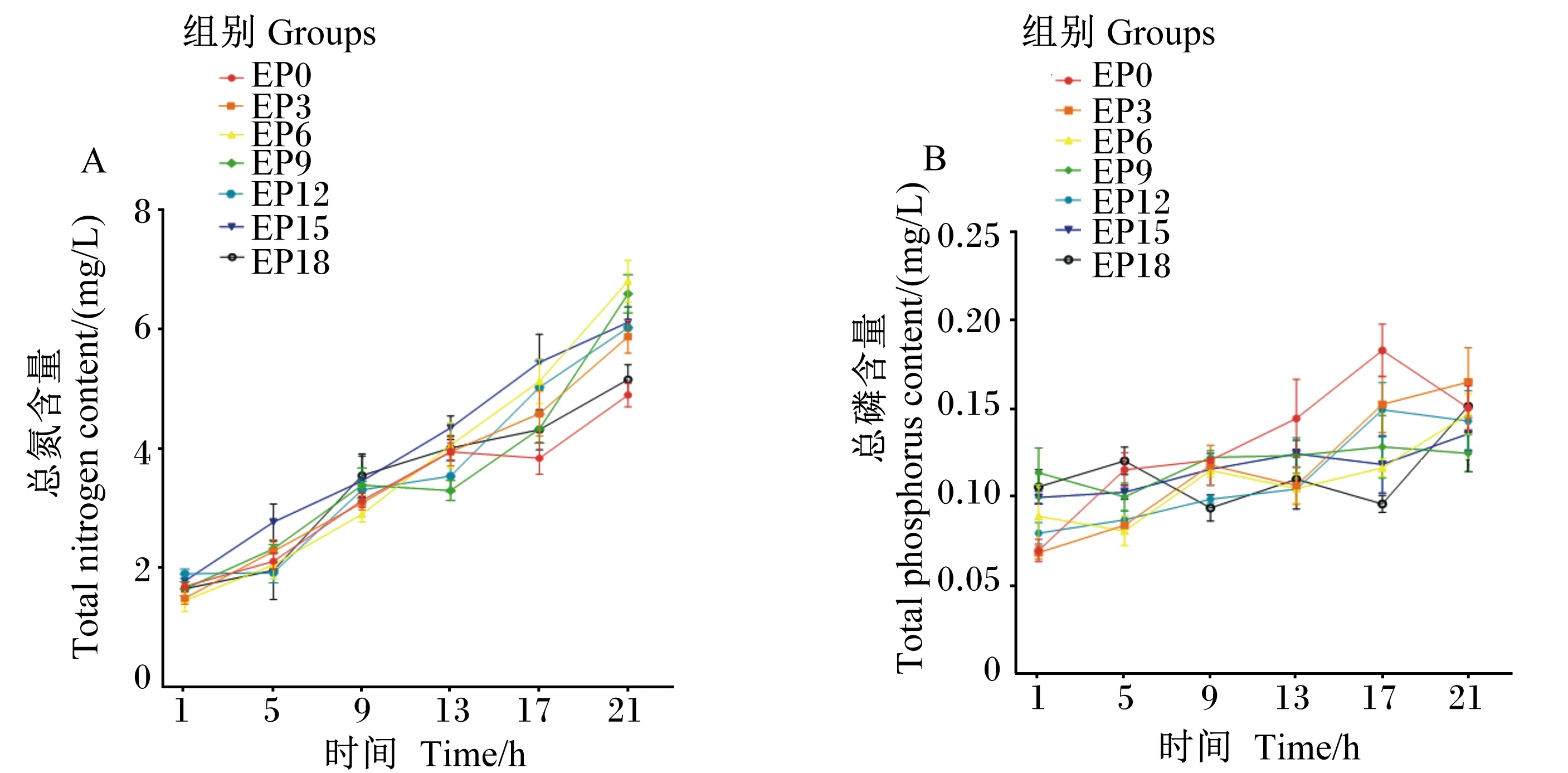
图5 养殖水体总氮和总磷含量随时间的变化Fig.5 Changes of total nitrogen and total phosphorus contents in cultured water with time
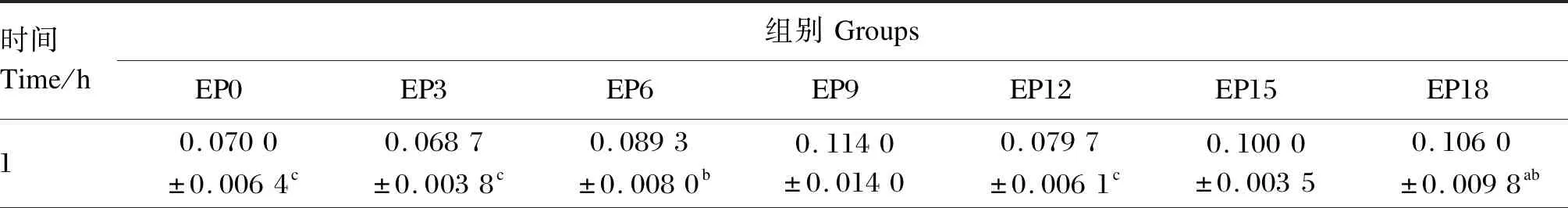
表9 养殖水体总磷含量随时间的变化Table 9 Changes of total phosphorus content in cultured water with time (n=3) mg/L
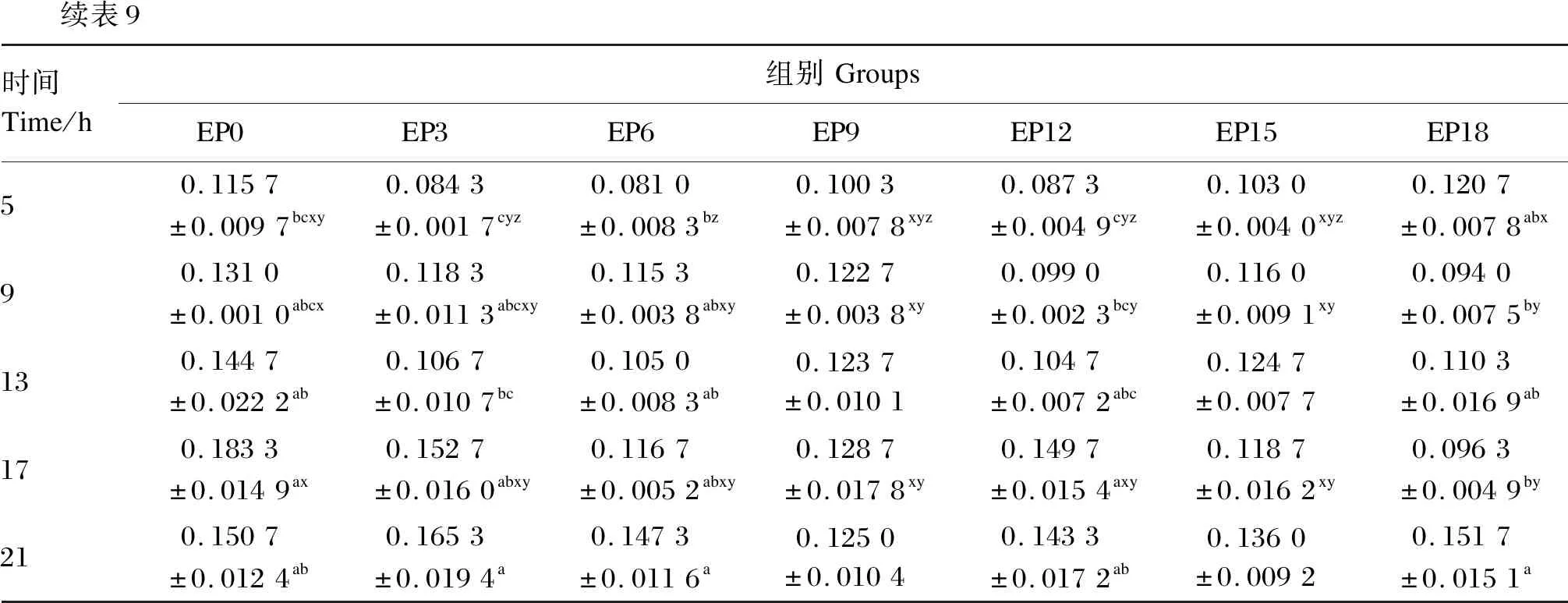
续表9时间Time/h组别GroupsEP0EP3EP6EP9EP12EP15EP1850.1157±0.0097bcxy0.0843±0.0017cyz0.0810±0.0083bz0.1003±0.0078xyz0.0873±0.0049cyz0.1030±0.0040xyz0.1207±0.0078abx90.1310±0.0010abcx0.1183±0.0113abcxy0.1153±0.0038abxy0.1227±0.0038xy0.0990±0.0023bcy0.1160±0.0091xy0.0940±0.0075by130.1447±0.0222ab0.1067±0.0107bc0.1050±0.0083ab0.1237±0.01010.1047±0.0072abc0.1247±0.00770.1103±0.0169ab170.1833±0.0149ax0.1527±0.0160abxy0.1167±0.0052abxy0.1287±0.0178xy0.1497±0.0154axy0.1187±0.0162xy0.0963±0.0049by210.1507±0.0124ab0.1653±0.0194a0.1473±0.0116a0.1250±0.01040.1433±0.0172ab0.1360±0.00920.1517±0.0151a
由表10和图6-A可知,随着时间的推移,各组养殖水体硝氮含量整体呈上升趋势。在摄食后各时间点,EP0、EP3和EP6组养殖水体硝氮含量均差异不显著(P>0.05)。在摄食后9~21 h,EP18组养殖水体硝氮含量一直低于其他组且上升趋势相对缓慢。各组养殖水体硝氮含量在摄食后21 h均达到最高且显著高于同组摄食后1~13 h(P<0.05)。

表10 养殖水体硝氮含量随时间的变化Table 10 Changes of nitrate nitrogen content in cultured water with time (n=3) mg/L
由图6-B可知,随着时间的推移,各组养殖水体亚硝氮含量整体呈上升趋势。EP18组养殖水体亚硝氮含量一直低于其他组且上升趋势相对缓慢。由表11可知,在摄食后1~9 h和21 h时,EP0、EP3和EP6组养殖水体亚硝氮含量差异不显著(P>0.05)。在摄食后13~17 h,EP0与EP6组养殖水体亚硝氮含量差异不显著(P>0.05),但均显著低于EP3组(P<0.05)。EP18组养殖水体亚硝氮含量除在摄食后13 h显著低于其他组外(P<0.05),其余时间点与EP0组差异不显著(P>0.05)。各组养殖水体亚硝氮含量在摄食后21 h显著高于同组摄食后其他时间点(P<0.05)。
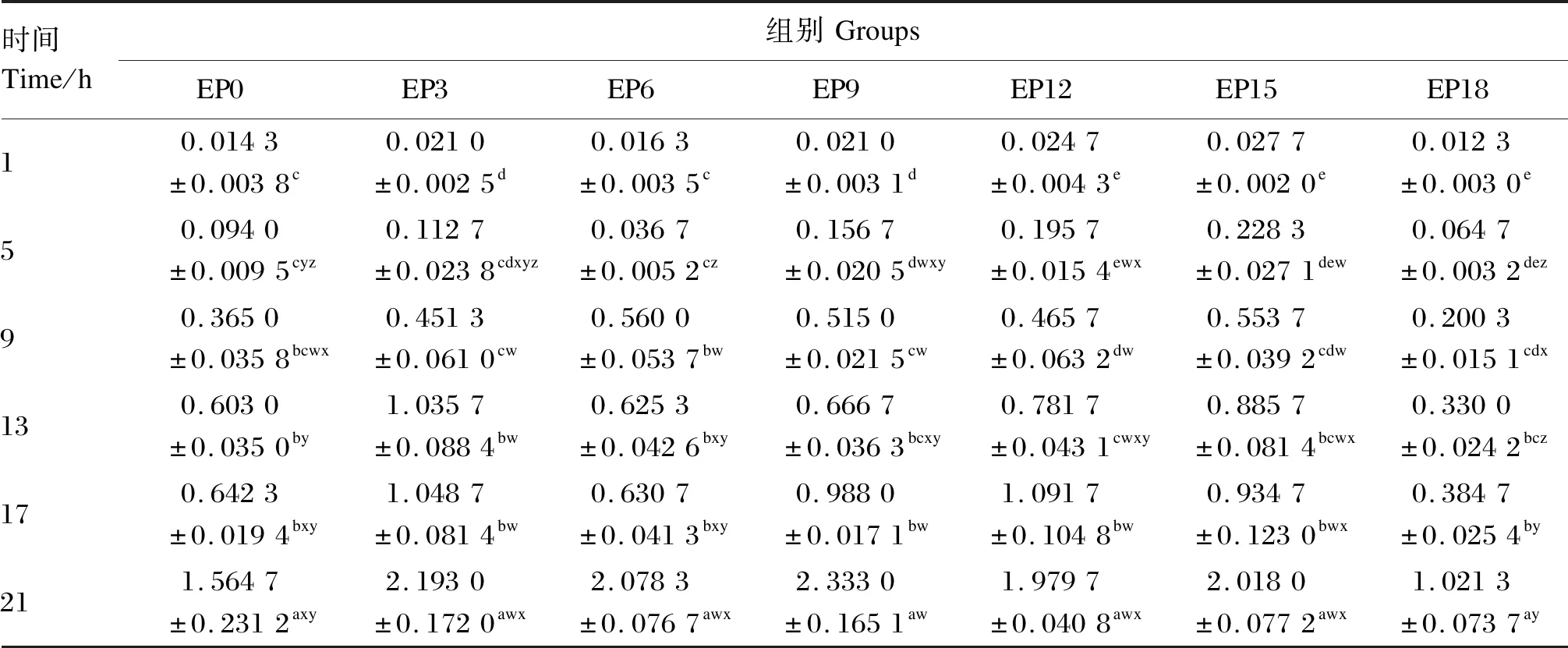
表11 养殖水体亚硝氮含量随时间的变化Table 11 Changes of nitrous nitrogen content in cultured water with time (n=3) mg/L
由表12和图6-C可知,随着时间的推移,各组养殖水体氨氮含量整体呈上升趋势。各组养殖水体氨氮含量在除摄食后17 h外的其他时间点均差异不显著(P>0.05)。在摄食后17 h,EP9组养殖水体氨氮含量显著低于EP6和EP15组(P<0.05),其他组间差异不显著(P>0.05)。各组养殖水体氨氮含量均在摄食后21 h达到最高且显著高于同组摄食后1~9 h(P<0.05)。EP3组养殖水体氨氮含量总体上升趋势相对缓慢且始终低于EP0组。在除摄食后9 h外的各时间点,EP3组养殖水体氨氮含量相较于EP0组降低了0.6%~21.0%。
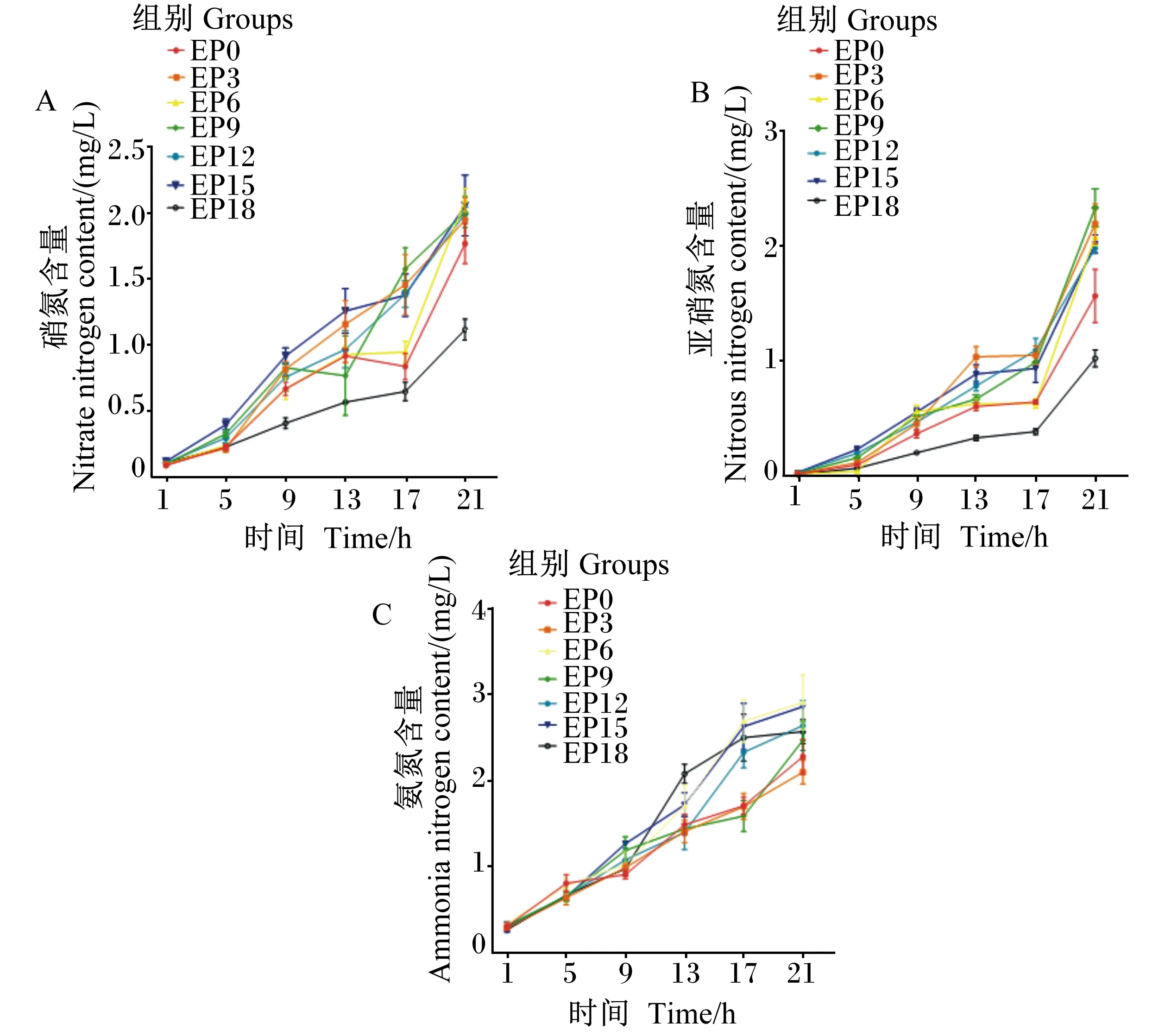
图6 养殖水体硝氮、亚硝氮和氨氮含量随时间的变化Fig.6 Changes of nitrate nitrogen,nitrous nitrogen and ammonia nitrogen contents in cultured water with time
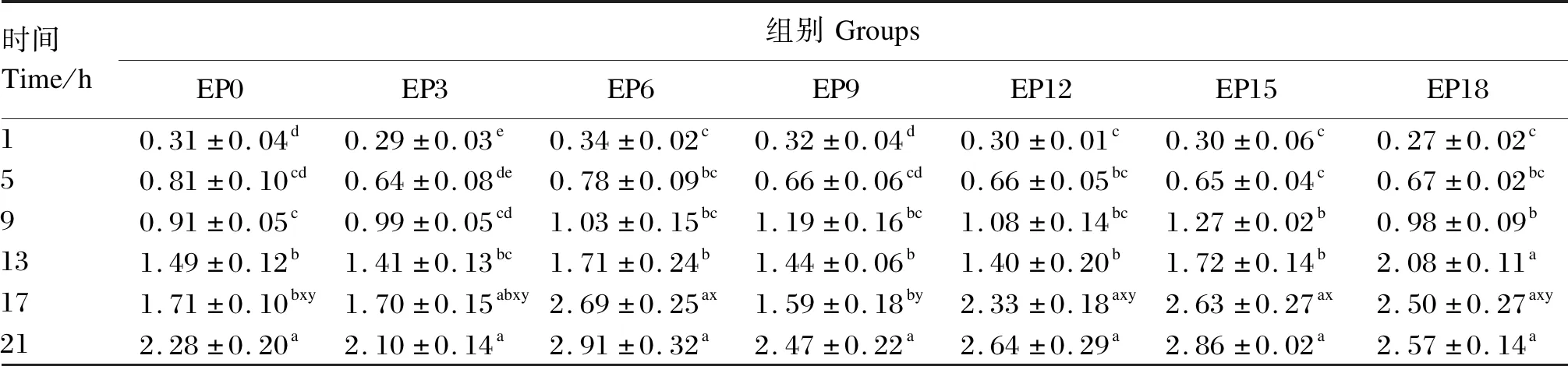
表12 养殖水体氨氮含量随时间的变化Table 12 Changes of ammonia nitrogen content in cultured water with time (n=3) mg/L
3 讨 论
3.1 酶解鸡肉粉替代部分鱼粉对珍珠龙胆石斑鱼生长性能的影响
已有研究显示,饲料中鸡肉粉添加量超过21%时,卵形鲳鲹的生长会受到抑制[10],然而,饲料中鸡肉粉添加量增加至32%时,并未对大菱鲆(Scophthalmusmaximus)幼鱼[22]和黄颡鱼(Pelteobagrusfulvidraco)幼鱼[23]的WGR和SGR产生显著负面影响,表明不同鱼种对鸡肉粉的利用率不同。本试验条件下,珍珠龙胆石斑鱼的WGR和SGR均EP3组达到最大值。酶解蛋白富含小肽和游离氨基酸,能提高鱼虾类的食欲,提高饲料转化率,对机体的生长、发育和饲料利用有着显著的促进作用[24-28]。小肽转运速度快、耗能低、载体不易饱和、能够改善氨基酸的转运速度[29],可以被动物的肝脏、肠道和皮肤等多种器官直接利用,提高了动物对营养物质的吸收利用效率,使得珍珠龙胆石斑鱼对饲料中蛋白质的吸收利用效率增高,本试验中EP3组珍珠龙胆石斑鱼的PER高于EP0组,表明饲料中适量添加酶解鸡肉粉有利于蛋白质沉积。随着饲料中酶解鸡肉粉添加量增加至15%,珍珠龙胆石斑鱼的生长性能和FCR始终保持稳定,未出现显著差异,这可能是因为:一方面,酶解鸡肉粉富含小肽,能减少氨基酸之间的拮抗作用,避免游离氨基酸吸收过程中发生吸收竞争,改善动物对饲料的利用[30];另一方面,饲料配方中补充了限制性氨基酸赖氨酸和蛋氨酸,充分满足了鱼体的生长发育需求。本试验中EP18组的WGR和SGR均显著低于其他组,这可能是由于酶解鸡肉粉添加量过高对鱼类的生长产生负面影响所致。研究发现,饲料中添加5.5%的水解鱼蛋白[31]或10%的磷虾水解物[32]可以提高大菱鲆对饲料中氨基酸的利用;饲料中添加19%的酶解磷虾粉可以提高珍珠龙胆石斑鱼幼鱼的WGR和SGR[33];饲料中鱼蛋白水解物添加量超过28.8%后,军曹鱼(Rachycentroncanadum)的WGR随添加量的升高而降低[34]。在酶解鸡肉粉替代部分鱼粉的状态下,饲料中潜在的促生长因子减少[22],而酶解鸡肉粉添加量过高导致饲料中小肽和游离氨基酸含量也逐渐增高至过量,出现了肽和蛋白至混合物比例不平衡的情况[35],而游离氨基酸被鱼体吸收需要一定的位点,当游离氨基酸含量过高时,会出现转运位点竞争抑制现象,造成吸收不同步,使这些营养物质在消化吸收过程中过多流失[36],以致PER、WGR和SGR逐渐降低,FCR逐渐升高[37]。在本试验条件下,FCR随酶解鸡肉粉添加量增加呈现出上升的趋势,可能是因为添加酶解鸡肉粉增加了饲料中小肽的含量,增加了饲料的适口性和诱食性。酶解产生的氨基酸残基[38]和生物活性肽[39]对水生动物有特殊的诱食作用,可促进金鲈(Latescalcarifer)[40-41]、星斑川鲽(Platichthysstellatus)幼鱼[42]、鲑鱼(Salmosalar)[43]、珍珠龙胆石斑鱼[27]的FCR升高,表明酶解鸡肉粉中的小肽具有一定的促进摄食的功效。
3.2 酶解鸡肉粉替代部分鱼粉对珍珠龙胆石斑鱼营养物质表观消化率的影响
在饲料中添加适量的酶解磷虾粉和家禽副产物酶解肽能够显著改善珍珠龙胆石斑鱼[27]和大菱鲆[44]的ADCDM,这说明酶解产生的小分子肽及氨基酸有利于提高水产动物对饲料的消化率。值得注意的是,随着饲料中酶解肽添加量的增加,大菱鲆的ADCCP先稳定后降低,ADCDM显著降低[45]。在本试验中,随着酶解鸡肉粉添加量的增加,珍珠龙胆石斑鱼的ADCDM和ADCCP也呈现出类似现象,即先稳定后降低。较多的酶解鸡肉粉使饲料中小肽和游离氨基酸的含量过高,过多的酶解肽反而会导致鱼类对饲料的消化率降低[44],游离氨基酸含量过高则导致位点竞争出现了吸收抑制情况,两者共同作用使得鱼类对蛋白质和干物质的消化吸收降低。崔家军等[46]的试验表明,随着饲料中酶解蛋白肽添加量的增加,猪的ADCCa呈现出先上升后下降的趋势。这与本试验研究结果类似,本试验中EP3、EP6和EP12组珍珠龙胆石斑鱼的ADCCa和ADCP高于EP0组,说明适量酶解鸡肉粉促进了钙和磷的消化,这可能是因为小肽有促进矿物元素消化吸收的作用[47]。
3.3 酶解鸡肉粉替代部分鱼粉对养殖水体水质的影响
陈思[48]的研究表明,珍珠龙胆石斑鱼最适生长水温为30.20~31.29 ℃,当养殖水温超过33 ℃时,石斑鱼的摄食量随温度的升高呈下降趋势。养殖水体温度的差异对鱼类摄食[49]、消化[50]和蛋白质合成率[51]均有直接或间接的影响。在外界温度对水温的影响一致的情况下,体增热越少,用于机体生长的净能越多。在08:00表观饱食投喂试验饲料后,随着外界环境温度的升高以及珍珠龙胆石斑鱼摄食后体内产热量的增加,养殖水体温度逐渐升高,养殖水体温度变化范围为30.83~31.77 ℃,间接提示饲料中鱼粉、豆粕等蛋白质源添加量下降而酶解鸡肉粉添加量的增加对珍珠龙胆石斑鱼的体增热影响不显著,对养殖水体温度未产生显著影响。
粪便和残饵会对养殖水体pH产生影响[52]。养殖水体pH下降可能是氨氧化菌等微生物将氨氮转化为亚硝酸盐的过程中产生酸性物质所致[53],也可能是因为鱼体的新陈代谢和排泄物导致养殖水体中总氮、氨氮、硝氮和亚硝氮的含量逐渐上升,与更多的氢氧根离子(OH-)结合发生化学反应,引起水体pH下降。本试验中,在摄食17~21 h后,养殖水体温度降低,一方面,可能是二氧化碳溶解度下降,与水分子结合生成碳酸的量减少,导致水体pH上升;另一方面,随着酶解鸡肉粉替代鱼粉比例的增加,ADCCP逐渐降低,鱼体代谢排出的粪便中氮的含量逐渐增加,以致摄食含酶解鸡肉粉饲料组养殖水体pH低于EP0组。鱼虾类养殖水体的适宜pH在6.5~8.5,水体生物呼吸作用以及饲料的溶失会对水体pH产生一定影响,本试验中同一时间点各组之间以及同组各时间点之间养殖水平pH均在6.82~7.16,尽管存在一定的差异,但保持在适宜范围内,表明饲料中鱼粉、豆粕和酶解鸡肉粉添加量的变化未对养殖水体pH产生不良影响。
养殖水体氨氮含量除了取决于养殖水体pH、温度、盐度等因素外,还受到鱼体对食物消化利用程度的影响[54]。相比于摄食人工饲料,大口黑鲈(Micropterussalmoides)[55]与大黄鱼(Pseudosciaenacrocea)[56]摄食鲜杂鱼后,养殖水体中总氮和总磷含量会有所上升。氮、磷排放率与食物中的氮、磷含量呈正相关[57],投喂低氮、磷含量的饲料提高了斑节对虾(Penaeusmonodon)的蛋白质消化率,降低了对氮、磷的排放率,有效减少了养殖水体中氮、磷的含量。EP3组ADCP高于EP0组且EP3组的生长性能也优于其他组,这表明添加适量酶解鸡肉粉后,磷被鱼类利用的效率更高,在水中残留更少,在一定程度上有效降低了磷对水体的污染。由此可见,食物的消化利用效率直接影响养殖水体水质。而水质不仅直接关系到鱼类的健康生长和成活率,还会决定藻类的生长,过量的氮、磷排放会使水体藻类繁殖旺盛,处于富营养化的状态,引起赤潮、水华的发生[58],对构建稳健平衡的养殖生态系统起着重要影响[59]。
养殖水体中氨氮、亚硝氮和硝氮的含量是衡量水质的重要标准,而氨氮又是养殖水环境中最重要的污染胁迫因子。由水中残饵、有机废物经细菌分解所产生的氨氮能直接对水生动物的鳃组织造成损害,甚至影响水生动物的生理代谢功能,从而抑制其生长[60]。养殖水体氨氮含量低时,鱼体生长发育正常,而氨氮含量过高时,鱼体摄食量明显下降,甚至出现死亡现象[60-61]。在本试验中,珍珠龙胆石斑鱼摄食含有酶解鸡肉粉的饲料1 h后,EP3和EP0组养殖水体总氮、氨氮、硝氮、亚硝氮和总磷含量均无显著差异。酶解鸡肉粉添加量超过6%时,养殖水体氨氮、硝氮和亚硝氮含量升高,且ADCCP和ADCP也低于EP0组。有研究发现,添加适量的酶解大豆蛋白和鸡肉粉对幼建鲤(Cyprinuscarpiovar.Jian)[62]和大菱鲆幼鱼[63]的生长有促进作用,使饲料中更多的能量用于生长,提高了饲料中氮、磷的利用率,而当酶解大豆蛋白和鸡肉粉添加量过高时,会引起饲料中氨基酸不平衡,导致氮、磷代谢失调,使鱼类摄入的蛋白质用于生长的量减少,而用于新陈代谢和排泄的量增加,多余的氨基酸通过脱氨基作用排出体外[64],导致鱼体对饲料的消化利用能力下降,引起氮、磷排泄率升高。由此可见,饲料中添加3%的酶解鸡肉粉替代部分鱼粉不仅可以促进珍珠龙胆石斑鱼的生长发育,还能改善养殖水体水质。
综合上述结果分析,饲料中添加适量的酶解鸡肉粉替代部分鱼粉可以有效降低养殖水体中亚硝氮、氨氮、硝氮和总磷的含量,降低饲料对水体的污染,从而推进水产养殖业的绿色发展,保护水域生态环境。
4 结 论
① 饲料中添加3%的酶解鸡肉粉替代部分鱼粉能够提高珍珠龙胆石斑鱼的生长性能。
② 饲料中添加3%的酶解鸡肉粉替代部分鱼粉对珍珠龙胆石斑鱼的ADCDM和ADCCP未造成负面影响,并且提高了ADCCa和ADCP。
③ 饲料中添加3%的酶解鸡肉粉替代部分鱼粉可通过提高珍珠龙胆石斑鱼对氮、磷的消化吸收,减少氮、磷在水体中的排放,有效减轻水产养殖对水质的污染。

