改性橘子皮对Cd2+、Cu2+和Zn2+的吸附
郑足红,王华伟,郑敏红
(1.湖北工程学院 湖北省植物功能成分利用工程技术研究中心,湖北 孝感 432000;2.洪山区疾病预防控制中心,湖北 武汉 430060; 3.洪山区妇幼保健院,湖北 武汉 430074)
随着采矿和有色金属工业的发展,水环境污染成为当前国内外面临的主要环境问题之一[1-3]。重金属离子Cu2+、Cd2+和Zn2+等是水资源的主要污染源之一[4],水环境中的重金属离子会对生态环境和人类健康造成严重的危害[5]。目前污水中重金属的处理方法包括微生物絮凝法、化学反应法、离子交换与吸附、膜分离等[6-7],但这些方法存在价格昂贵[7-8],且在重金属离子浓度低于100 mg/L时处理效率较低等问题[9-10]。吸附法是一种有效处理较低浓度重金属废水的良好技术[7-10],吸附法不仅用于水环境中重金属的固定,也可用于土壤重金属的钝化。要实现低耗高效处理重金属离子废水的目标,开发廉价高效的生物质吸附材料显得尤为重要。
柑橘在我国栽培面积大,而橘子皮成为废弃物后明显造成了资源浪费且污染环境[11]。研究表明,橘子皮中含有大量的木质素、纤维素和可溶性多糖(果胶),具有对金属离子较强的吸附能力,但是未改性的橘子皮存在很多的缺陷[2,4]。对橘子皮进行改性吸附重金属对于柑橘果皮的回收利用具有很广阔的应用前景。研究表明,经氢氧化钠和乙醇改性后的橘子皮吸附能力大大高于改性前[12],且可以再生重复使用。目前在国内外研究中,对于改性方法缺乏其原理的探讨解释,部分改性方法也缺少最优工艺条件。
本文选取橘子皮为原料,经氢氧化钠和乙醇改性后,探讨其对Cd2+、Cu2+和Zn2+的吸附特性,评价该吸附剂对水溶液中Cd2+、Cu2+和Zn2+的吸附效果,分析了等温吸附、吸附热力学、吸附动力学等,通过条件优化得到性能优良的吸附剂并用于对重金属离子的吸附,为改性橘子皮在工业废水处理中的应用提供理论依据。
1 材料与方法
1.1 实验材料
橘子皮改性吸附剂的制备:收集新鲜橘子皮,用去离子水清洗后晾干,70 ℃干燥箱中烘干至恒重,碾碎后过50目筛混合均匀,放入密封袋中置于干燥器中备用。称取50 g经过预处理的橘子皮粉末放入500 mL烧杯,向其中加入250 mL乙醇以及250 mL 0.4 mol/L的 NaOH[4],浸泡并搅拌,24 h后,水洗至pH接近中性,过滤后,将样品在70 ℃条件下烘干24 h,得到吸附剂。
硝酸镉、硫酸铜和氯化锌配成不同含Cd2+、Cu2+和Zn2+的吸附质溶液。所有化学药剂均为分析纯,购自国药集团,实验用水为超纯水。
1.2 实验方法
选择改性前后吸附效果对比、pH值、吸附剂的量、时间、浓度和温度这6个因素进行实验,考察最佳吸附条件。根据吸附前后溶液中的金属离子浓度,计算去除率和吸附量,以下所有实验均进行3次重复。
去除率E=(C0-Ci)/C0×100%
(1)
吸附量Q=(C0V0-CiV)/W
(2)
式中:E为去除率,%;C0为初始的离子浓度;Ci为吸附平衡时离子浓度(mg/L);Q为吸附量(mg/g);V0为初始溶液体积(mL);V为吸附平衡溶液体积(mL);W为吸附剂投加量(g)。
1.2.1 改性对吸附效果的影响
取若干份含50 mg/L金属离子的溶液25 mL,分别用10% HNO3和0.1 mol/L NaOH调节pH值为5.0,分别加入0.100 g改性前后的吸附剂,恒温(25 ℃)摇床中200 r/min振荡3 h,吸附完成后抽滤测定滤液中金属离子浓度。
1.2.2 pH值对吸附效果的影响
取若干份含50 mg/L金属离子的溶液25 mL,用10% HNO3和0.1 mol/L NaOH调节pH值分别为2.5、3、3.5、4、4.5、5.0和5.5,加入0.10 g吸附剂,恒温(25 ℃)摇床中200 r/min振荡3 h,吸附完成后抽滤测定滤液中金属离子浓度并测定反应液pH值。
1.2.3 吸附剂的量对吸附效果的影响
取若干份含50 mg/L金属离子溶液25 mL,调pH值为5.0,分别加入0.050,0.075,0.100,0.125,0. 150 g吸附剂,恒温(25 ℃)摇床中200 r/min振荡3 h,吸附完成后抽滤测定溶液中的金属离子浓度。
1.2.4 吸附动力学
取若干份含50 mg/L的含金属离子溶液25 mL,调pH值为5.0,加入0.10 g吸附剂,恒温(25 ℃)摇床中200 r/min振荡5,10,15,20,25,30,35,40,50,60,70,80,90,120,150,180 min,吸附完成后抽滤测定溶液中的金属浓度。
为探讨吸附的机理,动力学吸附结果采用准一阶拟合、准二阶拟合和颗粒内扩散拟合。三类方程的有效拟合分别是物理吸附、化学吸附和颗粒内扩散为速率控制阶段吸附类型[2]。从吸附动力学上看,吸附动力学模型是用来表征单位吸附量和其对应吸附时间的关系的方程[5]。其模型方程如下:
准一级动力学模型:
(3)
准二级动力学模型:
(4)
三阶动力学方程是颗粒内扩散模型:
qt=kit0.5+Ci
(5)
式中:qe为吸附平衡状态下的吸附量(mg/g);qt为t时刻的吸附容量(mg/g);k1为准一级吸附动力学常数(g/(mg·min));k2为准二级吸附动力学常数(g/(mg·min));t为吸附时间(min);ki为颗粒内扩散常数(mg/(g·min0.5));Ci为边界厚度。
1.2.5 等温吸附
取浓度分别为10 ~ 150 mg/L的金属离子溶液25 mL,调pH值为5.0,分别加入0.10 g吸附剂,恒温(25 ℃)恒温摇床中200 r/min振荡3 h,吸附完成后抽滤测定溶液中的金属离子平衡浓度Ce和平衡吸附量qe。
将实验所得的平衡浓度和吸附量绘得等温吸附曲线,采用Langmuir和Freundlich方程进行拟合。L方程是用来描述单层吸附的,它假设均质吸附,表面吸附位点具备相同的能量。
Langmuir方程转化成的线性形式如下:
(6)
式中:qe是平衡状态下的吸附容量(mg/g);Ce是平衡浓度(mg/L);qmL为完成单分子层吸附时的最大吸附容量(mg/g);b为重金属与吸附剂上吸附位点的亲和力。
b用来计算RL,一个无量纲分离因子,公式如下:
(7)
式中:C0是初始浓度(mg/L);RL值能够说明吸附是否可逆(> 1)、线性(=1)、有利(0 ~ 1)或不可逆(=0)。
Freundlich方程是假定非均质吸附,方程为
(8)
式中:KF是最大吸附量(mg/g);1/n表示重金属在吸附剂上的强度,若1/n小于1,仍然属于单层吸附。
取若干份含50 mg/L 金属离子溶液25 mL,调pH值为5,加0.1 g吸附剂,在20,25,30,35,40,45 ℃下恒温摇床中以200 r/min振荡3 h,吸附完成后抽滤测定滤液中金属离子浓度。由下面的公式计算反应的自由能ΔG0,焓ΔH0和熵ΔS0[5]。
(9)
ΔG0=-RTlnΚc
(10)
(11)
式中:Kc为平衡常数;Cads为平衡状态下重金属吸附量(mg/g);Ce为平衡状态下留在溶液中的重金属浓度(mg/g);R为气体常数(kJ/(mol·K));T为溶液绝对温度(K)。
本文实验数据均采用SPSS 25和Origin8.0进行处理和分析。
2 结果与分析
2.1 改性的影响
由图1可知,橘子皮对3种重金属离子均有一定的吸附性能,改性后的橘子皮对3种重金属的吸附量均高于改性前的橘子皮,吸附性能均有不同程度提升:对Cd2+的吸附量在改性前为11.95 mg/g,改性后为52.1 mg/g;对Cu2+的吸附量在改性前为6.68 mg/g,改性后为43.42 mg/g;对Zn2+的吸附量在改性前为8.125 mg/g,改性后为32.5 mg/g。其中,改性后的橘子皮比改性前的橘子皮对Cu2+的吸附量增加最为明显,增加了550%,而对Cd2+和Zn2+的吸附量增加分别为336%和300%。这说明用氢氧化钠改性能提高羧基的数目,增加离子交换率,氢氧化钠对橘子皮的表面特性或者生物质的官能团有明显的改造作用,使得生物质材料的吸附性能大大提高。
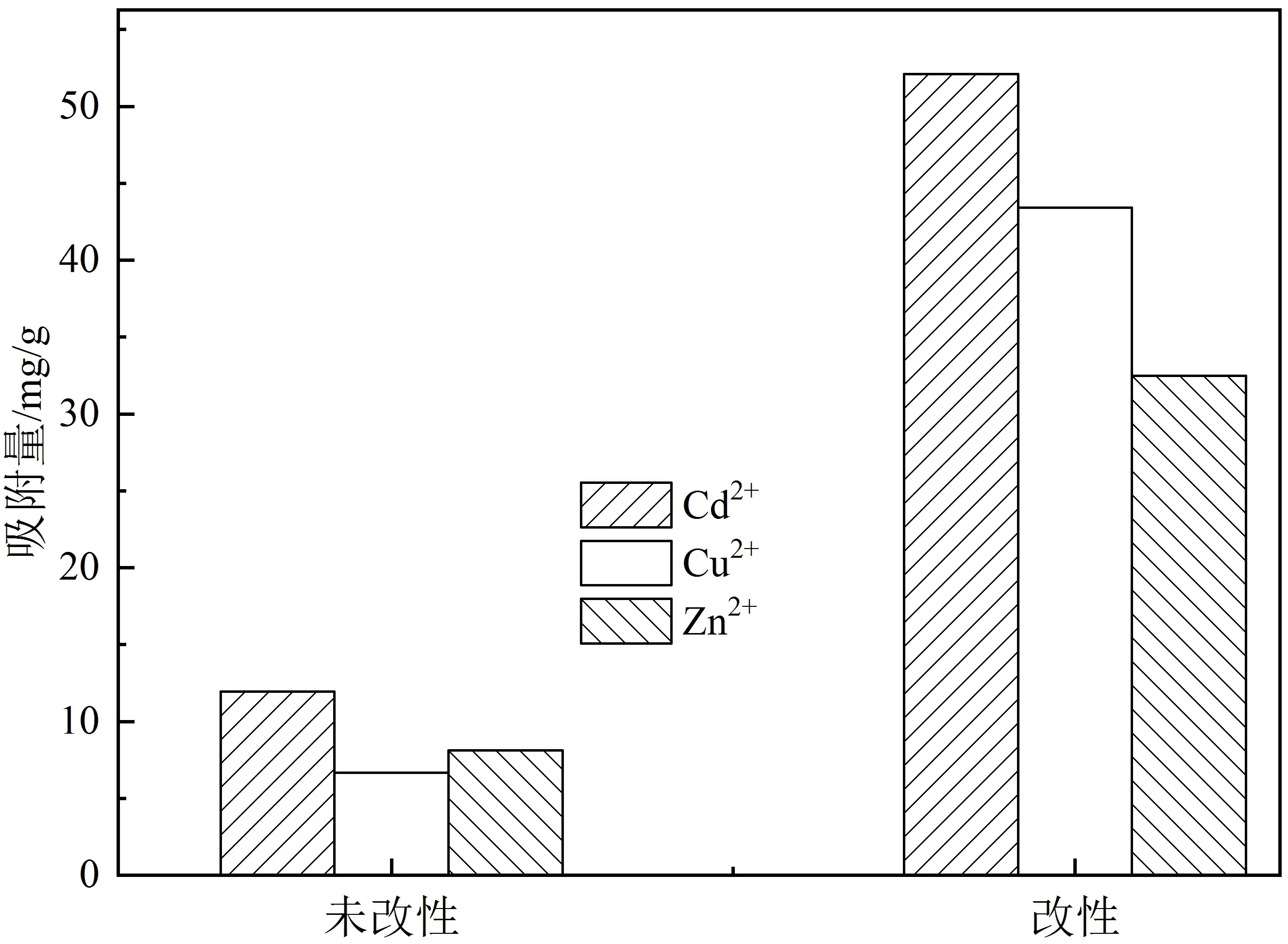
图1 橘子皮改性对Cd2+、Cu2+和Zn2+的吸附量的影响
2.2 pH值的影响
3种重金属在改性橘子皮上的吸附均受到pH值的明显影响(图2)。Cd2+、Cu2+和Zn2+在pH值从2.5升高到5.0的条件下,吸附量明显上升且均达到最大值,分别从22.78 mg/g到52.08 mg/g、12.69 mg/g到43.44 mg/g和16.24 mg/g到32.51 mg/g。在pH值5.0到5.5范围内,3种重金属的吸附量分别开始下降到48.47 mg/g、39.91 mg/g和30. 9 mg/g;3种重金属离子的吸附量分别降低6.93%、8.13%和4.95%。在pH值3.5到5.5范围内,吸附量大小均为Cd2+> Cu2+> Zn2+,而在pH值从2.5到3.5范围内,吸附量大小均为Cd2+> Zn2+> Cu2+。

图2 不同pH值对Cd2+、Cu2+和Zn2+吸附量的影响
这说明重金属在橘子皮表面的吸附明显受到H离子竞争吸附的影响。氢离子浓度一方面可能影响橘子皮表面的表面电荷,另一方面也对重金属阳离子的吸附产生竞争。这也说明,重金属在橘子皮表面的吸附中,静电作用较为重要。
由medusa软件拟合图(图3)可知,本实验条件下,Cd2+、Cu2+和Zn2+3种重金属离子分别在Cu2+5.5、Zn2+7.0、Cd2+8.5的pH值条件下开始沉淀,所以本实验选取pH值为5.0。
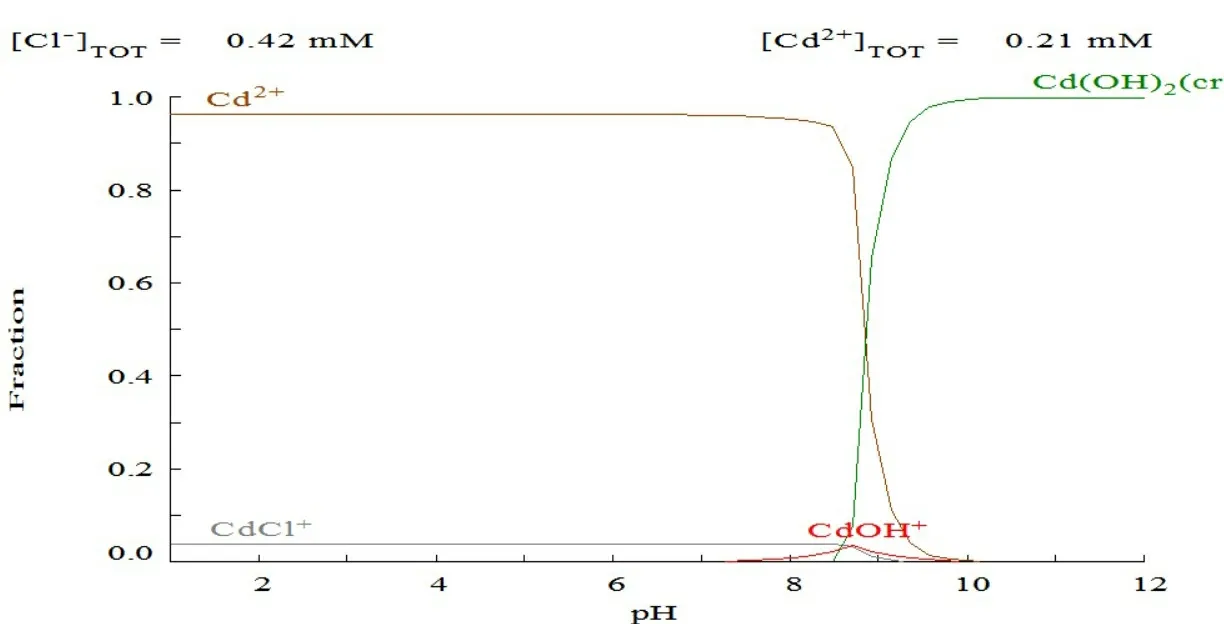
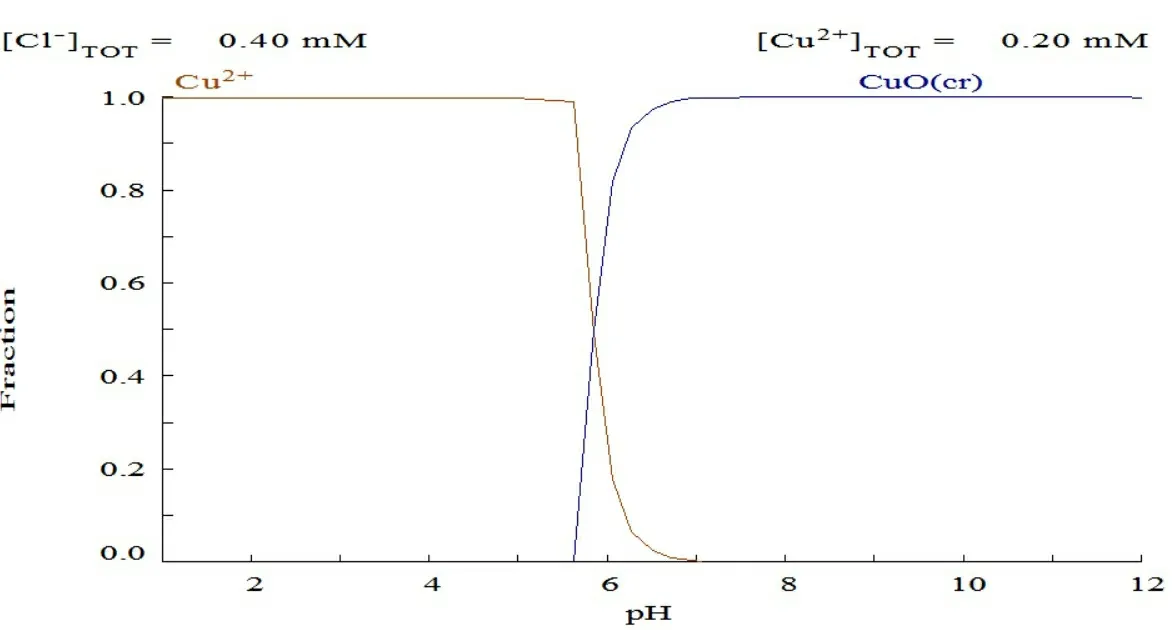
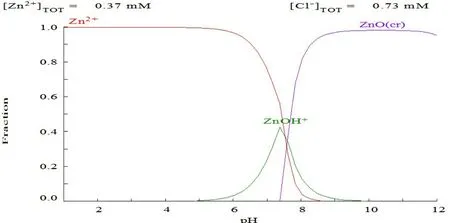
图3 medusa软件拟合图
2.3 吸附剂的量的影响
由图4可知,在吸附剂的量由0.05 g增加到0.15 g时,吸附量大小顺序为Cd2+> Cu2+> Zn2+;在吸附剂用量由0.025 g增加到0.1 g,再到0.20 g时,Cd2+、Cu2+、Zn2+吸附量均是先显著增加再趋于平稳,Cd2+的吸附量从56.35 mg/g降到49.99 mg/g,Cu2+的吸附量从45.45 mg/g降到43.09 mg/g,Zn2+的吸附量从36.43 mg/g降到32.50 mg/g后,再降到29.98 mg/g。
随着投加量的增加,吸附量刚开始逐渐升高,因为吸附剂量的增多一方面增大了吸附表面积,另一方面也增加了参入吸附的官能团数。在吸附初期,橘子皮吸附剂表面的吸附位点处于低饱和状态且模拟废水浓度高,从而促进了吸附量的迅速增加;之后随着投加量的增加,吸附量基本不变,可能是由于悬浮的吸附剂浓度过高,互相粘结在一起,使得其与溶液接触的面积减少,从而降低了有效的吸附表面,减少了吸附的活性点位[4],而当吸附剂的量大于某一特定值时,橘子皮吸附剂表面的吸附容量接近饱和,最终趋于平衡状态,吸附量处于某一稳定值。

图4 吸附剂用量对Cd2+、Cu2+和Zn2+吸附效果的影响
2.4 吸附动力学
由图5a可知,Cd2+、Cu2+和Zn2+的吸附量随吸附时间增加而增加。Cd2+、Cu2+和Zn2+在改性橘子皮上约50 min、90 min和30 min达到吸附平衡,吸附量达到最大,分别为Cd2+52.10 mg/g、Cu2+43.41 mg/g、Zn2+32.51 mg/g。在吸附时间由5 min增加到30 min时,吸附量大小顺序为Cd2+> Zn2+> Cu2+;由30 min到180 min时,吸附量大小顺序为Cd2+> Cu2+> Zn2+。
用吸附量、时间数据拟合准一阶方程(图5a)、准二阶方程(图5b)和内扩散模型(图5a),由表1中的准一阶、准二阶方程和内扩散模型对动力学吸附数据,可知准二阶方程在动力学吸附实验中的拟合效果更好,R2值大小顺序为:Zn2+(0.999)> Cd2+(0.998)> Cu2+(0.997);其次为准一阶拟合,R2大小顺序为:Cu2+(0.973)> Zn2+(0.934)> Cd2+(0.923);颗粒内扩散方程拟合较差,R2较小,顺序为:Cu2+(0.943)> Cd2+(0.876)> Zn2+(0.705)。由准一阶拟合得到的最大吸附量qe大小顺序为:Zn2+(105.199 mg/g)> Cd2+(104.460 mg/g)> Cu2+(46.813 mg/g),由准二阶拟合得到的最大吸附量qe大小顺序为:Cd2+(55.096 mg/g)> Cu2+(48.216 mg/g)> Zn2+(33.445 mg/g)。与准一阶方程拟合比较,准二阶方程拟合结果更接近实际吸附量。准二级吸附动力学常数k2分别为2.558×10-4g /(mg·min)(Cd2+)、1.406×10-4g /(mg·min)(Cu2+)和9.096×10-4g /(mg·min)(Zn2+)。
根据上述动力学方程的拟合,发现吸附过程都是化学吸附或以化学吸附为主,而非单纯物理吸附[10]。准二阶拟合较好,说明吸附存在饱和位点的限制,内扩散模型拟合效果相对较差。
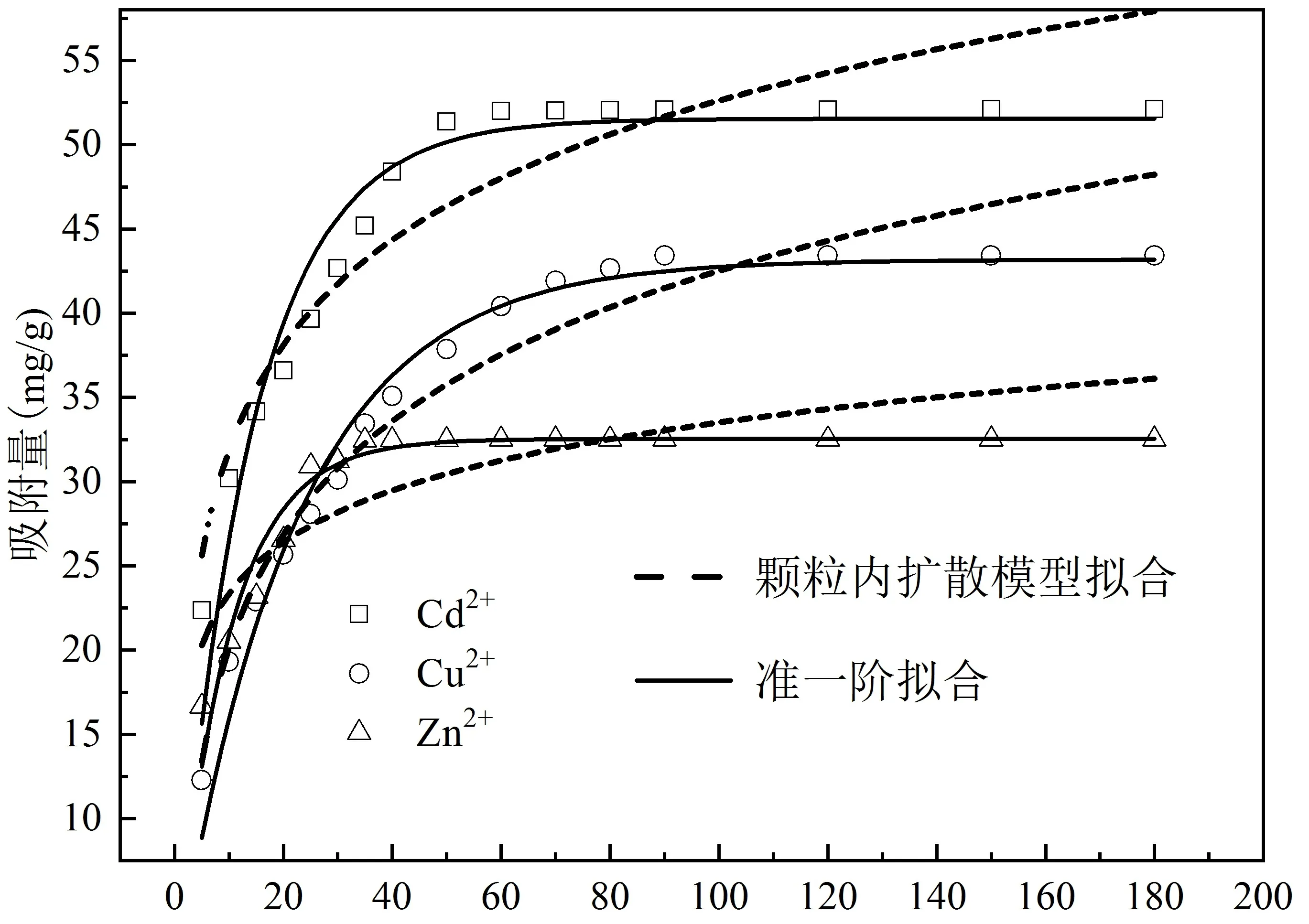
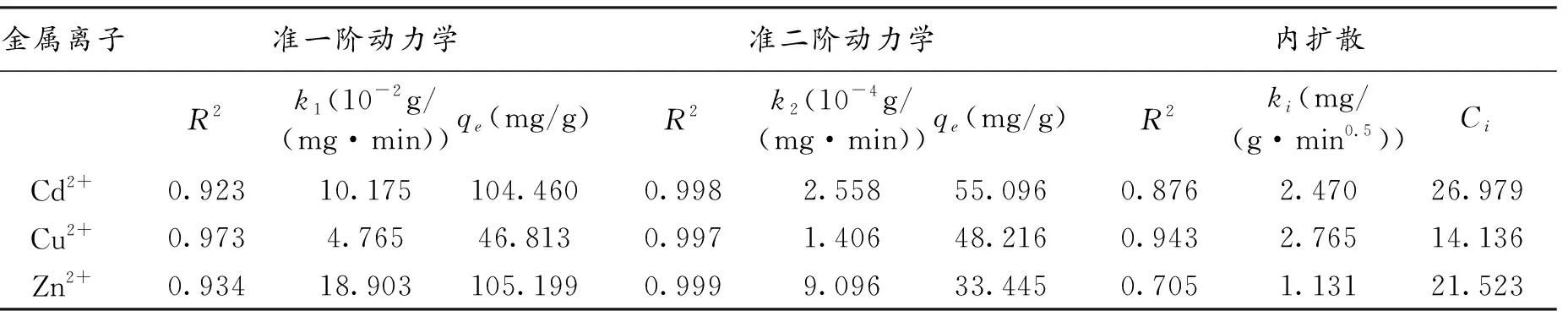
表1 准一阶、二阶动力学和内扩散模型拟合参数
2.5 等温吸附
由图6可知,在平衡浓度为0 ~ 50 mg/L时,吸附量随着浓度的增加而增加。由表2可知,Cd2+、Cu2+和Zn2+吸附用Langmuir模型(R2分别为0.99639(Cd2+)、0.99631(Cu2+) 、0.99167(Zn2+))拟合比用Freundlich模型(R2分别为0.9892(Cd2+)、0.96847(Zn2+)、0.92888(Cu2+))更好。1/n表示重金属在吸附剂上的强度,Cd2+、Cu2+和Zn2+的 1/n均小于1,说明吸附仍然属于单层吸附。由Langmuir方程拟合得到qmL, Cd2+、Cu2+和Zn2+的qmL分别为52.192 mg/g、43.352 mg/g和32.574 mg/g,更近似于实际测得的最大吸附量。
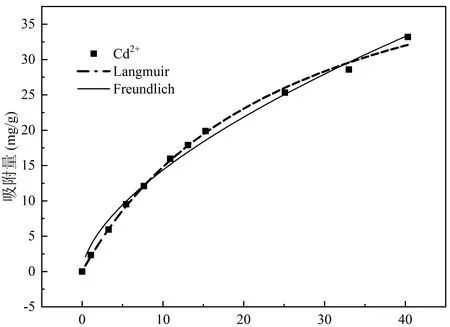
图6 Cd2+、Cu2+和Zn2+的等温吸附及其拟合
Cd2+、Cu2+和Zn2+的无量纲因子RL在各初始浓度条件下均小于1,说明Cd2+、Cu2+和Zn2+的吸附在实验条件下均为有利发生。
2.6 吸附热力学
由图7可知,在温度为20 ~ 45 ℃时,吸附量大小顺序为Cd2+> Cu2+> Zn2+;在温度由20 ℃增加到25 ℃再到45 ℃时,Cu2+、Zn2+吸附量均是先缓慢降低再迅速降低,Cu2+的吸附量从43.99 mg/g降低到43.9 mg/g后迅速降低到38.04 mg/g,Zn2+的吸附量从32.53 mg/g降到32.39 mg/g后迅速降到29.08 mg/g。说明在温度为20 ~ 45 ℃时,吸附量随温度的增加而减少,而Cd2+的吸附量随温度的增加而缓慢降低,从52.24 mg/g降到52.13 mg/g,再到51.65 mg/g。故选取最佳实验温度为25 ℃。
与Cd2+不同,Cu2+和Zn2+的吸附量随温度变化比较明显,这可能是因为溶液的温度升高时,不仅活性位点随着温度的增加而增加,且离子运动加强,同时在溶质和吸附剂表面的浓度差的推动下使离子向橘子皮吸附剂的内部扩散,增大了单位吸附量;升温有利于化学吸附克服活化能的障碍,加快了粒子内扩散速度,从而提高吸附量[10]。从吸附热力学上解释,化学吸附是个放热反应[10]。温度过高时,虽然离子运动加强,但温度的增加却抑制了橘子皮吸附剂表面的吸附位点的活性,故吸附量逐渐降低[2]。
由公式(1)、(2)、(3)及图7计算不同温度下的自由能ΔG0、焓ΔH0和熵ΔS0,根据热力学参数的正负比较,得表3所示吸附反应的相关特性。
吸附剂对重金属离子的吸附作用实际分为吸附和解吸两个过程。从表3可知,吸附剂对Cu2+、Cd2+和Zn2+的热力学参数ΔH0均为负值,说明对3种金属离子的吸附均是放热反应。负值越小,说明吸附受温度影响越大,从ΔH0数值上看,Cd2+> Zn2+> Cu2+,说明Cu2+受温度影响更大。吸附热力学参数ΔG0均为负值,说明吸附反应均是自发发生的。负值越小,越容易自发发生;为正,不能自发发生。Cu2+、Cd2+和Zn2+的热力学参数ΔH0在温度为25 ~ 35 ℃时均为负,并随着温度的升高ΔG0值增大,说明Cu2+、Cd2+和Zn2+的吸附反应在25 ℃下可以自发发生,并且温度升高不利于Cu2+、Cd2+和Zn2+的自发过程。从ΔG0数值上看,各温度下均存在Zn2+> Cu2+> Cd2+,说明Cd2+更容易自发发生。ΔS0均为负值,说明Cd2+、Cu2+和Zn2+吸附过程为焓推动过程[2]。

表2 Cd2+、Cu2+和Zn2+吸附的拟合参数

表3 Cu2+ 、Cd2+ 和Zn2+的热力学参数
3 结论
1)用0.1 g氢氧化钠改性处理后的橘子皮处理50 mg/L Cd2+、Cu2+和Zn2+,在pH为5.0、温度为25 ℃、吸附平衡时间为3 h的条件下,吸附量分别达到最高,分别为52.13 mg/g、43.90 mg/g和32.39 mg/g。
2)Cd2+、Cu2+和Zn2+吸附用Langmuir模型(R2大小顺序为Cd2+(0.99639) > Cu2+(0.99631) > Zn2+(0.99167)拟合比用Freundlich模型(R2大小顺序为Cd2+(0.9892) > Zn2+(0.96847) > Cu2+(0.92888)更好。
3)氢氧化钠改性处理后的橘子皮吸附剂对Cu2+、Cd2+和Zn2+的ΔH0均为负值,均是放热反应,Cu2+受温度影响更大;在温度为25 ~ 35 ℃时,ΔG0均为负值,均是自发发生的,温度升高不利于Cu2+、Cd2+和Zn2+的自发过程,Cd2+更容易自发发生。
4)氢氧化钠改性处理后的橘子皮吸附剂对Cu2+、Cd2+和Zn2+的吸附符合准二级吸附动力学方程,动力学常数k2分别为2.558×10-4g/(mg·min)(Cd2+)、1.406×10-4g/(mg·min)(Cu2+)和9.096×10-4g/(mg·min)(Zn2+)。

