射血分数保留的心力衰竭的诊断和治疗策略
刘蔚,尉然
本研究背景:
国内临床医务工作者对射血分数保留的心力衰竭(HFpEF)认识相对不足,故开展的相关基础研究和临床研究均较少,相关文献较缺乏。国外文献对HFpEF的研究较为丰富,但无论是发病机制还是诊断标准、治疗策略相关文献各种观点不一而足,且均未形成一致的结论,同时也提示了广大医务工作者对该领域探索的必要性。
心力衰竭(简称心衰)是指由心脏结构和/或功能异常导致心室收缩和/或舒张能力受损而引起一系列病理生理变化的临床综合征,是多种心血管疾病的终末阶段。根据左心室射血分数(left ventricular ejection fraction,LVEF)分为射血分数降低的心衰(heart failure with reduced ejection fraction,HFrEF)、射血分数保留的心衰(heart failure with preserved ejection fraction,HFpEF)和射血分数中间值的心衰(heart failure with mid-range ejection fraction,HFmrEF)。
HFpEF占心衰总数超过50%[1],随着人口老龄化和人类疾病谱的演化,这种趋势在进一步加剧。HFpEF近期和远期病死率与HFrEF接近,是危害人类健康的重大疾病。国外研究显示,普通人群中HFpEF的患病率为1.1%~1.5%,约占全部心衰患者的50%并逐步增高[2]。国内某医院对2003—2009年住院心衰患者的分析结果显示,LVEF≥50%的患者占54.5%[3];中国心力衰竭注册登记研究对2012—2014年住院的心衰患者进行分析发现,LVEF≥50%的患者占42%[4]。2013年欧洲ESCHF Pilot研究证明HFrEF患者的1年全因死亡率为18.6%,而 HFpEF患者为 13.4%[5]。对 HFpEF和HFrEF患者平均随访33.5个月发现,HFpEF患者病死率为33.1%,HFrEF患者为45.4%[3]。国内外研究均证明HFpEF患者病死率略低于或接近HFrEF患者。
目前HFpEF尚缺乏统一的诊断标准,临床研究未能证实血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)、β-受体阻滞剂和血管紧张素受体/脑啡肽酶抑制剂等能改善HFrEF预后的药物也能降低HFpEF患者的病死率。为提高基层医生对HFpEF的认识,增加HFpEF患者的检出率,缓解其临床症状和提高生活质量,早期干预其心衰的发生、发展,本文拟结合HFpEF目前的研究进展和权威指南/共识的推荐,总结分析HFpEF诊断流程和治疗策略,以期对我国基层医生起到帮助和指导作用。
1 HFpEF发生机制
HFpEF是一种在机制和临床表现均存在异质性的疾病,HFpEF患者具有各种潜在的病因和复杂的病理生理学特点。研究发现,与HFrEF相比,HFpEF患者常多发于老年群体,以女性多见,且伴随多种合并症,如高血压、心房颤动、肥胖、代谢综合征、肥厚型心肌病,而心肌梗死病史不常见[3,6]。高血压是HFpEF最常见的病因,高血压患者的HFpEF患病率为60%~89%[7]。HFpEF常见于有高血压史的老年女性,其病理生理机制尚不明确,可能的机制为左心室舒张期主动松弛能力受损,心肌顺应性降低(心肌细胞肥大伴间质纤维化)导致左心室舒张期充盈受损,心排血量降低,左心室舒张末压升高。而左心室舒张末压升高可引起左心房压升高、左心房衰竭,进而引起肺静脉压升高、肺淤血,临床上出现呼吸困难;分子学机制包括全身微血管炎症、心脏代谢功能异常、细胞肌联蛋白/细胞外纤维化结构异常。氧化应激、炎性反应、冠状动脉微血管障碍等可能参与了HFpEF的发生。与HFrEF相比,重组人白介素-1受体样1(IL1RL1)、C反应蛋白、生长分化因子15(GDF-15)等炎性递质在HFpEF患者血清中含量更高[8-11]。
2 HFpEF诊断要点
各国指南对HFpEF诊断标准描述不一。《中国心力衰竭诊断和治疗指南2018》[12]指出,HFpEF的诊断标准为患者需具有相应的症状和/或体征,利钠肽水平升高,LVEF正常或略低于正常,超声心动图提示LVEF≥50%,同时具有下列之一:(1)左心室肥厚和/或左心房扩大;(2)心脏舒张功能异常。
2.1 超声心动图 临床上诊断HFpEF常面临的问题是患者LVEF正常,而心衰的体征和症状通常是非特异的,不能很好地对心衰与其他疾病进行鉴别诊断,特别是对合并多种基础疾病且无明显容量负荷过重的老年人。既往HFpEF缺少特异度强、灵敏度高的辅助诊断指标,使HFpEF的诊断成为排他性诊断。心脏超声检查及侵入性血流动力学监测评估有无心脏结构及功能异常,使HFpEF的诊断逐渐明确。2016年欧洲心脏病学会(ESC)关于慢性心衰的指南[13]提出,HFpEF关键的心脏结构改变为左心房容积指数≥34 ml/m2或左心室质量指数男性≥115 g/m2(女性≥95 g/m2);关键的功能性参数为舒张早期左房室瓣血流速度与运动速度的比值(E/e')≥13、舒张早期左房室瓣环间隔和侧壁平均运动速度(e')<9 cm/s。因此,HFpEF的进一步诊断可使用半仰卧位的踏车运动方案行超声心动检查,甚至可行静息或运动时侵入性血流动力学方法评估左心室充盈压、肺动脉压力。
2.2 生物标志物 在生物标志物诊断方面,目前国内外心衰指南均推荐B型利钠肽(BNP)或N末端B型利钠肽原(NT-proBNP)用于心衰的筛查、诊断、评估疗效和判断预后。2017年美国心脏病学会(ACC)/美国心脏协会(AHA)/美国心力衰竭协会(HFRS)对《2013年ACCF/AHA心力衰竭管理指南》[14](简称为2013年ACCF/AHA指南)进行了更新,推荐对心衰高危人群应用BNP进行早期筛查可预防左心室功能障碍或新发心衰,急性失代偿性心衰患者入院时和出院前的BNP水平均有助于判断出院患者的预后[15]。诊断急性心衰时NT-proBNP需根据年龄和肾功能进行分层,50岁以下的患者NT-proBNP水平>450 ng/L,50岁以上 >900 ng/L,75岁以上 >1 800 ng/L,肾功能不全〔估算肾小球滤过率(eGFR)<60 ml/min〕>1 200 ng/L有诊断意义。由于特异度不高,BNP或NT-proBNP在HFpEF患者诊断和预后评估中并不是一种理想的生物标志物,其受到多种心血管和非心血管疾病的影响,如急性冠脉综合征、心肌炎、心肌病、心房颤动、心脏手术、年龄、贫血、肥胖和肾功能不全等因素的影响。脑啡肽酶抑制剂可使BNP降解减少,而NT-proBNP不受影响。相比于BNP,NT-proBNP的t1/2更长、稳定性更好,因此采用NT-proBNP诊断早期或轻度心衰的灵敏度更高,更适于临床应用。2020年ACC公布的PARAGONHF研究[16-17]显示,较高的基线NT-proBNP水平与总心衰住院和心血管死亡风险密切相关,而NT-proBNP水平的降低能预示HFpEF患者较低的心衰住院和心血管死亡的复合终点事件,为NT-proBNP在HFpEF患者中的预后分层和治疗评估提供了新的证据。此研究还发现,对于同一个相对稳定的NT-proBNP水平,心房颤动患者不良事件发生率较低,而肥胖患者不良事件发生率较高。另外,和心肌纤维化、炎症和氧化应激相关的标记物,如可溶性ST2、半乳糖凝集素-3、高敏心源性肌钙蛋白、IL1RL1、C反应蛋白、GDF-15等在HFpEF筛查和诊断中的应用价值还需要更多的研究证据,联合使用多种生物标志物是未来诊断HFpEF的发展方向。
2019年欧洲心力衰竭协会(HFA)/ESC共识建议[18],对HFpEF的诊断可分为4个步骤,即(1)初始评估:了解心衰的症状和体征,有无危险因素和合并症;(2)超声心动图和BNP水平:由心脏专科医生通过超声心动图参数评估心脏的结构和功能,并测定BNP水平;(3)功能性测试:运动超声心动图和血流动力学监测;(4)病因学检查:通过特殊的影像学检查和实验室检查进行病因诊断。虽然该诊断流程细化了HFpEF的诊断标准,使HFpEF的诊断更为科学,但需要更专业的技术和更先进的设备,在基层普及和应用中存在一定的局限性。
3 HFpEF治疗策略
适用于HFrEF的标准治疗策略并不适合用于HFpEF,临床研究未能证实ACEI/ARB、β-受体阻滞剂和醛固酮受体拮抗剂可以改善HFpEF的预后和降低病死率。目前尚无一种药物可显著改善HFpEF预后,主要通过使用利尿剂减少水钠潴留,改善呼吸困难和水肿,提高运动耐量。同时对伴随的心血管和非心血管疾病及合并症进行综合治疗。(1)合并高血压的治疗策略:高血压是HFpEF最常见的病因,积极控制血压可以降低心衰住院率、心血管事件和死亡率。国际高血压学会(ISH)2020年国际高血压实践指南[19]推荐的降压治疗目标值为<130/80 mm Hg(1 mm Hg=0.133 kPa),高血压合并左心室肥厚但尚未出现心力衰竭的患者,血压可先降至<140/90 mm Hg,如患者能良好耐受,可进一步降低至<130/80 mm Hg。老年患者根据可耐受程度个体化选择治疗的目标值。降压药的选择:尽管ACEI/ARB、β-受体阻滞剂和醛固酮受体拮抗剂不能改善预后,但这些药物用于降压治疗是安全有效的。如血压不能良好控制可选用二氢吡啶类钙通道阻滞剂(CCB)(如氨氯地平、非洛地平)和非二氢吡啶类CCB。(2)合并冠心病的治疗策略:冠心病是心衰的常见病因,可根据冠心病治疗相关指南进行治疗,经规范的抗心肌缺血药物治疗后仍有症状者可考虑血运重建治疗,减少缺血对心脏舒张功能的损害。合并冠心病的HFpEF患者,应进行积极的冠心病二级预防治疗,包括抗血小板药、他汀类调脂药、β-受体阻滞剂和ACEI/ARB。(3)合并心房颤动的治疗策略:心房颤动是HFpEF患者最常合并的心律失常,二者常同时存在、互为因果、相互促进。HFpEF合并心房颤动患者的治疗策略包括控制心率、控制节律和预防血栓栓塞。控制心率首选β-受体阻滞剂,如不能耐受可选用非二氢吡啶类CCB,必要时可考虑使用胺碘酮。控制节律指通过药物、电转复或射频消融恢复窦性心律,通常需要在综合医院的专科进行治疗。预防血栓栓塞治疗通常使用华法林〔监测国际标准化比率(INR)〕或新型口服抗凝药,建议使用CHA2DS2-VASC和HAS-BLED评分标准,充分评估患者的血栓和出血风险。(4)其他:控制血糖、体质量,适度运动,提高生活质量。
2017年ACC/AHA/HFRS对HFpEF治疗策略的更新建议包括:积极控制收缩压和舒张压;使用利尿剂减轻容量负荷,以改善临床症状;必要时进行冠状动脉重建,以减少缺血对心脏舒张功能的损害;控制心房颤动以改善心衰;推荐合适的HFpEF患者使用醛固酮受体拮抗剂,以降低住院率;不推荐HFpEF患者常规使用硝酸酯类药物或磷酸二酯酶-5抑制剂改善活动耐量或生活质量(见表1)[15]。
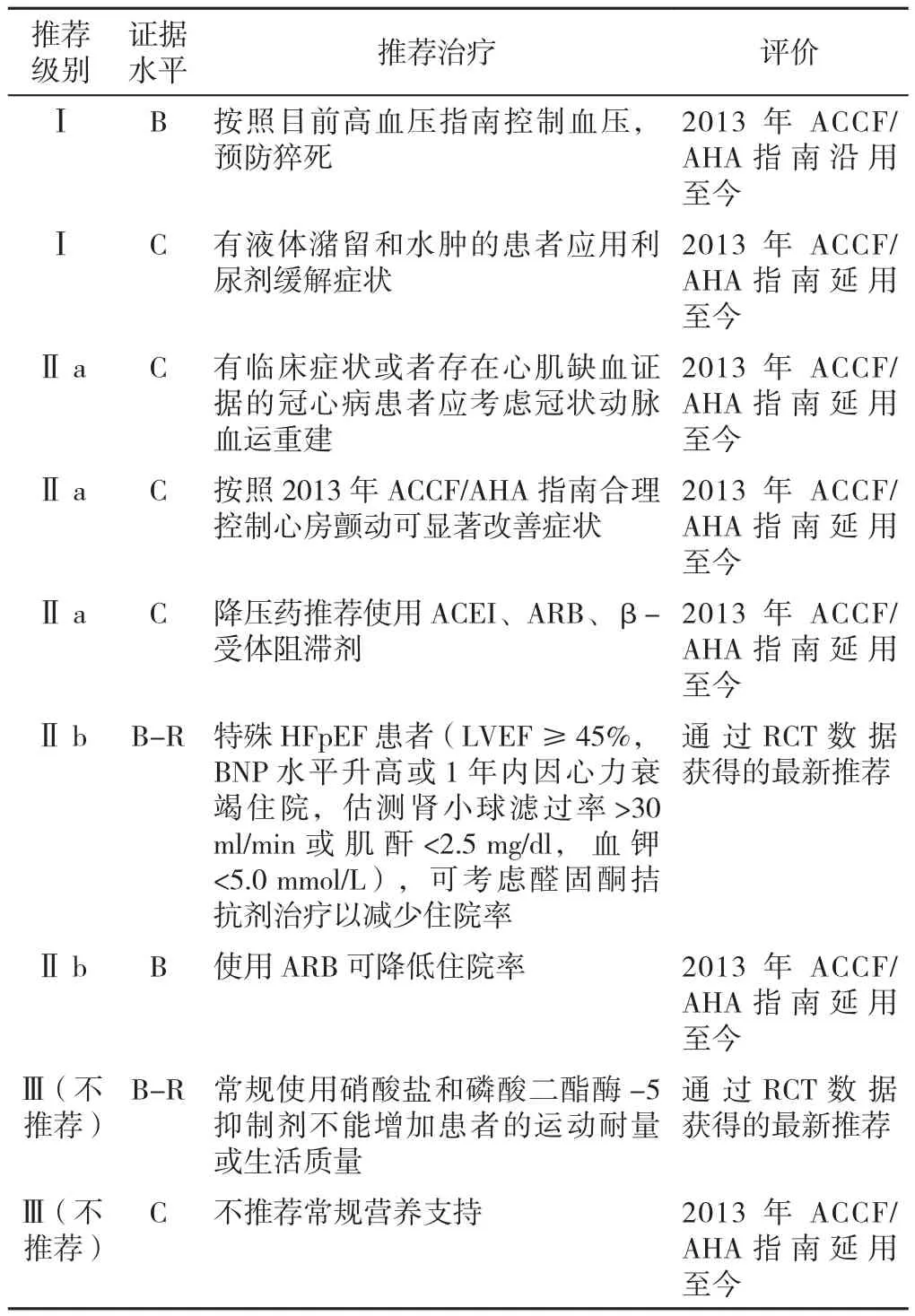
表1 2017年ACC/AHA/HFRS对HFpEF治疗策略的更新内容Table 1 2017 ACC/AHA/HFRS focused update of the 2013 ACCF/AHA Guideline for the management of heart failure with preserved ejection fraction
4 HFpEF治疗进展
4.1 药物治疗 传统心衰治疗药物如ACEI/ARB、β-受体阻滞剂、醛固酮受体拮抗剂、钙拮抗剂、洋地黄类药物等对HFpEF的预后无明显改善。ACEI/ARB 临床试验 CHARM-Preserved研究[20]、I-PRESERVED研究[21]、PEP-CHF研究[22],β-受体阻滞剂J-DHF研究[23]、奈必洛尔的SENIORS[24]及ELANDD 研究[25]、OPTIMIZ-HF研究[26],洋地黄类药物地高辛的DIG-PEF研究[27]等均未取得理想结果。2013年TOPCAT试验[28]研究了螺内酯对HFpEF患者复合终点、心脏猝死和心衰住院的影响,虽然心衰住院人数减少,但复合终点的小幅度降低无统计学意义。2015年NEAT-HFpEF的前瞻性研究显示,硝酸盐没有提高HFpEF患者的运动能力,反而减少了患者的体力活动[29]。
2019年发表的PARAGON-HF研究共纳入4 822例HFpEF患者,结果显示沙库巴曲缬沙坦仅能改善NYHA心功能分级、减缓肾功能恶化,不能降低总心衰住院率和心血管死亡率(P=0.06),但女性和LVEF低的患者可能从中获益[30]。2020年PARAGON-HF研究的最新结果显示,与缬沙坦相比,沙库巴曲缬沙坦可使HFpEF患者NT-proBNP降低19%,在男性和女性以及LVEF较低或较高的患者中表现一致,NT-proBNP的降低预示较低的主要终点事件风险,但是NT-proBNP的变化似乎与初步分析中女性和LVEF较低的患者药物反应性更高的结果不相符,基线NT-proBNP也不能预测药物治疗的效果,因此需要更多研究来验证上述结果[16-17]。
2020年发表的一项研究共纳入5 050例有临床恶化迹象的慢性心衰患者,其中4 316例患者LVEF<40%,在高危心衰患者中,服用维利西呱(vericiguat)的患者因心血管病发生的死亡率或心衰住院率低于服用安慰剂的患者[31]。但该试验纳入患者的平均LVEF为29%,此研究未证明维利西呱能改善HFpEF患者预后。2017年SOCRATESPRESERVED研究[32]结果显示,HFpEF患者接受维利西呱不同剂量治疗12周,主要疗效指标NT-proBNP水平及左心房容积未改变,但患者生活质量得到改善。
2019年发表的DAPA-HF研究[33]是第一个关于钠-葡萄糖共转运蛋白2(SGLT-2)抑制剂对不合并2型糖尿病的HFrEF患者预后影响的研究,结果显示在心衰标准治疗基础上,加用达格列净可显著降低心血管死亡或心衰恶化风险(26%,P=0.00 001)。随后同年发表的DEFINE-HF研究[34]也进一步支持了该结论,对伴或不伴2型糖尿病的HFrEF患者,应用达格列净6~12周均可改善HFrEF患者临床症状和生活质量。SGLT-2抑制剂有希望使HFpEF患者获益,目前正在进行的DELIVER和DETERMINE-Preserved试验将评估达格列净用于HFpEF患者的疗效和安全性,达格列净能否成为第一个改善HFpEF患者预后的药物值得期待。
4.2 非药物治疗 2016年REDUCE LAP-HF研究[35]显示,心房间分流装置(IASD)治疗可降低左心房压力,进而降低HFpEF患者的肺毛细血管楔压,且与基线相比,植入IASD的HFpEF患者在随访6个月时临床症状减轻、生活质量改善、运动能力提高,但这种机械效应能否转化为临床症状和预后的改善需进一步评估。CHAMPION研究[36]显示,植入式肺动脉压力监测可显著降低HFpEF患者再住院风险,该监测装置可用于HFpEF患者的管理,但并非治疗手段。除此之外,运动可改善左心房重构和左心室舒张功能,增加HFpEF患者的运动耐量;控制体质量等非药物治疗可提高患者的生活质量。心脏运动康复治疗可能在HFpEF患者中有效。
5 小结
HFpEF约占心衰总数的50%,其发病率及致死率有逐年上升的趋势。目前还面临着许多问题和挑战:HFpEF的发病机制尚不明确、既往缺乏统一的诊断标准、患者合并症较多、缺乏有效的治疗方法、大量临床试验呈阴性结果等,这些问题需要进一步完善和丰富基础、临床研究,寻找更多的证据,为HFpEF患者提供治疗的依据,以改善其生活质量,降低心血管事件的发生率和病死率。
作者贡献:刘蔚负责文章的构思与设计,论文修订,文章的质量控制及审校,并对文章整体负责、监督管理;尉然负责检索文献、撰写论文。
本文无利益冲突。

