可溶性硅酸钠盐水溶液在流动腐蚀行为中的作用机制研究
郝丽敏
(重庆航天职业技术学院党委办公室,重庆 400021)
硅、氧和金属钠元素构成的化合物总称为硅酸钠盐,分子式为Na·nSiO2,n 为模数[1~3]。硅酸盐应用领域主要集中在建材上,包括各种陶瓷、水泥以及玻璃制品中,都能够用到硅酸钠盐,甚至在建材和耐火材料上也有硅酸钠盐的一席之地,硅酸钠盐还可用于制作人工晶体。考虑到硅酸盐结构的特殊性,已知模数越大的硅酸钠盐,其可溶性越差。硅酸钠(n≤3)为最常见的可溶性硅酸钠盐,而偏硅酸钠和五水偏硅酸钠则不那么常见,这些硅酸钠盐溶于水时呈现出碱性。相比较汽油、硝酸盐、硫酸这类危险系数较高的物品,硅酸钠盐的腐蚀性似乎并没有引起人们的重视[4,5]。但是硅酸钠盐比起这些易燃易爆腐蚀物品,其腐蚀性造成的危害并不小。日常在化工生产和仓库储存中,常常发生硅酸钠盐泄漏的事件,由于防护不当导致的腐蚀性危害同样对生活产生严重的影响[6]。因此需要对可溶性硅酸钠盐水溶液的流动腐蚀作用机制做出进一步研究。
1 材料与方法
1.1 实验仪器及主要试剂
首先选择实验仪器,针对可溶性硅酸钠盐水溶液计量的pH 测定仪,型号PE28,pH 测量区间在0~14 之间。针对实验材料进行金属腐蚀性测试的仪器,型号为HWP04l0S,控温区间在室温达到80℃左右。实验试样选择非复合型7075-T6 的铝片金属材料,材料比例为50mm×20mm×3mm 的复合型金属材料;选择S235JR+CR(1.0037resp.St 37-2)型号的钢片材料,材料比例为50mm×20mm×3mm 的金属材料。实验试剂选择市面常见的硅酸钠盐颗粒,分子式为Na2SiO2,硅酸钠盐模数在2~3 之间;在可溶性水溶液添加五水偏硅酸钠,分子式Na2SiO3·5H2O;选择九水偏硅酸钠制备试剂,分子式Na2SiO3·9H2O。
1.2 应用可溶性硅酸钠盐水溶液进行流动腐蚀
在室温条件下,将(n=2,3)硅酸钠溶于钠和五水偏硅酸钠的水溶液中,待溶液静置10min后,选择6 组准备好的铝片和钢片,分别进行单相流腐蚀、双相流腐蚀以及多相流腐蚀[7]。对实验金属材料试样进行全浸、半浸和悬挂腐蚀,测量实验前材料金属的质量,进一步测量金属材料的悬空状态时表面锈层的厚度,分析可溶性硅酸盐溶液对材料的腐蚀作用。提取可溶性硅酸钠水溶液中存在的Na2SiO3、H2SiO3、O2、Na+、SiO32-、OH-的离子物质,利用离子物质在55℃时与Fe 的氧化反应,检测实验材料在碱性溶液中发生的吸氧反应。对于垢下腐蚀性质进行分析,整合其流动沉积特性[8]。观察实验材料在规定的时间内是否出现腐蚀状态。分别针对三种流动腐蚀状态进行腐蚀试验,对比铝片试样和钢片试样的腐蚀状态,针对半浸状态的试样腐蚀速率进行测量,并以半浸状态作为水平腐蚀顶峰,以此平行对比全浸状态下的实验材料流动腐蚀状态。并对实验材料的结垢速率和质量损失进行计算,通过结垢与质量损失进行流动腐蚀表面失膜速率的测定[9~11]。以实验铝片试样出现腐蚀气液界面为限,对其向周围扩散的腐蚀流动性进行分析,并根据腐蚀流动现象推导出可溶性硅酸钠盐水溶液对实验材料的腐蚀种类。通过吸氧腐蚀还原材料腐蚀阴极表面失膜过程,针对扩散反应蔓延速率进行测量,将液面中气泡迁移对比电子还原反应。利用阳极失去电子氧化对比吸氧腐蚀,腐蚀的过程正负极主要发生如式(1)的化学反应。
对实验材料试样三个实验阶段的表面结构进行分析,可以得到可溶性硅酸钠盐水溶液对铝的腐蚀过程,针对表面腐蚀均匀程度进行分析,利用点灼处理样本表面结构,对样本表面pH 值进行测量。利用样本材料吸氧腐蚀的特性分析其气液界面,并在周围蔓延进行流动腐蚀速率的计算。测试流动腐蚀材料表面钝化膜溶解的速率,当材料试样厚度被流动腐蚀呈现出均匀出现减薄均匀时,对稳定下来的腐蚀反应速率进行计算。实验开始后,腐蚀产物在实验材料试样表面开始大量积累,这在一定程度上会对金属表面的反应速率产生影响,从而造成金属表面反应不均,并进一步加剧实验材料表面点蚀,分析完上述实验过程后,对实验结果进行总结分析。
2 实验结果分析
2.1 测量流动腐蚀材料pH 值变化范围
使用可溶性硅酸钠盐水溶液进行流动腐蚀,监测实验中的流动腐蚀材料pH 值变化范围,如表1 所示。
通过分析表1 中数据可知:当可溶性硅酸钠盐水溶液模数≤3 时,流动腐蚀材料pH 区间维持在11~13.6 范围内,流动腐蚀材料呈现出碱性。当可溶性硅酸钠盐水溶液质量分数为0.1%时,流动腐蚀材料的pH 值在11~12 之间上下波动。当质量分数保持不变时,流动腐蚀材料的溶液的pH 值增加的幅度与随模数的减小相关,且其pH 值减小幅度也会随着溶液内水含量的增加而递减。当可溶性硅酸钠盐水溶液质量分数增加时,流动腐蚀材料的pH 值和溶液pH 趋向一致,稳定在13.3。
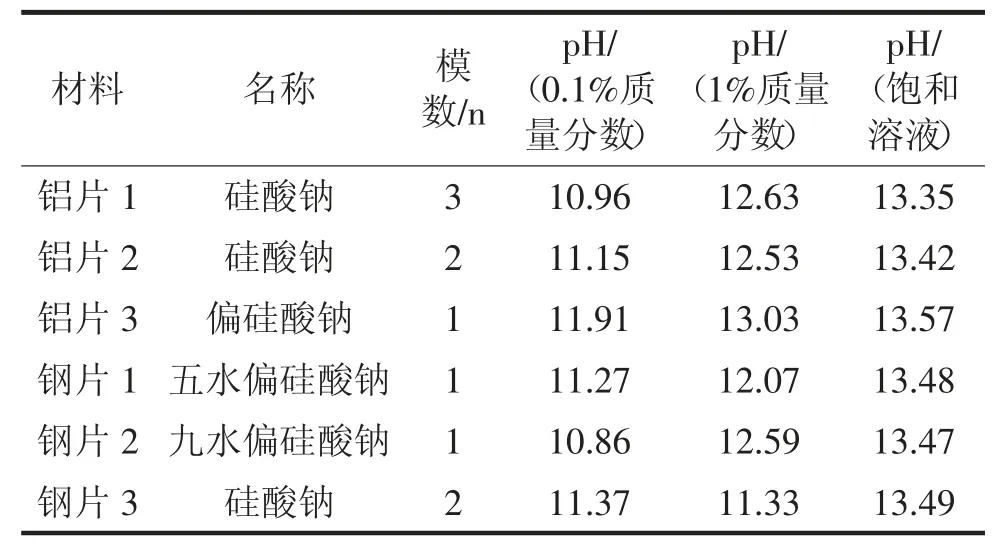
表1 流动腐蚀材料pH 值变化范围
2.2 测定可溶性硅酸钠盐水溶液对流动腐蚀材料特性的影响
使用可溶性硅酸钠盐水溶液,分别对两种流动腐蚀金属材料进行全浸、半浸和悬挂流动腐蚀,得到两种流动腐蚀金属材料,使用可溶性硅酸钠盐水溶液进行流动腐蚀前后的对比结果如图1 所示。

图1 流动腐蚀前后两种流动腐蚀金属材料对比结果
根据图1 中得到的对比结果可以看出:在使用可溶性硅酸钠盐水溶液进行流动腐蚀之后,采用全浸和半浸的方式对钢片金属材料进行流动腐蚀的表面质量与在使用可溶性硅酸钠盐水溶液进行流动腐蚀之前无太大的差别,其钢片金属材料颜色分别在中间和上半部分发生变化,且钢片金属材料表面质量出现不同程度的锈斑。而采用悬挂的方式对钢片金属材料进行流动腐蚀的表面质量与在使用可溶性硅酸钠盐水溶液进行流动腐蚀之前存在较大的差别,其钢片金属材料颜色变化得十分明显,且钢片金属材料表面质量严重受损,并在此基础上出现了结垢现象。
采用全浸和悬空的方式对铝片金属材料进行流动腐蚀的表面质量与在使用可溶性硅酸钠盐水溶液进行流动腐蚀之前无太大的差别,其铝片金属材料颜色较使用可溶性硅酸钠盐水溶液进行流动腐蚀之前加深,且铝片金属材料表面质量腐蚀均匀。而采用半浸的方式对铝片金属材料进行流动腐蚀的表面质量与在使用可溶性硅酸钠盐水溶液进行流动腐蚀之前存在较大的差别,其钢片金属材料表面的钝化膜出现溶解现象,且堆积了大量的流动腐蚀所生成的产物。
2.3 测定流动腐蚀材料表面失膜速率
使用可溶性硅酸钠盐水溶液进行流动腐蚀,计算得到实验中的流动腐蚀材料表面失膜速率,如图2 所示。
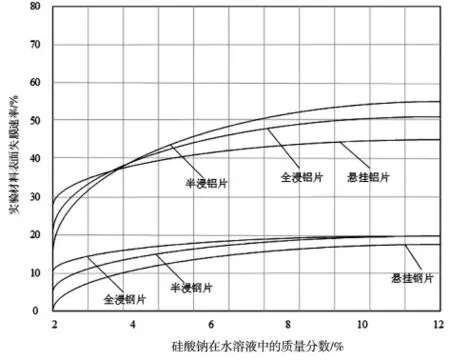
图2 流动腐蚀材料表面失膜速率
分析图2 中数据可知:流动腐蚀表面失膜速率,在可溶性硅酸钠盐水溶液质量分数达到一定程度后趋于稳定,不再随着质量分数的增加而增加。其中实验材料铝片在同试验中受到腐蚀的可能性更高,半浸铝片的流动腐蚀材料表面失膜速率最高为55%。全浸铝片的流动腐蚀材料表面失膜速率最高为50%,悬挂铝片的流动腐蚀材料表面失膜速率最高为45%。全浸钢片和半浸钢片的流动腐蚀材料表面失膜速率最高为20%,悬挂钢片的流动腐蚀材料表面失膜速率最高为18%。
2.4 测定流动腐蚀材料最大腐蚀速率
使用可溶性硅酸钠盐水溶液进行流动腐蚀,计算得到实验中的流动腐蚀材料最大腐蚀速率,如表2 所示。

表2 流动腐蚀材料最大腐蚀速率
根据表2 中的数据可知:硅酸钠在水溶液中的质量分数相同的条件下,随着可溶性硅酸钠盐水溶液模数的降低,两种流动腐蚀金属材料的最大腐蚀速率随之增加。其铝片金属材料的最大腐蚀速率为54.75%,钢片金属材料的最大腐蚀速率为30.57%。
3 实验结果讨论
当硅酸钠的模数≥3 时,可溶性硅酸钠盐的水溶液的流动腐蚀性不强,难以对金属材料造成腐蚀效果。因此,在进行日常运输时,按照普通货物(非腐蚀品)运输即可。当碳酸钠盐的模数≤2 时,可溶性硅酸钠盐的水溶液的流动腐蚀性大幅度提升,其对金属材料的腐蚀的最低质量分数区间为1.5%~4.3%之间。因此,在运输过程中,此类硅酸钠盐的参照标准应当向危险腐蚀性货物靠拢,并对硅酸钠盐的腐蚀性进行标注。对于日常生产、储存和使用硅酸钠盐,应当使用钢制设备或容器进行可溶性硅酸钠盐存储,尽量避免铝制设备和容器。若不可避免将两者置于同一空间内,应当采取悬挂的方式,或者用惰性物质镀在接触面,防止与硅酸钠盐发生流动腐蚀反应。在运输时,铝制容器会与可溶性硅酸钠盐水溶液发生反应,因此,应当保证硅酸钠盐是固体形态。
4 结束语
通过本文研究,得到可溶性硅酸钠盐水溶液在流动腐蚀中会与金属材料发生反应的结果,且流动腐蚀材料pH 值与可溶性硅酸钠盐水溶液的质量浓度相关。今后应当对于多相流的腐蚀规律进行研究,以腐蚀加剧的机制为方向,继续对多相流场下腐蚀的诱发机理进行分析。

