一株野生血红小菇的分离鉴定及液体培养基配方筛选
郭兴 高智涛 范冬茹 张德岩 刘继云 高云虹


摘要 血红小菇(Mycena haematopus(Pers.)P.Kumm.)是珍稀药用真菌,具有多种功能作用。液体菌种是血红小菇产业迈入标准化、规模化、工厂化的必由之路,而碳源、氮源、无机盐、维生素对血红小菇液体培养扩繁菌丝体具有重要影响。通过单因素试验和正交试验相结合,对菌丝含量进行测定,了解菌丝生长情况和各种参数之间的关系。结果显示,血红小菇液体最佳培养基配方为玉米粉40 g/L、蛋白胨4 g/L、KH2PO4 1 g/L、MgSO4 0.7 g/L、NaCl 0.2 g/L、VB1 0.001%、pH 6.5。
关键词 血红小菇;液体培养基;发酵
中图分类号 S646 文献标识码 A 文章编号 0517-6611(2021)22-0065-05
doi:10.3969/j.issn.0517-6611.2021.22.016
开放科学(资源服务)标识码(OSID):
Isolation and Identification of a Wild Mycena haematopus sanguineus and Screening of Its Liquid Medium
GUO Xing,GAO Zhi-tao,FAN Dong-ru et al
(Yichun Branch of Heilongjiang Academy of Forestry, Yichun, Heilongjiang 153000)
Abstract Mycena haematopus(Pers.)P. Kumm is a rare medicinal fungus with multiple functions. Liquid strain is the only way for the industry of Pleurotus sanguineus to be standardized, large-scale and industrialized. Carbon source, nitrogen source, inorganic salt and vitamin have an important influence on the liquid culture and propagation of mycelium of Pleurotus sanguineus.The content of hyphae was determined by combining single factor test and orthogonal test to understand the growth of mycelium and the relationship between the mycelium and various parameters. The results showed that the best liquid medium formula of Pleurotus eryngii was corn flour 40 g/L, peptone 4 g/L, KH2PO4 1 g/L, MgSO4 7 g/L, NaCl 0.2 g/L, VB1 0.001%, pH 6.5.
Key words Mycena haematopus(Pers.)P. Kumm.;Liquid medium;Fermentation
血紅小菇(Mycena haematopus(Pers.)P.Kumm.),又名血柄小菇、红叶小菇,为担子菌亚门(Basidiomycotina)、伞菌目(Agaricales)、白蘑科(Tricholomataceae)、小菇属(Mycena)的腐生菌[1]。初夏至秋季常簇生于腐朽程度较深的阔叶树腐木上,分布于东北、华中等地区。菌盖直径2.5~5.0 cm,幼时圆锥形,逐渐变为钟形,具条纹;幼时暗红色,成熟后稍淡,中部色深,边缘色淡且常开裂呈规则的锯齿状;幼时有白色粉末状细颗粒,后变光滑,伤后流出血红色汁液。菌肉薄,白色至酒红色。菌褶直生或近弯生,白色至灰白色,有时可见暗红色斑点,较密。菌柄长3~6 cm,直径2~3 cm,圆柱形或扁,等粗,与菌盖同色或稍淡,被白色细粉状颗粒,空心,脆质,基部被白色毛状菌丝体[2]。担孢子(7.7~11.1)×(5.8~6.9) μm,Q=1.3~1.8,Qav=1.5 椭圆形至长椭圆形,无色,光滑,薄壁,内含油滴,淀粉质[3]。试验证明血红小菇具有抗癌作用,对小白鼠肉瘤180和艾氏癌的抑制率均高达100%。为了使血红小菇产业迈入标准化、规模化、工厂化,研究液体菌种生产势在必行。液体菌种具有接种方便快速、发菌快、菌龄一致、制种周期短等优点,可以快速提取获得药效成分,提高生产效率,因此具有广阔的应用前景[4-6]。鉴于此,笔者对血红小菇进行液体培养基配方的筛选,旨在为实际生产提供理论的指导。
1 材料与方法
1.1 材料
1.1.1 供试菌株。
野生血红小菇于2020年8月22日采自黑龙江伊春兴安国家森林公园内,编号为YCMH-1。
1.1.2 培养基。
斜面培养基:去皮马铃薯 200.0 g、葡萄糖 20.0 g、琼脂 20.0 g,纯水定容至 1 000 mL[7]。
液体培养基:葡萄糖 30 g/L、蛋白胨3 g/L、硫酸镁0.05 g/mL、磷酸二氢钾1 g/mL[8]。
1.1.3 试剂。
试验所使用的主要化学试剂均为国产分析纯或食品级:葡萄糖、蔗糖、麦芽糖、可溶性淀粉、蛋白胨、酵母膏、尿素、硫酸铵、KH2PO4、MgSO4、CaCO3、FeSO4、ZnSO4、NaCl、HCl、NaOH、VC、VB1、VB2、VB6。玉米粉、黄豆粉经烘干粉碎过100目。
1.1.4 仪器与设备。
主要仪器设备有超净工作台(东莞雅宁净化科技有限公司)、电热鼓风干燥箱(广州市旭朗机械设备有限公司)、BSD-YF3200智能精密型摇床(上海博迅医疗生物仪器股份有限公司)、YXQ-30SII高压灭菌器(济南杰岛分析仪器有限公司)、AUW120D电子天平(日本岛津)。
1.2 方法
1.2.1 菌种活化与接种。
制作试管斜面培养基,灭菌条件设置为121 ℃、30 min;将保藏的菌种进行活化,无菌条件下进行扩繁,放入(25±1)℃的恒温培养箱内进行培养[9]。
在无菌条件下,取血红小菇菌种的10个菌块接入到盛有150 mL液体培养基的250 mL三角瓶中,在摇床上以25 ℃、150 r/min的条件培养20 d[10]。
1.2.2 ITS序列分析。
將纯化后的试管菌种送生工生物工程(上海)股份有限公司进行ITS全序列测定。采用SK8259(真菌)试剂盒提取基因组DNA,选用真菌鉴定通用引物(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增[11]。采用25 μL PCR反应体系:Template(基因组DNA 20~50 ng/μL)0.5 μL;10×Buffer(with Mg2+)2.5 μL;dNTP(各2.5 mmol/L)1.0 μL;Taq酶0.2 μL;F(10 μmol/L)0.5 μL;R(10 μmol/L)0.5 μL;加双蒸水至25 μL。反应程序为94 ℃预变性4 min,(94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min)30个循环,72 ℃延伸10 min,4 ℃终止反应。将测得的ITS序列用DNAMAN进行拼接,将ITS序列提交GenBank数据库进行BLAST比对[12]。
1.2.3 生物量测定方法。
菌丝体生物量的测定如下:取培养结束的血红小菇液体培养基,将培养基和菌丝体一起倒入滤网上,并用纯水反复冲洗,再将菌丝体置于培养皿中,放入70 ℃烘箱中至恒重后,称重[13]。
1.2.4 液体发酵培养基的优化。
进行适宜碳源、氮源、无机盐、维生素、pH的筛选,每试验重复3次。
1.2.4.1 碳源试验。
在配置液体培养基时,使用碳源分别为30 g/L的葡萄糖、蔗糖、麦芽糖、可溶性淀粉、玉米粉进行碳源单因素试验。
将筛选出的最佳碳源按含10、20、30、40、50 g/L,分别配制液体培养基,进一步筛选碳量试验。
1.2.4.2 氮源试验。
在配置液体培养基时,使用氮源分别为3 g/L的蛋白胨、酵母膏、尿素、硫酸铵、黄豆粉进行氮源单因素试验。
将筛选出的最佳氮源按含1、2、3、4、5 g/L,分别配制液体培养基,进一步筛选氮量试验。
1.2.4.3 无机盐及不同添加量试验。
在配置液体培养基时,使KH2PO4的添加量分别为0.5、1.0、1.5、2.0、2.5 g/L。
在配置液体培养基时,使MgSO4的添加量分别为0.1、0.3、0.5、0.7、0.9 g/L。
另配制5组液体培养基,额外分别添加0.3 g/L FeSO4、CaSO4、NaCl、ZnSO 并与空白液体培养基进行比较。
1.2.4.4 维生素试验。
在液体培养基中分别添加0.001% 的VC、VB1、VB2、VB6。
1.2.4.5 pH试验。
用HCl、NaOH将液体培养基的 pH 分别调为6.0、6.5、7.0、7.5、8.0。
1.2.4.6 正交优化。
在单因素试验结果上,以碳源、氮源、无机盐、维生素为影响因子,建立 L9(34)正交表(表1)。
1.2.5 数据处理及统计分析。
采用Excel 2010、SPSS 10.0进行数据处理和统计分析。
2 结果与分析
2.1 野生血红小菇的形态特征
所采集的YCMH-1为血红小菇(图1),菌盖直径2.8 cm,钟形,具条纹;幼时暗红色,成熟后稍淡,中部色深,边缘色淡且常开裂呈规则的锯齿状;幼时有白色粉末状细颗粒,后变光滑,伤后流出血红色汁液。菌肉薄,白色至酒红色。菌褶直生或近弯生,白色至灰白色,有时可见暗红色斑点,较密。菌柄长3~6 cm,直径2~3 cm,圆柱形或扁,等粗,与菌盖同色或稍淡,被白色细粉状颗粒,空心,脆质,基部被白色毛状菌丝体。
2.2 血红小菇的菌株鉴定及系统发育
菌株扩增的ITS片段经测序得到一个长度为661 bp的序列(TGCGGAAGGAT
CATTATT-GAATACGATTGGGACTGATGCTGGCTCTTCACTG-
AGCATGTGCTCGTCTCATCTATTTATCTTCTCTTGTGCACAT-
CTTGTGGTCTTGAATTGAAACCTTTCGCATTCGTGCGGTTTG-
GGAGATTGTTAAACCTTCTCCTGCTTCATTCAAGGTCATGTT-
TTCATATACACTATAAAGTTACAGAATGTCTTTTAACGATTG-
CGCTTGTCGTAGTCATTAAACCTATACAACTTTCAGCAACG-
GATCTCTTGGCTCTCCTATCGATGAAGAACGCAGCGAAATG-
CGATAAGTAATGTGAATTGCAGAATTCAGTGAATCATCGAA-
TCTTTGAACGCACCTTGCGCCCTTTGGTATTCCGAAGGGCA-
TGCCTGTTTGAGTGTCATTAAATTATCAACCTTGCTCGCTTT-
TACTAGCTTGAGTTAGGCTTGGATGTGAGGGCTTGCTGGCT-
TCCTTCAGTGGATGGTCTGCTCCCTTTAAATACATTAGTGGG-
ATCTCTTGTGGACCGTCACTTGGTGTGATAATTATCTATGCC-
TTGAGACTTTGAAGCAAACTAATGGGAATCCGCTTATAACC-
GTCTTCGGACAATTAATGACTATTTGACCTCAAATCAGGTA-
GGACTACCCGCTGAACTTAAGCATATC),電泳见图2。
将此结果在NCBI 上BLAST比对,结果见表2。由表2可知,最大匹配值为1 114~1 21 对比程度大;覆盖率最高可达100%;E值为0,说明对比完成匹配;相似性为99.39%~99.85%,表明对比结果相似性极高。综合得出,在10个对比结果中,YCMH-1与10组血红小菇(Mycena haematopus)相似程度较高,可以初步确定YCMH-1为血红小菇。
2.3 碳源试验结果
从表3可以看出,血红小菇菌丝体以玉米粉为碳源的吸收利用效果显著高于其他碳源,菌丝体生物量达到6.6 g/L,与其他组存在显著性差异。添加蔗糖的菌丝生物量次之,为4.5 g/L。因此,玉米粉为血红小菇液体培养基的最佳碳源。
将筛选出的最佳碳源玉米粉按含10、20、30、40、50 g/L分别配制液体培养基,开展进一步筛选碳量试验。从图3可以看出,当培养基中玉米粉添加量在10~40 g/L时,菌丝体生物量逐渐增加,在玉米粉添加量为40 g/L时,菌丝体生物量达到最大,为7.8 g/L。而当玉米粉添加量继续增加到5 g/L时,菌丝体生物量反而下降。
2.4 氮源试验结果
从表4可以看出,血红小菇菌丝体以蛋白胨为氮源的吸收利用效果好于其他4种氮源,菌丝体生物量为4.1 g/L;另外血红小菇菌丝体对酵母膏的利用效果也较好,菌丝体生物量为3.6 g/L;而对尿素和硫酸铵几乎不能利用。因此,蛋白胨为血红小菇液体培养基的最佳氮源。
将筛选出的最佳氮源蛋白胨按含1、2、3、4、5 g/L分别配制液体培养基,进一步筛选氮量试验。从图4可以看出,当培养基中蛋白胨浓度在1~4 g/L时,菌丝体生物量逐渐增加,在蛋白胨添加量为4 g/L时,菌丝体生物量达到最大,为4.8 g/L。而当蛋白胨添加量继续增加到5 g/L时,菌丝体生物量反而下降。
2.5 无机盐及其添加量试验结果
从图5可以看出,血红小菇菌丝体的生物量随KH2PO4添加量的逐渐增加出现先增加后降低现象,在KH2PO4添加量为0.5~1.0 g/L时,血红小菇菌丝体的生物量随KH2PO4添加量的逐渐增加而提高;在KH2PO4添加量为1.0 g/L时,菌丝体生物量最多,为4.1 g/L;而在KH2PO4添加量为1.0~2.5 g/L时,血红小菇菌丝体的生物量随KH2PO4添加量的逐渐增加而降低。因此,血红小菇液体培养基中KH2PO4的最佳添加量为1.0 g/L。
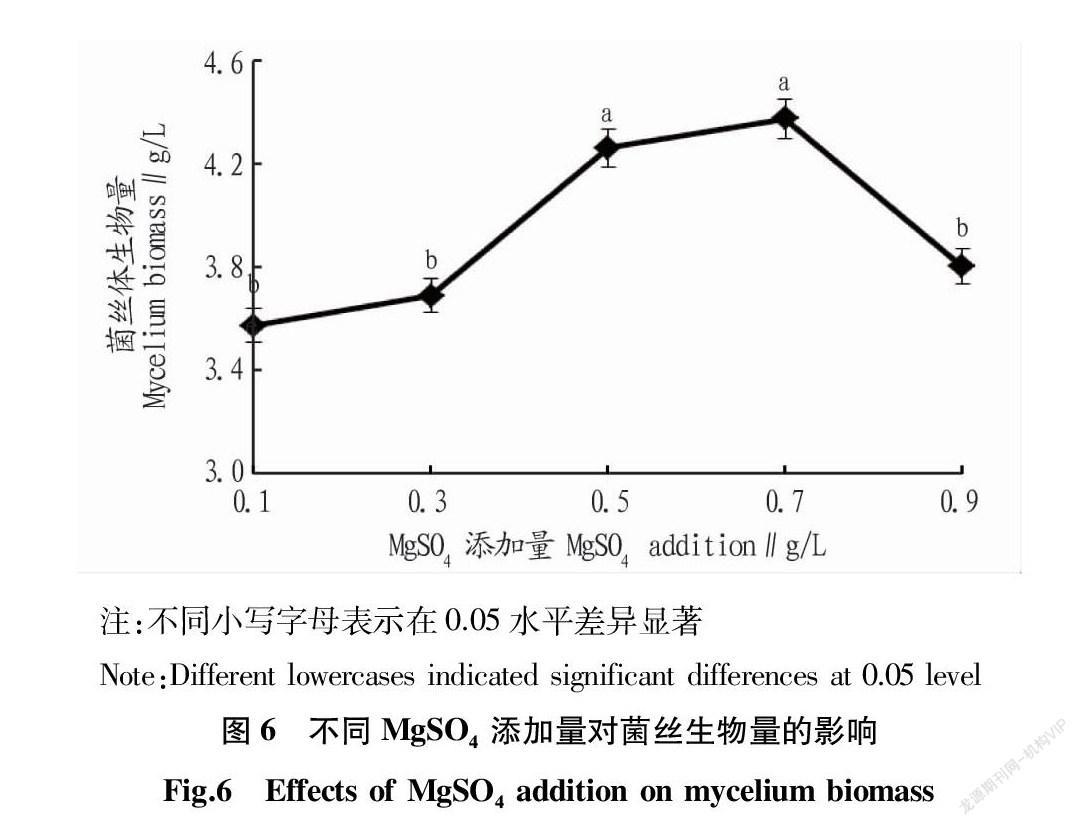
从图6可以看出,当MgSO4添加量在0.1~0.3 g/L时,血红小菇的菌丝体生物量随KH2PO4添加量的变化不大;当MgSO4添加量在0.3~0.7 g/L时,血红小菇的菌丝体生物量随KH2PO4添加量的逐渐增加而提高;当MgSO4添加量在0.7 g/L时,血红小菇的菌丝体生物量达到最大,为4.2 g/L;当MgSO4添加量在0.7~0.9 g/L时,血红小菇的菌丝体生物量随KH2PO4添加量的逐渐增加而降低。因此,血红小菇液体培养基中MgSO4的最佳添加量为0.7 g/L。
从表5可以看出,在各无机盐浓度均为0.3 g/L时,添加了NaCl的血红小菇菌丝体生物量为6.1 g/L,另外添加了FeSO4、CaCO3的血红小菇菌丝体生物量分别为4.4和4.2 g/L,均高于空白对照的4.1 g/L,而添加了ZnSO4的菌丝体生物量仅为0.3 g/L,对血红小菇菌丝体的生长有抑制作用。因此,血红小菇液体培养基中NaCl为最佳无机盐。
2.6 不同维生素对发酵的影响
由表6可以看出,在各维生素浓度均为0.001%时,添加VB1对血红小菇菌丝体生长具有促进作用,效果显著高于其他维生素,血红小菇菌丝体生物量为5.1 g/L;其次为添加VC的血红小菇菌丝体生物量为4.4 g/L;而添加了VB2、VB6的血红小菇菌丝体生物量低于空白对照,表明VB2、VB6血红小菇菌丝体生长有抑制作用。因此,血红小菇液体培养基中VB1为最佳维生素。
2.7 pH对发酵的影响
从图7可以看出,血红小菇菌丝体在pH 6.0~8.0时均可以生长。pH 6.5时菌丝生长速度最快,菌丝体生物量最多,为4.4 g/L,培养液颜色澄清、菌丝球生长势强、大小均匀;pH 7.0时菌丝生长情况较好;当pH在6.0~6.5时,菌丝体生物量随着pH的升高而提高;当pH在6.5~8.0时,菌丝体生物量随着pH的升高而降低;在pH<6.5和pH>7.5时,菌丝体生物量均低于空白对照。因此,血红小菇液体培养基的最佳pH为6.5。
2.8 优化正交试验
选取碳源为玉米粉,氮源为蛋白胨,无机盐为NaCl,维生素为VB1作为影响因子,建立L9(34)正交表,KH2PO4和MgSO4添加量分别1和0.7 g/L。
从表7可以看出,对菌丝体生物量影响最大的是碳源,其次是氮源,再次是无机盐,最后是维生素,最佳组合是A3B3C2D 即玉米粉40 g/L、蛋白胨4 g/L、KH2PO4 1 g/L、MgSO4 0.7 g/L、NaCl 0.2 g/L、VB1 0.001%。
3 结论与讨论
随着科技的进步,工厂化生产将成为食用菌产业发展的新方向,而体液菌种生产正是工厂化所必需的。
碳源和氮源是微生物生长所需的最基本营养因子[14]。碳源既是构成菌体细胞的碳骨架,也可为菌体活动提供能量来源,氮源则是菌体合成蛋白质、核酸、维生素等必需的原料[15]。
在碳源试验中,血红小菇菌丝体以玉米粉为碳源的吸收利用效果显著高于其他碳源,玉米粉在食用菌液体发酵培养中的作用已被相继报道,玉米粉为复合碳源,同时含有植物激素中的玉米素[16]、某些生长因子和氮源,营养丰富,能促进菌丝体生长[17],另因玉米粉溶液的黏度比较大,增加了发酵液的黏性拉力,使得形成的菌丝球易被发酵液机械性拉开而小型化,产生的菌丝球数量多,而大量的生长点更有利于菌丝体生物量的积累。在碳源浓度试验中,玉米粉的添加量为30 g/L效果最佳,当继续增加玉米粉的浓度时,血红小菇的菌丝生物量反而降低,分析原因可能是玉米粉的黏度过大,影响了发酵液的流动性,从而导致血红小菇的菌丝体生物量减少[18]。
在氮源试验中,血红小菇对有机氮和无机氮之间的利用差异很大,可能是因为有机氮富含蛋白质、脂肪酸、维生素、游离氨基酸等,且氨基酸的种类齐全。而尿素虽然属于有机氮,但尿素仅能给生物提供氨态氮,所以效果较差。另一方面可能是由于硫酸铵会使液体培养基的pH发生严重变化,影响了菌丝生长。因此,蛋白胨是血红小菇液体培养基的最佳氮源。
在无机盐试验中,血红小菇液体培养基中KH2PO4的最佳添加量为1 g/L,MgSO4的最佳添加量为0.7 g/L,另额外添加0.3 g/L的NaCl对血红小菇菌丝生长有显著促进作用。在维生素试验中,血红小菇液体培养基中添加0.001%VB 对菌丝生长有显著促进作用。不同pH对血红小菇菌丝的生长试验结果表明,血红小菇液体培养基的最佳pH为6.5。
通过单因素试验和正交试验相结合,对菌丝含量进行测定,了解菌丝生长情况以及和各种参数之间的关系,确定了血红小菇液体培养基,意在为血红小菇的工厂化、规模化、标准化生产打下基础。该研究显示,血红小菇液体最佳培养基配方为:玉米粉40 g/L、蛋白胨4 g/L、KH2PO4 1 g/L、MgSO4 0.7 g/L、NaCl 0.2 g/L、VB1 0.001%。
参考文献
[1] 刘旭东.中国野生大型真菌彩色图鉴[M].北京:中国林业出版社,2002.
[2] 李玉,李泰辉,杨祝良,等.中國大型菌物资源图鉴[M].郑州:中原农民出版社,2015.
[3] 娜琴.中国小菇属的分类及分子系统学研究[D].长春:吉林农业大学,2019.
[4] 廖浩锋,周振辉,陈东梅,等.食用菌工厂化栽培中菌种扩繁的质量控制浅析[J].中国食用菌,2019,38(1):16-20.
[5] 王杰,谌金吾.食用菌液体菌种技术优势、瓶颈及关键技术分析[J].食用菌,2019,41(1):4-7.
[6] 周峰,李巧珍,杨仁智,等.香菇液体菌种与固体菌种的生产成本和使用效果分析[J].食药用菌,2017,25(3):199-20 204.
[7] 黄春燕,宫志远,刘路明,等.不同碳氮源对金针菇液体菌种培养的影响[J].山东农业科学,2020,52(11):138-140.
[8] 郭兴,刘继云,李占君,等.元蘑液体培养基配方筛选[J].食用菌,2019,41(4):40-4 44.
[9] 秦影,刘娟,周学峰,等.适于吉林地区的6株榆黄蘑液体菌种品比试验[J].天津农业科学,2020,26(12):23-2 29.
[10] 王欢,娄玲,步洪石,等.叶生小皮伞的液体发酵工艺优化[J].北方园艺,2020(22):127-131.
[11] 岳万松,刘绍雄,郭相,等.一株野生紫丁香蘑的分离鉴定及其菌种扩繁技术初探[J].食用菌,2020,42(4):29-32.
[12] 余金凤,陈正启,周汐,等.云南省美味牛肝菌的遗传多样性分析[J].北方园艺,2018(6):139-144.
[13] 刘运伟,郭兴.黑皮鸡枞菌液体培养基配方筛选[J].中国林副特产,2020(4):23-25.
[14] 陈伟,冯欢,欧江,等.蜜环菌液体培养基碳氮源的筛选和优化[J].西北农林科技大学学报(自然科学版),2020,48(9):128-136.
[15] 刘宇,龚思慧,彭楠,等.蜜环菌液态发酵培养基及补料分批发酵工艺的优化[J].食品与发酵工业,201 42(5):187-19 197.
[16] 王言,余昌霞,曹晖,等.四种植物激素对刺芹侧耳和金针菇菌丝生长的影响[J].食用菌学报,201 22(4):23-26.
[17] 谭一罗,苏文英,王朝晖,等.工厂化金针菇菌株液体培养基的筛选和优化[J].食品与发酵科技,2019,55(1):35-37,43.
[18] 吴琪,张宇慧,苏荣荣,等.响应面法优化巴西蘑菇液体培养基的研究[J].中国农业科技导报,2019,21(3):152-160.

