甲基营养型芽孢杆菌对疮痂链霉菌的生防潜力
许子璇,吴达仁,2,王建宇,周 波,李 健,2,苏国成
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.福建省海洋功能食品工程技术研究中心,福建 厦门361021;3.山东农业大学生命科学学院,山东 泰安 271018)
0 引言
疮痂链霉菌(Streptomycesscabies)是马铃薯疮痂病的病原菌,作为革兰氏阳性、丝状、腐生放线菌,其菌丝尖端释放的孢子可在根际土壤、种子中传播,并通过茎块伤口、皮孔等侵染甜菜、萝卜、马铃薯等多种植物[1]。疮痂链霉菌能够产生黑色素、灰色气生菌丝和孢子螺旋链[2],并随着染病马铃薯的生长发育,链霉菌会影响其组织扩张,导致其呈现软木状表皮坏死性病变,最终使马铃薯表面形成凸起的硬癍[3]。染病的马铃薯在清洗过程中不易被处理干净,这不仅会导致加工成本增加,还严重降低其经济价值。2015年,我国农业部启动马铃薯主粮化战略,为满足日益增长的粮食需求,培育优质无病害的马铃薯是关键。马铃薯疮痂病在我国各大马铃薯产区普遍存在[4-7],但对其防治手段有限,目前主要依赖化学防治手段[8],这种手段存在农药残留、药效低、耐药性强、土壤污染等问题[9]。因此,近年来研究热点主要集中在生物防治,利用土壤微生物的拮抗特性开发生防菌剂[10-12],可以实现土壤生态体系的改良和病害的防治,是绿色、环保、高效的防治手段[13]。目前,有效针对马铃薯疮痂链霉菌的生防菌研究较少,仍未开发出可以代替化学农药且低毒、安全、高效的生防菌剂。
芽孢杆菌在植物根际土壤中广泛存在,它可以产生具有高度抗性的内生孢子[14],是开发生防菌剂的重要来源。目前,已有多种芽孢杆菌被报道,如解淀粉芽孢杆菌、枯草芽孢杆菌、多粘芽孢杆菌、贝莱斯芽孢杆菌等,它们可通过分泌抗菌代谢产物来抑制食源性病害[15-18],但对于土壤来源的甲基营养型芽孢杆菌(Bacillusmethylotrophicus)的研究相对较少。甲基营养型芽孢杆菌是2010年由Madhaiyan等[19]在水稻根际土壤中分离报道的新菌种,其对葡萄霜霉病[20]、葡萄灰霉病[21]、黄瓜炭疽病[22]、罗汉果斑枯病[23]、梨黑斑病[24]、西瓜枯萎病[25]等多种植物病害有抑制作用,对大肠杆菌、金黄色葡萄球菌等食源性致病菌也有抑菌作用[26],具有开发生防菌剂的潜力。
本实验探究了2种土壤来源的甲基营养型芽孢杆菌在不同条件下对马铃薯疮痂链霉菌的拮抗效果,测试其发酵上清液的最佳发酵时间以及经不同温度、紫外照射、pH值、蛋白酶处理后的稳定性,并与市售农药进行对比,明确其体外急性细胞毒性作用和抑菌效果,以评估其作为生防菌剂的潜力。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
病原菌:疮痂链霉菌(AMCC400023)[27]。拮抗菌:SJ80、SJ81甲基营养芽孢杆菌,山东农业大学资源与环境微生物实验室。LO2正常肝脏细胞,大白鼠肾上腺髓质嗜铬瘤细胞PC12,集美大学食品与生物工程学院。
LB培养基(g/L):胰蛋白胨10,氯化钠10,酵母粉5,琼脂粉20,pH=7.0~7.5。放线菌液体培养基,海博生物有限公司。
1.1.2 主要试剂
噻唑兰(MTT),南京奥多福尼生物科技有限公司;DMEM培养基、磷酸缓冲液(PBS)、双抗(PS),美国Hyclone公司;胎牛血清(FBS),澳洲GEMINI公司;咯菌腈(fludioxonil),瑞士先正达作物保护有限公司;辛菌胺醋酸盐,山西美源化工有限公司;其余试剂均为国产分析纯。
1.2 实验方法
1.2.1 菌株形态观察
将拮抗菌培养于LB固体培养基中,用革兰氏染色法处理拮抗菌后,在光学显微镜下观察菌体形态。
1.2.2 拮抗菌发酵上清液制备
挑取单菌落接种于装有50 mL LB液体培养基的250 mL三角瓶中,37 ℃、180 r/min振荡培养12 h,得到种子液。按1%接种量将种子液接种至装有20 mL LB液体培养基的500 mL三角瓶中,于37 ℃、180 r/min恒温振荡培养48 h。将培养好的发酵液12 000 r/min离心10 min,收集上清液,用0.22 μm滤膜过滤后,4 ℃ 保存待用。
1.2.3 病原菌孢子悬浮液制备
挑取一环活化好的疮痂链霉菌,紧密地划在高氏一号培养基上,28 ℃ 恒温静置培养2~3 d。吸取无菌水于平板上,用刀片轻轻刮下表面孢子,少量多次冲洗培养基表面孢子,收集至50 mL离心管中,4 ℃保存待用。
1.2.4 拮抗物质发酵时间优化
将2株拮抗菌连续6 d在同一时间接种于LB液体培养基中,在37 ℃、180 r/min条件下恒温培养,每隔24 h取一次样品,采用牛津杯法测定抑菌直径,每组重复3次。
1.2.5 拮抗菌发酵产物稳定性实验
牛津杯法抑菌试验:在放线菌固体培养基表面涂布200 μL病原菌孢子悬浮液[28],至表面没有明显水分后,将无菌牛津杯垂直插入培养基表面,每孔加入200 μL样品,28 ℃ 恒温静置培养48 h后,测量抑菌圈直径,计算抑菌率。计算公式为:抑菌率/%=(1-d对照-d样品/d对照)×100,其中,d为抑菌圈直径。
参照Huang等[15]的方法对发酵上清液稳定性进行实验。
1)温度稳定性。将拮抗菌发酵上清液分别在50,60,70,80,90,100,121 ℃条件下处理30 min,冷却后采用牛津杯法测定抑菌直径,以未处理的发酵上清液为对照,每组重复3次,计算抑菌率。
2)紫外照射稳定性。参照文献[29],将拮抗菌发酵上清液分别置于15 W紫外灯下照射6,12,24 h,通过牛津杯法测定抑菌直径,以未处理的发酵上清液为对照,每组重复3次,计算抑菌率。
3)pH值稳定性。将拮抗菌发酵上清液用1 mol/L HCl或1 mol/L NaOH调整pH值为1~13,静置24 h后调回原始pH值,通过牛津杯法测定抑菌直径,以未处理的发酵上清液为对照,每组重复3次,计算抑菌率。
4)蛋白酶稳定性。选择0.1,0.5,1.0 mg/L的胰蛋白酶和碱性蛋白酶处理发酵上清液,以1∶50的比例加入发酵上清液,37 ℃水浴2 h,90 ℃灭活蛋白酶,冷却至室温后用牛津杯法测定抑菌直径,以酶液为空白组,以未处理的发酵上清液为对照组,每组重复3次,计算抑菌率。
1.2.6 拮抗菌粗提物细胞毒性试验
利用含体积分数1%双抗(青霉素、链霉素)和体积分数10%胎牛血清的DMEM高糖培养基,在二氧化碳培养箱分别培养LO2细胞与PC12细胞,恒温 37 ℃,二氧化碳体积分数为5%。
将2种拮抗菌发酵上清液用等体积乙酸乙酯萃取3次,萃取剂合并后真空浓缩,得到乙酸乙酯浸提物,用适量甲醇复溶并稀释至不同浓度,用0.22 μm滤膜过滤后4 ℃ 保存待用。SJ80样品作用的质量浓度分别为50,100,150,200,250,300,350 mg/L;SJ81样品作用的质量浓度分别为25,50,5,100,125,150,175,200 mg/L。以辛菌胺醋酸盐[30]和咯菌腈[8]2种农药作为对照进行实验,按照推荐使用浓度选择辛菌胺醋酸盐36 mg/L(稀释500倍)、咯菌腈16.7 mg/L(稀释1 500倍)。此外,设一个高浓度组辛菌胺醋酸盐180 mg/L(稀释100倍)、咯菌腈167 mg/L(稀释150倍)作为参考。
参照肖宝平等[31]的MTT法测定体外急性细胞毒性,取对数生长期的LO2细胞制成均匀单细胞悬液,以1×104个/孔铺至96孔板,100 μL/孔,置于培养箱培养12 h,待细胞贴壁后,吸弃旧培养基,加入不同浓度粗提物或药品,继续培养24 h后,每孔换100 μL新培养基,并加入15 μL 0.5 g/L的噻唑兰,37 ℃ 孵育4 h后吸弃上清液,每孔加150 μL DMSO,震荡10 min,在490 nm处检测吸光度值。每个样品做6个平行,设定DMSO为空白组,甲醇为溶剂对照组。PC12细胞实验方法同上,计算细胞活力公式如下:细胞活力/%=(A样品-A空白)/(A溶剂-A空白)×100,其中,A为吸光度值。
1.2.7 农药对比试验
选择1.2.6中质量浓度为50,100,150,200 mg/L的SJ80粗提物,质量浓度为50,75,100,125 mg/L的SJ81粗提物,以及4个浓度的农药,用牛津杯法比较抑菌活性,每组重复3次,计算抑菌率。
1.2.8 数据处理与分析
数据以SPSS statistics 17.0软件进行处理,采用单因素方差分析(ONEWAY-ANOVA)检验其相关性和显著性,P<0.05被认为具有统计学意义。
2 实验结果
2.1 菌落形态
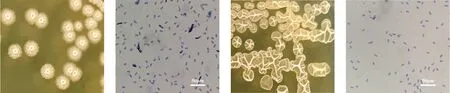
将2株拮抗菌接种在LB固体培养基上,于37 ℃ 恒温静置培养2 d,观察菌落形态和革兰氏染色后的显微形态(1 000倍),结果如图1所示。可见,2株菌形态有明显差异,SJ80单菌落呈圆形,边缘粗糙,中间有褶皱状圆形凸起,干燥无光泽,不透明 (见图1a );SJ81单菌落大,形状不规则,边缘较光滑,中间有不规则褶皱凸起,表面无光泽,干燥 (见图1c );2株菌在显微镜下观察均呈蓝紫色短杆状(见图1b、图1d),均为革兰氏阳性菌。
2.2 发酵时间优化
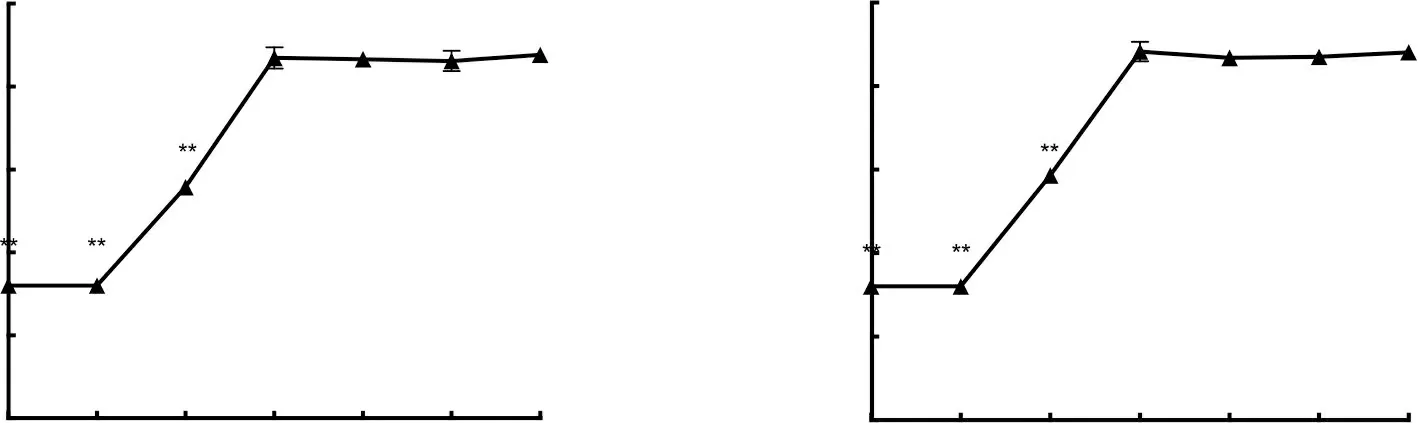
如图2所示,在1~3 d内,2株拮抗菌随着发酵时间的增加,抑菌圈直径显著增加(P<0.01);在4~6 d内,发酵液的抑菌效果逐渐趋于平缓,不再提高。因此,2株拮抗菌活性物质在发酵3 d达到饱和,最佳发酵时间为3 d。
2.3 温度稳定性
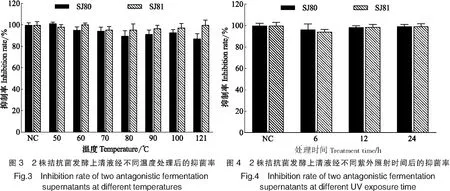
如图3所示,2种发酵上清液经50~121 ℃ 处理后,抑菌率均高于90%,与未经处理的对照组间没有显著性差异(P>0.05),说明2种发酵上清液的活性物质在高温下不会失活,对温度不敏感,具有较强的耐热性。
2.4 紫外照射稳定性
如图4所示,SJ80发酵上清液经紫外照射6,12,24 h后的抑菌率分别为96.23%,98.5%,99.3%,SJ81发酵上清液的抑菌率分别为94.22%,98.64%,99.25 %,2种发酵上清液抑菌活力均在90% 以上。与未经处理的对照组相比,抑菌圈直径均无显著性差异(P>0.05),表明2株拮抗菌的活性物质对紫外照射不敏感,在紫外线下较稳定。
2.5 pH值稳定性
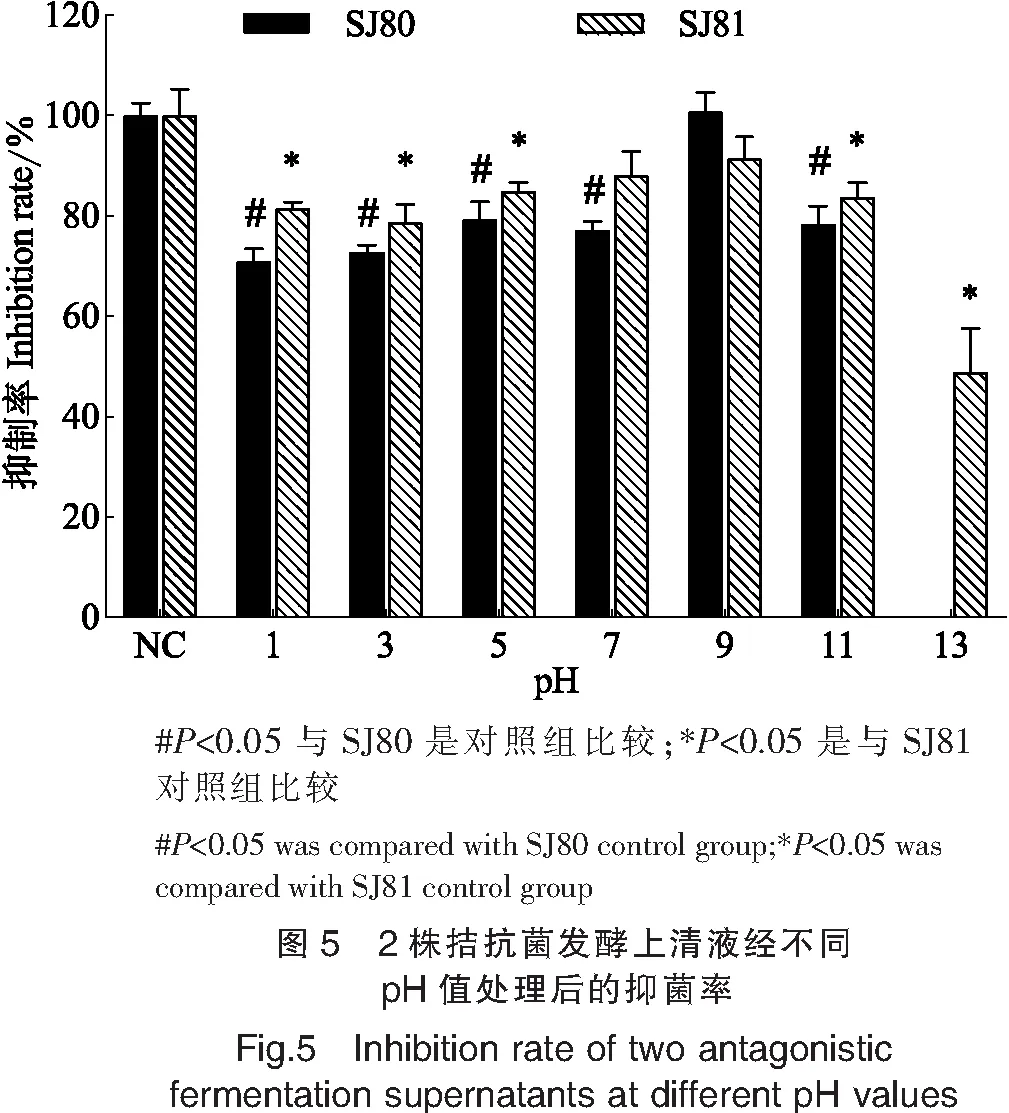
如图5所示,SJ81发酵上清液在pH=1~13时均有抑菌活性,在pH=7,9时抑菌率达到88%,91%,与未经处理的对照组无显著性差异,其余pH值条件下与对照组有显著性差异(P<0.05);SJ80发酵上清液在pH=1~11时均有抑菌活性,在pH=13时抑菌率为0,其中pH=9时抑菌率高达100%,与对照组无显著性差异,在其余pH值条件下抑菌率均小于80%,与对照组有显著性差异(P<0.05)。综上可得,2株拮抗菌发酵上清液在弱碱条件下抑菌活性较高,强碱或偏酸条件下抑菌活性降低。
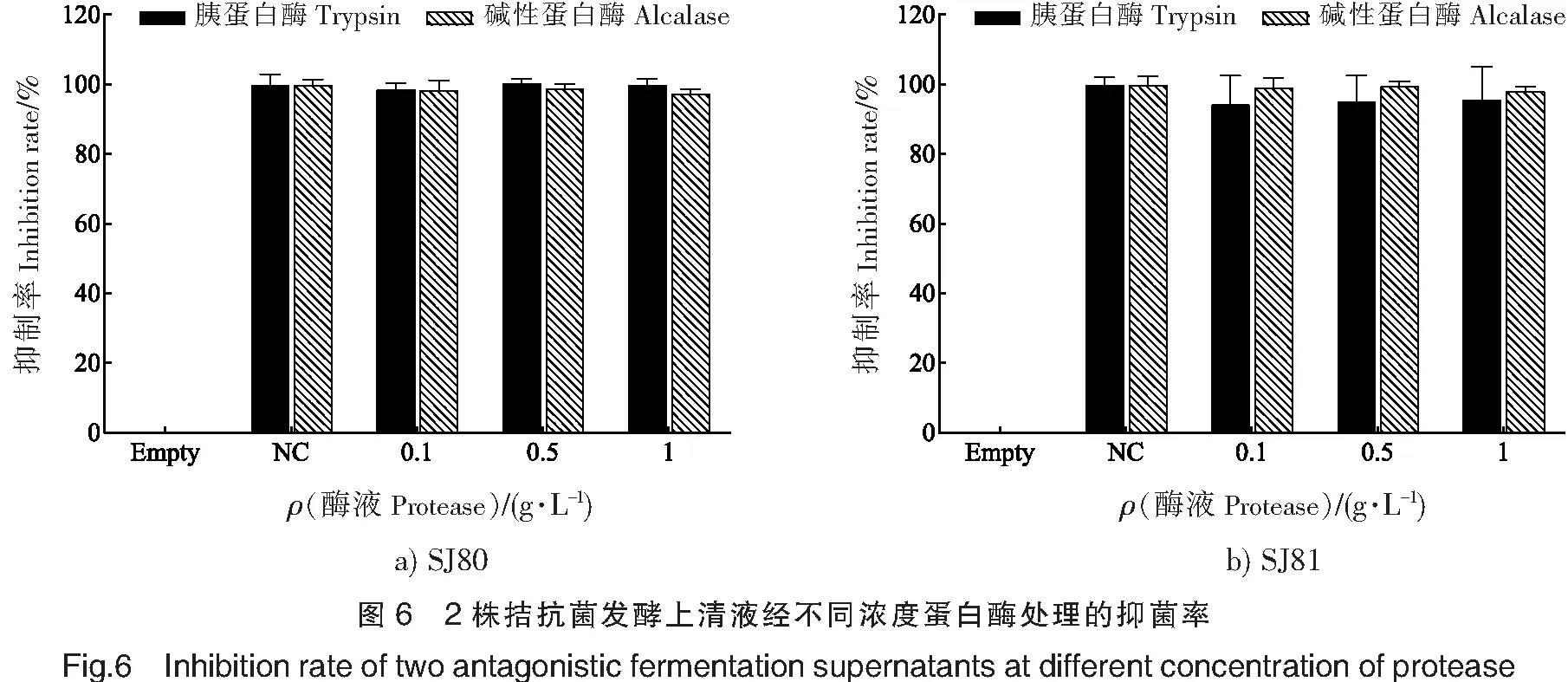
2.6 蛋白酶稳定性
由于2种发酵上清液自身呈碱性,因此选择胰蛋白酶和碱性蛋白酶进行实验,结果见图6。可见,空白组的抑菌率均为0,排除了酶的自身作用,2株拮抗菌发酵上清液经不同浓度酶液处理后,抑菌活性均高于95%,与对照组无显著性差异(P>0.05)。由此可见,胰蛋白酶与碱性蛋白酶对2种拮抗菌发酵上清液中活性物质无酶解作用。
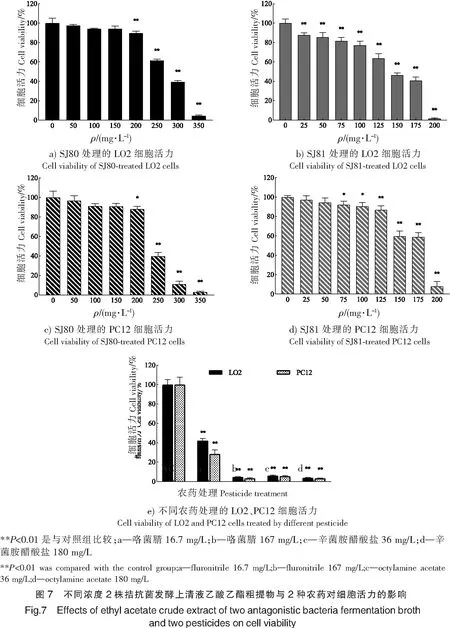
2.7 体外急性细胞毒性试验
由于拮抗菌发酵产生大量代谢产物,抑菌活性物质与毒素物质共同存在,若作为生防菌剂作用于农田,喷洒过程会在农作物上有些许残留,有直接入口的风险,因此,需要通过MTT实验确定其体外急性细胞毒性作用。如图7所示,随着样品浓度增加, LO2、PC12细胞活力逐渐降低。对于LO2细胞,样品质量浓度在200 mg/L时,细胞活力达到80%以上,在300 mg/L时,细胞活力低于50% (见图7a);样品质量浓度为75 mg/L时,细胞活力在80%以上,在150 mg/L时,细胞活力低于50%(见图7b)。对于PC12细胞,样品质量浓度为200 mg/L时,细胞活力仍在80%以上,在250 mg/L时,细胞活力明显下降,只有39.84%(见图7c);样品浓度在125 mg/L时,细胞活力在80%以上,在150 mg/L和175 mg/L时,细胞活力也处于较高水平,分别达到59.74%,58.89%,在200 mg/L时,细胞活力才显著降低至7.98%(见图7d)。对于SJ80,LO2、PC12 2种细胞中其IC50分别为239,266 mg/L;对于SJ81,LO2、PC12 2种细胞中其IC50分别为137,161.3 mg/L,因此可知SJ81毒性比SJ80强,可能是由于SJ81发酵产生的毒素物质较多的缘故。4组农药对应的细胞活力均低于50%,其中咯菌腈在16.7 mg/L时对LO2细胞活力为42.32%,对PC12细胞活力为28.52%,其余各浓度对2种细胞的细胞活力均在10%以下,细胞几乎全部死亡,与对照组有极显著性差异(P<0.01),与SJ80、SJ81粗提物相比表现出较大杀伤力,体现了拮抗菌生物防治的安全性(见图7e)。
2.8 农药对比实验
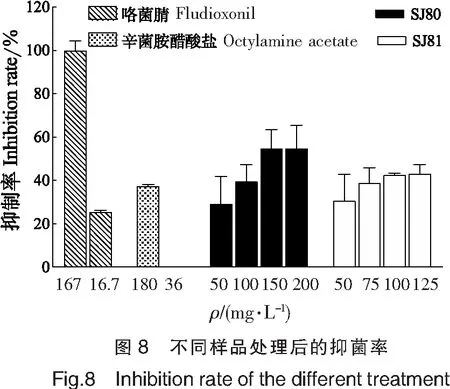
为了比较拮抗菌粗提物与农药的抑菌活性,选择节2.7中细胞活力在80%以上的作用浓度与农药进行对比,结果如图8所示。可见,以抑菌效果最强的167 mg/L咯菌腈为抑菌率100%的对照组,其推荐使用浓度(16.7 mg/L)的抑菌率为25.46%;辛菌胺醋酸盐在高浓度下的抑菌率为37.46%,在推荐使用浓度(36 mg/L)下的抑菌率为0。通过线性拟合,得到SJ80和SJ81粗提物的抑菌率方程分别为Y=0.215 7X+22.75和Y=0.176 3X+25.45。SJ80和SJ81粗提物在质量浓度为16.7 mg/L时的抑菌率分别为26.35%,28.39%,均强于咯菌腈的抑菌效果,在质量浓度为36 mg/L时的抑菌率分别为30.52%,31.8%,均强于辛菌胺醋酸盐的抑菌效果。因此,在推荐使用浓度下,2株拮抗菌的抑菌效果均强于2种农药,突出了SJ80、SJ81拮抗菌的作用优势。
3 讨论
本研究旨在对比2种农药与2株甲基营养型芽孢杆菌对疮痂链霉菌的抑菌效果。甲基营养型芽孢杆菌与农药相比,具有较好的抑菌效果,且相同浓度下有较低的细胞毒性。由于农药残留,人们长期、低剂量地摄入农药,在体内积累的农药不仅会造成慢性损伤,而且有一定的神经毒性与肝脏毒性。苟练等[32]发现,低剂量与高剂量农药均可导致PC12细胞DNA损伤,诱导细胞凋亡;陈洁等[33]阐述了不同农药导致细胞凋亡的不同途径,具体机制还需进一步探究。我国已经意识到农药与化肥对生态系统的严重破坏造成的粮食安全问题,在2015年制定了《到2020年化肥使用量零增长行动方案》和《到2020年农药使用量零增长行动方案》[34],大力推进农药减量控害。
生防菌剂一般要具有强稳定性,耐高温性、耐酸碱性、耐紫外照射都是重要指标。若作为生防菌剂代替农药施用于田间,耐高温特性是重要的指标。2株拮抗菌发酵上清液在121 ℃高温处理30 min仍对疮痂链霉菌有90%以上的抑菌效果,说明其活性物质高温下不易失活,有很好的耐热性;2株菌在24 h紫外连续照射后仍有较强抑菌活性,说明抑菌活性物质强光下不易被分解;在pH值呈中性或弱碱性时,2株拮抗菌抑菌活性稳定,在强酸性条件下仍有活性,表明其耐酸性较强,说明其在农田中可能对土地的酸碱性有很好的适应性;抑菌活性物质不易被蛋白酶酶解,是较稳定的生防菌剂。许多研究发现,芽孢杆菌可以产生多种抑菌活性物质,其中能够有效抑制植物病害的代谢产物有环状脂肽、聚酮化合物、杆菌素和核糖体合成的抗菌肽等几类物质;已经鉴定得到的环状脂肽类物质主要有脂肽(Surfactin)[35]、伊枯草素(iturin)[36]、丰霉素(fengycin)、多粘菌素(polymyxin)[37]、镰刀菌素(fusaricidin)等,聚酮化合物主要有巨乳素(macrolactin)、地非西丁(difficidin)等,其中脂肽的存在最广泛[38-39]。Huang等[15]研究发现,一些芽孢杆菌存在脂肽类抗生素的合成基因,可分泌大量抗生素,有广谱抑菌效果,且发酵上清液理化性质较稳定。因此,本文所用的2株甲基营养型芽孢杆菌可能也是通过产生天然抗菌物质来抑制马铃薯疮痂病的病原菌,但具体还需进一步深入研究。
甲基营养型芽孢杆菌针对马铃薯疮痂病的研究较少,2019年首次报道了一株甲基营养型芽孢杆菌对内蒙古马铃薯疮痂病有抑菌效果[40],但未明确其有效成分和抑菌机制。本研究发现SJ80与SJ81能有效抑制马铃薯疮痂病,体外急性细胞毒性比市售农药小,而且具有稳定的理化性质,有用于马铃薯疮痂病生物防治的潜力。为进一步探索其抑菌机理,后续将对发酵上清液粗提物分离纯化、活性鉴定等进行深入研究,为疮痂病研究提供新的方向,也为更好地将其应用于农业生产提供理论依据。

