经食管超声心动图在经胸微创膜周部室间隔缺损封堵术中的应用价值
郭朝锋 王晓静 史景璐 王岩青 杨再珍 王孝东
室间隔缺损(ventricular septal defect,VSD)是最常见的先天性心脏病,膜周部室间隔缺损(perimembranous ventricular septal defect,pmVSD)是其最常见类型,约占70%~80%[1]。近年来,由中国学者发起和主导的经胸微创VSD封堵术[1]融合了传统体外循环下修补和X线下心导管介入封堵术的优势,在经食管超声心动图(transesophageal echocardiography,TEE)引导下对正常跳动心脏VSD封堵治疗,其适应证广泛,且不受年龄、体质量和外周血管条件限制,迅速在国内外开展[2-3]。选择合适的封堵入路对手术成功至关重要,本研究回顾性分析pmVSD患者术中TEE影像及病例资料,探讨封堵入路夹角与手术成功率及心内操作时间的相关性,旨在为提高手术成功率,缩短心内操作时间提供参考依据。
资料与方法
一、研究对象
选取2016年1月至2018年12月在我院行单纯TEE引导经胸微创pmVSD封堵术治疗的77例患者,依据封堵入路夹角大小将其分为:封堵入路夹角<30°组56例,男26例,女30例,年龄0.5~25.0岁,中位年龄2.2岁,体质量6.5~68.0 kg,中位体质量12.6 kg;pmVSD大小2.0~6.0 mm,pmVSD上缘距离主动脉瓣>2 mm者37例,≤2 mm者15例,4例无边缘。封堵入路夹角≥30°组21例,其中男10例,女11例,年龄1.0~24.0岁,中位年龄3.1岁,体质量10~75 kg,中位体质量15.8 kg;pmVSD大小2.4~6.0 mm,pmVSD上缘距离主动脉瓣>2.0 mm者15例,≤2.0 mm者4例,2例无边缘。纳入标准:①超声心动图检查确诊为pmVSD;②pmVSD大小2.0~6.0 mm。排除标准:①对位不良型pmVSD或主动脉瓣脱垂及主动脉瓣中度以上反流者;②合并需同期体外循环外科手术矫正的其他心血管畸形;③合并感染性心内膜炎或心腔内有血栓者;④合并失代偿性心力衰竭,左室射血分数<30%者;⑤合并其他严重疾病,有手术禁忌症者;⑥TEE影像或病例资料不全者。本研究经我院医学伦理委员会批准,术前所有患者或监护人均签署知情同意书。
二、仪器与方法
使用Philips iE Elite彩色多普勒超声诊断仪,X7-2t或S7-3t探头,频率2~7 MHz,术中监视引导。手术均由具有多年经胸微创VSD封堵经验的心外科医师在心脏外科手术室完成,TEE引导pmVSD封堵方法[4-6]:①患者于全身麻醉状态下放置TEE探头,详细观察pmVSD具体位置、形状、大小及其周边结构关系,重点观察是否形成“膜部瘤”、右室面开口情况及其与三尖瓣腱索及隔瓣的关系,测量pmVSD边缘至主动脉瓣及三尖瓣隔瓣距离,选择适合引导封堵操作的TEE切面,使pmVSD位于图像中央,声束尽可能垂直于缺损口;②根据pmVSD的位置及分流方向,在胸骨下段正中或胸骨左缘做一小切口,部分切开并悬吊心包显露右室游离壁,指导手术医师在右室壁上选择穿刺点并在其周围缝置荷包;③将导引钢丝插入中空探条,穿刺右室游离壁“荷包”进入右室,TEE引导探条头端通过pmVSD送入左室,保留导丝退出探条,沿导丝推入输送鞘管,然后经鞘管送入封堵器(即探条法);④在TEE监视下,先释放封堵器的左盘面,回拉使其紧贴室间隔左室面,再释放腰部及右盘面;⑤在TEE监视下做推拉实验,确认封堵器位置良好,若无明显残余分流及新发瓣膜反流,无严重心律失常及心包积液,释放封堵器。具体操作见图1。以上操作均由3名副主任医师对TEE图像进行分析,意见不一致时协商解决。
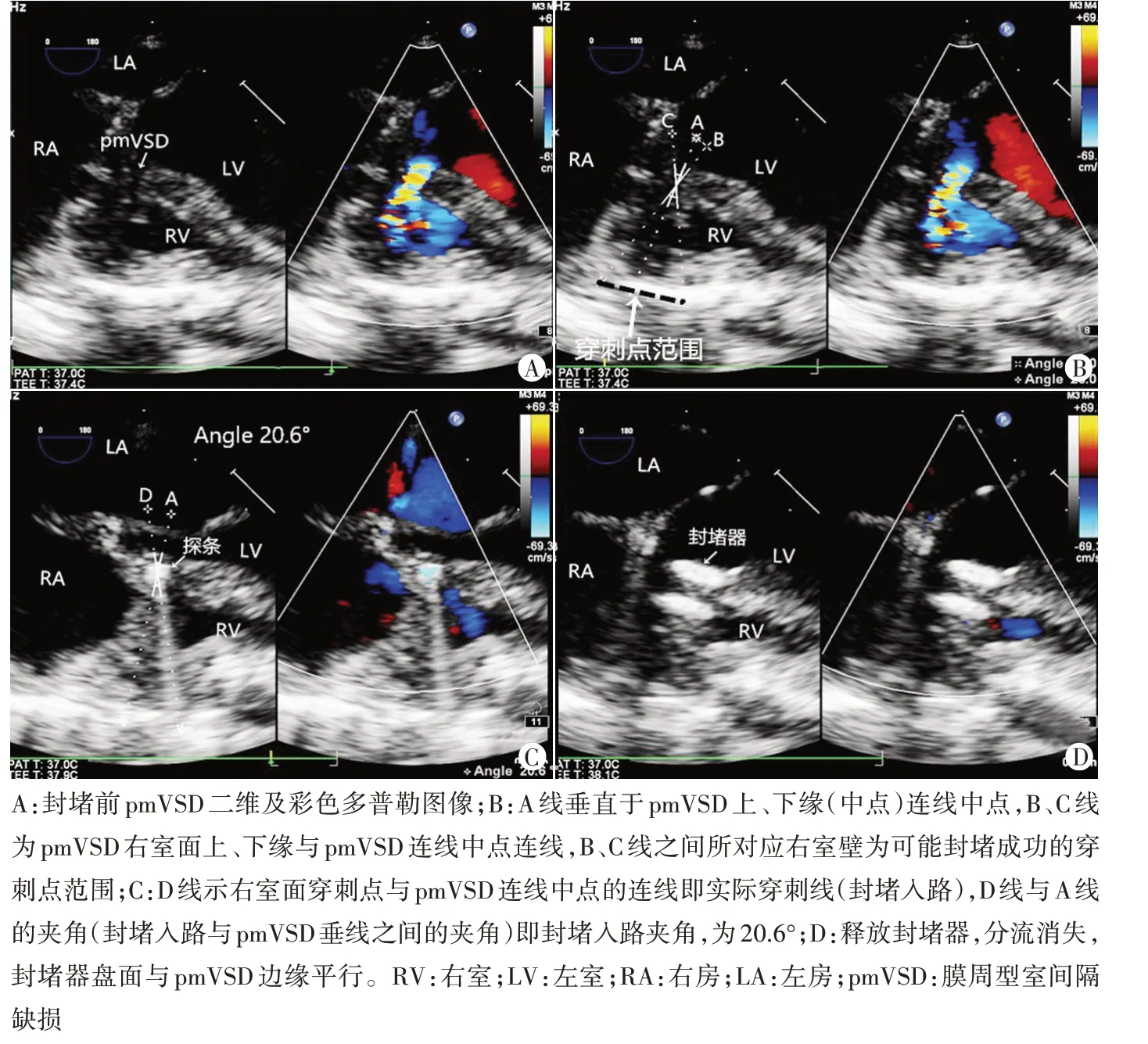
图1 TEE引导经胸微创pmVSD封堵图像
三、统计学处理
应用SPSS 16.0统计软件,符合正态分布的计量资料以±s表示,两组比较行t检验;不符合正态分布的计量资料以中位数表示,两组比较行Mann-WhitneyU检验。计数资料以频数或率表示,组间比较行χ2检验。封堵入路夹角与心内操作时间的关系采用Pearson相关分析法。P<0.05为差异有统计学意义。
结果
77例患者均封堵成功,共置入封堵器77枚,置入封堵器的腰部直径为4~8 mm,其中封堵入路夹角<30°组全部一次封堵成功;封堵入路夹角≥30°组中,4例患者右室壁穿刺点选择不恰当造成封堵入路夹角过大(分别为30.0°、35.0°、36.0°和45.0°),导丝无法顺利通过VSD,术中更换穿刺点位置缩小封堵入路夹角(分别缩小至20.6°、18.0°、24.0°和27.0°)后封堵成功。所有患者均无中量或者大量主动脉瓣反流、Ⅲ度房室传导阻滞、心包填塞等严重并发症。所有病例随访1年均无封堵器脱落、移位。
一、两组一般资料比较
两组年龄、体质量、性别构成及pmVSD大小比较差异均无统计学意义。见表1。
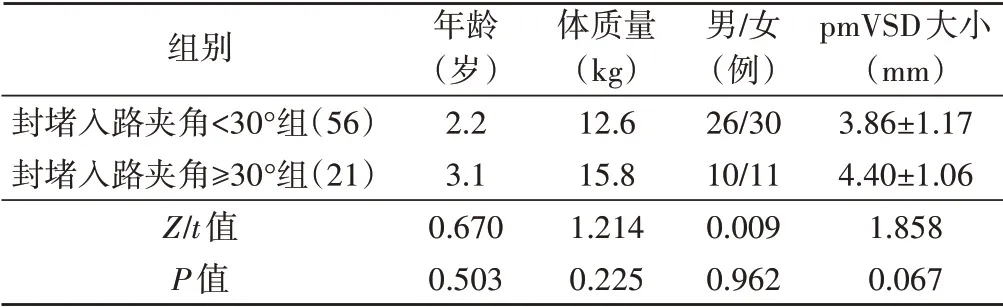
表1 两组一般资料比较
二、两组手术成功率、心内操作时间比较
封堵入路夹角<30°组手术成功率较≥封堵入路夹角30°组高(100% vs.80.95%),心内操作时间较封堵入路夹角≥30°组短[(24.50±5.39)min vs.(39.05±4.31)min],两组比较差异均有统计学意义(均P<0.05)。
三、封堵入路夹角与心内操作时间的关系
所有患者封堵入路夹角7°~45°,平均25.71°±6.33°;心内操作时间9~45 min,平均(28.47±8.27)min。封堵入路夹角与心内操作时间呈正相关(r=0.819,P<0.001)。见图2。
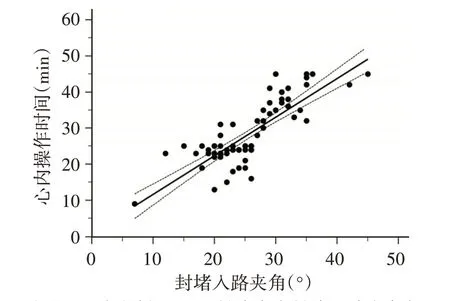
图2 TEE引导下经胸微创pmVSD封堵术中封堵入路夹角与心内操作时间的相关性分析散点图
讨论
TEE引导下经胸微创VSD封堵术是近年兴起的微创心脏外科手术方法,由于其具备传统体外循环下修补和X线下介入封堵术的优点,随着经验的积累和封堵输送装置的不断优化更新,目前已经广泛开展,且取得满意的近、中期临床效果[7-10]。与X线下VSD介入封堵术相比,该手术是由心外科医师在心外手术室进行,如封堵失败或者出现严重并发症,可以立即中转体外循环下手术紧急处理,保证手术成功率及患者生命安全,同时还可以保护手术医师及患者免受辐射损伤。单纯TEE引导下经胸微创VSD封堵术能否成功,关键在于导丝和鞘管是否可以顺利通过VSD,本研究显示右室游离壁穿刺点位置的选择至关重要,本研究尝试利用“封堵入路夹角”这一术语反映实际工作中右室壁穿刺点位置、VSD及封堵装置输送通路三者间的内在关系。
本研究心内操作时间为(28.47±8.27)min,较文献[11]报道的体外循环下修补及X线下心导管介入封堵术心内操作时间短,表明这种手术简便、易行。本研究显示,封堵入路夹角与心内操作时间呈正相关(r=0.819,P<0.001),即在同等条件下封堵入路夹角越小,导丝和鞘管越容易通过VSD,越容易完成封堵,所需的心内操作时间越短。分析原因为:①封堵入路夹角越小,穿刺点距VSD直线距离越近,操作力矩短,可控性强,可以精确控制封堵器输送装置避开三尖瓣及其腱索、通过VSD,对于较小缺损口且有一定弯曲度呈隧道样的pmVSD更有优势;②封堵入路夹角越小,封堵输送装置在TEE视野中央,有利于TEE对封堵过程进行实时监控,有利于控制封堵输送装置进入左室深度,如果封堵入路夹角过大,封堵装置易从TEE视野中消失,容易损伤主动脉瓣;③封堵入路夹角越小,封堵器边缘与VSD边缘越接近平行,利于封堵器展开、卡位、释放,封堵器周边组织受力均匀,可以早期准确判断是否存在残余分流及瓣膜反流;④封堵器完全释放前需行推拉实验,以判断封堵器是否牢固,封堵入路夹角越小判断越准确,角度过大,判断不准,本研究中1例患者因封堵入路夹角较大,行推拉试验后释放,封堵器在短时间内脱落。
从理论上讲,封堵入路夹角为0°是最佳选择。这对于部分肌部VSD可能较易做到,由于pmVSD位置特殊,结构复杂,同时为了避开冠状动脉血管和操作方便,在实际工作中,大多数情况下封堵入路夹角均大于0°。如果VSD较小,封堵入路夹角较大,导丝和鞘管有可能无法通过VSD,多数情况下需更换穿刺点位置缩小封堵入路夹角才能完成手术,本研究4例患者右室壁穿刺点位置选择不当,造成封堵入路夹角过大,反复尝试均无法通过pmVSD,最终通过更换穿刺点位置缩小封堵入路夹角完成封堵;如果VSD较大,封堵入路夹角稍大,导丝和鞘管虽可能可以通过VSD,但是容易损伤VSD周围组织及主动脉瓣,且不利于封堵器展开、卡位,不利于判断是否存在残余分流及瓣膜反流,从而增加手术操作难度及心内操作时间,甚至导致手术失败。因此,无论缺损口大小,均应选择尽可能小的封堵入路夹角来完成封堵。本研究结果显示,封堵入路夹角<30°组手术成功率较高,心内操作时间较短,与封堵入路夹角≥30°组比较差异均有统计学意义(均P<0.05)。
基于本研究结果总结经验:如TEE医师在手术医师选择右室壁穿刺点时可以给出可行的右室壁穿刺点位置范围,并指导选择更合适的右室壁穿刺点位置,以获取较小的封堵入路夹角,这样不仅可以提高手术成功率,还可以避免因更换穿刺点而浪费时间;另外,胸部微创小切口位置对于右室壁穿刺点选择至关重要,直接关系到可选择的范围、封堵入路的建立及封堵入路夹角的大小,目前有胸骨下段小切口、胸骨左缘小切口、胸骨右缘小切口和腋下小切口等方式[12-13],选择依据是VSD位置及分流方向,本研究中大部分(59例)选择胸骨下段切口,小部分(18例)选择胸骨左缘小切口。
本研究局限性:①心内操作时间及手术成功率影响因素较多,封堵入路夹角是其中之一;②心内操作时间一定程度上受手术医师学习曲线的影响,尽管本研究选取的是我院心脏大血管外科顺利开展该项手术2年之后的病例;③本研究是单中心研究,病例相对较少,代表性相对较差。
综上所述,TEE引导下经胸微创pmVSD封堵术中封堵入路夹角与手术成功率及心内操作时间相关,选择合适的右室壁穿刺点位置,缩小封堵入路夹角,可提高手术成功率,缩短心内操作时间,具有较好的临床应用价值。
——导丝概述及导丝通过病变技巧

