颅-耳-颈联合入路在复杂侧颅底手术中的应用
杨仕明,申卫东,吴 南
中国人民解放军总医院第六医学中心耳鼻咽喉头颈外科医学部 国家耳鼻咽喉疾病临床医学研究中心 聋病教育部重点实验室 聋病防治北京市重点实验室,北京100853
颅底外科是临床医学中最后兴起的学科之一,随着学科分化和新技术的涌现,目前已成为国内外各大医学中心竞相开拓的新领域。侧颅底疾病病种庞杂,大部分为良性或低度恶性疾病,手术切除是最主要的治疗手段。由于颅底是重要血管和神经穿行的部位,发生在侧颅底的病变常常累及颅内外及颈部,该区域异常复杂的解剖结构给手术带来了巨大挑战。如何在减小创伤、改善病变暴露和提高切口美观之间取得平衡,以及如何根据术中出现的情况进行变通,是侧颅底外科需要不断精进的重要方向。针对复杂侧颅底手术,中国人民解放军总医院耳鼻咽喉头颈外科提出了颅-耳-颈联合入路,经过20余年不断改进和完善,逐渐形成了一套较为成熟的手术入路。本文重点介绍这一手术入路的技术要点,以期为临床诊疗提供借鉴。
1 侧颅底疾病概述
侧颅底狭小的解剖空间容纳了多组神经、血管结构,熟悉颅底解剖是手术入路设计、病变切除、神经血管暴露的基础。伴随着颅底外科的发展,颅底解剖经历了大体解剖、局部解剖、显微解剖和内镜下解剖的不同阶段。该区域精细的手术操作要求推动了海绵窦、颈静脉孔、岩骨及其周围、颞下窝、颅颈交界、桥脑小脑角等区域的显微解剖[1-3]。
侧颅底疾病包括先天畸形、外伤骨折、良性肿瘤、原发性恶性肿瘤、转移性恶性肿瘤等。但临床上颅底肿瘤并不常见,文献很少有系统性报道,故颅底疾病的准确发病率难以估计[4-5]。侧颅底疾病的治疗方案以手术切除为主,然而,即使在影像学技术发达的今天,术前诊断与鉴别诊断仍然困难,因此术前评估面临巨大挑战[6]。
侧颅底的良性肿瘤分别来源于骨组织、软骨、结缔组织、组织细胞、血液或血管,其他类型还包括骨纤维异常增殖症、变形性骨炎(Paget’s disease)、表皮样囊肿(epidermoid)、皮样囊肿(dermoid)、动脉瘤样骨囊肿(aneurysmal bone cysts)。原发性恶性肿瘤除上述来源外,还可来源于神经上皮、鳞状细胞或外分泌腺。侧颅底转移癌相对少见,且大部分无症状,导致发生转移距离原发肿瘤诊断的时间较长,因此诊断和治疗延误现象常见。
2 侧颅底手术入路的发展
侧颅底外科的发展与技术进步密不可分,成像技术在侧颅底疾病的诊断、鉴别诊断、肿瘤部位与毗邻组织器官的关系以及手术计划的制订方面居于中心地位。从CT、MRI、数字减影血管造影(digital subtraction angiography,DSA)到术中导航,这些新技术的引入推动了侧颅底外科手术入路的演进。经过以Krause、Rhoton、Yasargil、Samii、House、Fisch等为代表的几代神经外科和耳鼻喉科医生的努力[7-11],颅底外科已能够提供360°到达颅底不同区域的相应手术入路。经典的侧颅底开放手术路径包括颅中窝入路、颞下窝入路、(扩大)迷路入路、乙状窦后入路、远外侧入路等,这些入路涵盖了从上方、侧方或下方到达颅底的不同区域[12]。
3 颅-耳-颈联合入路技术要点
尽管在多数情况下,单独采用上述入路即可切除大部分肿瘤,但当单一的入路无法暴露肿瘤周围情况,如肿瘤向前累及颞下窝、上颌窦,到达眶尖,鼻咽和斜坡的后下,向内到达海绵窦,或向下到达枕骨基底、上颈部时,则需联合多个入路才能一期切除肿瘤[13]。这些联合入路通常需要附加额外的皮肤切口和骨质切除,如颈侧切开、远外侧入路等。
颅-耳-颈联合入路在解放军总医院耳鼻咽喉头颈外科侧颅底中心已成熟应用多年,可较好地处理各类复杂的颅底病变,无需作额外切口,适合跨区生长、单一常规手术入路难以胜任的侧颅底病变。
3.1 术前评估
术前除需评估专科的听力、前庭功能、面神经功能外,还应评估Ⅸ~Ⅻ后组脑神经功能。影像学评估包括CT、MRI,以了解侧颅底肿瘤的部位和性质,为术前手术方案的制订提供依据(图1)。血管的评估手段包括磁共振静脉血管成像(magnetic resonance venography,MRV)、磁共振动脉血管成像(magnetic resonance angiography,MRA),对于富血供的肿瘤,还需行头颈部DSA检查及责任血管栓塞。
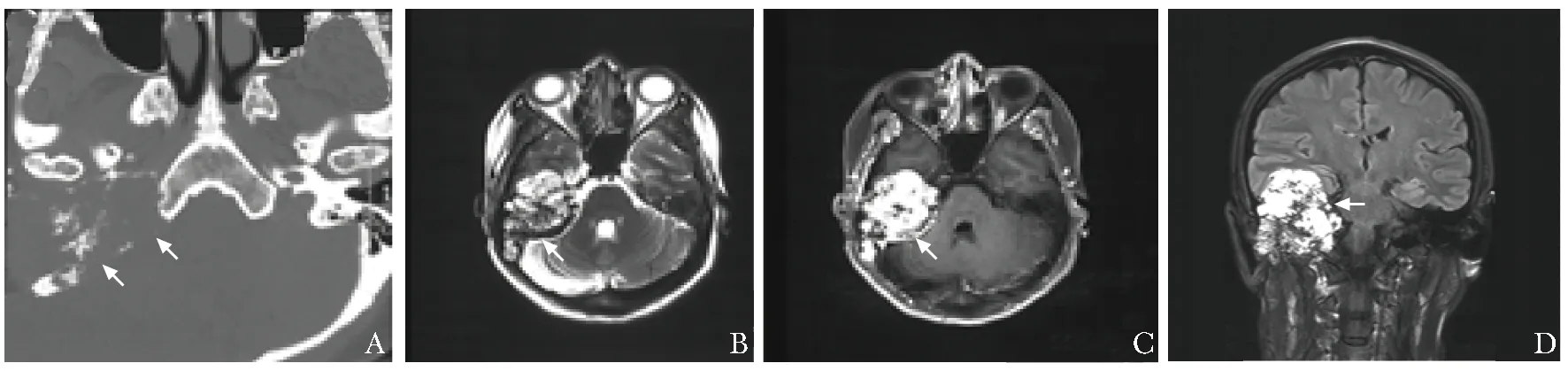
图1 患者女性,48岁,因复发性内淋巴囊肿瘤拟行颅-耳-颈联合入路切除肿瘤,术前影像学评估结果(箭头)A.CT示病变累及颞骨、枕骨基底,可见嵴状突起;B.MRI T1加权成像示病变呈混杂信号,累及颅中窝并突入后颅窝;C.MRI T1+C示病变不均匀强化;D.冠状位MRI T2加权成像示肿瘤位于颅中窝、颞骨、颈静脉孔并突入后颅窝
3.2 麻醉、体位及术中脑神经监测
该手术入路通常采用静脉-吸入复合全身麻醉。患者仰卧位,肩下垫枕、头偏向对侧60°,三点式头架固定,头部略高于胸部以利于静脉回流。除非患者术前颅内压增高,通常无需行腰大池和侧脑室引流。术中行包括Ⅶ、Ⅷ和体感诱发电位在内的持续脑神经监测。
3.3 皮肤切口
颅-耳-颈联合入路的皮肤切口起自耳廓上方的颞部,经耳后、乳突表面向下延伸至上颈部的大“?”形切口(图2)。该切口既保证向上至颅中窝,向后至颅后窝,向前到达颞下窝,以及向下至上颈部的充分暴露,又兼顾了皮瓣血供和美观的要求。

图2 颅-耳-颈联合入路皮肤切口示意图
3.4 术中解剖及肿瘤切除
根据病变的性质和范围,通常需完成扩大的乳突切除或颞骨次全切除术,暴露上颈部,解剖并显露颈内动脉、颈外动脉、颈内静脉及后组脑神经,打开受侵犯的颈静脉孔。若肿瘤侵犯颞下窝,还需进一步离断并封闭外耳道,解剖面神经并向前改道,暴露颈内动脉的颞骨内段;若肿瘤累及颅中窝或颅后窝,则需将幕上或幕下的颅骨切开(图3)。

图3 颅-耳-颈联合入路颅骨切开范围示意图
根据肿瘤向颅内蔓延的位置和大小,可进一步在乙状窦前或乙状窦后切开后颅窝的脑膜,后颅窝内肿瘤的处理原则同其他桥脑小脑角内肿瘤的切除。若肿瘤累及颅中窝及颞叶,则需将小脑幕上的脑膜切开。侧颅底来源的肿瘤通常会通过脑膜侵犯颅中窝或颅后窝,但脑组织常不受累,一旦受累,可请神经外科协助一期切除病变脑组织,有经验的颅底外科医生也可独立完成这一步。术前T2加权成像或FLARE序列能显示出软脑膜或脑组织受累引起的水肿。若脑干受累,为避免术后导致脑干梗死,可保留部分囊壁在脑干表面。
肿瘤切除后,与术腔相通的乳突气房、鼓窦入口以及开放内听道、岩尖周围的气房/蝶窦均需刮除黏膜,仔细用肌肉或骨蜡封闭,作为脑脊液漏共同的、最后出口的咽鼓管鼓室口亦需以肌肉组织填塞封闭,以免术后发生脑脊液漏。
3.5 侧颅底缺损修补及功能重建
侧颅底肿瘤切除后往往会遗留较大术腔,通常采用腹部脂肪进行填塞。腹部脂肪易获取,且便于利用核磁的“压脂”和强化技术进行随访。小的缺损也可采用颞肌修补。若术区皮肤受累,则需与整形外科医生协作,利用游离的背阔肌或带蒂的斜方肌肌皮瓣修复。若病变合并感染,脂肪填塞会导致感染、液化,需采用抗感染能力更强的游离皮瓣或带蒂皮瓣修复缺损区域。
最常见的术后并发症是脑脊液漏及其导致的颅内感染。颅底手术很难做到“密不透水”的脑膜缝合,肿瘤切除后缺损的脑膜可利用自体颞筋膜、阔筋膜隔离脑组织与术腔,也可采用人工脑膜修补、缝合或纤维蛋白胶固定。
3.6 术后管理及并发症预防
术后,患者进入具有神经外科功能的ICU,密切观察反映患者脑水肿的意识状态。一般情况下,患者术后第2天即可返回普通病房。术后需使用预防癫痫发作的药物,尤其是累及颞叶的病变,必要时随时行头颅CT平扫,以了解颅内情况。患者需穿弹力袜,术后24 h皮下注射肝素或低分子量肝素可有效预防下肢深静脉血栓的形成,对于手术时间长、术前肥胖、高血压、糖尿病的患者,尤其是D-二聚体高的病例,更需如此。
侧颅底手术因手术范围大、涉及面广,术后发生并发症的机会显著增加,预防严重并发症的发生是复杂侧颅底手术需要关切的重要问题之一。例如术中避免长时间持续使用脑压板牵拉颞叶、避免损伤穿过脑膜引流颞叶的静脉等。术后并发症大致可分为以下几类:脑神经、颞叶、小脑、脑干、血管损伤相关问题和脑脊液漏,一旦发生,常常是灾难性的。
4 小结
本文介绍的颅-耳-颈联合入路已经在中国人民解放军总医院耳鼻咽喉头颈外科应用多年,处理各类跨区域复杂颅底病变100余例,一期手术肿瘤全切率高,术后患者康复效果较为满意[14-16]。该入路无需作额外的切口,即可到达小脑幕上、下,上颈部及颞下窝,具有良好的灵活性和实用性。
作者贡献:杨仕明负责论文设计和内容审核;申卫东、吴南负责文献查阅、论文撰写及修订。
利益冲突:无

