冷等离子体技术在蛋白质改性中的应用研究进展
王俊鹏,贺稚非,2,李敏涵,齐世超,李洪军,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
蛋白质不仅是人类饮食中必不可少的营养物质,同时也是重要的食品工业原料,具有许多与食品加工质量相关的功能特性[1]。但天然蛋白质的功能特性可能并不理想,如存在溶解性差、有致敏性等缺陷,从而限制了其在食品工业中的应用[2-3]。在食品加工过程中通常会使用酶、化学和物理法改善蛋白质的功能特性以满足实际生产的要求,然而传统改性方法通常需要较高的能耗和成本,化学试剂的使用则可能对人体健康产生不利影响[4]。因此,使用生态友好的非热物理方法修饰蛋白质结构并改善其功能特性已经成为当下食品科学领域的一个研究热点[5]。目前已用于蛋白质改性的非热物理技术有高压、超声波、脉冲电场、辐照、超临界流体、冷等离子体等[6-7]。其中冷等离子体技术最初多应用于电子工业以及高分子材料印刷与表面涂覆性能的改良,随着近几年食品非热加工研究的兴起,冷等离子体技术的应用范围逐渐拓展到食品工业领域中[8]。
冷等离子体作为一种新兴的非热加工技术,不仅为易挥发性和热敏性食品灭菌提供了新的思路[9],同时在改善蛋白质功能特性方面也显示出巨大潜力,具有可在无外源化学试剂或酶的条件下有效改变天然蛋白质功能结构的优势[10]。冷等离子体中的活性氧、活性氮是蛋白质改性的关键成分,这些成分可以诱导蛋白质的结构发生改变,如化学键形成、氨基酸侧链氧化、多肽链之间交联等,进而达到改善蛋白质功能的作用[11]。因此,研究经冷等离子体处理后蛋白质功能特性的变化对挖掘冷等离子技术的实用价值具有重要意义。基于此,本文对冷等离子体技术改善蛋白质功能特性的应用研究进行系统总结,以期为冷等离子体技术在蛋白质改性方面的应用提供参考。
1 冷等离子体概述
1.1 冷等离子体的定义
冷等离子体是一类温度接近室温(30~60 ℃)的等离子体[12]。美国物理学家Langmuir于1928年首次提出了等离子体的概念,指出等离子体是电子和离子达到电荷平衡的一种电离气体[13]。后来有学者将等离子体的概念进一步总结为由正负离子、自由电子、自由基、电磁辐射量子、激发态或非激发粒子组成的电离气体,整体呈电中性[14]。冷等离子体的产生过程可分为电子碰撞阶段和重粒子碰撞阶段。在电子碰撞阶段,电子从电、热、电磁波中获取能量发生振动、激发、解离、电离、俘获;在重粒子碰撞阶段,氮气(N2)、氧气(O2)等粒子与电子发生碰撞,产生活性氮、活性氧类物质,如臭氧(O3)、羟自由基(·OH)和氮氧化物类等[11]。冷等离子体中电子和其他粒子处于非热力学平衡状态,电子温度远高于其他粒子温度,体系能量主要集中在高能电子中,因此整体温度可维持在较低水平[15-16]。除了冷等离子体,根据等离子体是否处于热力学平衡状态以及电离程度还可将其分为高温等离子体和低温等离子体。高温等离子体呈完全电离状态,体系内部电子和其他粒子温度处于高度热力学平衡状态,整体温度可达1×106~1×108K,而低温等离子体呈部分电离或未电离状态[17]。低温等离子体进一步可分为热等离子体和冷等离子体,热等离子体中电子和其他粒子处于局部热力学平衡状态,电子与其他粒子温度接近,整体温度可达2×104K[18]。
1.2 冷等离子体的产生方式
冷等离子体的载气可使用一种或多种气体,如空气、氧气、氮气、氦气、氩气等,其中空气是最常用的气体[19]。冷等离子体常见的产生方式有大气压等离子体射流(atmospheric pressure plasma jets,APPJ)、介质阻挡放电(dielectric barrier discharge,DBD)、电晕放电(corona discharge,CD)、微波放电(microwave discharges,MD),图1为这4 种产生方式示意图[20]。
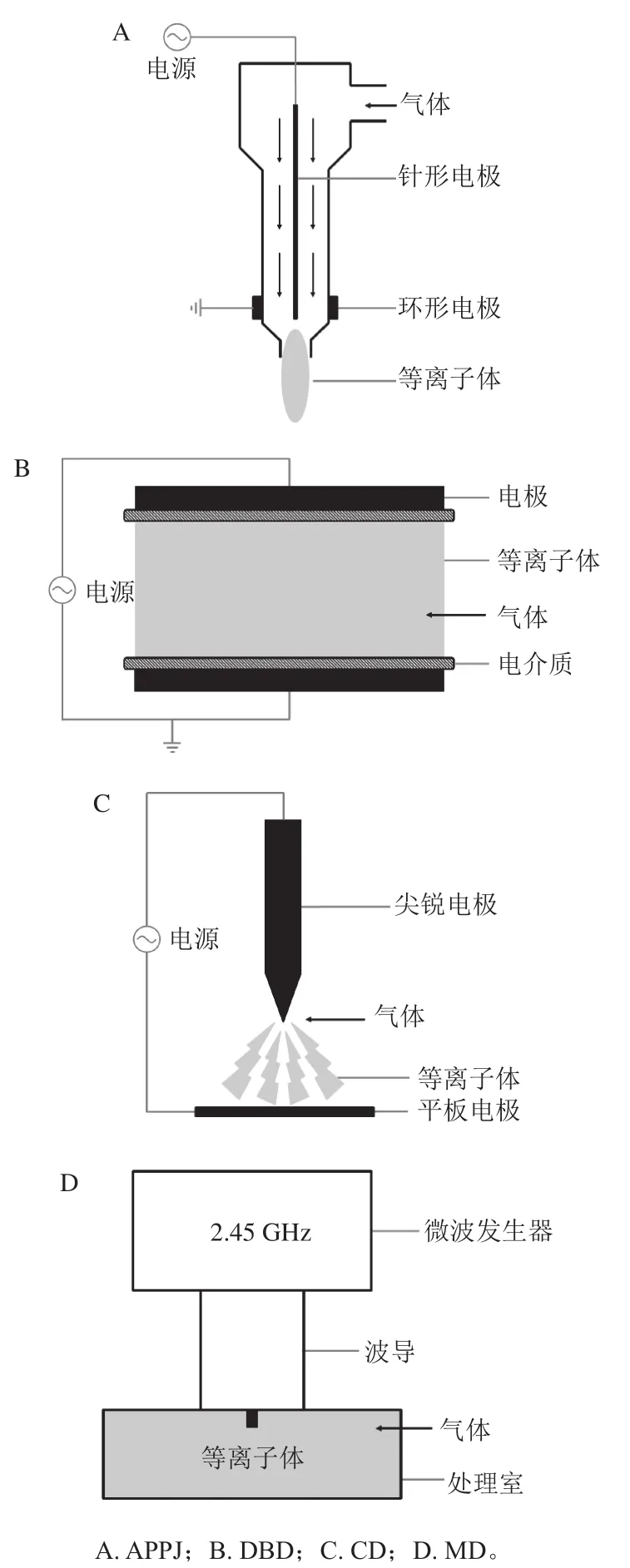
图1 冷等离子体产生方式示意图Fig. 1 Schematic diagram of cold plasma generation methods
APPJ装置通常由位于陶瓷喷嘴结构中的针形电极和环形电极(接地)组成,喷嘴出口间隙通常在几毫米,产生的冷等离子体可以进入具有高纵横比的狭窄空间[21];DBD装置是应用最广泛的冷等离子体发生装置,包含两个金属电极,其中至少有一个电极被电介质覆盖,当两个电极之间的电压达到击穿电压时,由于电介质的阻隔作用,电流无法通过,放电间隙会产生大量的微放电效应,产生等离子体[22];CD是一种弱发光放电,一般发生于几何形状十分尖锐的电极附近,电极尖端场强极高,可以将电子加速到周围气体原子或分子的电离水平,形成等离子体,包括自由选择直流或脉冲模式,常见的CD模式为点对板组合[12]。MD装置无需电极,由磁控管产生的微波作用处理室中的气体产生等离子体,频率一般为2.45 GHz,但大气压下产生的MD等离子体温度较高,因为有过多的气体分子需要大量的能量来维持等离子体状态,所以MD等离子体通常在低压条件(10~200 Pa)下产生[23]。不同类型的冷等离子体产生方式各有优缺点,如表1所示[20-23]。

表1 不同类型冷等离子体产生方式的优缺点[20-23]Table 1 Advantages and disadvantages of different methods for the generation of cold plasma[20-23]
1.3 冷等离子体技术在食品工业领域的研究现状
冷等离子体在食品工业领域中的应用主要有食品杀菌、食品组分改性、包装材料改良、农药降解等[24]。目前关于冷等离子体食品灭菌机制的观点尚不统一,早期研究认为是紫外线对DNA造成的光化学损伤或活性氧对细胞主要成分(如蛋白质、脂肪、DNA等)造成的氧化损伤诱导了微生物的死亡,但现在也有研究认为带电粒子的静电作用和电穿孔作用对细胞壁或细胞膜造成的机械损伤才是微生物死亡的主要原因[25];冷等离子体在食品组分改性方面的主要研究对象是淀粉和蛋白质,气体电离产生的活性化学物质能够改变这些大分子物质的结构,促进分子间的交联与解聚以及新官能团的形成,从而达到改变功能特性的作用[26-27];冷等离子体可以使包装材料表面官能化,即在聚合物材料表面形成官能团(如含氧或含氮基团)进而优化包装性能,此外还可用于提高食品包装的印刷效果和包装表面的杀菌效果[28];臭氧和羟自由基被认为是冷等离子体降解农药的主要活性成分,可通过氧化作用破坏与毒性有关的官能团或化学键使农药降解[29]。
2 冷等离子体技术对蛋白质功能特性的影响
食品中蛋白质的功能特性通常可以归为以下几类:1)水合性质,即蛋白质-水分子之间的相互作用,包括溶解性、黏附性、吸水性和持水性等;2)界面性质,蛋白质在两个不同相界面的作用,包括乳化性和起泡性;3)聚集和凝胶特性[30]。蛋白质功能特性的不同取决于氨基酸组成、序列及其空间构象的不同[31]。因此冷等离子体能够通过诱导蛋白质的结构变化,如氧化、硝化、脱酰胺、羟基化等,改变蛋白质的功能特性[32]。
2.1 溶解性
溶解性是蛋白质其他功能特性的基础,在食品加工中为了获得更好的乳化性或起泡性,通常需要蛋白质具有较高的溶解性[33]。蛋白质的溶解性与其疏水相互作用(蛋白质-蛋白质分子之间)和离子相互作用(水-蛋白质分子之间)有关[34]。高溶解性蛋白的疏水性氨基酸残基一般被包埋在蛋白质分子内部,当疏水性残基更多地暴露于蛋白质分子表面时,蛋白质的溶解性降低[35]。
近几年的研究显示,冷等离子体可以对蛋白质的二、三级结构进行修饰,改变疏水性氨基酸侧链暴露程度,影响蛋白质的溶解度。Dong Shuang等[36]采用电压分别为50、75、100、125 V的DBD冷等离子体处理玉米醇溶蛋白2 min后发现,不同电压条件均可提高蛋白质的溶解度,当电压为75 kV时溶解度最大。进一步研究发现α-螺旋含量的变化趋势与溶解度相同,该作者分析溶解度提高是由于蛋白表面形成了新的含氧或含氮亲水基团。Bußler等[37]在电压为8.8 kV的条件下对豌豆蛋白进行0~10 min的DBD冷等离子体处理后发现,蛋白溶解度与处理时间成正比,处理10 min后溶解度提高到了原来的191%,328 nm波长处色氨酸荧光强度也随时间变化有所增加。但该研究人员在另一项研究却得到了相反的结果[38],在采用相同实验条件对黄粉虫蛋白进行处理后,蛋白质的溶解度随着处理时间的延长不断下降,最大荧光强度也随之减弱,表明更多色氨酸等荧光氨基酸从蛋白质的疏水内核暴露出来,外部溶剂中的疏水性残基含量增加,导致蛋白质溶解度降低。由此可见冷等离子体处理并不总是能够提高蛋白质的溶解度,其处理效果可能与蛋白质类型、样品浓度以及样品pH值有关。
2.2 凝胶性
蛋白质的凝胶特性与许多食品的品质密切相关,如香肠、鱼糜、豆腐等。蛋白质凝胶是变性蛋白质分子重新聚集形成的有序三维网格结构,可以将色素、水分、脂肪和风味物质包裹在其中[39]。凝胶的形成通常与未折叠蛋白质分子间的各种化学作用力有关,包括二硫键、氢键、疏水相互作用和静电相互作用[40]。
冷等离子体处理可以使蛋白质在凝胶化过程中产生更多的共价键,使形成的凝胶具有更加致密的网络结构。Nyaisaba等[41]采用60 kV的DBD冷等离子体对鱿鱼分别进行15、60、120、180、240、300 s的处理后发现,蛋白凝胶硬度在0~120 s的处理过程中显著增加,从0.29 N增加到0.81 N,继续处理则硬度下降;持水性在180 s时比对照组高5.31%;通过电泳图谱分析发现,冷等离子体处理诱导了蛋白质分子间的交联和聚集,促进了共价键的形成。Miao Wenhua等[42]采用不同电压(10、20、30、40、50 kV和60 kV)的DBD冷等离子体对鳕鱼肌原纤维蛋进行10 min的处理,结果显示,在电压从0增加到60 kV的过程中硬度从1.88 N增加到了3.33 N,持水量增加了12.86%。研究还发现样品中的游离巯基含量下降,电泳图谱中200 kDa的条带强度减弱,这可能是蛋白质片段之间形成了更多的二硫键所致。从这些研究中可以发现,冷等离子体处理可诱导蛋白质分子间的聚集和交联,促进而二硫键的形成,改善蛋白质凝胶特性,但要获得理想的处理效果则需要选择合适的电压与处理时间。
2.3 乳化性
蛋白质乳化特性指的是蛋白质促进乳状液中油滴形成和稳定的功能特性。蛋白质可以在均质化过程中吸附在油-水界面,降低界面张力,并提供足够的排斥力阻止油滴之间的聚合,从而形成稳定的乳状液[43]。蛋白质乳化性受表面电荷、亲水-亲油平衡性和构象柔韧性的影响,蛋白质解折叠会导致疏水氨基酸残基暴露和构象柔韧性增加,从而增强油-水界面活性和蛋白质的吸附能力[44]。
冷等离子体对蛋白质乳化性的影响同样与电压和处理时间有密切关系。Mehr等[45]等研究了DBD冷等离子体处理对山黧豆蛋白乳化特性的影响,结果显示,9.4 kV处理60 s的乳液油-水界面张力最低,但油滴尺寸较大,不能形成足够牢固的界面层;18.6 kV处理60 s的乳液油滴尺寸最小,界面蛋白吸附量最高,具有厚而牢固的界面膜,乳化稳定性显著高于对照组;结构分析结果显示α-螺旋和二聚酪氨酸含量以及表面疏水性显著增加,表明蛋白质了发生解折叠和重新聚集交联。Mehr等[46]在另一项关于DBD冷等离子体制备山黧豆蛋白纳米颗粒(Grass pea protein isolate nanoparticles,GPPINP)的研究中发现,18.6 kV、300 s条件下制备的GPPINP能够更有效地吸附在油-水界面,形成更稳定的界面膜,乳化性能得到改善。在体外细胞毒性实验中发现,正常人皮肤成纤维细胞(normal human skin fibroblasts,NHDF)经不同条件下制备的GPPINP处理并培养24 h后仍具有较高的细胞活力(大于87.7%),经过48 h培养后所有处理组的细胞活力均有所增加,表明GPPINP对NHDF无细胞毒性。Ji Hui等[47]报道称DBD冷等离子体(35 V、(2.0±0.2)A)可以提高花生分离蛋白的乳化特性,乳液稳定性通过稳定性指数(turbiscan stability index,TSI)表示,TSI越低,乳液稳定性越高。研究表明,经过7 h的储存放置后,对照组TSI超过25.00,而处理组TSI均在10.00以下,且2 min处理的TSI仅为2.92。进一步研究发现,在1~3 min处理中,蛋白质的α-螺旋和游离巯基含量下降,β-折叠增加,平均粒径从1 112.7 nm减小到1 062.3 nm。一般认为具有较小粒径的蛋白质可以更快速地移动并扩散到油-水界面进行吸附,提高乳化特性[48]。乳状液的稳定性与多种因素有关:1)液滴平均尺寸和尺寸分布;2)蛋白质浓度和界面蛋白吸附量、油的种类和体积;3)连续相的黏度、储存时间和温度[49]。结合上述研究分析,冷等离子体可以改变蛋白质的二级结构,使蛋白质解折叠,减小乳液中液滴粒径,增加界面蛋白吸附量与表面疏水性,提高蛋白质的乳化特性。
2.4 起泡性
泡沫和乳液一样是亚稳定体系,蛋白质的起泡性包括起泡能力和泡沫稳定性,是冰淇淋、蛋糕、面包等搅打食品的关键性质[50]。空气在蛋白溶液搅打过程中可以进入溶液形成泡沫,蛋白质能够快速的吸附到气-水界面,形成黏弹性界面膜从而维持泡沫的稳定状态[51]。
冷等离子体对起泡能力和泡沫稳定性的影响存在差异。在冷等离子体处理初期蛋白质折叠部分展开,能够更快速的在界面膜展开,起泡能力提高;随着处理时间的延长,蛋白质发生聚集,粒径增大,界面膜刚性增加,泡沫稳定性提高,但蛋白质粒径的增加会降低其在气-水界面的吸附率,造成起泡能力降低[52-53]。Segat等[53]在70 kV条件下使用DBD冷等离子体对乳清分离蛋白模型溶液进行1~60 min的处理,研究表明,蛋白起泡能力在15 min内最大增加了近30%,随着处理时间延长,起泡能力迅速下降,而泡沫稳定性不断提高;此外蛋白质的羰基含量增加,巯基含量下降,表明蛋白质发生氧化。Chizobaekezie等[54]的研究得到了类似的结论,通过APPJ冷等离子体(功率50 kHz、电压7 kV)处理大虾肌动球蛋白发现,经过5 min的处理后大虾肌动蛋白起泡能力提高了约50%,巯基含量和内源荧光强度下降,同样表明蛋白质发生了氧化。因此,可以推测冷等离子体处理能够通过适度氧化改变蛋白质的结构,从而提高起泡性能。
2.5 风味物质结合能力
风味是食品重要的感官性质,蛋白质与风味物质的结合会显著影响食品的整体品质[55]。蛋白质结合风味物质的能力与氨基酸侧链的结构有关,已知的结合机制包括氢键、离子键、二硫键、分子间作用力和疏水相互作用[56]。目前关于冷等离子体对蛋白质风味吸附能力影响的研究相对较少,具体影响机制仍需进一步研究。Luo Ji等[57]研究了DBD冷等离子体对干腌培根中肌原纤维蛋白与芳香族化合物结合能力的影响,结果表明,在60 kV和70 kV条件下处理150 s后,肌原纤维蛋白与多种醛类(尤其是壬醛和辛醛)的结合能力均有不同程度的提升,该作者推测这与肌原纤维蛋白的降解、疏水氨基酸含量的增加以及α-螺旋结构的解旋有关。
3 冷等离子体技术在蛋白质改性方面的应用
3.1 提高蛋白膜包装性能
随着世界经济的快速发展,合成包装材料对坏境的污染日益严重,生物可降解的天然聚合物包装材料受到了更多的关注[58]。多种蛋白质已被用于包装薄膜的开发,如小麦面筋蛋白、玉米蛋白、乳清蛋白、酪蛋白等[59]。天然蛋白质膜的包装性能相比于传统合成包装材料而言有一定的缺陷,如玉米醇溶蛋白虽然有稳定的生物降解性、成膜性以及良好的活性物质缓释能力,但这类蛋白膜普遍结构较脆、表面性能较差[60]。冷等离子体中的高能粒子可以轰击固体表面,在微米或纳米范围内改变材料的表面形态,同时引入各种活性基团[61]。因此,将冷等离子体技术用于改善蛋白膜的包装性能,对推动蛋白质在食品包装领域的应用具有重要意义。
已有研究表明冷等离子体技术可以改善蛋白质膜的机械强度、阻隔性、吸水性等包装性能。Moosavi等[62]对比了乳清蛋白可食膜和谷蛋白可食膜经低压辉光放电冷等离子体(载气为空气)处理后的包装性能,研究发现处理10 min后,乳清蛋白膜的拉伸强度(tensile strength,TS)和断裂伸长率(elongation at break,EAB)分别增加了56.09%和84.84%,谷蛋白膜的TS增加了38.67%,EAB有所下降;乳清蛋白的接触角从61.18°下降到了42.05°,表明膜的亲水性提高;两种蛋白膜的处理结果并不相同,这可能是由于两种蛋白质的组成不同,乳清蛋白中的半胱氨酸更容易产生二硫键,而谷蛋白中的谷氨酰胺更易形成氢键。Chen Guiyun等[63]采用DBD冷等离子体对壳聚糖-玉米蛋白复合膜进行30、60、90、120、150 s的处理后发现,纯玉米蛋白膜和复合玉米蛋白膜的TS均显著提高,并在60 s时到达到最大值;傅里叶变换红外光谱分析表明冷等离子体处理过程中部分的β-转角和无规卷曲转化成了α-螺旋和β-折叠结构。Wu Xiaomeng等[64]在DBD冷等离子体对酪蛋白膜性能改善作用的研究中发现,当条件为50 V、60 s时,蛋白膜的TS增加了33.33%,而当条件为50 V、30 s时,蛋白膜的TS增加了61.29%;不同条件处理均能显著降低水蒸气透过率。该学者推测冷等离子体处理可以改变酪蛋白膜内晶体分布的平衡,水分子可以通过的间隙数量和间隙大小也随之变化,这在扫描电子显微镜分析结果中得到印证。Viviane等[65]研究了辉光放电冷等离子体结合巴西棕榈蜡对鱼蛋白膜包装性能的改善作用,结果显示鱼蛋白膜在10 Pa、5 W条件下处理1 min后,TS增加75%,水蒸气透过率减少65%。虽然冷等离子体技术能够改善蛋白膜的包装性能,但以上研究均发现,经冷等离子体处理后的蛋白膜存在热稳定性下降、色泽偏黄、透明度降低等问题,这在一定程度上会影响消费者对此类包装产品的可接受度。可见冷等离子体对不同蛋白质膜的处理效果是不同的,即便是同种蛋白质膜,由于选择的气体成分不同,处理效果也会存在一定差异。此外,不同的电压和处理时间也会显著影响蛋白膜的改性效果,在实际应用中要合理选择冷等离子体处理条件。对经过冷等离子体处理后的食品原料进行安全性分析是保障食品安全的重要环节,但目前相关的毒理性研究十分有限。Han等[66]在MD冷等离子体对脱脂豆粕可食膜口服毒性影响的研究中发现,在400 W的条件下处理15 min后,可食膜的强度、拉伸性和防潮性分别提高了6.8%、13.4%和24.4%。在急性和亚急性毒性实验中,大鼠每天口服可食膜悬浮液剂量分别为5 000 mg/kgmb和1 000 mg/kgmb,连续投喂14 d后,所有大鼠均未出现死亡或中毒迹象,血液理化分析和肝脏切片观察也无明显异常。因此研究人员认为MD冷等离子体处理不会在可食膜中产生有害副产物。
3.2 降低致敏蛋白抗原性
食物过敏是影响人体健康的全球公共卫生问题之一。能够引发过敏反应的蛋白质来源有牛奶、鸡蛋、鱼、甲壳类、坚果、花生、小麦和大豆等食物[67]。其中分子质量为10~70 kDa的水溶性糖蛋白是导致食物过敏的主要致敏原,当人体摄入致敏蛋白后,免疫球蛋白(immunoglobulins,IG)(IgE、IgG等)会与致敏蛋白的特定位点(表位)结合,从而发生非正常免疫反应[68]。表位与蛋白质的三维构象有关,当蛋白质因外源因素导致结构变化时,表位的功能结构也可能随之发生变化,从而影响致敏蛋白表位与免疫球蛋白的结合,降低相关蛋白质的致敏性[69]。冷等离子体中的活性物质可以改变天然蛋白质的结构,因此在修饰食物中致敏蛋白抗原结构,降低致敏蛋白抗原性方面有重要的研究价值。
Sun Fusheng等[70]采用APPJ冷等离子体对麦醇溶蛋白处理60 min后发现,麦醇溶蛋白的免疫反应性仅为对照组的48.05%,实验中的R5抗体可以特异性结合麦醇溶蛋白的表位结构(特异性五肽QQPPFP),据此可推断麦醇溶蛋白免疫反应性降低与冷等离子体对其表位结构的修饰有关。Meinlschmidt等[71]讨论了DBD冷等离子体和MD冷等离子体对β-伴大豆球蛋白(Gly m5)和大豆球蛋白(Gly m6)两种过敏原的结构修饰作用,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)图谱显示,经过10 min的DBD冷等离子体处理后,Gly m5和Gly m6对应的10 kDa和15 kDa条带几乎完全消失,而经过15 min的MD冷等离子体处理后,10 kDa和15 kDa条带灰度也明显变浅;在Gly m5的酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)分析中,DBD冷等离子体可使蛋白的免疫反应性几乎100%丧失,而MD冷等离子体处理90 min时蛋白免疫反应性也下降了89%。Venkataratnam等[72]采用80 kV的DBD冷等离子体对带皮花生粉和脱脂花生粉进行0~60 min处理后发现,花生过敏原Ara h1与免疫球蛋白IgG的结合能力下降,两种花生粉的抗原性分别降低了43%和9.3%。以上研究对冷等离子体降低蛋白质致敏性的机理有着相似的看法,即认为冷等离子体产生的活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)会攻击氨基酸侧链,裂解肽的二硫键,破坏表位结构,使致敏性下降。然而关于冷等离子体对致敏蛋白影响的研究结论并不统一,Filho等[73]报道称,腰果致敏蛋白经低压辉光放电冷等离子体处理后的SDS-PAGE图谱与对照组无明显差异,在ELISA实验中也得到了同样的结论;对非蛋白成分分析发现,蔗糖含量从33 mg/g减少到了18 mg/g,脂肪酸含量相较于对照组增加了7.6%。冷等离子体在降低抗原蛋白致敏性方面存在差异,原因可能与冷等离子体产生方式有关,Filho等[73]在其研究中使用的是低压冷等离子体,产生的ROS、RNS的种类和浓度可能与常压等离子体有较大的不同。
3.3 降低内源酶活性
天然内源酶广泛存在于众多食品之中,不同种类的酶会对食品品质产生不同的影响。蛋清中的溶菌酶可以酶解微生物细胞壁,能够有效杀灭多大部分革兰氏阳性菌及部分革兰氏阴性菌(如大肠杆菌等)[74]。但也有部分酶的存在会对食品的质量产生不利影响,如新鲜水果和蔬菜在贮藏加工过程中会因多酚氧化酶和过氧化物酶的作用发生酶促褐变[75]。食品中大部分酶的化学本质是蛋白质,具有蛋白质的理化性质和各级结构,因此冷等离子体技术可以用于食品中内源酶的物理改性[76]。
近年来越来越多的研究显示冷等离子体技术可以有效降低食品中内源酶的活性。Segat等[77]分别使用40、50、60 kV的DBD冷等离子体对碱性磷酸酶(alkaline phosphatase,ALP)进行15 s~5 min的处理,研究发现,经过120 s处理的ALP活性损失45%~50%,经过180 s处理后活性低于10%。通过圆二色光谱分析,ALP的主要二级结构为α-螺旋,随着处理时间的延长和电压的增加,α-螺旋含量呈下降趋势,这有可能是ALP失活的主要原因。Bußler等[78]对鲜切马铃薯和苹果进行2.5、5、7、10 min的MD冷等离子体处理后发现,多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)的活力均随处理时间的延长而下降,当处理时间为10 min时,苹果中的PPO和POD活力分别下降了62%和65%,马铃薯中的PPO和POD活力分别下降了77%和89%。Kang等[79]在MD冷等离子体处理对马铃薯PPO活力影响的研究中发现,当MD冷等离子体功率为900 W,处理时间为40 min时,马铃薯中PPO活力从72.4%显著降低至59.0%。Tappi等[80]研究了DBD冷等离子体处理对鲜切苹果品质的影响,经过10、20、30 min处理后PPO活力均有所下降,其中30 min处理组的PPO活力下降了58 %。目前关于冷等离子体灭活酶的机理比较一致的解释是ROS和RNS会破坏蛋白质的二级结构(如α-螺旋含量减少),并对芳香族氨基酸侧链进行结构修饰,造成酶失活[81-82]。表2总结了近几年冷等离子体技术在降低食品中内源酶活性方面的应用。
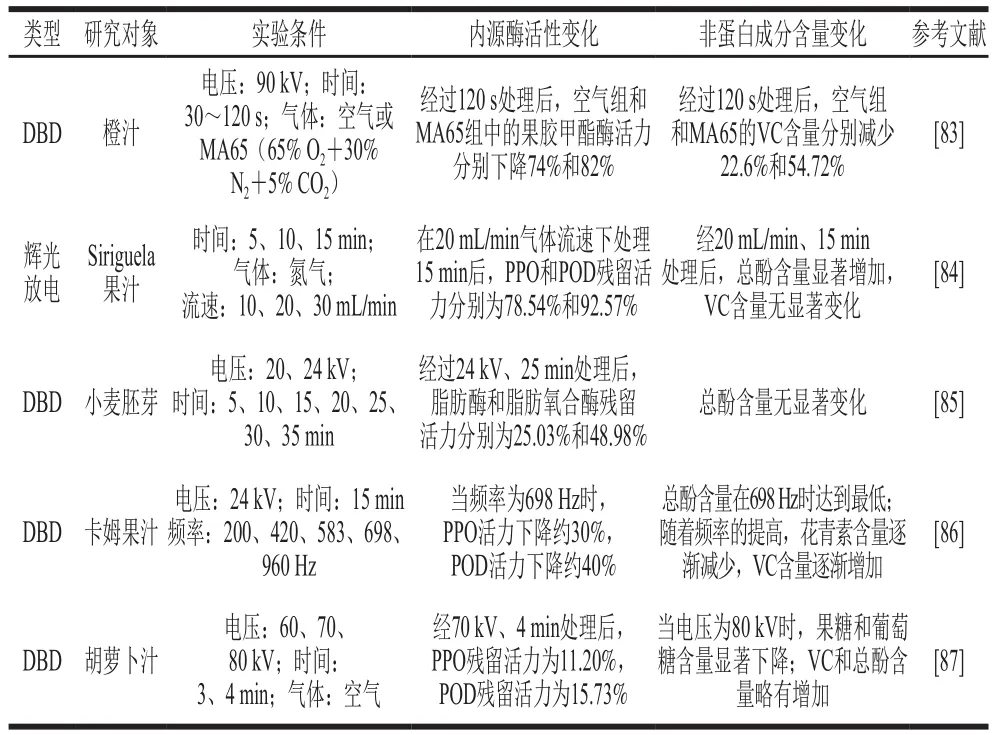
表2 冷等离子体技术在降低食品中内源酶活性方面的应用Table 2 Application of cold plasma technology in reducing the activity of endogenous enzymes in foods
4 结 语
食品中天然蛋白质的改性一直以来都是国内外学者研究的重点。冷等离子体技术作为一种新兴的非热物理加工技术,能够在最大限度保持蛋白质营养价值的同时改变蛋白质的结构,优化蛋白质的功能特性,且在使用过程中无需额外添加化学试剂,无残留物、高效节能、环境友好,是传统蛋白质功能改性技术良好的替代方法。但目前冷等离子体技术在实际应用中并不十分成熟,未来可以从以下3 个方面展开研究:1)缺乏与传统蛋白质功能改性方法的对比研究,冷等离子体技术虽然有着自身独特的优势,但要真正作为传统改性方法的替代技术就必须与酶法、化学法等技术进行全方面的对比研究,如效率、稳定性等;2)安全性研究不足,冷等离子体中的有效活性成分复杂,作用食品蛋白质后的安全性需要大量的实验来验证;3)技术条件不明确,设备、气体、电压、频率,这些因素都会影响到冷等离子体的工作效率。尤其是气体,电离后产生的化学活性成分在很大程度上取决于气体的类型,而且稀有气体的用量也会直接影响到使用成本。因此,研究冷等离子体技术的具体作用机制、建立统一的技术标准,对推动其工业化应用意义重大。
- 食品科学的其它文章
- 天然抗氧化剂对鱼糜及鱼糜制品抗氧化能力及品质影响的研究进展
- 茶多酚对小麦淀粉理化特性和面包品质的影响及机理
- 运动对苏尼特羊脂肪代谢和肉品质的影响
- 升温方式对鲢鱼肌球蛋白结构和理化性质的影响
- Thermal Unfolding and Aggregation Process of Recombinant Staphylococcal Enterotoxin M (rSEM) Associated with Potential Toxin Responsible for Staphylococcal Food Poisoning
- 小米麸皮水溶性膳食纤维-Cr(III)配合物的合成、表征及其体外抗氧化活性

