基于高压静电场处理的樱桃番茄果实贮藏期生理品质及其代谢
杨智超,曹 阳,沈超怡,孙崇德,吴 迪,*
(1.浙江大学农业与生物技术学院,浙江 杭州 310058;2.浙江大学新农村发展研究院,浙江 杭州 310058)
番茄(Solanum lycopersicumL.)又称西红柿,含有丰富的维生素、矿物质、酸类和糖类等营养物质,经常食用能提高人体免疫力[1-3]。樱桃番茄是番茄大家族的重要成员,在我国的种植面积不断扩大[4]。樱桃番茄皮薄多汁,成熟后会迅速软化,贮运过程容易腐烂,造成品质下降[5];同时由于樱桃番茄常被鲜食,其表面的食源性致病菌过多容易引发食源性疾病[6-7]。因此,减少樱桃番茄果实采后腐烂和降低果实表面微生物数量非常重要。
高压静电场(high voltage electrostatic field,HVEF)是指在单位距离上通过稳定的高压作用而形成的一种静电场[8]。HVEF处理可以通过多种方式实现果蔬保鲜[9-10],主要包括:1)改变果实的电场能;2)电离空气中的氧气形成臭氧;3)影响果实细胞膜的离子通透性;4)改变果蔬酶活性;5)破坏乙烯和有关挥发性物质;6)去除空气传播的真菌孢子;7)在贮存环境中产生和释放空气负离子和其他活性物质。由于HVEF处理只涉及物理过程,无化学药物残留,因此是一种绿色的杀菌保鲜方法[11]。并且与传统高温杀菌相比,HVEF处理不产生高温,能更好地保留果蔬中的营养成分,并且具有耗能低的优势。因此,HVEF在果蔬等食品杀菌中有着广阔的应用前景[12]。
此前研究发现,HVEF处理会引起生物体内的酶活性变化,从而影响一系列代谢功能[9]。已有学者研究了不同果蔬经HVEF处理后的品质变化,包括苹果[13]、芒果[14]、柿子[15]、柑橘[16]、梨[17]等。代谢组学是研究生物系统对生物刺激或遗传信息改变的整体动态代谢反应,理解复杂多细胞系统中随时间的系统变化,寻求对复杂生物样本代谢进行分析描述的一门学科[18]。由于代谢物能将基因和蛋白表达的微小变化进行体现与放大,因此,通过代谢组学分析既可发现生物体在受到各种内外环境扰动后的不同应答,也可以区分同种不同个体之间的表型差异[19]。
本实验以新鲜‘黄妃’樱桃番茄为材料,以表面腐烂率、大肠杆菌菌落总数、乙烯释放量、呼吸速率、质量损失率等为评价指标,研究了在不同电场强度和不同处理时间下HVEF处理对樱桃番茄采后贮藏保鲜的影响;同时对HVEF处理后的樱桃番茄果实进行代谢组学分析,探究其代谢产物在处理后的含量差异和变化趋势。
1 材料与方法
1.1 材料与试剂
新鲜‘黄妃’樱桃番茄购于湖州南浔庆丰园农场,挑选大小一致、无病虫害的樱桃番茄若干,30 min内运送至浙江大学紫金港校区实验室;大肠杆菌O157:H7(菌种编号:ATCC25922) 上海生物保藏中心。
伊红美蓝(eosin-methylene blue,EMB)培养基浙江格陵设备科技有限公司;氯化钠 浙江同力信息科技有限公司。
1.2 仪器与设备
ZJU-GYJD-001型高压静电场试验仪器为浙江大学自主研发,包括控制台、高压静电电源(电压范围为0~90 kV)和果实处理装置(电场强度范围为0~1 800 kV/m)。其中,果实处理装置为带卡槽的绝缘支架组成的密闭箱体,通过调节高低压电极板的距离,可形成不同的电场强度。
BSA2202S电子天平 德国Sartorius公司;Research plus移液枪 德国Eppendorf公司;HZ-9210K摇床天津华立达公司;7980气相色谱仪 美国Agilent公司;CheckPoint II便携式O2/CO2测定仪 美国MOCON Europe A/S公司;Scientz-100F冻干机 宁波新芝生物科技股份有限公司;MM400 Retsch研磨仪 德国RETSCH公司。
1.3 方法
1.3.1 单因素试验设计
实验1:以樱桃番茄表面大肠杆菌菌落数为评价指标,以电场强度、处理时间为因素,设置10 个水平进行试验,试验设计见表1。
实验2:进一步以腐烂率、乙烯释放量、呼吸速率和质量损失率为评价指标,从表1中选择CK、处理组1-1(处理组1,电场强度最低、时间最短)以及处理组3-3(处理组2,电场强度最高、时间最长)进行试验,试验设计及见表2。
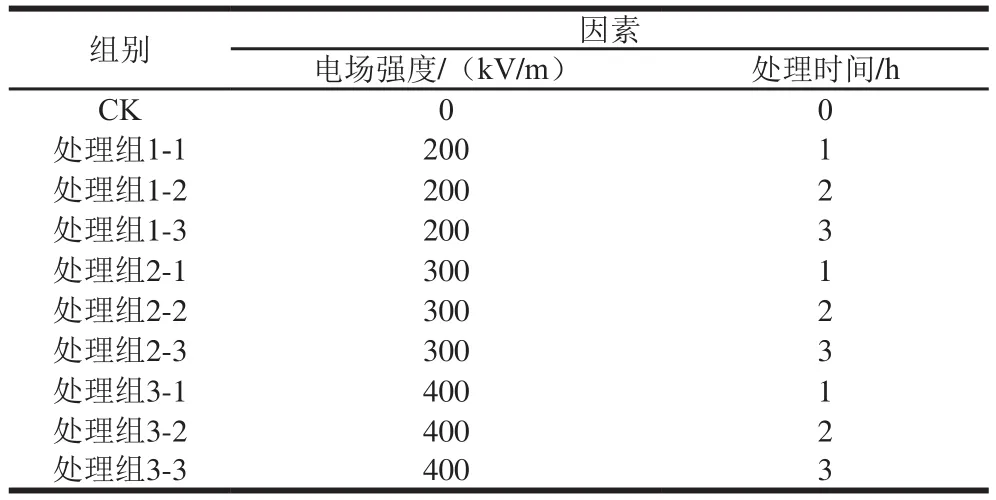
表1 高压静电场处理樱桃番茄试验因素水平Table 1 Electric field intensities and durations of HVEF treatment
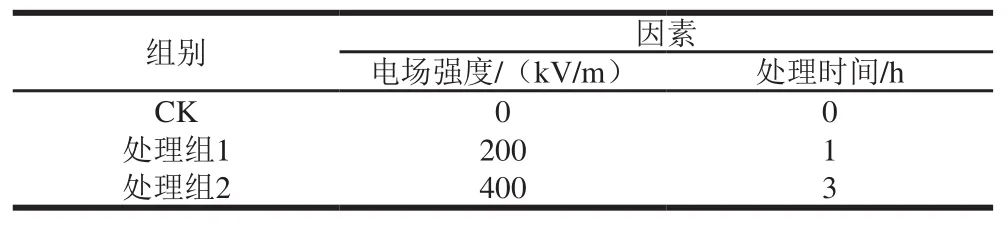
表2 高压静电处理实验组别表Table 2 Experimental groups for high voltage electrostatic field treatment
对实验2中CK组、处理组1和处理组2的果实,通过超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrum,UPLC-MS/MS)检测平台和自建数据库进行代谢物检测,并对检测出的代谢组数据进行代谢物数据处理与分析。每组处理共3 次重复。
1.3.2 大肠杆菌接种
将大肠杆菌O157:H7在37 ℃ LB液体培养基中培养至浓度约为5×106CFU/mL备用。在实验1中,将果实浸泡在大肠杆菌悬液中5 min,以保证充分接种。每次处理15 个樱桃番茄,5 个一组,共3 组重复。
1.3.3 HVEF处理
将樱桃番茄置于高压静电场试验仪器的果实处理装置中进行HVEF处理,其中实验1为接菌后的果实,实验2为未接菌的果实。实验2将处理后的果实置于90%相对湿度、4 ℃的冷库贮藏备用。HVEF处理在室温下进行。本实验所设计使用的高压静电场试验仪器可手动调节电压和电极板间的距离。因此,本实验中不同处理组所需要的电场强度是通过改变电压和电极板间距离的数值来获得的,具体计算如公式(1)所示。

1.3.4 菌落形成单位计数法计算大肠杆菌菌落总数
实验1中,HVEF处理后,采用菌落形成单位计数法计算樱桃番茄表面的大肠杆菌数量。选取(25±1)g完整樱桃番茄果实置于225 mL、质量浓度为0.85%的氯化钠溶液中,樱桃番茄与氯化钠溶液的质量体积比为1∶10,置于摇床上充分摇晃得到样品原液。取100 µL原液,分别用无菌蒸馏水稀释10、100、1 000倍,共3 个梯度。吸取稀释后的溶液各100 µL,于无菌EMB培养基涂布均匀,等待培养基上无水滴后于37 ℃恒温培养48 h,进行平板菌落计数。计算樱桃番茄表面大肠杆菌菌落总数[20]。
1.3.5 腐烂率测定
实验2中,HVEF处理后测定腐烂率。每隔24 h测定腐烂率。每次处理120 个樱桃番茄,40 个一组,共3 组重复。腐烂率按式(2)计算。
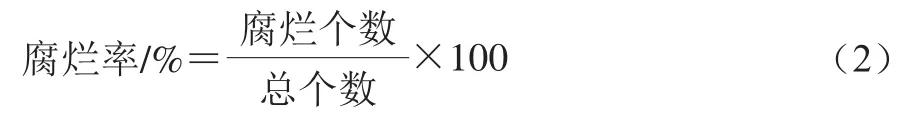
1.3.6 质量损失率的测定
实验2中,HVEF处理后测定质量损失率。每隔24 h测定质量,计算质量损失率。每次处理120 个樱桃番茄,40 个一组,共3 组重复。质量损失率按式(3)计算。

1.3.7 乙烯释放量的测定
实验2中,HVEF处理后测定乙烯释放量。将樱桃番茄置于300 mL乐扣盒中,每隔24 h盖上盖子,1 h后用1 mL针管抽取1 mL气体,进样口中,加热器设定温度140 ℃,流速33 mL/min,隔垫吹扫流速为3 mL/min;色谱柱流速30 mL/min,压力18.118 psi;柱箱温度100 ℃;检测器中,加热器温度230 ℃,空气流速400 mL/min,氢气燃气流速40 mL/min,尾吹气流速(N2)为10 mL/min。每次处理24 个樱桃番茄,8 个一组,共3 组重复。
1.3.8 呼吸速率的测定
实验2中,HVEF处理后测定呼吸速率。将樱桃番茄置于300 mL乐扣盒中,每隔24 h盖上盖子,1 h后用便携式O2/CO2测定仪测定呼吸速率。每次处理24 个樱桃番茄,8 个一组,共3 组重复。
1.3.9 代谢组学分析样品提取流程
实验2中,HVEF处理后进行代谢组学分析。樱桃番茄样品放置于冻干机中真空冷冻干燥,随后利用研磨仪研磨(30 Hz、1.5 min)至粉末状。称取100 mg的粉末,溶解于0.6 mL体积分数70%甲醇提取液中,并将溶解后的样品于4 ℃冰箱过夜,期间漩涡6 次以提高提取率;将提取液离心(10 000×g、10 min)后吸取上清液,用微孔滤膜(0.22 µm)过滤样品,并保存于进样瓶中,用于UPLC-MS/MS分析。
1.3.10 代谢物定性与定量分析
基于自建数据库MWDB(metware database),根据二级谱信息进行物质定性,分析时去除了同位素信号,含K+、Na+、NH4+的重复信号,以及本身是其他更大分子质量物质碎片离子的重复信号。
1.4 数据处理与分析
1.4.1 主成分分析
主成分分析(principal component analysis,PCA)利用前几个主要成分揭示各组之间的总体代谢差异以及组内样本之间的变异性。将原始数据压缩成n个主成分来描述原始数据集的特征,PC1表示能描述多维数据矩阵中最明显的特征,PC2表示除PC1之外所能描述数据矩阵中最显著的特征,PC3…PCn以此类推。PCA用R软件(www.r-project.org/)的内置统计prcomp函数,设置prcomp函数参数scale=True,表示对数据进行unit variance scaling(UV)归一化。
1.4.2 正交偏最小二乘法判别分析
正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)可以最大程度地提高组间的差异,是一种筛选差异代谢物的有效方法。OPLS-DA在原始数据进行log2转换后,再进行中心化处理,利用R软件中的MetaboAnalystR包OPLSR.Anal函数进行分析。Q2是评估OPLS-DA中模型的重要参数。Q2大于0.5时可认为是有效的模型,Q2大于0.9表示模型出色。
1.4.3 差异代谢物筛选
在对检测到的代谢物进行定性和定量分析后,结合具体样品的分组情况,比较各分组中代谢物定量的差异倍数(fold change,FC)变化,并对各分组间的差异倍数进行log2处理后,将变化排在前面的差异表达代谢物进行结果展示。筛选标准:选取FC≥2和FC≤0.5的代谢物。代谢物在对照组和实验组中FC≥2和FC≤0.5,则认为差异显著。
1.4.4 差异代谢物KEGG分类和代谢物富集分析
利用KEGG数据库[21]对差异代谢物进行注释,对差异显著代谢物KEGG的注释结果按照KEGG中通路类型进行分类。根据差异代谢物结果,进行KEGG通路富集,其中富集因子为通路中差异表达代谢物的个数与该通路中所有检测到的代谢物总数之间的比值,该值越大表示富集程度越大。
2 结果与分析
2.1 微生物分析结果
采用菌落形成单位计数法测定未经HVEF处理(CK组)和HVEF处理后的樱桃番茄表面大肠杆菌菌落总数,结果如图1所示。与CK组大肠杆菌菌落总数(4.79(lg(CFU/g)))相比,不同处理水平的果实表面大肠杆菌菌落总数均显著降低(P<0.05),降低数量在1.44~2.15((lg(CFU/g)))之间,说明HVEF处理能够有效杀灭樱桃番茄果实表面的食源性致病菌,保障消费者健康。
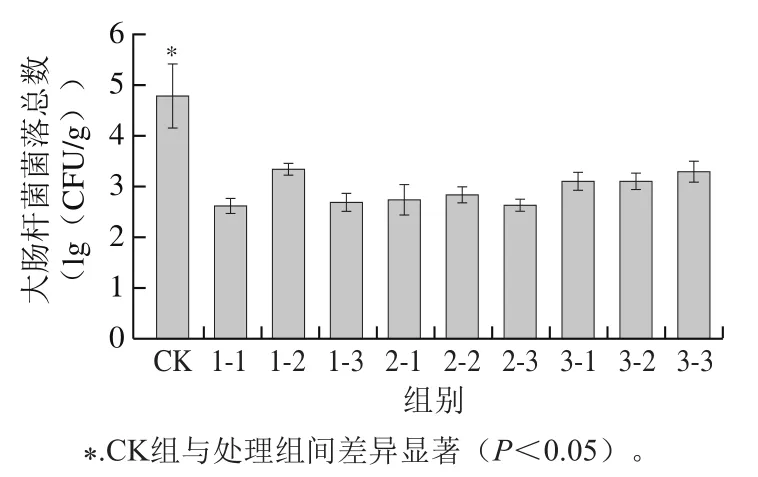
图1 HVEF处理对樱桃番茄果实表面大肠杆菌菌落总数的影响Fig. 1 Effect of HVEF treatment on the total number of Escherichia coli colonies on the surface of cherry tomato fruits
2.2 生理指标分析结果
2.2.1 腐烂率
腐烂率是判断果蔬保鲜效果的重要指标。HVEF处理后果实在18 d贮藏期的腐烂率变化如图2所示。CK组果实在第8天开始腐烂,腐烂率达到5.83%;处理组1没有发生腐烂,而处理组2腐烂率仅为0.83%。贮藏8~18 d,各组腐烂率均逐渐增加,但两个处理组的腐烂率较CK组始终低5%~10%。此外,两个处理组在贮藏8~12 d期间的腐烂率较为接近,但在贮藏14 d后,处理组2的腐烂率与处理组1相比低5%~9%。上述结果表明,HVEF处理能够延缓樱桃番茄采后腐烂,延长贮藏时间,且腐烂率的降低与处理强度和时间有关。
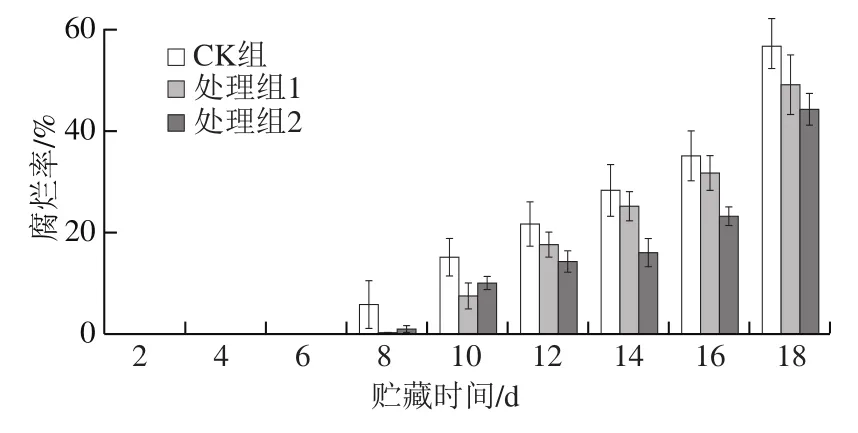
图2 HVEF处理对樱桃番茄果实腐烂率的影响Fig. 2 Effect of HVEF treatment on decay rate of cherry tomato fruits
2.2.2 质量损失率
质量损失率可以反映果实水分的散失状况[22]。HVEF处理后樱桃番茄的质量损失率变化如图3所示。随着贮藏时间的延长,CK组和处理组的质量损失率都呈增加趋势。各组间质量损失率差异均不显著,说明HVEF处理对樱桃番茄采后质量损失并无影响。
2.2.3 乙烯释放量
内源乙烯的大量合成会加速果实的成熟与衰老[23]。由于4 ℃贮藏环境下,果实的乙烯释放量偏低,为了更好地研究HVEF处理后果实的乙烯释放量变化,将HVEF处理后的果实放置于20 ℃下贮藏,并测定其乙烯释放量,结果如图4所示。HVEF处理后第0天,处理组的乙烯释放量均低于CK组;处理后1~2 d,两个处理组的乙烯释放量仍低于CK组;随着贮藏时间的延长,3 组之间乙烯释放量总体无显著性差异,但处理组的乙烯释放量依然低于CK组。以上结果表明,HVEF处理对果实内源乙烯的合成与释放在贮藏前期有一定的抑制作用,从而有助于延缓樱桃番茄果实的衰老进程,延长贮藏时间。
2.2.4 呼吸速率
呼吸速率是评价果实采后成熟衰老和贮藏性的重要指标之一[24-25]。由于4 ℃贮藏环境下果实呼吸速率偏低,为了更好地研究HVEF处理后樱桃番茄的呼吸速率变化,将HVEF处理后的果实置于20 ℃下贮藏,并测定其呼吸速率,结果如图5所示。在前中期贮藏过程中果实的呼吸速率呈下降趋势,但在贮藏后期果实呼吸速率上升。番茄属于呼吸跃变型果实[26],因此后期呼吸速率上升可能是由于内源乙烯含量上升,诱导番茄果实发生呼吸跃变。但不同的处理组之间总体无显著差异。上述结果表明,HVEF处理在杀菌保鲜的同时,可以保证樱桃番茄果实正常的呼吸速率。

图5 HVEF处理对樱桃番茄果实呼吸速率的影响Fig. 5 Effect of HVEF treatment on respiration rate of cherry tomato fruits
2.3 代谢组学分析结果
2.3.1 代谢物定性分析结果
利用Analyst 1.6.3软件处理质谱数据。对每个时间点质谱图中所有离子的强度进行加和,然后连续描绘得到图谱,进而分析获得混样质控(quality control,QC)样本的总离子流(total ions current,TIC)重叠图。通过对不同QC样本TIC图进行重叠展示分析,可以判断代谢物提取和检测的重复性和可靠性。结果如图6所示,代谢物检测总离子流的曲线重叠性高,表明质谱对同一样品检测不同时间时,信号稳定性较好。同时,以橘皮素和5,6,7,4’-四甲氧基黄酮为例,对具体代谢物二级质谱图进行展示(图7)。二级质谱图显示出两种代谢物在质谱分析过程中的碎片离子信息。将检测出的二级质谱图与数据库中二级谱图进行比对,实现代谢物定性。

图6 QC样本质谱检测TIC重叠图Fig. 6 Overlapping total ion current (TIC) chromatographs of QC samples
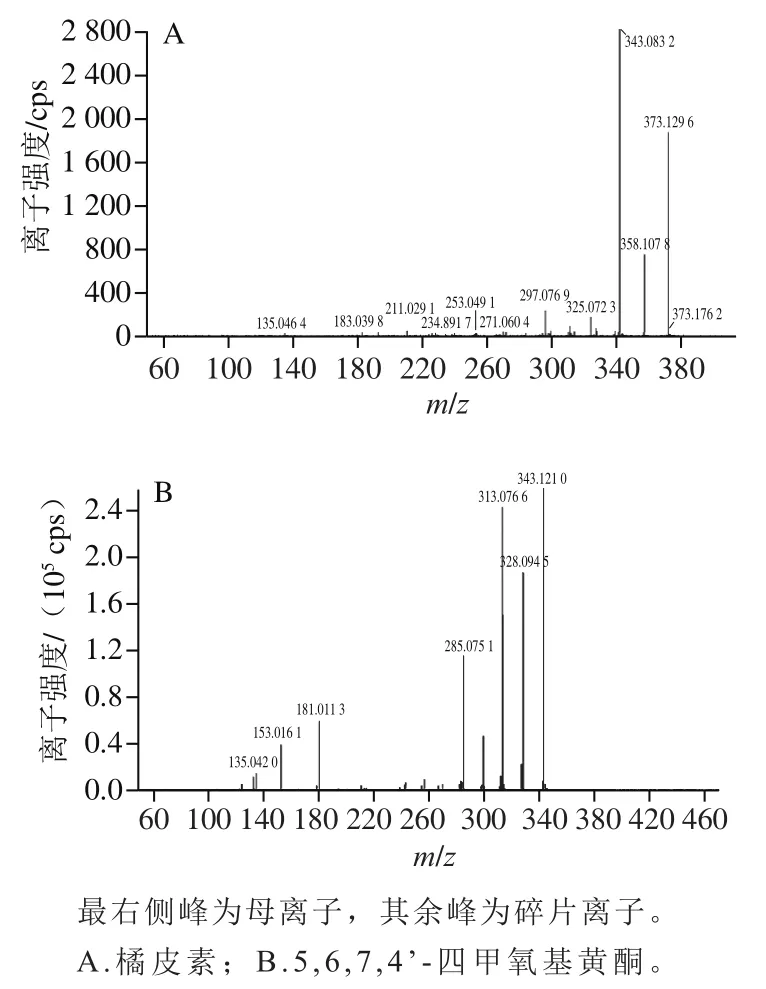
图7 代谢物二级质谱图Fig. 7 Secondary mass spectra of metabolites
2.3.2 代谢物PCA和层次聚类分析结果
PCA得分图如图8所示。前两个主成分PC1和PC2的贡献率分别为24.07%和20.93%,两者的累计贡献率达到45%。在PCA得分图中3 个组和QC样品可以分开,并且处理组1、处理组2和QC重复的样本紧凑聚集,表明实验可重复且可靠。CK组样本较离散,可能是由于生物差异性导致的。为消除数量对模式识别的影响,对每种代谢物的峰面积进行lg变换,随后进行层次聚类分析,以展示CK组分别与处理组1和处理组2的代谢物差异。图9中CK组含量较高的代谢物集中在聚类分析结果的中下部,而处理组1和处理组2含量较高的代谢物分别聚集在中上部和上部。PCA和聚类分析共同表明3 个组的果实具有不同的代谢产物谱。
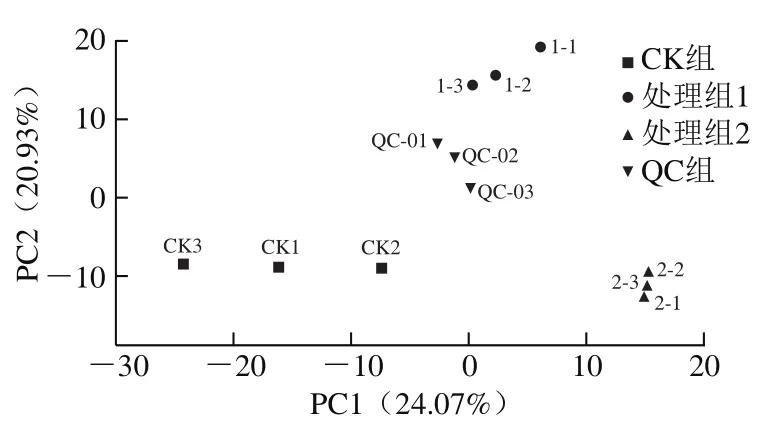
图8 PCA得分图Fig. 8 PCA score plot of PC1 versus PC2
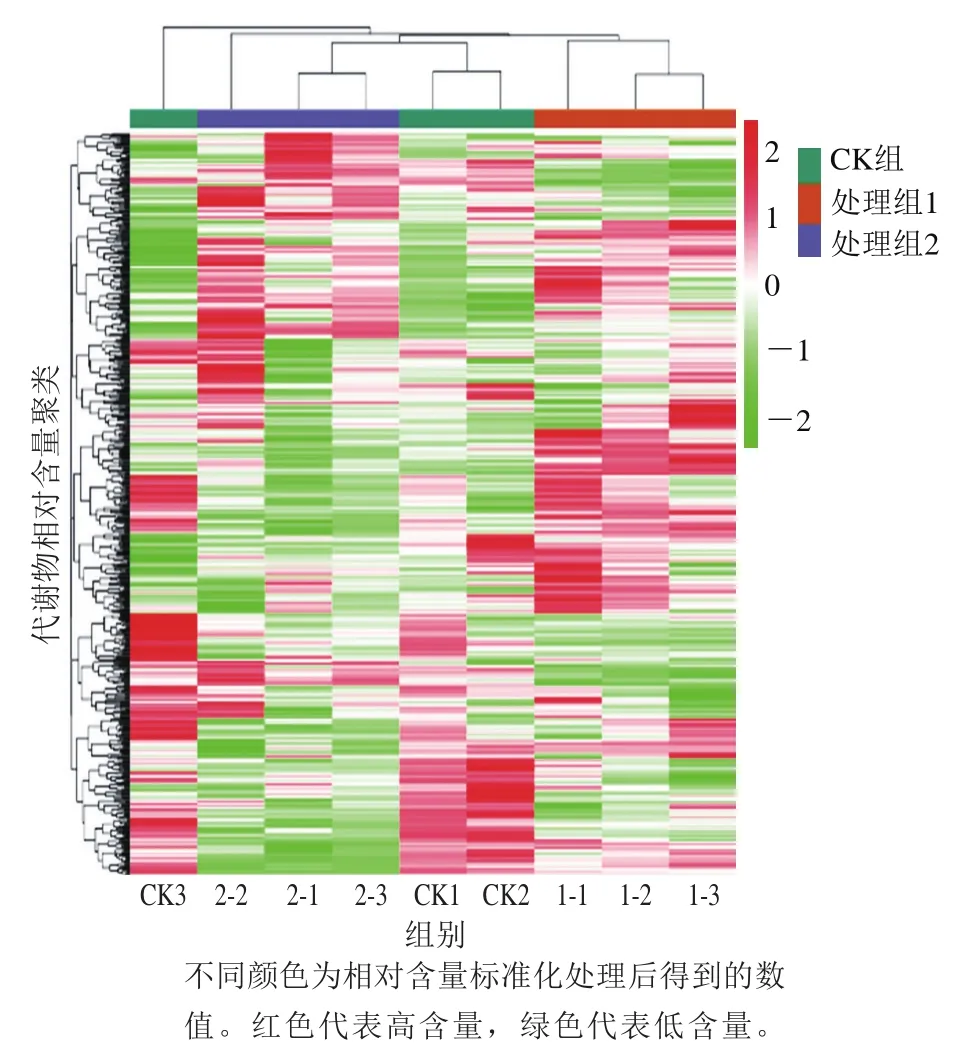
图9 层次聚类分析Fig. 9 Hierarchical clustering analysis
2.3.3 代谢物OPLS-DA结果
OPLS-DA模型成对比较了不同处理组中样品的代谢物含量。图10分别显示了CK组和处理组1间的差异(R2X=0.747,R2Y=1,Q2=0.988)、CK组和处理组2之间的差异(R2X=0.727,R2Y=0.999,Q2=0.992)以及处理组1和处理组2之间的差异(R2X=0.722,R2Y=1,Q2=0.998)。所有处理组间比较的Q2均超过0.9,说明这些模型稳定且可靠,可用于代谢物筛选。
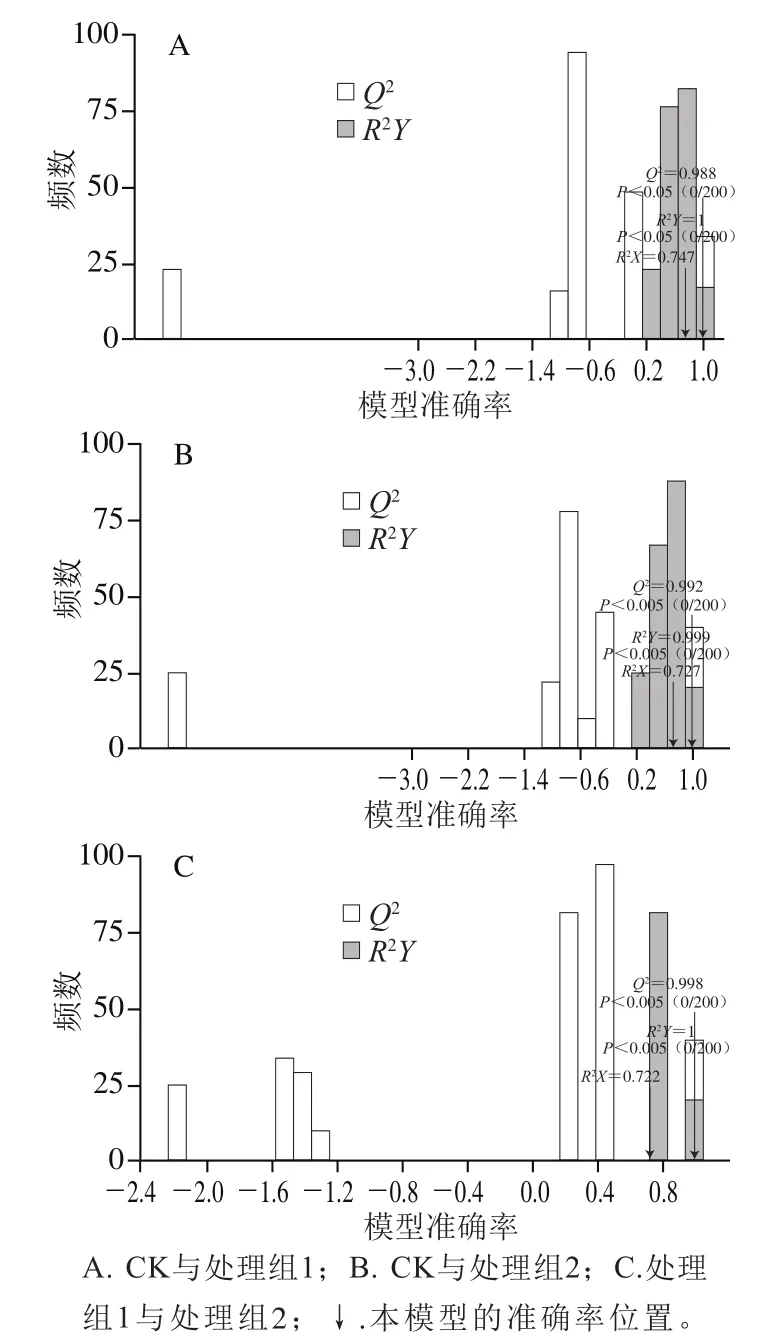
图10 OPLS-DA模型Q2Fig. 10 Q2 value of OPLS-DA model
2.3.4 差异代谢物筛选
如图11所示,处理组1与CK组间共有20 种代谢物存在显著差异(P<0.05),其中10 种代谢物上调,10 种代谢物下调;处理组2与CK组之间共有14 种代谢物存在显著差异(P<0.05),其中8 种代谢物含量上调,6 种代谢物含量下调。表3显示,HVEF处理后差异代谢物的变化主要存在上调和下调两种趋势。

表3 HVEF处理后樱桃番茄差异代谢物的主要变化趋势Table 3 Major trend of differential metabolites in cherry tomato fruits after HVEF treatment
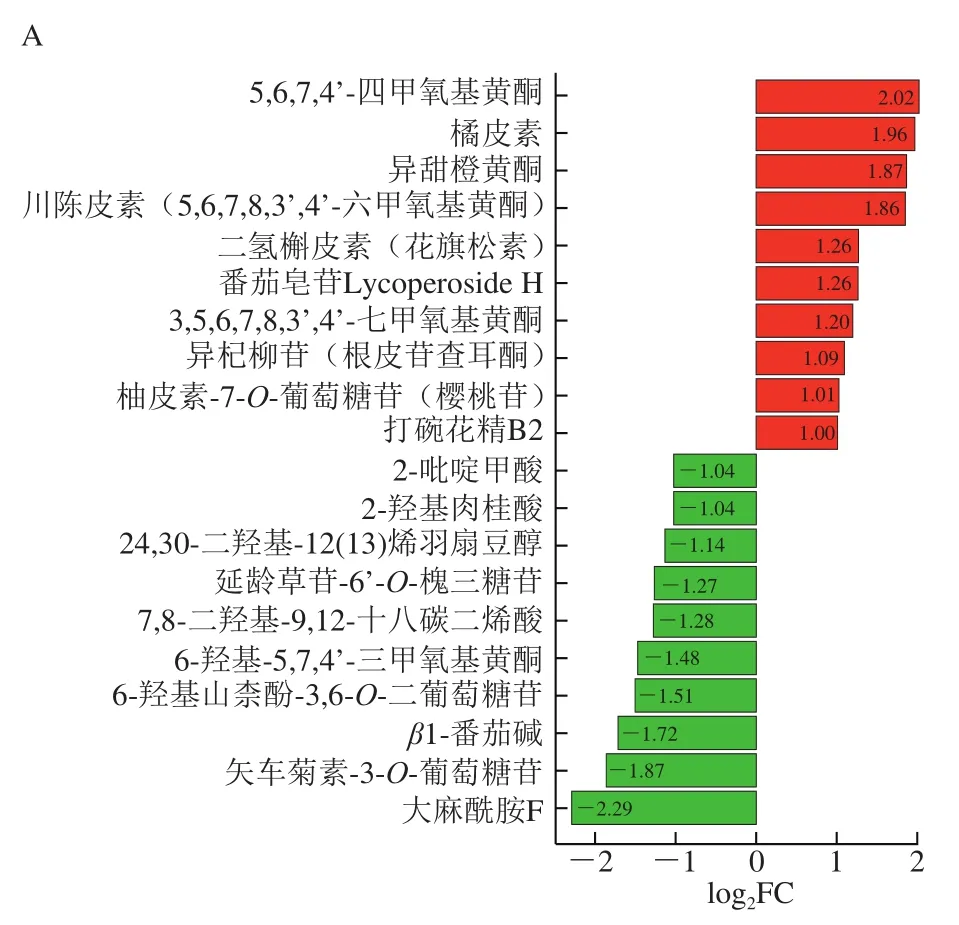
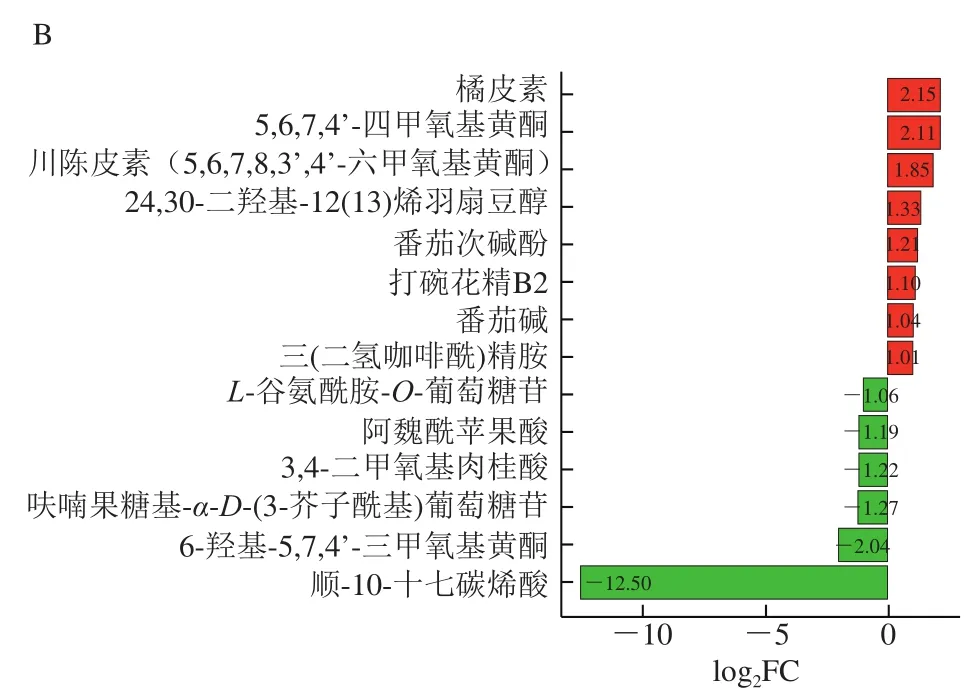
图11 处理组1与CK组差异代谢物(A)以及处理组2与CK组差异代谢物(B)Fig. 11 Differential metabolites between treatment group 1 and control group (A), and between treatment group 2 and control group (B)
在上调趋势中,共有3 种上调形式。第1种上调方式是相比CK组,处理组1和处理组2的代谢物含量均显著上升(P<0.05),但两个处理组间无显著差异(P>0.05)。该类代谢物主要包括属于类黄酮的橘皮素、川陈皮素(5,6,7,8,3’,4’-六甲氧基黄酮)、5,6,7,4’-四甲氧基黄酮,以及生物碱中的打碗花精B2。说明在电场强度最低、时间最短和电场强度最高、时间最长的条件下,这些代谢物含量变化程度是一致的。第2种上调方式是处理组1的代谢物含量与CK组无显著差异(P>0.05),但当电场强度和处理时间在处理组1的基础上进一步增加和延长时(处理组2),代谢物含量显著上升(P<0.05)。这类代谢物主要包括生物碱中的三(二氢咖啡酰)精胺和番茄碱。说明只有电场强度较大的时候,才会引起这些代谢物的变化。第3种上调方式是代谢物的含量会随着电场强度增大和处理时间延长而增加,即处理组1的代谢物含量高于CK组,而处理组2的代谢物含量高于处理组1且较CK组显著提高(P<0.05),如生物碱中的番茄次碱酚。说明这些代谢物含量的变化与高压静电的强度有关。
在下调趋势中,共有3 种下调形式。第1种下调方式是相比于CK组,处理组1和2中代谢物含量均显著下降(P<0.05),但两个处理组间无差异(P>0.05),如类黄酮中的6-羟基-5,7,4’-三甲氧基黄酮。第2种下调方式是处理组1与CK组的代谢物含量间无显著差异(P>0.05),但处理组2的代谢物含量较CK组显著下降(P<0.05),主要有酚酸类的3,4-二甲氧基肉桂酸、阿魏酰苹果酸以及脂质中的顺-10-十七碳烯酸。第3种下调方式是处理组1的含量低于CK组,而当电场强度和处理时间进一步增加时(处理组2),代谢物含量进一步下降,且与CK组比显著下降(P<0.05),包括酚酸类的呋喃果糖基-α-D-(3-芥子酰基)葡萄糖苷和属于氨基酸及其衍生物的L-谷氨酰胺-O-葡萄糖苷。
总体而言,HVEF处理后的差异代谢物主要为类黄酮、有机酸、生物碱、脂质和萜类等。其中类黄酮作为植物中一类重要的多酚类次生代谢物质,不仅能够影响果实的色泽和风味,还在抗癌、降血脂、抗病毒、抗糖尿病等方面也有重要作用[27-28];而番茄碱有助于增强机体免疫功能,并具有抗肿瘤的潜在功效[29-30];此外,有机酸和酚酸类物质与果实甜酸风味密切相关[31]。由于HVEF处理后樱桃番茄中部分类黄酮和番茄碱物质含量上升且一些酚酸类物质含量下降,说明HVEF处理具有改善樱桃番茄果实的风味品质和营养价值的作用。
2.3.5 差异代谢物KEGG分类和代谢物富集分析结果
将不同代谢物映射到KEGG数据库,查看有关途径的信息。差异显著代谢物KEGG的注释结果按照KEGG中通路类型进行分类。处理组1与CK组的不同代谢物富集结果表明,所有代谢产物都映射为“代谢”(图12)。进一步进行KEGG途径富集分析,以确定处理组1与CK组之间代谢途径的差异。富集分析结果显示,“类黄酮生物合成(flavonoid biosynthesis)”的代谢物在两个组之间具有显著差异(P<0.05)(图13)。然后对“类黄酮生物合成”途径上的代谢物进行分析,如图14所示。与CK组相比,处理组1的樱桃苷(prunin)、查耳酮2’-O-葡萄糖苷(chalcone 2’-O-glucoside)、二氢槲皮素(dihydroquercetin)在类黄酮生物合成通路中代谢旺盛。对处理组2与CK组进行代谢物富集,但不同代谢物无法富集到代谢通路,这可能是由于差异代谢物没有对应的KEGG通路。

图12 差异代谢物KEGG分类(处理组1与CK组对比分析)Fig. 12 KEGG classification of differential metabolites (comparison between treatment group 1 and control group)
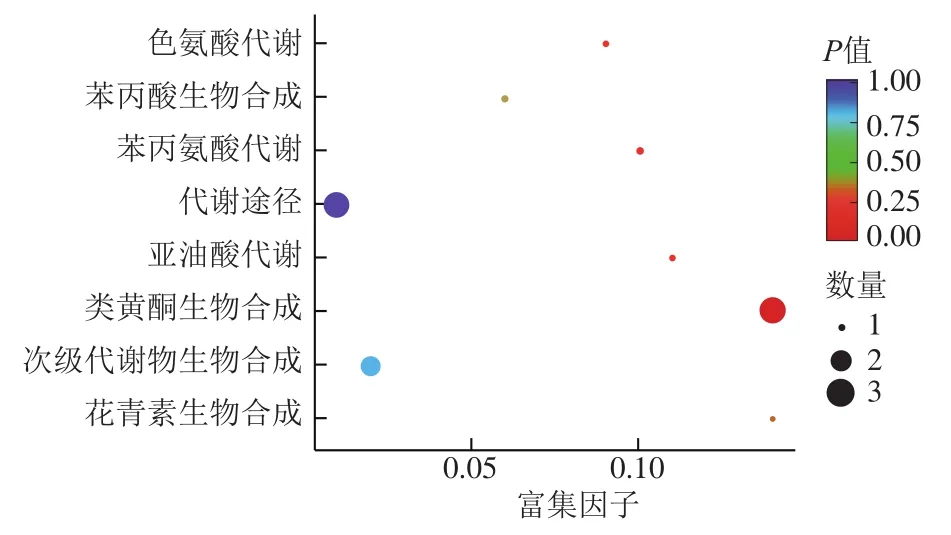
图13 差异代谢物富集分析Fig. 13 Enrichment analysis of differential metabolites
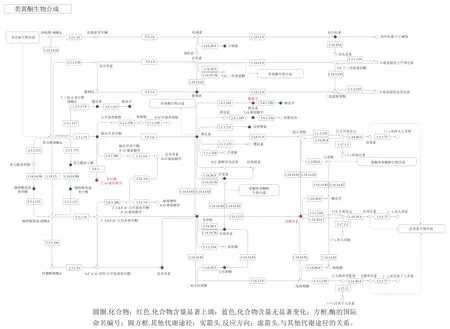
图14 类黄酮生物合成代谢通路(处理组1与CK组对比分析)Fig. 14 Metabolic pathways of flavonoid biosynthesis (comparison between treatment group 1 and control group)
3 结 论
本实验研究了HVEF处理技术对樱桃番茄采后腐烂率、大肠杆菌菌落总数、相关生理指标以及代谢物含量的影响。结果表明,不同电场强度和处理时间的HVEF处理均能显著降低果实表面的大肠杆菌菌落总数,但各处理组间无显著差异。同时,HVEF处理能降低樱桃番茄果实采后贮藏期间的腐烂率,且增大电场强度和延长处理时间能够在贮藏后期进一步降低果实腐烂率。生理生化指标分析结果表明,HVEF处理能够减少果实采后贮藏早期的乙烯释放量,但随时间的延长该影响会逐渐减弱;同时,HVEF处理对贮藏过程中果实的质量损失率和呼吸速率影响较小。对HVEF处理后的果实样品进行代谢组学分析、PCA和聚类分析,结果表明不同HVEF处理的樱桃番茄存在代谢产物谱差异,筛选结果显示差异代谢物主要为黄酮类、有机酸、生物碱、脂质和萜类,其中类黄酮、生物碱等物质含量升高,酚酸类含量下降,说明HVEF处理能够有助于改善樱桃番茄果实的采后品质;类黄酮生物合成代谢通路的分析表明,处理组1与CK组之间部分代谢物具有显着差异(P<0.05)。本实验结果可为樱桃番茄采后杀菌保鲜和品质改善提供技术参考。同时,有关HVEF处理对樱桃番茄果实的杀菌机制和代谢通路的调控机制还有待进一步研究。
- 食品科学的其它文章
- 天然抗氧化剂对鱼糜及鱼糜制品抗氧化能力及品质影响的研究进展
- 茶多酚对小麦淀粉理化特性和面包品质的影响及机理
- 运动对苏尼特羊脂肪代谢和肉品质的影响
- 升温方式对鲢鱼肌球蛋白结构和理化性质的影响
- Thermal Unfolding and Aggregation Process of Recombinant Staphylococcal Enterotoxin M (rSEM) Associated with Potential Toxin Responsible for Staphylococcal Food Poisoning
- 小米麸皮水溶性膳食纤维-Cr(III)配合物的合成、表征及其体外抗氧化活性

