化学平衡中若干问题浅析
高树林,李艳妮,马银海,姜 雯
(昆明学院 化学化工学院,云南 昆明 650214)
化学平衡属于热力学基本原理应用之一,在物理化学中占有重要的地位.文中列举了化学平衡中几个重点和难点问题并进行了讨论,希望对物理化学的教学或学习有所帮助.
1 摩尔反应Gibbs自由能变(ΔrGm)与标准摩尔反应Gibbs自由能变
化学反应发生时,原子或电子之间重新组合,不仅分子的种类和数目发生的变化,而且分子的聚集方式也可能发生变化.显而易见,发生化学反应的系统为组成可变系统,需要用到化学势来解决变化的方向和限度问题,对于只做膨胀功的系统
dG=-SdT+Vdp+∑μBdnB.
(1)
若系统中有多个相α,β,…,应有:dG=dGα+dGβ+…[1].在等温等压条件下,上式变为
dG=∑μBdnB.
(2)
在一巨大系统中,当反应进度Δξ=1 mol时,ΔnB=νB.某物质的化学势是温度,压力和浓度的函数.由于系统巨大,反应前后各物质的浓度(基本)保持不变,因此化学势也不变,对(2)两边同时积分得
ΔrGm=∑νBμB.
(3)
把dnB=νBdξ代入(2)式有
dG=∑νBμBdξ.
(4)
上式两边同除以dξ,与(3)式联立可得
(5)
定义气体的活度为aB=fB/p⊖[2],则化学势的表示通式为
(6)
把上式代入(3)式右边整理得到
(7)
令
(8)
(9)

(10)
此式即为化学反应等温式.在等温等压不做非体积功条件下, ΔrGm的值可以解决化学反应的方向和限度问题.

1.1 物理意义

1.2 影响因素
化学势是对某相某物质而言的,是强度性质的状态函数.若某相中有k种物质
μB=f(T,p,x1,x2, …,xk-1)
(11)
根据(3)式,影响ΔrGm的因素主要有2个:νB和μB的值.①化学反应方程式的写法.例如,一个化学反应如果两边同时乘以一个常数,化学计量数νB会发生改变,因此ΔrGm的值也会改变;②温度、压力和浓度.根据(3)和(11)式,化学势μB是温度、压力和浓度的函数,因此这3个因素也会影响ΔrGm的值.

1.3 作为判据




2 活度商J与标准平衡常数K⊖
J的定义为(9)式,称为活度商.前面提到气体的活度定义为aB=fB/p⊖,对于实际气体和理想气体反应可分别用下2式表示
(12a)
(12b)
Qf和Qp又分别称为逸度商和压力商.当化学反应达到平衡时有ΔrGm=0,根据(10)式
(13)
把(13)式代入(10)式得到
(14)


(15)
当总压力p增加或减小的瞬间(“新状态”),即平衡移动之前,可以认为xB是不变的.这样“新状态”J的变化(变大或变小)完全由p∑νB决定.例如,对于减分子反应(反应后气体分子数减少,∑νB<0),如果增加压力则p∑νB变小,J也随之变小.对于实际气体尤其是高压气体反应,压力对J的影响情况要复杂一些,不能简单地套用上述规律.浓度不影响K⊖,但会影响J,这种情况这里不再赘述.

Kx= ∏xBνB.
(16)
根据pB=pxB,结合(12b)式不难得到
(17a)
(17b)
由式(17b)可见,Kx不仅受温度影响,也和总压力p有关.温度一定时,若∑νB<0,则增加压力Kx变大[4],反之变小;同理,若∑νB>0,则增加压力Kx变小,反之变大.Jx形式上和Kx一样,但二者意义不一样,Kx是化学反应达到平衡时的∏xBνB,而Jx是反应某一时刻的∏xBνB.前面提到对于理想气体反应,式(17a)左边的J只受压力影响.笔者认为,温度和压力都不影响Jx,因为即便温度或压力改变,只要xB不变那么Jx= ∏xBνB就不会改变.把式(17a)和式(17b)代入(14)式得到[4]
(18)
在一定温度下,对于处于平衡态的理想气体反应,若∑νB<0(反应后气体分子数减少),增加压力则Kx变大而Jx不变,ΔrGm<0则平衡正向移动,其它情况依次类推.
(19a)
(19b)
(20)
van’t Hoff等压方程为
(21a)
把(20)式代入上式得,
(21b)

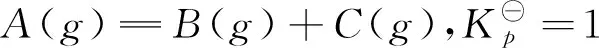


3) ΔrGm为多少?

或者采用第2)问的结果计算,注意到pi=ciRT,
4 结语


