芒萁黄酮类物质成分鉴定及体外抗氧化活性研究
欧阳可凡,王文君
(1.南昌大学食品学院,江西 南昌 330031;2.江西农业大学食品科学与工程学院,江西 南昌 330045)
芒萁(Dicranopterispedata),真蕨目里白科芒萁属植物,是亚热带红壤丘陵区次生植被的标志种和识别种,广泛分布于中国长江以南各省及东南亚地区[1-2]。因其耐旱耐瘠耐酸、繁殖生长能力极强,在保护南方红壤侵蚀区水土流失起着重要作用[3-4]。由于芒萁茎叶刚韧且粗糙,不易消化吸收,适口性较差[5],通常不做饲草用,而被视做生态草、观赏草、能源草,同时也可做为工业草提取天然色素或做为药用草。据记载,芒萁可全株入药,有泻火利尿、止血化瘀的功效[6]。芒萁含黄酮、皂苷及多糖类等活性成分,具有很强的抗氧化、抗菌、抗癌活性,对帕金森病也有一定的疗效[7-10]。黄酮是一种植物次生级代谢产物,在人体中无法合成,仅可通过食物摄入。因其优异的抗氧化活性,能够起到预防心脑血管疾病、抗癌等作用[11]。经测定芒萁中黄酮的含量高达13%以上[7],比红豆草和小冠花等豆科牧草的黄酮含量(0.46%~1.70%)[12]要高得多。目前,芒萁在我国虽然分布极广,产量也极为巨大,但芒萁黄酮的保健功效和药理作用并未受到人们的关注。本研究采用超声波法辅助法提取芒萁黄酮,分析其总黄酮的含量,并对其成分进行鉴定,进而探讨了其体外抗氧化活性,以期为进一步开发利用芒萁这一南方地区常见药用草提供理论基础。
1 材料和方法
1.1 试验材料
供试芒萁于2020年7月采摘于江西省赣州市宁都县翠微峰国家森林公园。芦丁标准品、异槲皮苷标准品、木犀草素-5-O-葡萄糖苷标准品、阿福豆苷标准品:分析纯,北京Solarbio科技有限公司;聚酰胺树脂:30-60目,国药集团化学试剂有限公司;乙腈、甲醇:色谱纯,TEDIA USA;1,1-二苯基-2-三硝基苯肼(DPPH):纯度≥97%,东京化成工业株式会社;2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、盐酸、过氧化氢、硫酸亚铁、硝酸铝、水杨酸、亚硝酸钠、氢氧化钠、维生素C、无水乙醇、过硫酸钾等:分析纯。
1.2 试验仪器
粉碎机:XM-800Y型,永康市鑫之鸿电器有限公司;数控超声波清洗器:KQ-250DE型,昆山市超声仪器有限公司;酶标仪:M2型,美国Molecular Device公司;有机相微孔滤膜:0.22 μm,Millipore USA;冷冻干燥机:Scientz-10N,宁波新芝生物科技股份有限公司;液相色谱仪:Agilent 1260 Infinity,Agilent USA;数显恒温搅拌循环水箱:HH-60型,国华仪器制造有限公司;电子天平:AUY220型,日本京都岛津制作所;循环真空水泵:SHZ-D(Ⅲ)型,巩义市子华仪器有限责任公司;旋转蒸发仪:N-1100型、油浴锅:OSB-2100型,上海爱朗仪器有限公司;低速离心机:TD4型,上海卢湘仪离心机仪器有限公司。
1.3 芒萁黄酮的提取与纯化
1.3.1 芒萁黄酮粗提物制备 取其地上部位茎叶,剪碎并于60℃干燥后进行粉碎,过60目筛后密封保存。芒萁黄酮粗提物采用超声波辅助提取法提取[7],取芒萁茎叶粉末5.0 g、与50%乙醇500 mL加入锥形瓶中混合,超声处理20 min,温度50℃,功率125 W;采用85℃恒温水浴90 min,4 000 r/min离心10 min后过滤,于60℃下进行真空减压浓缩至原体积的30%;冷冻干燥后保存备用。
1.3.2 芒萁黄酮的分离纯化 采用乙醇梯度洗脱法,根据文献[13]略作修改:活化聚酰胺树脂后,取适量芒萁粗提物,用蒸馏水配制成浓度25 mg/mL的试样液,缓慢添加进层析柱上端,吸附时间为2 h。采用4个浓度梯度(0%、30%、50%、70%)的乙醇溶液进行梯度洗脱,流速为1.5 mL/min,洗脱至解吸液无明显颜色即换用更高浓度。收集各梯度醇洗液,于60℃减压浓缩后冷冻干燥,最终得到水洗物、30%、50%、70%醇洗物。
1.3.3 芦丁标准曲线制作 称量芦丁标准品10.0 mg,用50%乙醇配制成0.2、0.1、0.05、0.025、0.012 5、0.006 25 mg/mL的标准液,采用NaNO2-Al(NO3)3-NaOH显色法,于510 nm波长下测定其吸光度(A值),并制作标准曲线。采取最小二乘法进行线性回归,得到回归方程:Y=0.380 82A+0.019 67,R2=0.999 87,线性范围为0~0.02 mg/mL(图1)。

图1 芦丁标准曲线Fig.1 Standard curve of rutin
1.3.4 芒萁黄酮含量的测定 分别取2 mg上述芒萁黄酮粗提物及不同梯度乙醇洗脱物,以50%乙醇溶解后定容至10 mL容量瓶中,按1.3.3的方法测定其黄酮浓度,并计算总黄酮含量。
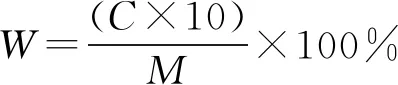
式中:W为总黄酮百分含量,%;C为总黄酮浓度,mg/mL;M为样品质量,mg。
1.4 芒萁黄酮成分分析
采取HPLC法进行分析。分别取适量的芒萁黄酮粗提物和各浓度梯度醇洗物经甲醇溶解、有机滤膜(0.22 μm)过滤后采用C18色谱柱(4.6 mm×250mm,5 μm),以乙腈(α)- 0.4%乙酸超纯水(β)系统为流动相,梯度洗脱(0~15 min,10%~25% α;15~30 min,25%~40% α;30~40 min,40%~50% α),进样量10 μL,流速1.0 mL/min,波长254 nm,柱温40℃。
将粗提物HPLC图谱各峰的峰面积数据代入标准品标准曲线,得到单体组分浓度,并计算黄酮单体组分百分含量。
式中:W为单体组分百分含量,%;C0为粗提物浓度,μg/mL;C1为单体组分浓度,μg/mL。
1.5 芒萁黄酮体外抗氧化试验
1.5.1 芒萁黄酮清除羟基自由基(·OH)能力试验 根据文献[14]修改如下:于10 mL离心管中加入2 mL FeSO4(6 mmol/L),2 mL试样,2 mL过氧化氢(6 mmol/L),2 mL水杨酸-乙醇(6 mmol/L),恒温水浴处理20 min (37℃),以蒸馏水为参考,于510 nm处测定吸光度。试样为不同浓度的(0.1、0.2、0.4、0.6、0.8、1.0 mg/mL)芒萁纯化黄酮溶液或Vc溶液。重复3次。
采用以下公式计算·OH清除率。
式中:A0为空白对照的吸光度,A1为加入供试品的吸光度,A2为不加入水杨酸-乙醇溶液的吸光度。
1.5.2 芒萁黄酮清除ABTS+能力试验 参考文献[15-16]的方法:称取ABTS粉末5.0 mg于离心管,按照文献[17]配制成ABTS+工作液。于4 mL离心管中按顺序添加1 mL 80%乙醇,1 mL ABTS+工作液,摇匀,避光静置30 min,于734 nm下测定吸光值A0。于4 mL离心管中按顺序添加0.25 mL不同浓度(20、40、60、100、200、400 μg /mL)的芒萁纯化黄酮溶液或Vc溶液,0.75 mL 80%乙醇,1 mL ABTS+工作液,摇匀,避光静置30 min,于734 nm下测定吸光值A1。重复3次。
采用以下公式计算ABTS+清除率。
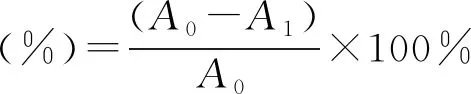
式中:A0为空白对照的吸光度,A1为加入供试品的吸光度。
1.5.3 芒萁黄酮清除DPPH自由基能力试验 参考文献[14]的方法:于4 mL离心管中按顺序添加2 mL的DPPH-乙醇溶液(0.1 mmol/L),2 mL浓度递增的芒萁纯化黄酮溶液(10、15、20、30、40、60 μg/mL),避光反应0.5 h,以70%乙醇为参考,于517 nm测定其吸光度。试样为不同浓度的(10、15、20、30、40、60 μg/mL)芒萁纯化黄酮溶液或Vc溶液。重复3次。
采用以下公式计算DPPH自由基清除率。
式中:A0为空白对照的吸光度,A1为加入供试品的吸光度,A2为不加入DPPH-乙醇溶液的吸光度。
1.5.4 统计分析 采用Origin 2019软件绘图,采用SPSS 21.0进行t检验分析并计算其半抑制浓度IC50值。
2 结果与分析
2.1 芒萁黄酮提取率及芒萁黄酮纯化物的黄酮含量
本试验通过超声波辅助提取法得到了芒萁黄酮粗提物(CEE),黄酮提取率为13.42%。采用乙醇梯度洗脱法对芒萁黄酮粗提物进行分离纯化,分别获得了水洗物(WE)、30%醇洗物(30%EE)、50%醇洗物(50%EE)、70%醇洗物(70%EE)。粗提物和不同梯度洗脱物黄酮含量测定结果见图2。以50%EE的黄酮含量最高,可达76.25%,其次为30%EE、CEE、WE,70%EE的黄酮含量最低,仅为2.37%。

图2 芒萁黄酮粗提物和不同梯度乙醇洗脱物的总黄酮含量Fig.2 Total flavonoid content of CEE and different ethanol eluates注:CEE:粗提物;WE:水洗物;30%EE:30%醇洗物;50%EE:50%醇洗物;70% EE:70%醇洗物
2.2 芒萁黄酮HPLC图谱及分析
芒萁黄酮粗提物和各醇洗物的HPLC图谱见图3。除70%EE组分的HPLC图无明显峰外,无论是粗提物还是各洗脱物的各峰分离效果都较好,杂峰较少,其纯化前后图谱各峰出峰时间并无明显差异。芒萁黄酮3个明显峰分别对应混合对照品中的异槲皮苷标准品、木犀草素-5-O-葡萄糖苷标准品、阿福豆苷标准品。

图3 芒萁黄酮HPLC图Fig.3 HPLC chromatogram of flavonoids from Dicranopteris pedata注:A:CEE(粗提物);B:WE(水洗物);C:30%EE(30%醇洗物);D:50%EE(50%醇洗物);E:70% EE(70%醇洗物);F:标准品
通过各标品标准曲线(表1)计算,可得芒萁粗黄酮中所含有的3种黄酮类化合物含量分别为:异槲皮苷0.856%、木犀草素-5-O-葡萄糖苷1.462%、阿福豆苷2.155%。

表1 黄酮标准品线性关系
2.3 芒萁黄酮体外抗氧化试验结果
本研究选择了黄酮纯度最高的50%EE进行试验,以评价芒萁黄酮的抗氧化能力。
2.3.1 芒萁黄酮对羟基自由基的清除能力 当浓度较低(< 200 μg/mL)时,芒萁黄酮的·OH清除能力略强于Vc,但是随着浓度递增,达到400 μg/mL及以上时,Vc的抑制效果明显好于芒萁黄酮。芒萁黄酮、Vc对羟基自由基的IC50值分别为:1 079.01、301.02 μg/mL(图4)。
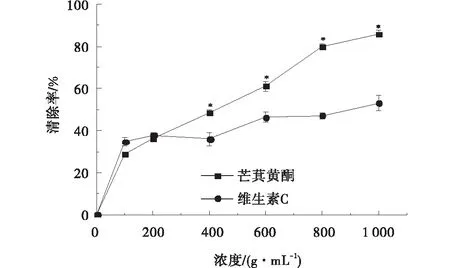
图4 芒萁黄酮与Vc对羟基自由基的清除率Fig.4 Scavenging rate of dicranopteris pedata flavonoids and Vc on hydroxyl free radicals (·OH)注:*表示同一浓度下的值差异显著(P<0.05),** 表示同一浓度下的值差异极显著(P<0.01),无标志表示同一浓度下的值差异不显著(P>0.05),下图同
2.3.2 芒萁黄酮对ABTS+的清除能力 在本试验条件下,芒萁纯化黄酮对ABTS+自由基的清除率与浓度几乎呈线性关系。在低浓度时芒箕黄酮对ABTS+自由基的清除效果远不如Vc,但在400μg/mL的浓度下,芒萁黄酮的清除效果达到Vc的78.01%。如剂量再提高,有可能会进一步缩减两者的差距。芒萁黄酮、Vc对ABTS+自由基的IC50值分别为248.74、40.34 μg/mL(图5)。
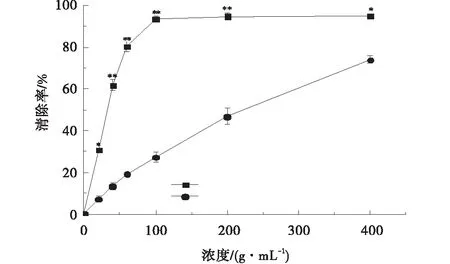
图5 芒萁黄酮与Vc对ABTS+自由基清除率Fig.5 Scavenging rate of Dicranopteris pedata flavonoids and Vc on ABTS+
2.3.3 芒萁黄酮对DPPH自由基的清除能力 芒萁黄酮对DPPH自由基的清除率同样也存在剂量依赖,随浓度增加清除率提高较快,近线性关系。芒萁黄酮、Vc对DPPH自由基的IC50值分别为50.14、2.74 μg/mL(图6)。
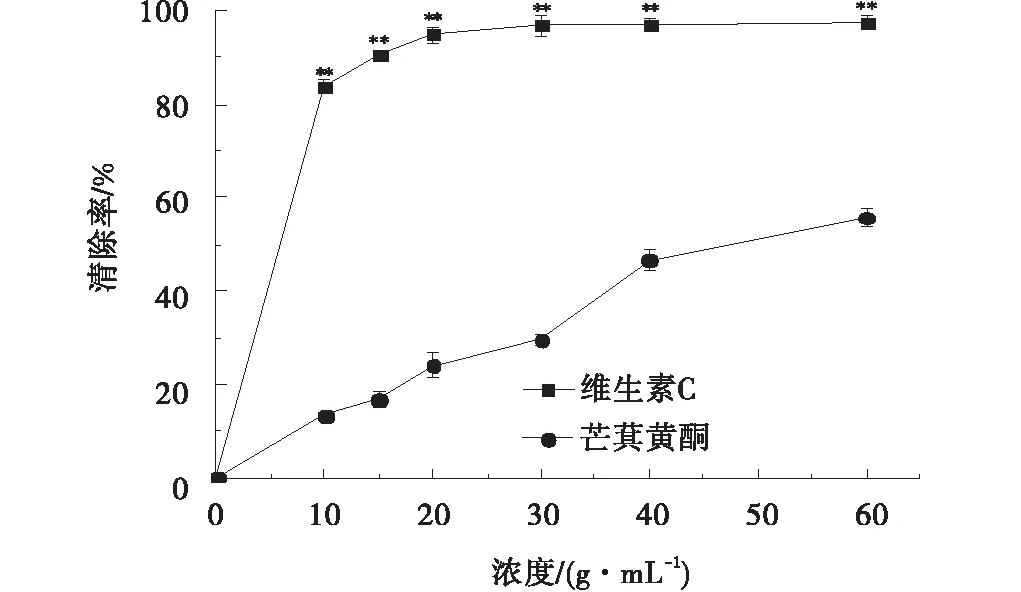
图6 芒萁黄酮与Vc对DPPH自由基清除率Fig.6 Scavenging rate of Dicranopteris pedata total flavonoids and Vc on DPPH free radicals
3 讨论
目前,黄酮类化合物已在食品、化工、保健食品等多个行业广泛应用,是多种医药、护肤品、食品添加剂的重要成分[11]。芒萁作为药用草分布广泛,根据丁利君等[7]的研究,其全株黄酮含量达到13.56%,是开发和利用黄酮的优质原料[8]。陈少美等[20]发现,不同采集部位对芒萁黄酮成分与含量的影响较大,其中以主根中含量最高(28.06%),依次是老叶(22.05%)、嫩叶(15.32%)、老茎(9.64%)、嫩茎(5.94%)。本研究以芒萁茎叶为原料,运用超声波法辅助法提取芒萁黄酮的提取率为13.42%,与上述研究中的茎、叶黄酮含量平均值接近。同时,运用本方法提得的芒萁黄酮得率,远高于同类方法提取紫花苜蓿(0.64%)、辣木叶(4.89%)的黄酮得率[17-18],说明芒萁黄酮含量高,较易提取,在生产上具有较好的应用前景。倪再辉等[19]检测出芒萁中含有芦丁、槲皮苷、阿福豆苷、槲皮素和山柰酚5种黄酮类物质。毛娟玲等[10]于芒萁纯化后的二氯甲烷部分中鉴定出 15 个黄酮类化合物,于正丁醇部分中鉴定出 19 个黄酮类化合物。本研究在芒萁黄酮粗提物和各梯度醇洗物中鉴得阿福豆苷、木犀草素-5-O-葡萄糖苷和异槲皮苷3种黄酮类化合物,其中木犀草素-5-O-葡萄糖苷和异槲皮苷系首次在芒萁中发现。陈少美等[20]认为芒萁不同部位、不同采集时间对黄酮成分与含量影响较大,或为产生差异的原因之一。同时,提取途径和纯化方法的差异也是影响黄酮类物质鉴定的重要因素。
植物源黄酮具有很强的抗衰老和抗氧化能力,在增益机体免疫调节功能、促进人类和家畜健康以及预防慢性病等方面发挥重要作用[21-24]。因其具有抑制并清除活性氧的特性,可用于抵御氧化损伤。其机理是从黄酮类物质骨架上的羟基取代基电离出氢原子,来中和氧自由基,再与已电离的黄酮类物质结合,生成防止逆向结合的双体[25-26]。丁利君等[7]的研究中发现芒萁的水提液对羟自由基有很好的清除效果,而其乙醇提取液却不能清除羟自由基。但本研究中纯化后的芒萁黄酮能够很好地清除羟自由基,这与曾伟[27]的研究结果相一致,这可能是纯化后黄酮成分与含量不同所致。芒萁纯化黄酮在对3种不同自由基的抑制效果上表现出较大差异,推测与其所含成分的协同作用、单体结构有关,芒萁成分与抗氧化活性的构效关系还有待更深层次的探讨。
4 结论
本研究通过超声波辅助醇提法对芒萁茎叶黄酮的提取率为13.42%,纯化所得50%醇洗物部分的总黄酮含量最高,达76.25%,主要含有阿福豆苷(2.155%)、木犀草素-5-O-葡萄糖(1.462%)、异槲皮苷(0.856%)3种黄酮类物质。芒萁黄酮清除·OH、DPPH、ABTS+自由基的IC50值分别为:1 079.01、248.74、50.14 μg/mL。表明芒萁黄酮含量高,抗氧化活性优良。

