间充质干细胞在疾病治疗中的应用潜力
王惠,赵鹏翔,张旭娟,姚婷婷,刘梦昱,YAO Mawulikplimi Adzavon,谢飞
北京工业大学环境与生命学部基础医学研究室,抗病毒药物北京市国际科技合作基地,北京100124
随着细胞疗法的出现,越来越多的研究者对间充质干细胞(mesenchymal stem cell,MSCs)进行了研究。MSCs是多能细胞,可分化为多种细胞类型,且来源较广泛,其治疗潜力引起了人们广泛的关注。有研究表明,骨髓不仅是造血干细胞的来源,也是间充质干细胞的来源。间充质干细胞是由Caplan等[1]于1991年提出,2006年国际细胞治疗学会(International Society for Cellular Therapy,ISCT)发布了MSCs的定义,并建议称为多能间充质基质细胞,但间充质干细胞仍被广泛使用。研究证实MSCs具有自我更新、调节免疫功能等作用[2]。但MSCs在不同疾病治疗中的作用尚鲜见报道。本文通过概括介绍MSCs的来源及生物学特性,并总结MSCs几种不同类型疾病治疗过程中发挥的作用,旨在为MSCs的临床应用提供参考。
1 间充质干细胞的生物学特性
MSCs最早是在骨髓中发现的,后来在几乎所有胎儿和新生婴儿的组织和器官中均发现了MSCs[3],且大量的学者在成人骨髓[4]、牙髓[5]、骨骼肌[6]、胎盘、脐带、羊水[1]、滑膜[7]、脂肪[8]等中也发现并分离了该类细胞。
在实际操作过程中,由于不同研究人员对MSCs分离、培养、鉴定方法以及MSCs组织来源等存在差异,最终导致细胞活性、干性等不一致,严重制约了MSCs临床应用策略的制定,此外,对不同群体的比较研究较少也进一步阻碍了该领域的进展。为解决以上问题,ISCT定义了人类MSCs的最低标准[9]:在标准培养条件下,MSCs必须保持塑 料 黏 附 性;MSC必 须 表 达CD105、CD73和CD90,且缺乏CD45、CD34、CD14或CD11b、CD79a或CD19和HLA-DR等表面分子的表达;在标准的分化条件下,MSCs在体外能分化为成骨细胞、脂肪细胞和软骨细胞。已有研究证实,MSCs可通过分泌细胞因子或直接接触免疫细胞参与免疫反应的调节[10]。然而,最近的研究发现,凋亡和代谢失活的MSCs,甚至片段化的MSCs也具有免疫调节能力[11]。虽然MSCs存在于多个组织器官中,但有研究发现,脂肪组织来源的MSCs(adipose tissue derived mesenchymal stem cells,AT-MSCs)较骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BM-MSCs)具有更强的免疫调节作用;此外,脐带来源MSCs(UC-MSCs)具有更低的免疫原性,且更易获得,有望成为临床治疗的候选药物之一[12]。
2 间充质干细胞参与的疾病治疗
2.1 MSCs与肿瘤
肿瘤是由不同类型的癌细胞组成的,使肿瘤具有异质性。癌症干细胞(cancer stem cells,CSCs)具有与干细胞(stem cells,SCs)相似的自我更新和分化能力,在癌症的发生和发展中发挥重要作用。肿瘤微环境中除了肿瘤细胞和CSCs,还包括许多基质细胞和细胞外基质(extracellular matrix,ECM)[13]。多种细胞之间相互作用,共同影响肿瘤的发展进程(图1)。细胞外基质主要包括糖蛋白、胶原蛋白和酶,通过影响肿瘤细胞的黏附、增殖和通信,进而影响肿瘤细胞的迁移。MSCs向肿瘤部位迁移并释放细胞因子,从而通过影响肿瘤微环境影响CSCs的生成、上皮−间充质转化(epithelialmesenchymal transformatio,EMT)、血管生成、肿瘤细胞的耐药性和转移等。
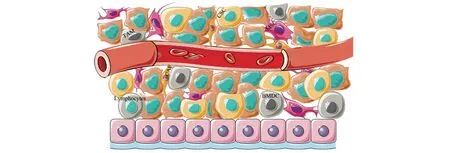
图1 肿瘤微环境中不同细胞间的相互作用Fig.1 Interactions between different cells in the tumor microenvironment
肿瘤细胞周围MSCs的增多可促进肿瘤的发展。Karnoub等[14]研究证明,将来源于人骨髓的MSCs与弱转移的人乳腺癌细胞共注射至皮下部位使其形成肿瘤后,MSCs可促进乳腺癌细胞的转移。在探讨AT-MSCs对体内、外黑素瘤细胞系作用的一项研究中显示,与单独的M4Beu黑色素瘤细胞相比,AT-MSCs与M4Beu黑色素瘤细胞共植入显著缩短了肿瘤发作的时间,同时,AT-MSCs共注射组平均肿瘤体积更大[15]。还有研究显示,与单独注射人前列腺基质细胞MDA PCa 118b相比,MDA PCa 118b细胞和AT-MSCs共注射诱导的前列腺肿瘤的平均体积提高了3倍以上。此外,共注射组的前列腺肿瘤坏死平均体积也显著高于单独注射MDA PCa 118b组[16]。以上结果表明肿瘤细胞周围的MSC具有加速肿瘤发展进程的能力。
由于MSCs具有迁移和靶向肿瘤组织的能力,相关研究者利用经过改造的MSCs直接递送药物至肿瘤部位杀死肿瘤,如表达干扰素-β(interferon-β,IFN-β)[17]、白细胞介素-28(interleukin 28,IL-28)[18]、白介素-2(IL-2)[19]、肿瘤坏死因子相关的凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)[20−22]、IL-15[23]等抗肿瘤细胞因子,MSCs将相关配体直接递送至肿瘤部位可有效诱导肿瘤消退。2004年Matus等[17]研究发现,MSCs在体内有向肿瘤周围转移的现象,与单独培养的肿瘤细胞相比,携带IFN-β的MSCs细胞与黑色素瘤细胞A375SM或人乳腺癌细胞MDA 231共培养,可使肿瘤细胞生长受到抑制。Mcguire等[18]的研究证实,MSCs分泌的IL-28可通过白细胞介素28受体α(interleukin 28 receptor-α,IL-28Rα)-STAT1信号通路,触发前列腺癌细胞的凋亡。目前,多种来源的MSCs已被用作靶向肿瘤治疗的载体。静脉注射稳定表达IL-2的人类羊水间充质干细胞(amniotic fluid MSCs,AF-MSCs)可趋化至卵巢肿瘤细胞周围,并局部分泌IL-2,导致肿瘤细胞的凋亡[19]。与正常细胞相比,膀胱癌组织和细胞中多梳抑制复合物(polycomb repressor complex 1,PRC1)水平明显升高,抑制PRC1表达可减弱膀胱癌癌细胞增殖、迁移的能力。而MSCs可作为载体,将能够抑制PRC1表达的miR-139-5p传递至膀胱癌细胞中,从而下调PRC1的表达,进而抑制膀胱癌的发展[22]。将分泌坏死因子相关的凋亡诱导配体TRAIL的MSCs(MSCs-TRAIL)与肝癌细胞HepG2共培养发现,MSCs-TRAIL可有效抑制HepG2的生存[23]。有研究显示,短期处理MSCs-TRAIL可使神经胶质瘤大鼠的肿瘤体积减小56.3%,并加速神经胶质瘤细胞的凋亡,还可显著增加神经胶质瘤大鼠的存活时间[24]。此外,给患有Pan02胰腺肿瘤的小鼠静脉注射MSC-IL15,结果发现,MSC-IL15在小鼠体内向肿瘤迁移并在肿瘤特异性位点分泌IL-15,可有效抑制肿瘤生长并延长荷瘤小鼠的存活率。MSC-IL15还被发现具有诱导荷瘤小鼠肿瘤特异性T细胞免疫记忆反应的能力[25]。
以上研究表明,间充质干细胞对肿瘤微环境具有显著趋向性,可利用这些细胞作为传递基因或抗癌药物载体。此外,这些细胞在响应组织损伤和炎症时表现出类似于免疫细胞的趋化特性,并分泌广泛的生物活性分子,通过直接作用于肿瘤细胞和基质微环境影响肿瘤的发生和发展[26]。MSC或将成为靶向递送药物至癌症位点的有效载体。
综上所述,MSCs因其多向分化,低免疫原性,分泌抗炎、抗凋亡及血管生成因子,向肿瘤位点迁移等特点,在疾病治疗中效果显著。但MSCs分泌的细胞因子也可促进肿瘤的形成和肿瘤细胞转移(图2),因此,在临床中不建议直接运用MSCs进行肿瘤相关疾病的治疗。MSCs联合其他化疗药物或使用分泌肿瘤杀伤因子型的MSCs治疗肿瘤相关疾病或可作为未来的发展方向之一。此外,MSCs在肿瘤进展中的确切作用尚未完全阐明,且不同来源的MSC是否具有相同的作用,还有待进一步深入研究。
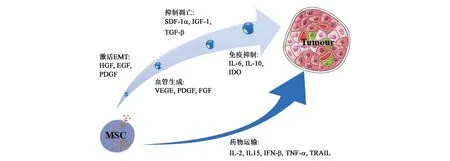
图2 MSCs对肿瘤组织的影响Fig.2 The effect of MSCs on tumor tissue
2.2 MSCs与伤口愈合
难愈合伤口的治疗一直是临床亟待解决的难题。虽然各类敷料和基于细胞的产品正在被不断的研发更新,但其性能仍不能完全满足临床需求[25]。有研究显示,伤口愈合过程的重点是内源性MSCs,这类细胞不但可募集其他宿主细胞协调修复反应,还可迅速迁移到损伤部位,分化为多种皮肤细胞,从而加速伤口愈合。此外,MSCs还可分泌多种生长因子,促进细胞增殖、血管生成,加快组织重塑过程[26]。
多种组织来源的MSC均具有促进伤口愈合的能力。有研究显示,扁桃体来源的间充质干细胞(tonsil-derived MSCs,TMSCs)可抑制外周血单核细胞和T细胞的增殖及巨噬细胞样细胞的M1极化。此外,TMSCs还通过促进细胞增殖、调节炎症来促进损伤皮肤的重塑[27]。外界损伤可能触发角膜伤口愈合(CWH)反应,并导致新血管形成,损害视觉功能,而有研究显示,脂肪来源的间充质干细胞(adipose tissue derived mesenchymal stem cells,AT-MSCs)参与角膜中性粒细胞的清除,有效抑制乙醇诱导小鼠角膜损伤过程中的新生血管形成,明显减少对视觉功能的损伤[28]。Hanson等[29]研究表明,注射AT-MSCs有助于改善伤口外观和促进上皮再生。
尽管不同来源的MSCs均表现出促进伤口愈合的能力,但AT-MSCs因其在临床应用中的局限性更小、更易大量获得而被广泛应用。MSCs在正常皮肤中的存在[30]及其在伤口愈合中的关键作用[31]证明,外源MSCs的应用有望成为治疗难愈合伤口的有效方案。
2.3 MSCs与纤维化疾病
纤维化与器官衰竭和高死亡率有关,通常以异常成纤维细胞的积累为特征。据统计,在发达国家器官纤维化约占总死亡率的50%[32]。成肌纤维细胞是多种已知的纤维化疾病共有的潜在细胞类型,因此,研究各种疾病中成肌纤维细胞的来源对于开发新的治疗方法至关重要。
MSC在治疗纤维化疾病方面也展现了一定的优势。在辐射诱导肺损伤的研究中发现,移植的MSCs可迁移至损伤部位,并通过分泌单核细胞趋化蛋白3(monocyte chemoattractant protein 3,MCP-3)、基质衍生因子-1(stromal derived factor-1,SDF-1)、TGF-β1、血管内皮生长因子(vascular endothelial growth factor,VEGF)、血小板衍生生长因子(platelet-derived growth factor,PDGF)和肝细胞生长因子(hepatocyte growth factor,HGF),发挥免疫抑制作用。从而刺激血管生成,为宿主细胞的恢复建立保护环境,减少肺损伤的发生[33]。在一项Ⅰ期试验中发现,4例代偿性肝硬化患者外周静脉注射自体骨髓来源的MSCs后,无明显不良反应,且其中2例患者的晚期肝病评分明显改善[34]。Kharaziha等[35]研究显示,通过外周静脉注射自体MSCs,可改善肝硬化患者的肝功能。Selim等[36]研究显示,静脉注射MSCs可改善急性肾功能损伤。
MSCs还可通过调节基质金属蛋白酶,抑制成纤维细胞活化,减少细胞外基质沉积,并最终改善心肌功能。MSCs分泌的多种细胞因子也有利于对抗纤维化。研究显示,移植至心肌梗死周围区域的MSCs可通过直接接触病灶细胞并释放HGF,抑制miR-155介导的纤维化信号,从而促进心肌梗死小鼠的左心室重构[37]。MSCs衍生的细胞外囊泡可通过AMPK/mTOR和Akt/mTOR途径[38]增强心肌细胞自噬,并通过缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)/Jagged 1通路[39]促进血管生成,减少细胞凋亡。有研究[40−41]发现,移植的MSCs可迁移至梗死的心肌组织,减少炎症反应和纤维化,促进新血管的形成,并分化为心肌样细胞,有助于梗死心肌的修复。
尽管MSCs具有治疗纤维化疾病的优势,但其在临床中的应用仍面临较多挑战,仍需继续探索其主要的作用机制,为纤维化疾病的临床治疗提供理论基础。
3 展望
虽然在多种疾病的治疗中,MSCs均表现出了良好的治疗效果,但仍存在以下问题。
首先,MSCs在参与疾病治疗的过程中存在一定的安全性问题。由于不同的MSCs对促进和抑制肿瘤具有不同的功能,在植入MSCs进行疾病治疗前,需检测MSCs的肿瘤标志物的表达。此外,MSCs具有分化为纤维化疾病潜在细胞类型的风险,因此,降低使用风险,使MSCs优势最大化是当下亟待解决的难题之一。随着研究的深入,更多的证据表明,MSCs的条件培养基(conditioned medium,CM)或细胞外囊泡(extracellular vesicles,EV)中含有MSCs分泌的促进抗炎、抗凋亡及血管生成的因子,因此,如何利用CM或EV代替MSCs治疗相关疾病,还需进一步探索。
其次,体外培养过程中,如何维持MSCs的干性。有研究显示,未分化的BM-MSCs主要通过糖酵解代谢获取能量以维持自我更新和增殖。同时,高糖酵解率和低氧化代谢也有利于干细胞的增殖和干性保持[42]。通过控制培养条件改变能量代谢,从而调控MSCs的分化途径,可为临床应用提供新的思路。
再次,MSCs应用潜力有待进一步开发,因其具有可再生为其他组织细胞的能力目前被应用于医疗美容,以促进组织再生,延缓衰老,但未来还需要通过大量的研究深入了解这类细胞,扩大应用范围。
最后,MSCs已被广泛应用于动物疾病模型的研究及疾病治疗,但是如何通过调控其相关Wnt通路、Notch1通路等影响MSCs的定向分化仍需进一步深入研究。

