大鼠正畸牙移动过程中坏死性凋亡对牙周组织中IL-1β及IL-17的影响
陈思言,季开心,张敏杰,唐 林,张苗苗
正畸牙移动中牙周组织改建的分子生物学机制是正畸学者的研究方向,但正畸牙齿移动中压力侧牙周组织细胞死亡方式的具体机制尚不明确。在正畸力的作用下,压力侧牙周膜的间隙变窄,毛细血管管腔缩小,循环受阻,血流量减少,使牙槽骨组织细胞处于低氧环境,胶原纤维和基质降解吸收,大量破骨细胞分化,牙槽骨发生骨吸收,张力侧牙周膜的牙周间隙增宽,胶原纤维和基质增生,成骨细胞分化,新骨沉积[1-2]。除此之外,在正畸力作用后,牙周组织发生无菌性炎症,龈沟液(gingival crevicular fluid,GCF) 中产生大量炎性介质和酶类,其中炎症因子在骨吸收中有多种影响,体内的炎症反应是由复杂的细胞因子网络所调控的,白介素-1β(interleukin-1β,IL-1β)、白介素-8(interleukin-8,IL-8)、白介素-17(interleukin-17,IL-17)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)以及转化生长因子(transforming growth factor-β, TGF-β)可以促进破骨细胞的形成[3-5],影响牙齿移动。坏死性凋亡是由受体相互作用蛋白(receptor-interacting protein 1,RIP1)、RIP3及其底物混合系列蛋白激酶样结构域(mixed lineage kinase domain-like protein,MLKL)所介导的一种新型细胞死亡方式,它可以由多种因素激活,包括TNF-α、脂多糖(lipopolysaccharide,LPS)、DNA损伤、缺氧和营养缺乏[6]。当TNF-α激活RIP1后,招募RIP3形成坏死复合体,继而促进RIP3靶向作用MLKL渗透质膜,释放炎性因子。根据国外的相关研究结果发现阻断坏死性凋亡的进一步发生可通过抑制RIP1的活性来实现。坏死性凋亡特异性抑制剂(Necrostatin-1,Nec-1)是一种经研究证实的通过抑制RIP1磷酸化与RIP3相互作用来抑制坏死性凋亡的抑制剂,它已经广泛地应用于研究坏死性凋亡的体内、体外模型中[7-8]。近年来科学研究发现,多种细胞死亡方式均与机械力作用下压力侧牙周组织细胞数目减少有关,包括凋亡、焦亡、自噬等,这些不同的死亡类型之间存在相互关联和转化。已有研究证明,坏死性凋亡介入到牙周炎的病理生理过程中,但在正畸力作用下,牙周组织内营造的缺血缺氧环境是否会激发坏死性凋亡的发生需要进一步证实。本实验建立大鼠正畸牙移动模型,通过抑制坏死性凋亡相关蛋白RIP1,观察炎性因子IL-1β、IL-17表达情况,探讨坏死性凋亡对正畸牙齿压力侧牙周组织中的炎性因子以及牙齿移动距离的影响,为临床治疗提供实验依据。
1 材料与方法
1.1 实验动物及正畸装置
选用80 只6~8 周龄健康雄性SD大鼠(辽宁省长生生物技术有限公司),体质量(220±20)g。随机将大鼠分为空白对照组、抑制剂组(Nec-1)、加力组(加力50 g)、加力+抑制剂组(加力50 g+Nec-1),再按加力时间1、3、5、7、14 d分为五个亚组,每组4 只。适应性饲养一周,术前禁食12 h,建立大鼠正畸牙移动模型,2%戊巴比妥钠腹腔注射麻醉(0.1 mL/100 g),磨短大鼠下颌切牙,将上颌切牙近牙颈部打磨出一圈直径约0.2 mm的槽沟,将镍钛拉簧(深圳市速航科技发展有限公司)放置于大鼠左侧上颌切牙和第一磨牙之间,弹性结扎丝(0.2 mm)固定,上颌切牙酸蚀,涂粘接剂,流体树脂包裹,光敏灯固化处理,防止脱落。使用50 g的正畸力牵引左侧上颌第一磨牙向近中移动(图1)。
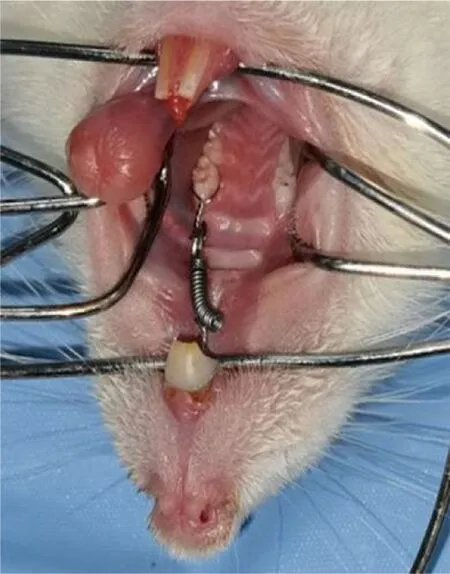
图1 大鼠第一磨牙正畸移动模型Fig.1 Orthodontic tooth movement model of rat's first molar
1.2 Nec-1注射
根据国外的相关研究发现Nec-1既不会直接影响细胞的正常生物学功能也不会直接抑制细胞的自噬与凋亡,已广泛应用于研究坏死性凋亡的体内、体外模型中,其在大鼠腹腔注射使用浓度为1 mg/kg[9-11]。正畸刚开始加力后,对抑制剂组及加力+抑制剂组大鼠Nec-1腹腔注射(1 mg/kg)(MedChemExperss,美国),注射频率为2 d注射一次,注射时间保证在上午9∶00—11∶00,于1、3、5、7、14 d处死进行组织准备。
1.3 组织准备
在正畸牙移动1、3、5、7、14 d后使用2%戊巴比妥钠进行腹腔注射,待大鼠停止呼吸后,4%多聚甲醛心脏灌注处理,将大鼠左侧上颌第一磨牙及其周围牙周组织置于4%多聚甲醛中固定24~48 h,然后置于0.5 mol/L的EDTA中脱钙6 周后进行梯度乙醇脱水,石蜡包埋,连续矢状切片,厚度为5 μm。
1.4 测量牙齿移动距离
固定一名实验人员使用游标卡尺测量第一磨牙和第二磨牙近中颊尖与远中颊尖之间的距离,每个组织测量3次,取平均值。
1.5 HE染色观察
在光学显微镜下进行选片,置于二甲苯原液中进行脱蜡,在进行性梯度乙醇脱水,蒸馏水冲洗。每个切片中加入100 μL苏木精染色液,染色的时间为10 min,蒸馏水清洗,1%的盐酸乙醇进行分化,分化的时间为20 s,蒸馏水清洗,1%稀氨水反蓝,时间为30 s,蒸馏水清洗,伊红染色,染色时间为3 min,组织梯度乙醇脱水,再放入二甲苯浸泡2 次,中性树胶封片,Olympus-SZX16光学显微镜观察各组大鼠压力侧牙周组织形态,拍照记录。
1.6 IL-1β, IL-17免疫组织化学染色及定量分析
切片常规脱蜡至水后3%过氧化氢避光浸泡20 min,使用蒸馏水冲洗3次,37 ℃胰酶消化法修复抗原20 min,然后使用蒸馏水、PBS溶液各冲洗3次。滴加IL-1β多克隆抗体(Santa,美国),IL-17A多克隆抗体(Affinity,美国),4 ℃孵育过夜 ,PBS溶液冲洗3次,37 ℃滴加生物素化二抗30 min,PBS溶液冲洗3次,DAB(北京中杉金桥生物技术有限公司)显色,苏木精复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。Olympus-SZX16光学显微镜镜检,图像采集,以深棕黄色颗粒为阳性着色细胞,采用Adobe Photoshop CS6图像分析系统软件对免疫组化染色后细胞进行计数。
1.7 统计学分析
采用GraphPad Prism 8.0软件包使用ANOVA检验进行统计学分析,P<0.05具有统计学意义。
2 结 果
2.1 正畸加力后大鼠牙周组织形态的病理变化
HE染色显示空白对照组牙周膜纤维排列整齐,牙槽骨表面及牙根表面较光滑平整,随着加力时间的延长,大鼠压力侧牙周膜间隙从3 d开始逐渐变窄,牙周膜纤维排列紊乱,骨吸收陷窝逐渐增多,14 d牙周膜间隙恢复趋于空白对照组,牙周膜纤维排列较为规则(图2)。
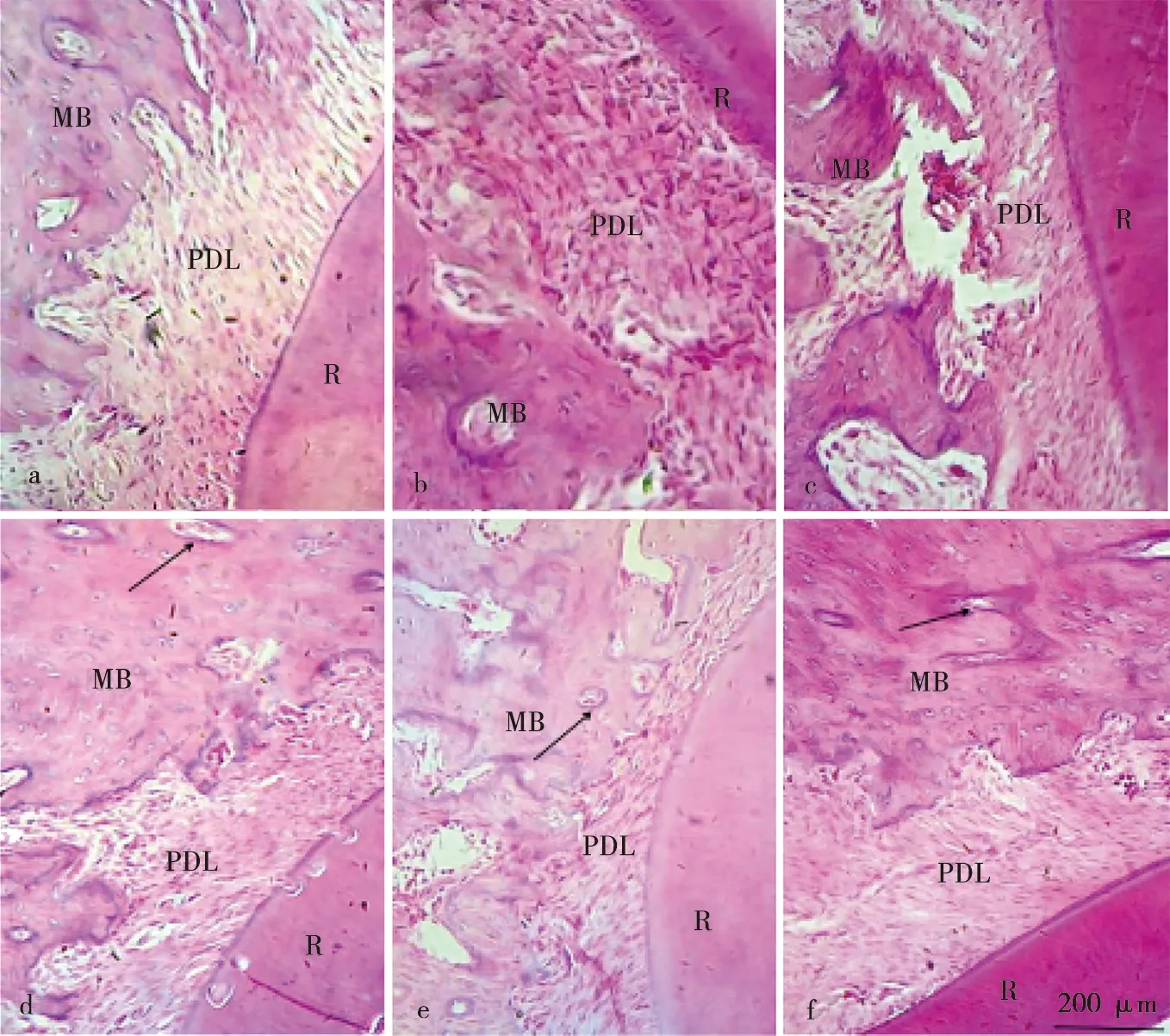
a:空白对照组;b:加力1 d组;c:加力3 d组;d:加力5 d组;e:加力7 d组;f:加力14 d组;箭头示骨吸收陷窝;PDL:牙周膜;R:牙根;MB:近中压力侧牙槽骨图2 不同时间加力组的HE染色结果( ×100)Fig.2 Staining images of force group at different times( ×100)
2.2 大鼠正畸牙齿移动情况
加力组大鼠正畸牙齿移动距离随加力时间增长而增加,加力+抑制剂组与加力组相比较明显降低(P<0.05),加力组牙齿移动速率1~3 d明显增加,随后下降,7~14 d趋于平缓,加力+抑制剂组牙齿移动1~3 d相对缓慢,5~7 d明显加快,7~14 d趋于平缓(图3),空白对照组与抑制剂组大鼠均无移动。
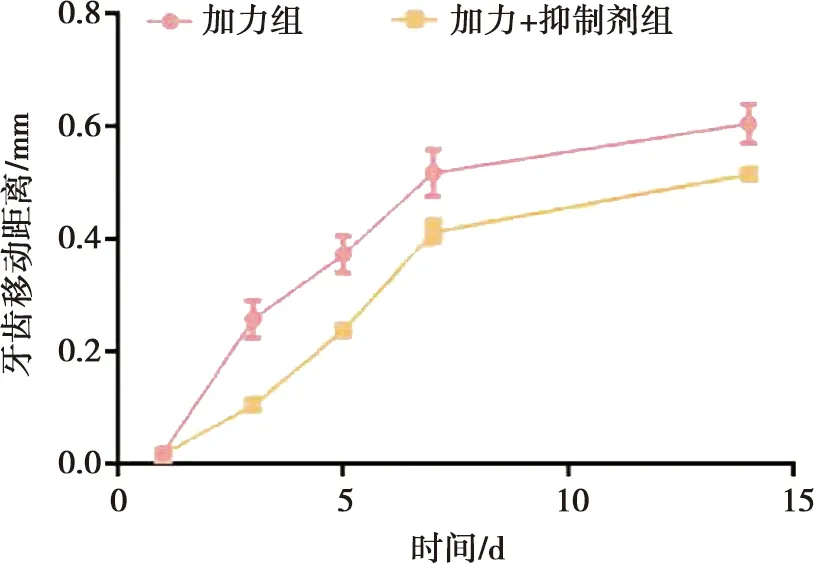
图3 各组大鼠牙齿移动距离时相变化曲线Fig.3 Phase change curve of tooth movement distance of rats in each group
2.3 IL-1β免疫组织化学染色结果
结果显示IL-1β表达主要分布在牙周膜成纤维细胞、破骨细胞、牙髓细胞等中(图4)。

a:空白对照组;b:3 d加力组;c:3 d加力+抑制剂组;AB:牙槽骨;PDL:牙周膜;R:牙根图4 IL-1β表达情况( ×400)Fig.4 Expression of IL-1β( ×400)
加力组IL-1β表达3 d达到高峰,随后逐渐下降,与空白对照组比较具有统计学意义(P<0.000 1)。1~7 d的加力+抑制剂组IL-1β的表达整体显著低于加力组,但均高于空白对照组,3 d组下降至最低,5、7 d恢复到1 d水平,建模后1 d至7 d加力组与加力+抑制剂组相比较差异有统计学意义(P<0.05),抑制剂组与空白对照组表达差异无统计学意义(图5)。

***:P<0.001;****:P<0.000 1图5 各组IL-1β阳性细胞个数Fig.5 Numbers of IL-1β positive macrophages in each group
加力组牙齿移动速度和IL-1β表达在1~3 d均迅速增长,3~7 d有所下降,7~14 d近于平缓(图6)。
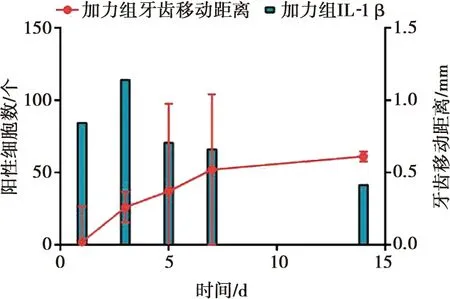
图6 加力组牙齿移动距离和IL-1β随时间变化Fig.6 Tooth movement distance and IL-1β changed with time in the force group
2.4 IL-17免疫组化染色结果
结果显示IL-17表达于牙周膜成纤维细胞、血管内皮细胞中,呈棕黄色颗粒(图7)。
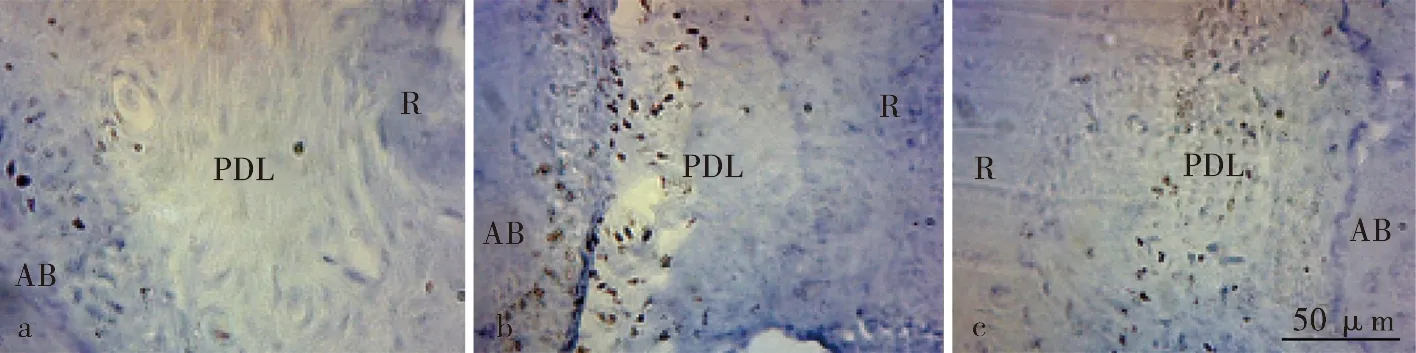
a:空白对照组;b:5 d加力组;c:5 d加力+抑制剂组;AB:牙槽骨;PDL:牙周膜;R:牙根图7 IL-17表达情况( ×400)Fig.7 Expression of IL-17( ×400)
空白对照组中IL-17呈弱阳性表达,正畸加力组中,IL-17表达随时间延长而逐渐增加,7 d达到高峰,14 d下降到5 d组水平,3 d至14 d组与空白对照组相比较差异有统计学意义(P<0.000 1)。加力+抑制剂组IL-17表达与加力组比较均降低,5 d组降低到最低值,至14 d恢复到加力组1 d水平,具有统计学意义(P<0.05)。1 d组与空白对照组差异无统计学意义(P>0.05),抑制剂组与加力+抑制剂组变化趋势相似(图8)。
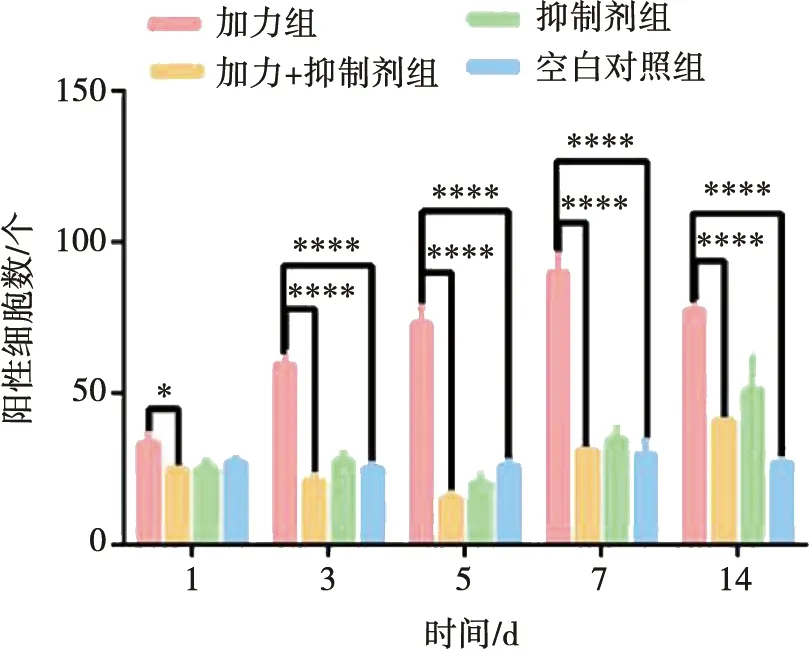
*:P<0.05;****:P<0.000 1图8 各组IL-17阳性细胞个数Fig.8 Numbers of IL-17 positive macrophages in each group
3 讨 论
3.1 大鼠正畸牙移动模型的建立
据文献统计57%正畸牙移动模型使用大鼠建立[12],而50 g的正畸力对于促进正畸牙齿移动牙周组织改建最为明显。本实验建模后,大鼠牙周组织病理变化明显,牙齿移动距离显著增加,证明大鼠正畸牙移动模型建立成功。有文献表明,随着加力时间增加,牙齿移动速率可分为:初始快速移动期,滞缓期,滞缓后移动期[13]。大鼠牙齿加力后1 d至3 d移动距离迅速增加,7 d至14 d出现滞缓,有学者认为滞缓现象的出现与牙周组织压力侧成纤维细胞的玻璃样变有关,清除玻璃样变组织后进入滞缓后移动期[14]。本实验在适宜正畸力作用下,随着加力时间延长,大鼠牙移动有从初始快速移动期至滞缓期的过程,而对于滞缓后移动期出现的时间需要进一步观察探究。
3.2 坏死性凋亡
坏死性凋亡是一种受调节的细胞死亡方式,由RIP1、RIP3及MLKL介导[15],其在形态学上具有坏死的特征,细胞裂解死亡释放大量细胞内容物引起周围炎症反应[16]。坏死性凋亡可以被多种刺激激活,包括TNF-α、LPS、DNA损伤、缺氧和营养缺乏[5]。RIP1在细胞存活、炎症和细胞凋亡中发挥作用,并被确定为坏死性凋亡的主要参与者。有研究表明,Nec-1能抑制RIP1激酶的活性,阻断RIP1、RIP3蛋白相互磷酸化,进而抑制复合物的形成,它是坏死性凋亡过程中的特异性抑制剂[17-19]。正畸力作用下,牙周膜细胞经受复杂的三维环境变化,使其处于缺血缺氧的环境中。近年来,有文献报道力学刺激可诱导多种细胞发生程序性细胞死亡[20-21]。程序性细胞死亡包括凋亡、坏死凋亡、焦亡、自噬等。有实验研究发现牵张加载可诱导人牙周膜细胞发生程序性细胞死亡,且不同牵张时段可能诱导不同阶段的程序性细胞死亡发生[22]。加力+抑制剂组大鼠牙齿移动距离与加力组大鼠相比明显减少(P<0.05),说明注射坏死性凋亡抑制剂后可减少大鼠正畸牙移动距离,且抑制剂作用在3 d时最为明显,由此推测,坏死性凋亡可能参与正畸力作用下大鼠牙齿移动的某一阶段过程中。
3.3 IL-1β的表达变化
正畸牙齿移动是一个高度复杂的过程,施加机械力后牙周组织发生重建,牙齿运动过程中的骨重塑是一种涉及急性炎症反应的生物学机制。IL-1β主要由单核细胞和局部的巨噬细胞、上皮细胞和成纤维细胞合成分泌,是一种强大的骨吸收刺激因子,它已被证明是能够刺激破骨细胞活化并吸引白细胞和其他细胞介质来进行骨重塑最有效的细胞因子,IL-1β由牙周韧带(periodontal ligament,PDL)产生,大量扩散到GCF中,被认为是正畸牙齿移动的生物标志物[23]。本实验结果显示在正畸力作用下IL-1β表达在早期迅速达到高峰,而后逐渐下降,与牙齿移动速率趋势相适应,说明IL-1β可影响破骨细胞分化促进骨吸收,与牙齿移动变化周期有关,可为正畸患者复诊时间提供依据。加力+抑制剂组大鼠IL-1β表达降低,推测坏死性凋亡抑制剂可通过抑制牙周膜细胞坏死性凋亡的发生,减少IL-1β的表达,从而抑制破骨细胞分化,影响骨吸收,减少牙齿移动距离。IL-1β在抑制剂组中的表达量与空白对照组接近且加力+抑制剂组与抑制剂组变化趋势相似,表明抑制剂本身对IL-1β的分泌没有影响。
3.4 IL-17的表达变化
IL-17是由CD4+的T细胞亚群Th17细胞产生的一种因子,免疫细胞 Th17 及其细胞因子 IL-17 同时参与破骨细胞的分化、成熟和激活[4]。有研究证实,IL-17通过促进局部炎性细胞因子的产生等间接方式,参与破骨细胞的分化、成熟、活化过程[24],并与其他炎性因子协同作用影响骨改建。此外,IL-17在各种涉及骨丧失疾病(如牙周炎、风湿性关节炎、骨关节炎等)中发挥强大的促炎作用和骨吸收作用,范瑞贤等[25]发现IL-17参与了正畸牙齿移动牙周组织改建及牙根表面改建的过程。IL-17的分泌可促进破骨细胞分化,促进牙槽骨吸收,或直接抑制成骨细胞的分化从而阻碍骨修复再生影响牙齿移动[26],加力+抑制剂组大鼠IL-17表达降低,推测坏死性凋亡抑制剂可通过抑制牙周膜细胞坏死性凋亡的发生,影响IL-17骨改建过程,减少大鼠正畸牙移动距离。IL-17在抑制剂组中的表达量在1、3、5、7 d组中与空白对照组接近,但在14 d组中出现明显升高,加力+抑制组在14 d组中IL-17含量也有上升趋势,此现象说明可能随着Nec-1注射量的增多,当达到一定量时Nec-1的抑制作用减弱,或有促进IL-17表达的作用,也可能由于抑制剂组14 d组统计数据产生误差所致。
根据本实验研究可发现坏死性凋亡可能存在于正畸加力后的牙周组织中,抑制坏死性凋亡可降低炎性分子的水平,影响破骨细胞分化从而影响牙齿移动,然而影响炎性因子分泌的途径及机制尚待进一步研究。

