ORFV诱导HaCaT细胞CK1等分子mRNA转录波动
刘圆圆,张帆,于永忠
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
羊口疮病毒(orf virus,ORFV)是痘病毒科副痘病毒属的代表成员[1],其基因组为两端闭合的双链DNA,大小约为138 kb,主要由两端反向重复序列(inverted terminal reapt,ITR)[2]和中央核心区(central core region,CCR)组成[3]。病毒基因组共编码134个基因,其中中央核心区编码100个左右的基因能够维持遗传稳定性,主要负责病毒的复制与装配;而两侧反向重复序列呈共价闭合的发夹结构,主要包含一些与病毒毒力因子强弱有关和致病机理有关的基因,但两侧反向重复序列的基因常常有突变的情况发生,进而呈现出种属间差异显著的现象,不仅如此该区域在感染性宿主时还发挥着免疫调控作用。尽管ORFV感染只是在宿主口唇等部位形成局部上皮病变,但极易造成宿主严重的持续性感染以及继发性感染[4-5]。在临床学上,ORFV主要引起羊传染性脓疱皮炎俗称羊口疮(Orf),即在患病羊只的口唇等部位皮肤或黏膜上皮形成增生性病变,以丘疹、脓疱、溃疡和炎症渗出以及桑葚状厚结痂为主要特点[6-7]。羊口疮常群发于开放性牧场,尤其是羔羊和免疫力低下的羊群中,虽然单纯病毒感染的成年动物的死亡率在5%以下,但由于其它病原微生物的继发感染或混合感染,往往致使病畜的死亡率会达到30%[8],在一些防疫欠佳的牧场偶尔也会因爆发羊口疮而会造成严重的经济损失,因此,该病在国内外养羊国家受到普遍重视,在我国也被列为三类动物疫病。值得关注的是,羊口疮也是一种人兽共患病[9],常引起与患病动物密切接触人群如农场主或屠宰场工人和兽医的体表关节部位形成丘疹脓疱,也有少部分人群会在口鼻处产生一些典型的临床症状,针对羊口疮疫情的防控和ORFV感染机制的研究成为全球研究的热点。
角质细胞又称为表皮细胞是一种主要由角质形成细胞组成的动态组织,也可以说是由四层鳞状分层上皮细胞组成的,分别为基底层、棘层、颗粒层和角质层,增殖只发生在与基底膜相邻的基底层,而表皮细胞的分化及向表面移动都经过棘层、颗粒层和角质层,且分化往往伴随着特异性标记物的(如中间丝形成蛋白、细胞角蛋白和桥粒钙粘着蛋白家族、桥粒芯蛋白)表达量变化。经研究证明角质形成细胞都需经历从基底层向基底上层移动的一个严格控制的分化程序,而角质形成细胞的增殖、分化和复制衰老之间的平衡对于防止表皮的病理改变起到重要作用。
细胞角蛋白(cytokeratin,CKs)是上皮细胞特征性标记物,在人表皮中是由Ⅰ型酸性和Ⅱ型碱性-中性角蛋白多肽杂聚物形成的一个大的蛋白质家族,根据细胞角蛋白的分子质量的不同将其分为20种,而细胞角蛋白表达含量的检测往往有助于鉴别皮肤不同的上皮性结构,也作为鉴别诊断肿瘤的方法之一,其在角化分层鳞状上皮的基底层则会过量表达CK5(Ⅱ型)/CK14(Ⅰ型)[10],最上面的表皮层(在棘层和颗粒层的上部)差异化的角化细胞表达CK2[11],两者中间的则是随着基底层细胞会向上移动分化的棘层和颗粒层,往往会抑制CK5/CK14的表达取而代之的是表达细胞角蛋白1和10〔CK1(Ⅱ型)/CK10(Ⅰ型)〕[12-13],与细胞角蛋白结合的蛋白如外聚蛋白,可以共同形成细胞内角蛋白网络用来提供抵抗机械应力[14]。
研究表明,人类永生化表皮细胞系(HaCaT)是自发转化的细胞系,有良好的表皮分化能力,且无致癌性,作为模式细胞目前已经广泛应用于相关领域的研究[15-18]。研究利用ORFV-HaCaT感染模型,通过RT-PCR等方法监测病毒感染对细胞CK1/CK10等Marker分子的实时影响,为阐明ORFV感染引起宿主黏膜上皮增生与分化的诱因,以及未来抗病毒药物的研发奠定基础。
1 材料与方法
1.1 材料
羊口疮病毒(ORFV)OV-HLJ/05株,由实验室分离于黑龙江省大庆市某私营牧场,保存于黑龙江八一农垦大学生命技术学院细胞生物学与分子病毒试验室;人类永生化表皮细胞(HaCaT),由黑龙江八一农垦大学生命科学技术学院韩英浩老师惠赠,冻存于实验室。
1.2 细胞传代培养与处理
HaCaT细胞从液氮中取出,于37℃水浴锅中复苏后,置于添加了10%胎牛血清和1%青链霉素混合液的DMEM高糖培养基中,放入含5%CO2的37℃恒温培养箱中培养。当培养细胞长至培养皿底部60%~70%融合度时通过细胞计数进行传代、冻存。试验使用病毒感染处理一定时间,然后收集细胞,裂解、提取RNA,进行后续试验。
1.3 TCID50检测
取1×105个HaCaT细胞种植于96孔板内,将ORFV病毒液用细胞培养液进行10倍系列稀释至10-1~10-9接种于96孔板内细胞,每个稀释度接种8孔,每孔100μL病毒稀释液(设有未接毒的细胞对照),置于CO2恒温培养箱中,每天观察细胞状态。待细胞孔出现50%CPE,运用Reed-Muench算法来计算毒株的TCID50。其中距离比例=(高于50%的百分数-50%)/(高于50%的百分数-低于50%的百分数);LgTCID50=距离比例×稀释度对数之间的差+高于50%的病变率的稀释度的对数。
1.4 细胞活性和细胞死亡率的检测
将细胞传代至96孔板中,设置试验组、对照组和空白组。当传代细胞数量达到可铺满每孔底部60%~70%时,进行细胞接毒处理,然后在病毒感染不同时间段内,按每孔液体总体积的10%加入2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐(CCK-8),再避光移入CO2恒温培养箱中孵育30 min,然后移至多功能酶标仪上读取数值,测定分析细胞活力。
1.5 qRT-PCR分析
采用100μL TCID50病毒感染细胞后,于不同时间段收集细胞,进行细胞计数,用mRNA快速提取试剂盒(Solarbio,China)提取总RNA,然后用Novodrop 2000测定提取RNA的浓度,并依据PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒(TaKaRa,China)说明进行反转录制备cDNA(根据基因参考序列设计的特异性引物列于表1中)。使用荧光染料法(NovoStart SYBR qPCR Super Mix Plus,Novoprotein)试剂盒处理得到的cDNA,移入Bio-Rad CFX96的qRT-PCR系统进行RT-PCR检测。扩增条件为:95℃,作用时间1 min,40个循环;95℃,主要是20 s;60℃,作用1 min和72℃,作用30 s。数据分析采用2-△△CT方法,将所有试验组目的基因中的mRNA归一化到内参GAPDH标准。整个过程均使用DEPC水处理过的材料及用具,防止RNA降解。

表1 qRT-PCR引物序列Table 1 Primer sequence for qRT-PCR
1.6 统计与分析
试验中,每个试验均设置三组平行试验,每组平行试验又均设有三个重复孔。反复确定得到的所有数据均以平均值±SD表示,对于两组以上显著性差异的比较采用单因素方差分析(One-way ANOVA test),而其他数据比较采用GraphPad Prism软件中非配对t检验,其中P<0.05视为显著(*);P<0.01视为极显著(**)。
2 结果与分析
2.1 TCID50检测病毒毒价
OV-HLJ05株ORFV分离株来源于东北地区一起羊传染性脓疱病暴发疫情,收集患病动物口唇部的丘疹结痂,研磨捣碎提取病毒粒子,在用Madin-Darby牛肾细胞(MDBK)进行几轮细胞扩繁病毒后,用蔗糖梯度超速离心法纯化成熟的病毒粒子,接着按照实验室病毒TCID50操作规程,验证了ORFV的TCID50(如表2所示)。采用Reed-Muench法计算距离比例为0.5,LogTCID50等于-7.5,则得出TCID50数值为10-7.5,即试验中所使用的ORFV的TCID50为10-7.5·0.1 mL-1,将所有病毒储存于HaCaT细胞中,滴定保存于-80℃以供进一步使用。

表2 ORFV的TCID50效价Table 2 The TCID50 of ORFV
2.2 ORFV影响HaCaT细胞增殖
通过CCK-8检测HaCaT细胞存活率结果如图1所示,结果发现ORFV在一定程度上能够影响细胞的增殖,尤其是在病毒感染24 h后,能较明显的抑制细胞增殖。但除了凋亡坏死的细胞,病毒对细胞增殖影响具体机制仍需进一步探究,除此之外ORFV是否可以促进细胞分化,需要通过细胞角蛋白(CKs)变化情况加以分析。
2.3 ORFV感染HaCaT细胞后引起的角蛋白变化
根据图1结果显示的ORFV对HaCaT细胞增殖的影响情况,研究采用ORFV-HaCaT体外感染模型进一步研究了病毒感染后对HaCaT细胞角蛋白表达的影响。如图2所示,采用RT-PCR方法检测了HaCaT细胞中各个分化阶段表达的标志物及CKs的mRNA水平变化。结果显示,在ORFV感染细胞整个过程中,细胞内标志物都呈不同的变化趋势。其中,桥粒芯糖蛋白3(DSG3)作为棘层中细胞间的桥粒,在病毒感染后细胞间桥粒表达量少于对照组,则表明病毒感染减少了细胞间连接,影响细胞增殖;而Ki67是一种存在于除表皮层外的各个角质细胞中的核蛋白,可以作为一个细胞增殖的标记物,且Ki67在细胞增殖的各期(G1、S、G2和M)中均有表达,但在细胞静止期G0期几乎不表达。由此,可以从基因水平上证明病毒感染细胞后影响细胞增殖。此外,表皮层表达的CK2没有异常变化。值得关注的是,基底层表达的CK5/CK14;棘层和颗粒层表达CK1/CK10在病毒感染时变化较为显著。尤其是棘层、颗粒层表达的CK1与CK10,这对角蛋白的变化趋势较对照组最为明显。整体变化呈正向波动影响了细胞正常分化的趋势,所有检测分析结果均列于图2中。
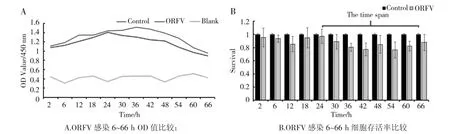
图1 ORFV感染6~66 h内对细胞增殖的影响Fig.1 Effect of ORFV infection on cell proliferation within 6-66 h

图2 ORFV感染HaCaT细胞不同时间段内CKs变化情况Fig.2 Changes in CKs of HaCaT cells infected by ORFV at different time periods
3 讨论
ORFV是一种人畜共患病毒,临床上可造成人或动物表皮增生、角质化不全或角质化过度、角化细胞变性以及炎症浸润反应等皮肤病变。此外,ORFV还可以反复感染宿主,宿主再次感染后尽管病变部位面积缩小,恢复时间缩短,但受到感染的动物仍然存在继发和混合感染的风险。在病理学方面研究表明,ORFV主要感染宿主皮肤的角质形成细胞即棘层细胞,因为如果角质细胞过度增生、分化,会导致病畜饮食功能障碍,久病难愈。由此,病毒与宿主细胞互作,特别是病毒感染影响细胞增殖、分化的特异性标记物的变化趋势,是目前国内外学者热衷于研究的焦点。2019年,Muhsen等[19]采用3D体外感染模型研究ORFV对角质形成细胞的CKs和loricrin进行了研究。据报道,ORFV在上皮组织模型中,会促使CK1和CK10分子的减少,并以此表明角质细胞的去分化的趋势。
在分子机制方面具体研究显示,CK1表达变化通常反映了角质细胞系基底细胞的状态[20],而CK10消长也常通过受控于蛋白激酶B(PKB,也称为Akt)和非典型的PKC通路,从而影响细胞增殖[21],故角质形成细胞的进一步分化(从棘层到颗粒层)往往伴随着CK1抑制及CK10的转录表达[22]。因此,CK1与CK10是角质细胞增殖分化的首要标志(Marker)分子[23]。在ORFV感染中,上皮组织因细胞病变(cytopathic effect,CPE)而过度角质化形成桑葚状结痂样的病灶,期间血管内皮生长因子(VEGF)也促进了上皮细胞增生[24]。尽管这样,还是怀疑ORFV对这些CKs的影响并不单纯,尤其是感染初期阶段,与宿主细胞对于CKs的竞争细节,可能会让我们更为客观地描述ORFV侵染细胞行为,从而可以进一步探索病毒与细胞相互作用的分子机制。
试验中结果显示了CK1与CK10受病毒影响表达水平产生了波动,反映出病毒与细胞间竞争的动态关系。此现象可能由于病毒与宿主细胞之间相互作用非常复杂,所以在一个不确定性因素较多的系统中得出的结论可能不具有统计学意义。而在相对独立的体系中,许多类似的研究对于客观评价数据的可靠性还是可取的。而人体永生化表皮细胞系(HaCaT)经常被用作角质形成细胞功能的研究模型,也为体外研究角质形成细胞的生长与分化之间转换提供了一个合适的研究平台。研究首先利用ORFVHaCaT感染模型,通过CCK-8方法检测了病毒感染6~66 h期间细胞的存活率与细胞活性。结果显示在病毒存在的18 h和60 h区间内细胞活性受到较大影响(如图1所示)。此结果或许验证了病毒复制和装配等行为干扰了细胞正常的生理和代谢,同时也存在细胞启动凋亡这种程序性死亡的机制以抑制病毒复制的可能性,但具体的调节机制还需进一步研究。
除了研究病毒对细胞增殖的影响,又进一步采用RT-PCR的方法监测病毒感染对细胞CK1/CK10等Marker分子的实时影响,以阐明ORFV感染引起宿主黏膜上皮细胞增生与分化的趋势。此前曾有文献报道,桥粒芯糖蛋白3(DSG3)分子作为肺及皮肤等器官的自身免疫性疾病(天疱疮)一种主要的特异性抗原,一旦基因沉默会导致HaCaT细胞黏附缺陷和细胞增殖能力锐减[25]。而Ki67分子作为细胞增殖的主要标志物,能够示踪G和S期细胞增殖情况,可通过检测Ki67表达水平来辅证细胞增殖情况[26]。试验运用了RT-PCR检测DSG3及Ki67的mRNA表达水平,证明ORFV感染HaCaT细胞后一定时间内可影响细胞的增殖。除此以外,我们又检测了其他细胞形态相关的CKs,诸如CK2等,但CK2在ORFV感染过程中变化趋势不明显。曾有研究表明,CK1和CK10作为棘层细胞分化的标志物,在HaCaT细胞中却能表现出从无染色到强染色的异质性染色形式,即HaCaT细胞可以同时表达CK1和CK10两种分子,或者CK1和CK10其中之一,或者CK1和CK10都不表达。而在角蛋白表达上,HaCaT细胞也存在异质性,即具有基底细胞和棘层细胞的双重特质[27]。试验正是考虑到该细胞具有的这种双重特性,着重阐述了ORFV感染HaCaT细胞后在不同时段的CKs的表达量变化,在6 h试验组中CK5/CK14的转录水平就高于对照组;而在6~24 h,试验组中CK1/CK10的转录水平也高于对照组。由此,推测病毒感染细胞后会影响细胞增殖或者促进细胞异常分化。而且,在6~24 h使得细胞停留在棘层细胞分化状态的同时病毒感染细胞也有分化至表皮层的趋势。尽管如此,病毒对于细胞的上述影响及其内部的分子机制,需要从病毒对细胞分子信号通路的影响研究方面得到进一步证实。目前,通过文献查找与研究发现有4个主要的细胞信号通路,可能受到ORFV不同程度的干预,从而造成试验中细胞CKs的异常现象。这些通路包括PI3K/Akt通路[28]、MAPK(Raf/MEK/ErK、JNK和p38)通路[29]、Wnt/β-catenin通路[30]和Hippo通路[31]等。当然,也不排除病毒同时干预IP3-Ca2+和DAGPKC双信号通路[32],以及各个信号通路之间交互作用可能性,总之还需进一步通过加入信号通路抑制剂来探究病毒感染细胞后,可能调控的信号通路影响细胞分化的分子机制。
4 结论
试验主要通过CCK-8法检测病毒对细胞活性以及存活率的影响,结果显示在病毒感染24 h后能明显影响细胞的增殖情况,除此之外又通过qRTPCR方法在mRNA转录水平,检测了ORFV感染HaCaT细胞后在不同时间段对DSG3、Ki67及CKs等分子表达变化的影响,结果表明,病毒感染可以使CK1/CK10等分子表达产生波动,影响了细胞分化趋势,之后将进一步探索对细胞增殖与分化的具体影响以及相应的分子机制研究。总之,研究为了解病毒与宿主细胞间“互作”奠定了基础,也为抗羊口疮病毒感染的深入研究提供了参考。

