1-磷酸鞘胺醇与动脉瘤性蛛网膜下腔出血后脑血管痉挛的相关性研究
汤华,陈少军,韩晶,夏开来,姜莱,郑刚
颅内动脉瘤破裂后蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)引起的脑血管痉挛(cerebral vasospasm,CVS)是影响患者预后的关键因素之一,其发病机制主要是各种原因引起的血管平滑肌收缩[1]。研究表明,来源于细胞膜鞘脂类和甘油磷脂的1- 磷酸神经鞘氨醇(sphingosine-1-phosphate,S1P)和 溶 血 磷 脂 酸(lysophosphatidic acid,LPA)等脂质介质,维持着血管内皮细胞和平滑肌细胞的正常功能和成熟分化[2-4]。Coussin等[5]发现S1P可引起脑动脉收缩。本研究通过分析aSAH 患者CVS 的程度与脑脊液及血清S1P 水平的关系,探讨S1P 与aSAH 后CVS 的相关性。
1 资料与方法
1.1 一般资料
收集2016 年7 月至2019 年9 月我院神经外科收治的自发性SAH患者37例,其中27例行DSA检查证实至少有1~2个分段血管痉挛,纳入痉挛组;另有10 例DSA 检查未发现CVS,纳入无痉挛组。纳入标准:均经头颅CT 或腰穿证实为aSAH,且入院24 h内行DSA检查确诊颅内动脉瘤,并同时成功行颅内动脉瘤介入栓塞治疗;意识障碍较轻,无明显或仅有轻度局灶性神经功能障碍,Hunt-Hess 分级Ⅰ~Ⅲ级。排除标准:外伤性或病因不明性等非动脉瘤破裂所致的SAH;病情危重,Hunt-Hess 分级Ⅳ~Ⅴ级;具有严重的并发症或其他系统疾病;既往有相关血管病史(颈内动脉狭窄、烟雾病等);已纳入无痉挛组患者,在TCD跟踪检测期间血流速度>120 cm/s,复测一次仍增高。另在同时期我院未破裂颅内动脉瘤介入栓塞治愈术后半年复诊患者中,选取入院DSA 检查未见血管痉挛及血管狭窄的患者12例为对照组,纳入标准:均为单纯弹簧圈栓塞,未放入支架,术后未行阿司匹林和氯吡格雷抗凝抗聚治疗。对照组12 例,男7 例,女5 例;平均年龄(62.5±10.3)岁;吸烟25.0%,饮酒16.7%;糖尿病33.3%,高血压66.7%,高脂血症16.7%。无痉挛组10 例,男6 例,女4 例;平均年龄(63.2±9.8)岁;吸烟20.0%,饮酒10.0%;糖尿病30.0%,高血压70.0%,高脂血症10.0%。痉挛组27 例,男16 例,女11 例;平均年龄(61.3±8.9)岁;吸烟18.5%,饮酒14.8%;糖尿病22.2%,高血压77.8%,高脂血症11.1%。3组一般资料差异均无统计学意义(均P<0.05)。本研究通过伦理学审批,受试者及家属签署知情同意书。
1.2 方法
1.2.1 治疗方案 所有患者均给予对症治疗。痉挛组及无痉挛组患者入院后均给予静脉输注尼莫地平治疗:每剂25 mg,速度0.5 μg/(kg·min),监测血压,以血压不下降或略有下降为宜,2 周后改口服,每次30~60 mg,每日3次,口服1周。对照组不使用尼莫地平等抗血管痉挛药物。
1.2.2 血清及脑脊液中S1P 的高效液相色谱法测定 S1P 标准品和2,3-萘二甲醛(NDA)购自美国Sigma 公司,甲醇等其他有机试剂购自中国国药集团公司。25 μL 血清加入150 μL 氯仿∶甲醇(1∶2,V/V)后超声5 min;然后加入100 μL 1 mmol/LNaCl、100 μL 氯仿、10 μL 浓盐酸后离心(13 000g,2 min)取有机相(萃取2 次)蒸干得到脂质结晶,以25 μL乙醇溶解。10 μL样本加入20 μL NDA衍生混合物(25 mmol/L 硼酸盐缓冲液,pH9.0;2.5 mmol/L NDA;2.5 mmol/L NaCN),50℃水浴10 min;加入3倍体积的无水乙醇稀释,室温离心(13 000g,5 min),最后以C18色谱柱(Phenomenex公司,美国)和高效液相色谱仪(AVRIAN240,美国)分析。色谱条件:流动相采用梯度法,根据出峰时间定性,标准曲线定量。标准品按上述方法进行HPLC后以峰面积为纵坐标绘制标准曲线。
1.2.3 血管痉挛判定 所有患者在诊断性DSA检查确诊后,尚未行介入栓塞前,利用DSA 机电脑软件依次测定大脑中动脉(middle cerebral artery,MCA)M1、M2 段血管直径。对照组患者采用同样方法测定相应血管的直径,并取平均值做参考标准。按照Weidauer[6]推荐的判定标准,确认是否有血管痉挛:血管直径缩小比例<10%为无血管痉挛;血管直径缩小比例≥11%可判定为血管痉挛。患者发病后第3、5、7、10、14天分别行TCD检测,跟踪血管痉挛变化。国内外标准选MCA(M1段、M2段)为最佳测试血管段,根据双侧MCA脑血流平均速度分类,<120 cm/s 无痉挛,120~140 cm/s 为轻度痉挛;140~200 cm/s 为中度痉挛;>200 cm/s 为重度痉挛。
1.3 统计学处理
采用SPSS19.0统计软件分析数据,计量资料以(均数±标准差)表示,符合正态分布数据的组间比较使用独立样本t检验;计数资料以率(百分比)表示,χ2检验;Person相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组MCA血流速度比较
TCD结果显示,在发病后第3、5、7、10天,痉挛组的MCA血流速度高于无痉挛组,见图1A;与对照组相比,发病后第7天痉挛组的MCA 血流速度显著增高(P<0.01),但无痉挛组则无显著改变,见图1B。其中痉挛组的MCA 血流速度在第3 天已显著高于无痉挛组(P=0.003),第5 天呈进行性升高趋势(P=0.002),第7 天达到峰值(P=0.001),第10 天呈下降趋势但仍高于无痉挛组(P=0.022),第14 天下降至与无痉挛组差异无统计学意义(P=0.079)。
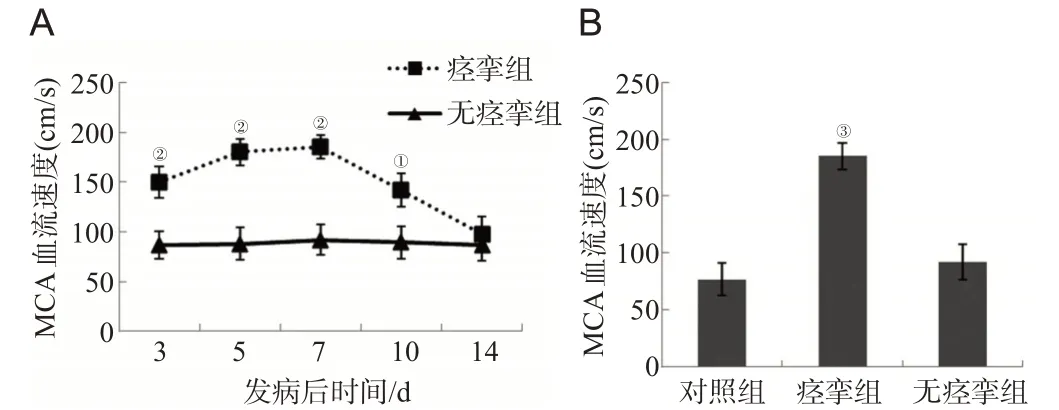
图1 TCD测定各组MCA血流速度
2.2 各组脑脊液与血清中的S1P水平比较
以S1P 标准品配制浓度梯度的标准品溶液,通过HPLC 法检测的结果表明浓度在0.1~1.6 nmol/L 内S1P 的浓度与峰面积具有良好的线性关系,相关系数为0.995,见图2A。与无痉挛组相比,痉挛组发病后3 d患者脑脊液和血清中S1P的含量升高,痉挛组发病后5 d和7 d脑脊液和血清中S1P含量显著高于无痉挛组(P<0.01),于第10 天时下降,但仍高于无痉挛组(P<0.05),至第14天时2组对比差异则无统计学意义(P>0.05),见图2B、图2C、表2。与对照组相比,痉挛组发病后7 d 脑脊液和血清中S1P含量显著升高(P<0.01),无痉挛组差异则无统计学意义(P>0.05),见图2D、图2E。
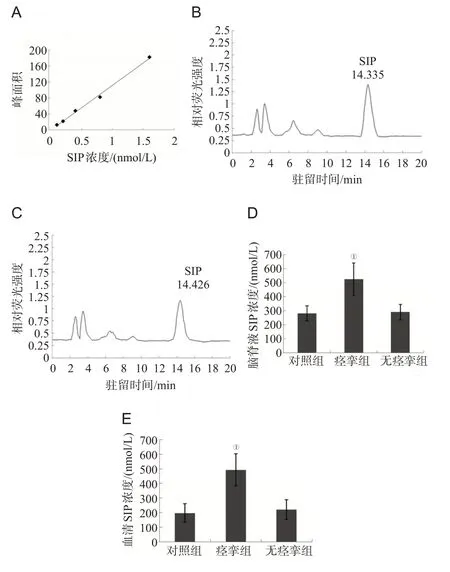
图2 HPLC检测3组脑脊液和血清中S1P水平的比较
2.3 痉挛组患者MCA血流速度与血清、脑脊液S1P含量的相关性分析
痉挛组aSAH 患者在发病后第7 天的MCA 血流速度与血清和脑脊液的S1P含量均呈正相关(P<0.05),见图3。
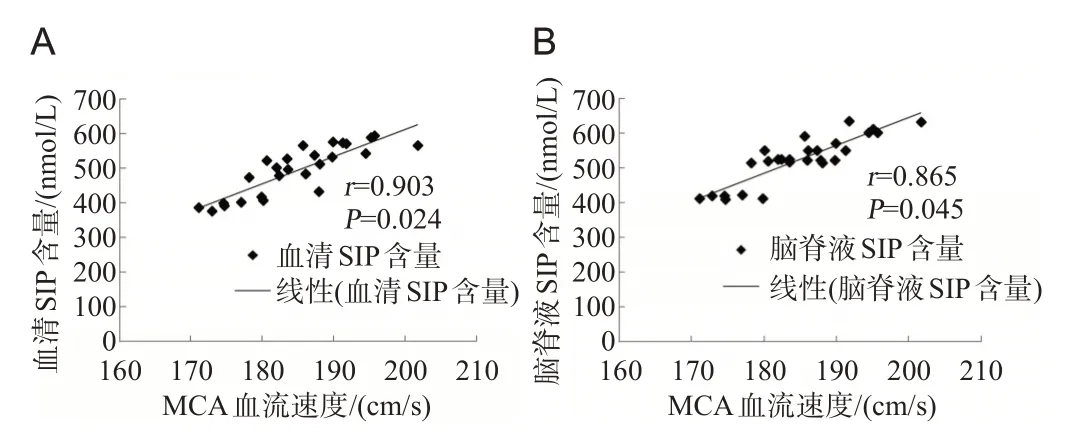
图3 痉挛组患者发病后第7天MCA血流速度与血清(A)及脑脊液(B)中S1P含量的相关性分析
3 讨论
CVS导致严重的脑组织缺血是aSAH致死和重残的主要因素[7]。因而防治aSAH 后的CVS 成为临床aSAH 治疗的核心问题。S1P是近年来发现的具有重要生理功能的一种膜磷脂类分解和代谢产物,其既可作为一种细胞内第二信使,又可作用于细胞表面特定的受体分子而发挥其重要的生物学功能[8,9]。S1P由鞘氨醇激酶1(sphingosine kinase 1,SphK1)和鞘氨醇激酶2(sphingosine kinase 2,SphK2)催化鞘氨醇生成,S1P作为G蛋白耦联受体家族的一员,是一种高效的脂质介质,能在多种生理和病理活动中作为第二信使传导细胞内信号。研究人员在血管内皮细胞和平滑肌细胞都发现了S1P受体[10]。S1P和鞘氨醇的刺激可导致钙离子释放,而在细胞滑面内质网中则无此效应。由于钙离子的释放不是由于内质网膜的通透性改变,而是同非三磷酸肌醇有关,说明内质网是磷脂刺激敏感性钙池的主要位置,同时也是鞘氨醇激酶合成S1P的地点[11]。
表1 aSAH患者各时间点血清和脑脊液的S1P含量(nmol/mL,±s)
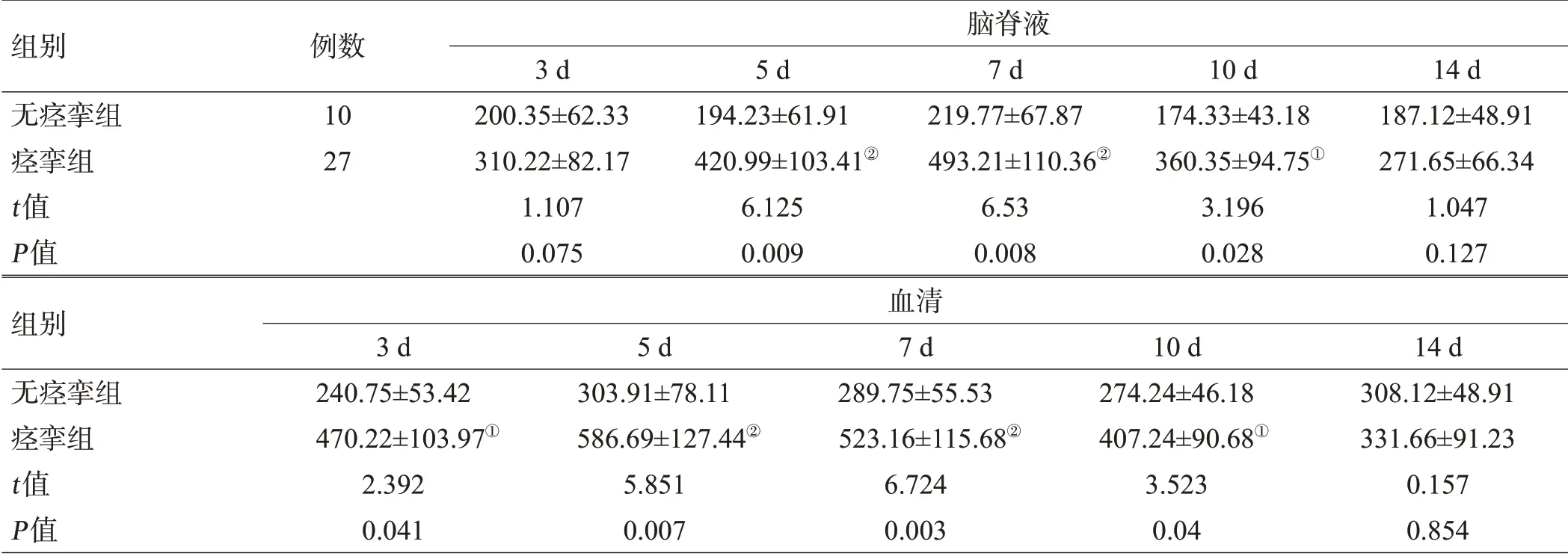
表1 aSAH患者各时间点血清和脑脊液的S1P含量(nmol/mL,±s)
注:与无痉挛组比较,①P<0.05,②P<0.01
组别无痉挛组痉挛组t值P值血清3 d 240.75±53.42 470.22±103.97①2.392 0.041 5 d 303.91±78.11 586.69±127.44②5.851 0.007 7 d 289.75±55.53 523.16±115.68②6.724 0.003 10 d 274.24±46.18 407.24±90.68①3.523 0.04 14 d 308.12±48.91 331.66±91.23 0.157 0.854组别无痉挛组痉挛组t值P值例数10 27脑脊液3 d 200.35±62.33 310.22±82.17 1.107 0.075 5 d 194.23±61.91 420.99±103.41②6.125 0.009 7 d 219.77±67.87 493.21±110.36②6.53 0.008 10 d 174.33±43.18 360.35±94.75①3.196 0.028 14 d 187.12±48.91 271.65±66.34 1.047 0.127
Coussin 等[5]发现S1P 可引起脑动脉收缩,但对主动脉无效。研究发现,脑动脉平滑肌细胞中S1P3/EDG-3 和S1P2/EDG-5 的受体表达水平是主动脉平滑肌细胞的4 倍,而两者之间S1P受体的表达没有区别[12]。提示S1P可能通过其受体在不同系统中表达的类型和数量的不同,来实现不同的生理功能。Muraki 等[13]研究发现S1P 作用于兔、小鼠大动脉则不会出现钙离子水平增高的现象,但是兔的脑部大血管在S1P 作用下会发生钙离子水平增高。这表明,不同的血管平滑肌细胞对S1P 的反应有差异性。笔者前期在兔aSAH动物模型发现,aSAH后第3~5 天,基底动脉可高表达SIP 磷酸酶,使得S1P 的合成明显增加。兔aSAH动物模型血清及脑脊液中S1P表达的曲线变化趋势与基底动脉S1P的浓度及血管横截面积管径的变化一致[14]。
本研究通过动态检测aSAH后CVS患者、aSAH无痉挛患者脑脊液与血清S1P的表达水平,并同步动态检测MCA血流速度来变相监测血管痉挛程度的变化趋势,发现aSAH 后CVS 患者脑脊液S1P表达明显高于aSAH无痉挛患者,aSAH后CVS患者脑脊液S1P 升高幅度与其血管痉挛程度呈正相关,与Pulcrano-Nicolas等[15]报道一致。
本研究揭示了S1P 表达与aSAH 后脑血管痉挛的关系,为临床干预aSAH 后CVS 提供新的潜在治疗靶点和研究思路,S1P有望成为临床预测CVS严重程度的一个新指标。此外,本研究也存在一定的局限性,主要是纳入病例数较少,而对于S1P参与aSAH后CVS的具体机制尚未阐明,还需要进一步研究。
