脑出血急性期血压的管理策略研究进展
郑林歆,陈舒悦,许峰
原发性脑出血,简称“ 脑出血”(intracerebral hemorrhage,ICH),是最严重和最难治疗的卒中类型,全球每年约200 万例患者罹患ICH[1],在我国,ICH 占所有卒中的17.1%~55.4%[2],远高于国外。即使这样,ICH后的高死亡率,在最近30年一直居高不下,所以如何更好地降低死亡率和改善功能预后是目前ICH 的研究热点,而急性期的血压管理正是其中的重要环节。本文拟讨论ICH急性期血压与预后的关系,总结ICH急性期血压变化的机制,重点关注急性期血压管理的现行策略,归纳常用静脉降压药物的临床应用进展。
1 脑出血急性期的高血压与预后的关系
ICH 急性期常出现高血压[ 收缩压(systolic blood pressure,SBP)>140 mm Hg],这也是患者死亡的一个强有力的预测因子。1995年的一项研究发现,入院时平均动脉压(mean artery pressure,MAP)超过145 mmHg 与较高的30 d 死亡率相关[3]。后续研究也发现,SBP>180 mmHg 与发病后1 年内的死亡相关[4]。ICH 患者在发病后24 h 内常出现血肿扩大,后者高度预示临床病情和功能预后的恶化。急性控制收缩压可能会降低该事件的几率,然而血压的过度矫正又可能以减少两个关键区域的灌注为代价:血肿灶周脑组织和终末器官灌注。血肿周围灌注减少可能扩大灶周血肿的缺血范围,而终末器官的灌注减少则很有可能引起急性肾损伤[5]。
大型随机对照临床试验对强化(<140 mm Hg)和标准(<180 mm Hg)收缩压管理进行比较,见表1。由于INTERACT2 试验[6]发现强化降压可能会改善ICH 的功能预后,最新的美国自发性ICH 治疗指南[7]关于急性血压管理有2 项建议:对于SBP 150~220 mmHg 的患者,SBP 迅速降至140 mmHg 是安全的;SBP 超过220 mmHg 的患者,积极降低血压和连续静脉输注是合理的。然而,基于ATACH-2试验发表提出的安全问题[7],最近美国心脏病学会/美国心脏协会的高血压指南,建议“自发性成人ICH发病后6 h内的收缩压,如果之前为150~220 mmHg,立即降至140 mmHg 以下,并不能减少死亡或严重残疾,甚至可能有害”[8],这与之前的ICH 治疗指南相互矛盾[7]。而且最近的一项荟萃分析评估了六项研究中的共4 385 例患者,发现急性期血压降至140 mmHg 以下并不会使ICH 总人群获益[9]。我国最新的ICH 急性期治疗指南[10]推荐,对于病前SBP 150~220 mmHg的患者,在没有降压禁忌的情况下,SBP迅速降至130~140 mmHg是安全的,但对于神经功能预后的影响尚不明确;对于SBP超过220 mmHg的患者,收缩压的目标血压值为160 mmHg,但证据级别偏低。所以,目前ICH急性期的目标血压值仍存在争议。
2 ICH急性期血压变化的病理生理机制
通常在ICH发病后24 h内血压会高于发病前[11],该现象的确切病理生理机制尚不清楚;然而,在涉及调节血压和心脏功能的大脑区域,包括脑岛、扣带皮质、杏仁核、前额叶区域受损或脑干受到血肿压迫时,该反应更常见[12]。这可能是因为这些区域的损伤会释放各种激素(如醛固酮和血管紧张素)、儿茶酚胺(如去甲肾上腺素和肾上腺素),并增加压力感受器的敏感性。岛叶皮质出血的患者体内发现儿茶酚胺水平的变化,这些变化导致交感神经自主功能的显著增加,导致血压(blood pressure,BP)、舒张压(diastolic blood pressure,DBP)和心率(heart rate,HR)升高[13]。而在生理条件下,脑血管紧张素Ⅱ和一氧化氮则可抑制交感神经活动从而控制血压[14]。
ICH急性期高血压反应是对脑损伤的一种生理反应,而控制血压以前被认为可能会诱发血肿灶周的缺血。ICH-ADAP研究[15]发现,在ICH后迅速降低血压并不会减少血肿灶周的脑血流,因此不会诱发ICH患者的颅内缺血。此外,因为收缩压超过200 mmHg是患者血肿扩大的独立危险因素,所以收缩压可作为治疗目标。尽管表1 为一般的ICH 患者定义了收缩压目标值,但目标血压值的设定需要结合整体病情。例如,大面积ICH患者伴明显占位效应,确保脑灌注压维持在50~70 mmHg 非常重要,这样才能保证充分的脑血流灌注[16,17]。另一方面,由于收缩压升高与ICH扩大之间的密切联系,为了充分控制收缩压,同时保证足够的脑灌注,采用传统干预手段(如渗透疗法或者手术)来控制颅高压就显得至关重要。
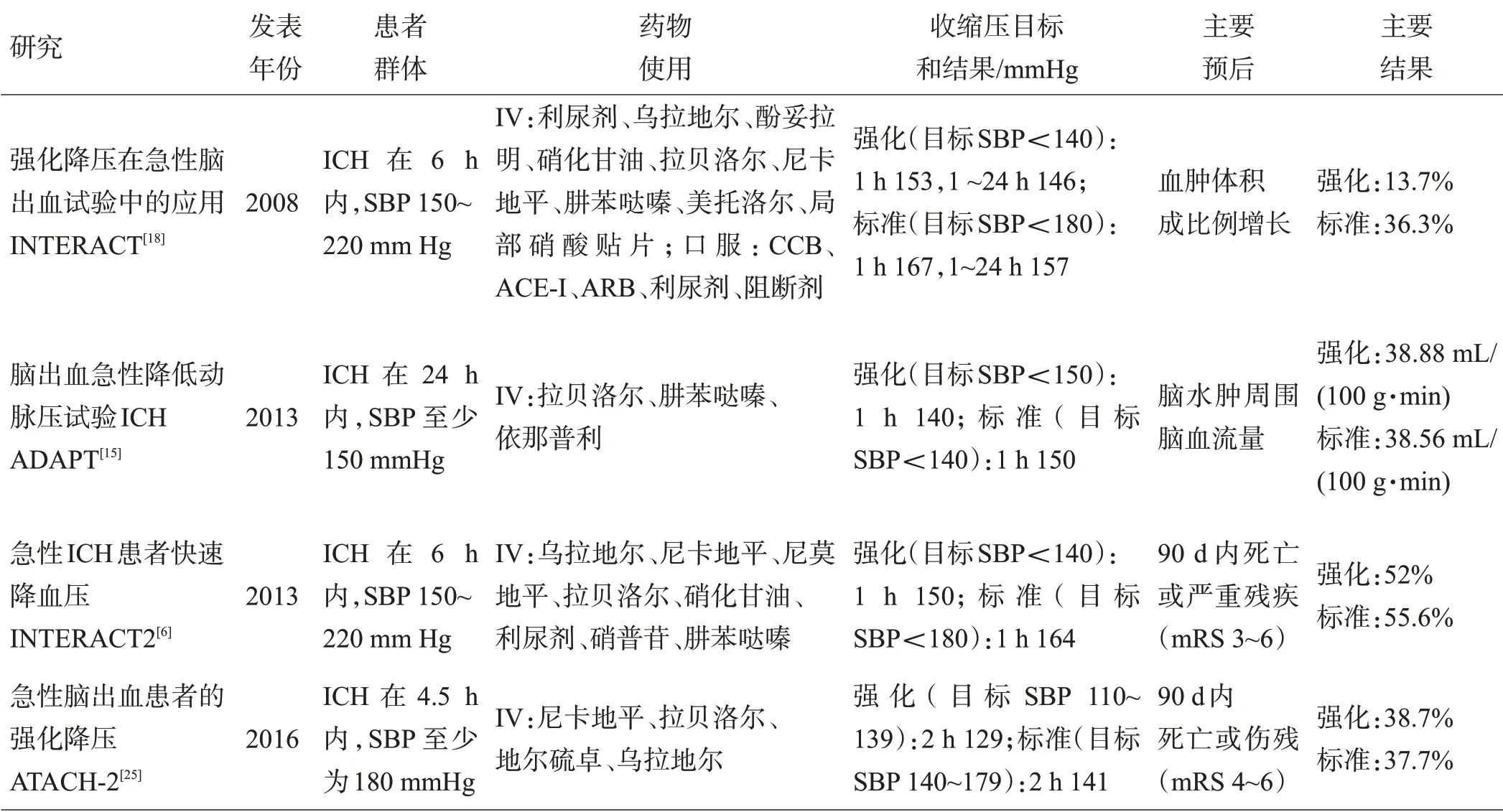
表1 ICH后急性期收缩压管理研究
3 脑出血急性期常用静脉降压药物
虽然目前ICH急性期目标血压尚不完全明确,临床医生仍然需要根据现有的证据,来确定降压治疗对于特定的ICH人群是否有益,并了解现行的降压策略以改善ICH患者的预后。由于迅速起效、代谢快的静脉降压方式是高血压急症的常见治疗手段,因此,本文综述ICH急性期常用的静脉降压药物,见表2。
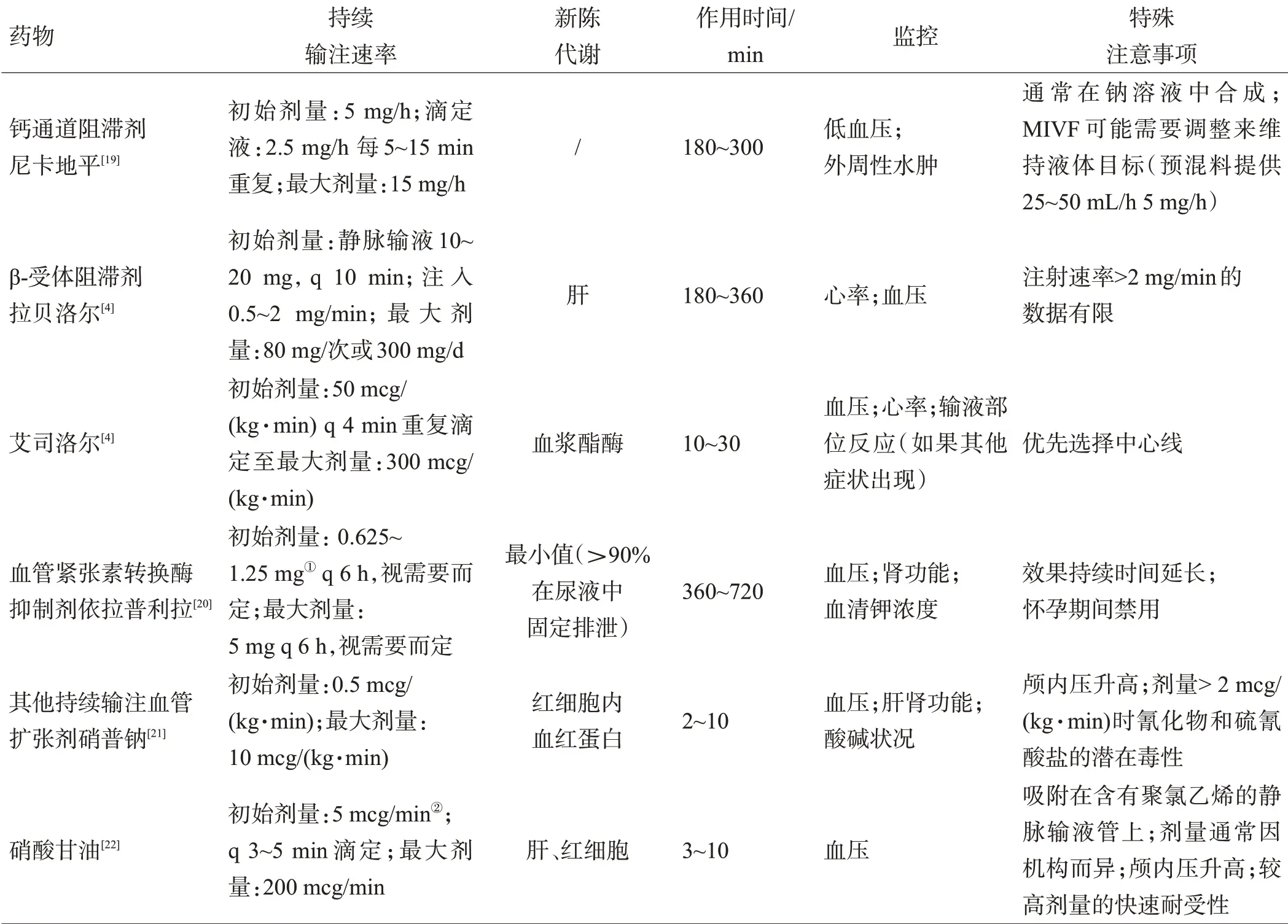
表2 ICH急性期常用静脉降压药物
3.1 钙通道阻滞剂
尼卡地平作为一种二氢吡啶钙通道阻滞剂,已成为高血压急重症的主要抢救药,在神经重症中,也是血压管理的一线药物。它可以阻断心脏中l 型或长期的电压门控钙通道,减少导致肌肉收缩的钙流入。尼卡地平对血管平滑肌选择性更强,因此可在不降低心脏收缩力的情况下降低血压,偶见的心脏不良反应包括反射性心动过速、心肌梗死风险增加和心绞痛。它的给药方式是持续静脉输注,并可滴定以达到目标血压。
静脉输注尼卡地平的降压疗效确切,不良反应少,在神经危重症患者中应用较普及。对于ICH患者,尼卡地平不影响脑动脉血流速度、颅内压或脑灌注压。Maleske 等[23]发现,与拉贝洛尔相比,尼卡地平在30 min 内达到目标血压的比例更高(83%v.s.67%,P=0.04)。一项在脑出血和蛛网膜下腔出血患者中比较尼卡地平和拉贝洛尔疗效的研究[24]中,两种药物在给药后的第一个小时内都有效控制了血压,而且两者引起低血压或心动过缓的风险类似,不过尼卡地平达到目标血压更快。与其他研究类似,与拉贝洛尔相比,尼卡地平需要联合第二种药物来控制血压的可能性更小。尽管ATACH-2 试验[25]的设计目的不是为了验证特定药物的疗效,但该试验只使用尼卡地平作为主要降压药物来对ICH 后3 h 内的患者进行血压干预,并比较收缩压目标≤140 mmHg 和≤180 mmHg 的2 组患者的血压。2 组患者前2 h 的平均最低收缩压分别为(128.9±16.0)和(141.1±14.8)mmHg。这些值远低于在没有涉及尼卡地平的INTERACT2试验[6]中观察到的值。
3.2 β-肾上腺素能受体拮抗剂
肾上腺素能受体拮抗剂可抑制儿茶酚胺在β-和α-受体的作用。β-肾上腺素能受体拮抗剂(简称“β受体阻滞剂”),通过结合β受体不同亚型,内在拟交感神经活性,对α-肾上腺素能受体的阻滞,及扩张血管而发挥作用。β受体阻滞剂的降压机制是多因素的,可能包括拮抗儿茶酚胺、减少交感神经输出和/或抑制肾素活性。由于其良好的药代动力学特性,拉贝洛尔和艾斯洛尔代表了脑出血急性期最常用的β受体阻滞剂针剂。
拉贝洛尔是非选择性β上腺素能受体拮抗剂。不同于单一的β1选择性受体阻滞剂,拉贝洛尔还可同时作用于α受体,所以能更大程度降低外周血管阻力和血压。拉贝洛尔可持续输注,也可静脉推注。静脉推注时注射时间应大于2 min,以避免心率或血压的急剧下降。静脉注射拉贝洛尔后5 min,降压效果最明显。与其他β受体阻滞剂一样,拉贝洛尔禁用于窦性心动过缓、心传导阻滞、心源性休克或失代偿性心力衰竭患者。国外研究已证实拉贝洛尔静脉推注或持续输注控制脑出血后的高血压的疗效和安全性。Hecht等[26]观察了99例接受注拉贝洛尔或尼卡地平持续输注的急性卒中患者,其中81 例(82%)为脑出血患者。拉贝洛尔组和尼卡地平组在达到目标血压时所需时间没有差异(68%v.s.67%,P=0.885),而且达到目标血压的时间、血压变异性、不良反应发生率也相近。Liu-DeRyke 等[27]观察卒中患者队列来比较静脉推注拉贝洛尔和持续输注尼卡地平进行血压管理的疗效,共纳入90例患者,其中ICH患者49例(54%),64例使用拉贝洛尔,26例使用尼卡地平。在最初的24 h内,与尼卡地平相比,尽管拉贝洛尔与较高的血压变异性有关(10.78 mmHgv.s.8.19 mmHg,P=0.003),因为2 组之间的收缩压大约仅相差2 mmHg,所以这种差异的临床意义不明。此外拉贝洛尔静脉输注也可能需更多的剂量调整或更多降压药物的联合应用。与其他研究结果一致,2 组间低血压或心动过缓的发生率差异无统计学意义。所以,拉贝洛尔的静脉推注也可用于ICH急性期降压治疗,但是对于需要反复静脉推注拉贝洛尔或难治性高血压患者,拉贝洛尔则需考虑持续静脉输注。关于拉贝洛尔降压的临床ICH病例在国内也有报道,需进一步深入研究[28]。
艾司洛尔是一种超快速起效的高选择性β1受体阻滞剂,以连续静脉输注的形式给药,可用于室上性心动过速、窦性心动过速、围手术期心动过速和高血压。给药后,艾司洛尔被红细胞的血浆酯酶迅速分配和水解,导致作用时间短。艾司洛尔的代谢不受肝功能或肾功能障碍的影响,可快速滴定,以达到理想的血流动力学效果。艾司洛尔一般耐受性良好,但常见的不良反应包括低血压、输液反应、恶心、头晕和嗜睡。为避免输注部位的局部反应和外渗,建议使用中心静脉给药。据报道,作为一种短效静脉降压药,艾司洛尔可有效缓解神经外科全麻手术患者的围手术期高血压反应,并且疗效和拉贝洛尔相当[29]。然而,由于艾司洛尔对β1受体具有高选择性,其主要的血流动力学效应是降低心率,因此目前尚缺少证据证明艾司洛尔能有效控制ICH急性期的血压。虽然艾司洛尔已被推荐用于出现高血压危象的患者,但循证医学证据主要局限于胸主动脉疾病患者,而非神经急症患者[8]。
3.3 血管紧张素转换酶抑制剂
依拉普利拉是一种静脉注射制剂,是血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制剂依拉普利拉的活性代谢物。血管紧张素转换酶抑制剂通过抑制血管紧张素Ⅰ向血管紧张素Ⅱ的转化而对肾素-血管紧张素-醛固酮系统产生影响。最终结果包括血管扩张以及通过降低醛固酮活性和减少交感神经活动来排泄钠和水[30]。依拉普利拉的起效时间约为15 min,用药后1~4 h内降压效果达到峰值,药效持续时间超过6 h。潜在的不良反应包括低血压、头痛、恶心、咳嗽、高钾血症,以及由于缓激肽积聚引起的血管性水肿。低血压在肾功能不全、血容量和/或钠缺乏、肾素活性高的患者中更常见。对于肾功能不全的患者,应谨慎使用依拉普利拉,因为这些患者出现高钾血症的风险很高。依拉普利拉和其他ACE抑制剂一样,孕妇禁用。因为起效偏慢,药效持续时间较长及相关安全性风险,依拉普利拉目前尚难以列为ICH患者急性期的一线降压药。国内也尚未见ICH患者应用依拉普利拉的临床报道。
3.4 其他血管扩张剂
乌拉地尔(urapidil)为新型抗高血压药,属于肾上腺素能α受体阻滞剂,具有中枢和外周双重作用机制:在外周,可阻断突触后α1 受体、抑制儿茶酚胺的缩血管作用,从而降低外周血管阻力和心脏负荷;在中枢,通过兴奋5-羟色胺-1A 受体,调整循环中枢的活性,防止因交感反射引起的血压升高及心率加快。乌拉地尔不良反应较轻微且短暂,最常见的不良反应有头痛、头晕、恶心、疲乏、心悸、荨麻疹等。该药3~5 min 起效,既可以静脉推注,也可以持续静脉输注,临床上常用于治疗高血压急症和围手术期的血压管理[31]。Interact2 研究中,大量中国ICH 患者急性期采用乌拉地尔来控制血压,提示乌拉地尔在我国应用广泛[32]。据报道,ICH 急性期通过乌拉地尔来强化降压可能会减少再出血的风险和血肿灶周的水肿,改善短期预后[33]。也有学者认为,虽然乌拉地尔和尼卡地平的安全性相似,但是乌拉地尔的降压速度和平稳性可能不及尼卡地平[34]。目前乌拉地尔相关的大型随机对照临床研究仍较少,其研究证据主要来自于规模较小的观察性临床研究。因此,今后的研究工作应积极引入规模较大、以临床事件为终点的随机临床试验,以期更深入客观地认识乌拉地尔的临床作用。
硝普钠是一种有效的动脉和静脉血管扩张剂,可降低全身血管阻力和右心房的静脉回心血量[35]。它起效迅速,在1~2 min内就可出现降压作用,而且作用持续时间很短,只有2~10 min。硝普钠最令人关注的副作用之一是氰化物和硫氰酸盐(硝普钠的代谢产物)的毒性。氰化物中毒的患者可能表现为静脉高氧血症、乳酸性酸中毒、呼吸窘迫和精神错乱、癫痫发作[36]。此外,硝普钠还可能通过扩张脑血管和破坏血管的自动调节功能而增加ICH 的颅内压[20]。在一项对ICH 患者的多中心观察研究中,入院后24 h内硝普钠的使用与较高的住院死亡率相关。所以,ICH患者急性期应避免使用硝普钠[17]。
硝酸甘油是一种有机硝酸盐,通过松弛血管平滑肌使外周动脉、静脉和冠状动脉扩张。硝酸甘油起效迅速(2~5 min),药效持续短(3~10 min)。最常见的副作用包括头痛、恶心、低血压和反射性心动过速。此外,硝酸甘油还可能通过作用于颅内容量血管而增加颅内压[37]。目前尚缺乏ICH患者使用硝酸甘油静脉降压的安全性和有效性的证据。该人群中规模最大的降压药物相关研究是Interact 2 试验,268 例患者(包括14.9%的强化组)接受硝酸甘油的经皮制剂,即甘油三硝酸酯(GTN)[6]。另一方面,一氧化氮脑卒中疗效(Efficacy of Nitric Oxide in Stroke,ENOS)试验对4 011 例急性脑卒中患者进行GTN 评估,发病后48 h 内出现缺血性或出血性卒中、收缩压为140~220 mmHg 的患者被随机分为接受GTN 组(n=2 000)或不接受GTN 组(n=2 011),对ICH患者(n=629)进行ENOS试验的亚组分析。与无GTN 组相比,GTN 组的血压显著降低(P<0.05),但2 组第90 天的功能预后差异无统计学意义[38]。因此,有学者建议应尽量避免使用该药物[17]。
4 总结
综上所述,ICH 后高血压与临床预后恶化相关。虽然鉴于现有文献[39],ICH急性期血压目标值仍不明确,但是临床医生应该熟悉ICH急性期的现行血压管理策略。本文创新之处在于介绍了目前国内外常用的ICH急性期静脉降压药物的特点、使用方法和注意事项,希望能为临床实践提供参考,从而促进关于ICH 急性期血压管理的临床研究在国内的进一步开展,从而改善ICH患者的预后。
