血清PTX3、Cav-1、hs-CRP与急性脑梗死患者病情及预后的关系研究
刘浩,吴瑞杰,丁玉雪,朱军
脑梗死具有高发病率、高致残率、高死亡率的特征。急性脑梗死的发生与动脉粥样硬化密切相关,动脉粥样硬化是一种慢性炎症性疾病,炎症能引起巨噬细胞、血管内皮细胞、平滑肌细胞结构异常和功能紊乱,这也是动脉粥样硬化的病理生理学基础[1]。血管通透性会随血管内皮细胞损伤的发生而增加,继而造成血小板功能异常,血小板大量聚集、黏附造成动脉内膜增厚,进而增加血栓形成风险[2]。可见炎症反应与动脉粥样硬化、脑梗死均有密切关系。超敏C 反应 蛋白(hypersensitive C-reactive protein,hs-CRP)由肝细胞分泌产生,其对炎症反应有较高的敏感性[3]。正五聚蛋白3(pentraxin 3,PTX3)是新近发现的一种急性期反应蛋白,由血管内皮细胞、单核细胞、巨噬细胞等在炎症因子刺激下分泌产生,可参与动脉硬化,能在一定程度上反映脉管系统的炎症反应程度。陷窝蛋白1(caveolin-1,Cav-1)是构成细胞膜上向内凹陷微区域的主要成分,参与细胞膜合成、细胞胞吞、胆固醇转运等重要过程,并且在中枢神经系统内自由基形成、氧化应激反应、神经炎症反应等过程中均有参与,是神经血管单元的保护因子[4]。目前,临床关于血清PTX3、Cav-1、hs-CRP与急性脑梗死关系的研究较少,本研究通过分析血清PTX3、Cav-1、hs-CRP与急性脑梗死患者病情严重程度及预后的关系,为急性脑梗死病情评估及预后预判提供一种新的思路。
1 资料与方法
1.1 一般资料
选取2019年1月至2019年12月本院收治的急性脑梗死患者98例,纳入标准:符合《中国急性缺血性脑卒中诊治指南2014》[5]中急性脑梗死诊断标准;首次发病,发病后24 h 内入院;脑梗死发生后72 h内完成头颅MRI/CT;自愿参与研究,并签署知情同意书。排除标准:有脑血管意外病史;有心力衰竭、冠心病、瓣膜性心脏病、心肌病史;合并自身免疫性疾病、免疫功能障碍;严重肝肾功能不全;严重感染;伴慢性炎症性疾病;有血液系统疾病或恶性肿瘤;正在应用免疫抑制剂、抗炎药物或激素类药物。男50 例,女48 例;年龄(62.35±10.40)岁;高血压71 例,糖尿病26 例,高脂血症46 例;吸烟50 例,饮酒42例。本研究通过本院医学伦理委员会批准。
1.2 方法
1.2.1 信息收集 收集患者的病历资料,包括性别、年龄、疾病史、饮酒史、吸烟史、用药史、影像资料、血压、血脂及凝血相关指标,以及入院时的美国国立卫生研究院脑卒中量表(NIH Stroke Scale,NIHSS)评分等。
1.2.2 指标检测 所有患者在入院次日采集2份空腹静脉血标本。一份用于测定血小板计数(platelet,PLT)、尿酸(urine acid,UA)、肌酐(creatinine,Cr)、同型半胱氨酸(homocysteine,Hcy)及血脂相关指标,包括总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂 蛋白胆固 醇(low density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)。另一份以乙二胺四乙酸(EDTA)抗凝保存,离心后保留血清,使用酶联免疫吸附法测定血清PTX3、Cav-1、hs-CRP水平。
1.2.3 神经功能损伤程度及预后评估 所有患者在入院后第1天,运用NIHSS量表评估神经功能损伤程度。NIHSS总分0~42分,评分越高表明神经功能缺损程度越严重。在发病3月后,通过电话随访或门诊复查方式,运用改良Rankin 量表(modified Rankin scale,mRS)对患者的预后情况进行评估。mRS 结果分为0~6 分,评分越高表明预后越差,mRS 评分>2 分为预后不良,≤2分为预后良好。
1.3 统计学处理
使用SPSS23.0软件处理数据,计数资料以率(%)表示,χ2检验,符合正态分布的计量资料以(均数±标准差)表示,t检验,变量关系做Spearman相关性分析,绘制受试者工作特征(receiver operating characteristic,ROC)曲线分析血清PTX3、Cav-1、hs-CRP 水平对脑梗死患者预后不良的预测效能,P<0.05 为差异有统计学意义。
2 结果
2.1 血清PTX3、Cav-1、hs-CRP与脑梗死患者病情的关系
98 例脑梗死患者的PTX3 为(15.20±3.86)ng/mL,Cav-1 为(21.60±8.21)ng/mL,hs-CRP 为(12.16±3.52)mg/L;NIHSS 评分为4~21分,平均(12.25±9.05)分。线性相关分析结果显示,血清PTX3、Cav-1、hs-CRP 均 与NIHSS 评分呈正相关(r=0.863、0.747、0.689,P<0.05),见图1。

图1 血清PTX3(A)、Cav-1(B)、hs-CRP(C)与NIHSS评分的关系
2.2 不同预后脑梗死患者的血清PTX3、Cav-1、hs-CRP 水平比较
98例患者治疗3月随访死亡5例(5.10%)为死亡组、生存93例(94.90%)为生存组。93例生存者的mRS评分显示预后良好74 例(79.57%)为预后良好亚组,预后不良19 例(20.43%)为预后不良亚组。死亡组的血清PTX3、Cav-1、hs-CRP 水平高于生存组(P<0.05),生存组中预后不良亚组的血清PTX3、Cav-1、hs-CRP水平高于预后良好亚组(P<0.05),见表1。
表1 不同预后脑梗死患者的血清PTX3、Cav-1、hs-CRP水平比较(±s)

表1 不同预后脑梗死患者的血清PTX3、Cav-1、hs-CRP水平比较(±s)
注:t1、P1为死亡组与生存组比较的统计值;t2、P2为预后良好亚组与预后不良亚组比较的统计值
组别死亡组生存组预后良好亚组预后不良亚组t1值P值t2值P值例数5 93 74 19 PTX3/(ng/mL)29.25±2.79 12.20±3.06 10.35±2.47 16.62±2.34 15.241<0.05 14.028<0.05 Cav-1/(ng/mL)48.82±18.75 20.13±7.96 16.33±6.21 28.69±8.01 13.004<0.05 10.874<0.05 hs-CRP/(mg/L)23.96±4.58 11.78±3.82 10.68±2.65 15.87±4.12 12.952<0.05 11.138<0.05
2.3 血清PTX3、Cav-1、hs-CRP对脑梗死预后不良的预测效能
ROC曲线分析显示,PTX3预测脑梗死预后不良的曲线下面积(area under curve,AUC)值为0.813,最佳截断值为17.24 ng/mL,预测敏感性、特异性分别为75.01%、77.62%;Cav-1的AUC值为0.898,预测脑梗死预后不良的最佳截断值为18.58 ng/mL,预测敏感性、特异性分别为87.53%、77.64%;hs-CRP 的AUC 值为0.747,预测脑梗死预后不良的最佳截断值为12.95 mg/L,预测敏感性、特异性分别为70.85%、77.66%,见图2。
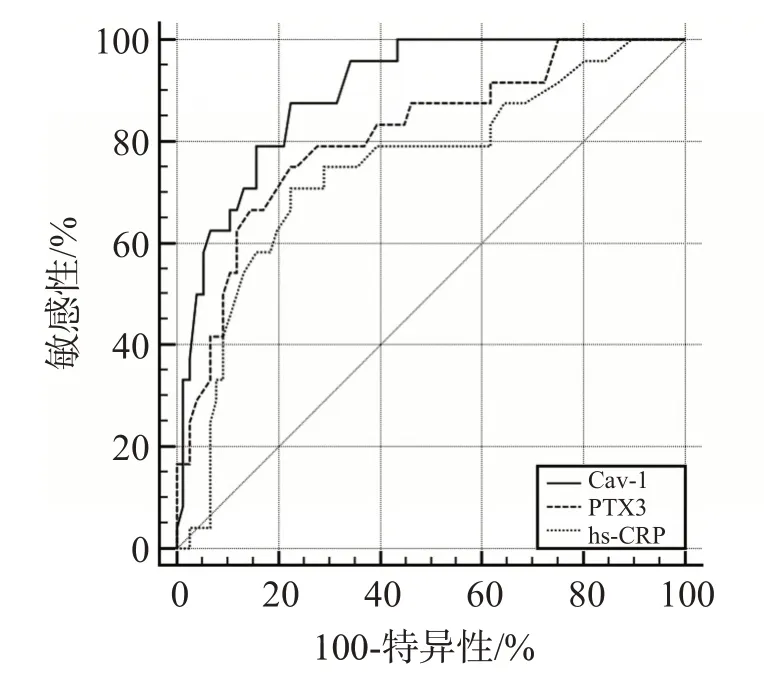
图2 血清PTX3、Cav-1、hs-CRP预测脑梗死预后不良的ROC曲线
3 讨论
现有的研究普遍认为缺血性脑损伤的多种发病机制中,免疫炎症、缺血再灌注损伤发挥主要作用,其次为缺血导致的脑损伤[6]。hs-CRP 是临床常用的炎症标志物,研究认为其与脑卒中的发病风险及预后情况密切相关[7]。PTX3 和hs-CRP 均为正五聚蛋白超家族成员,近年来PTX3 在缺血性脑损伤中的应用也受到高度重视。PTX3主要由内皮细胞、成纤维细胞、血管平滑肌细胞、单核巨噬细胞等产生,这些细胞均会直接参与动脉粥样硬化过程,其在IL-1、TNF-α等促炎因子的刺激下会分泌大量的PTX3[8]。而PTX3 又能反过来刺激和增强血管内皮细胞、巨噬细胞功能,增加血栓形成风险及已形成斑块的不稳定性。由此可见,PTX3 可作为反映血管损伤后炎症反应和新生内膜增厚程度的有效指标。国外有报道指出,急性脑梗死患者的血清PTX3水平明显高于健康人,并且血清PTX3升高程度与脑梗死严重程度显著相关[9]。急性心肌梗死患者的hs-CRP水平能正向预测神经功能缺损程度[10]。本研究显示,急性脑梗死患者的血清PTX3、hs-CRP水平与NIHSS评分呈正相关,其作用机制可能为:患者发生急性脑梗死时有明显的炎症反应,炎性信号作用于小胶质细胞,激活其M1表型,促炎性细胞因子会激活并诱导转录M1 型小胶质细胞,其核转录因子被激活后会产生大量的促炎性细胞因子[11]。肝细胞在促炎性细胞因子的作用下分泌大量的hs-CRP,同时促炎性因子还能作用于血管平滑肌细胞和内皮细胞,使其产生大量的PTX3,进而加重炎症反应,进一步加剧脑损伤。
Cav-1是细胞膜窖的主要分泌蛋白,血管平滑肌细胞、内皮细胞、脂肪细胞中均含有大量的细胞膜窖,Cav-1具有调节神经炎症、氧化应激、血脑屏障渗出等重要作用,同时还会参与髓鞘修复、血管及神经元突触再生[12]。近年来,Cav-1在缺血性脑血管疾病中的探究越来越多,不少研究都显示急性脑梗死病情的演进与Cav-1 关联密切。动物模型实验显示,在急性脑梗死早期,Cav-1蛋白表达会随梗死面积和水肿带的扩大而升高,并在发病后12 h达到峰值,72 h后开始降低[13]。促进Cav-1表达可加重急性脑梗死小鼠神经功能缺损症状,同时扩大梗死面积。本研究发现,急性脑梗死患者的血清Cav-1 水平明显高于正常健康人,而急性脑梗死患者的血清Cav-1 水平与NIHSS 评分呈正相关。这与相关报道[14]结论一致。
急性脑梗死患者的预后预测一直倍受临床关注,找寻可准确预测急性脑梗死患者预后的相关指标,对于指导临床工作具有重大意义。本研究发现,脑梗死后死亡患者的血清PTX3、Cav-1、hs-CRP水平明显比存活者更高,并且存活者中预后不良患者的血清PTX3、Cav-1、hs-CRP要高于预后良好者,由此提示血清PTX3、Cav-1、hs-CRP 水平可能与急性脑梗死患者预后相关。ROC曲线分析发现,血清PTX3、Cav-1、hs-CRP对脑梗死后预后不良均有一定的预测价值,其中Cav-1>18.58 ng/mL 对脑梗死预后不良的预测敏感性最高,PTX3>17.24 ng/mL、hs-CRP>12.95 mg/L 对脑梗死预后不良也有较好的预测效能。这与瞿伦学等[15]和许位等[16]的报道结论相符,证实血清PTX3、Cav-1、hs-CRP 在急性脑梗死患者预后评估的价值。这可能是因为脑梗死发生后,血清PTX3 水平要比hs-CRP 更早达峰值,是心血管系统局部炎症状态的高敏感炎性标志物,其血清浓度反映局部动脉壁损伤后的炎症反应,所以其对脑梗死后预后不良的预测敏感性要比hs-CRP 更高。血清Cav-1 可发挥血脑屏障保护作用,在血清Cav-1表达升高时会增加血脑屏障通透性,破坏血脑屏障完整性,从而增加出血转化风险,而出血转化是导致脑梗死预后不良的重要因素。另一方面,Cav-1 水平的升高还会通过上调VEGF/bFGF/CD34 通路来促进血管内皮细胞的增殖、迁移,从而促进微血管形成,增加血管栓塞风险,因此血清Cav-1水平的升高往往预示着预后不良。
综上所述,急性脑梗死患者的血清PTX3、Cav-1、hs-CRP表达明显升高,并且PTX3、Cav-1、hs-CRP 水平与病情严重程度、预后情况密切相关,血清PTX3、Cav-1、hs-CRP水平升高预示着预后不良。监测急性脑梗死早期血清PTX3、Cav-1、hs-CRP 水平,可为临床预测急性脑梗死患者预后提供一定参考。
