海南地区care HPV联合VIA/VILI作为分流筛查宫颈癌的价值
吴欣妮,张丽君,郑海茹,陈 虹,余月彩,吴熊军
(海南医学院第二附属医院体检科,海南 海口 570311)
宫颈癌是威胁女性健康的生殖道恶性肿瘤之一。目前,部分国家已通过接种人乳头瘤病毒(human papillomavirus,HPV)疫苗实现了对子宫颈癌的一级预防,并通过对子宫颈癌及其癌前病变进行早期筛查实现了二级预防[1]。传统巴氏涂片、液基细胞学、醋酸/碘染色肉眼观察检查(visual inspection with acetic acid /Lugol′s iodine,VIA/VILI)、阴道镜检查以及HPV检测等是来筛查子宫颈癌的常用技术,大规模细胞学筛查能够显著降低宫颈癌的发病率以及死亡率[2]。国内外研究结果显示HPV检测是筛查宫颈癌和癌前病变的有效手段,简易人乳头瘤病毒DNA检测(simple human papillomavirus DNA testing,care HPV)具有可靠、易于重复等优势,细胞学阅片工作量大大减少,提高了筛查效率[3]。90%以上感染HPV的女性在两年内会自动清除HPV,若仅采用care HPV检测作为筛查宫颈癌方法,会造成阴道镜转诊率增高以及过度治疗,从而导致HPV阳性妇女的恐慌和卫生资源的浪费[4]。我国“两癌”筛查项目采用VIA/VlLI或传统的巴氏涂片法进行宫颈癌的初筛,但是后者假阴性率高,敏感性也不理想,并且需要训练有素的实验人员、设备完善的实验场所,在实际筛查中的效果差强人意[5]。在经济发展欠发达地区,VIA/VILI价格低廉、易于掌握,也具有理想的检测准确率,被临床所接受。本研究从卫生经济学的角度对海南地区care HPV联合VIA/VILI筛查宫颈癌的方法进行评价,以确定适合海南地区的宫颈癌筛查方法。
1 资料与方法
1.1 一般资料
选取2020年1月至12月在海南医学院第二附属医院接受宫颈癌筛查女性3 150名为研究对象,纳入标准:①在海南地区常住女性,即居住时间大于6个月;②年龄35~65岁;③近3年未行宫颈癌筛查;④受检者知情同意。排除标准:①有宫颈癌前病变、宫颈癌病史;②子宫切除;③盆腔有放射治疗史。根据筛查方案分为A组(n=1 820)和B组(n=1 330)。
1.2 筛查方案
1.2.1 Care HPV检测采样方法
妇科医生将宫颈刷插入宫颈管内,在宫颈口及移行带处顺时针快速旋转6~8圈后将宫颈刷刷头放入保存液中。检查前打开机器预热,在海绵架上上下震摇样品5min,care HPV试剂盒购于深圳凯杰生物医药公司。检测方法:①变性:按照排板表向各孔加入25μL试剂1,然后加入50μL对照和样品在加热器/振荡器上变性30min;②杂交捕获:向各孔加入40μL的试剂2,在加热器/振荡器上反应15min;再加入20μL的试剂3,于振荡器上作用半小时;③配对:将板取出放在磁力架上,3min后倒掉液体,向各孔加入40μL试剂4。反应30min原理:酶标抗DNA:RNA杂交物抗体,与被磁珠捕获的DNA:RNA杂交物偶合;④清洗:将板取出放在磁力架上,倒掉液体,用洗液洗5遍,需20min左右;⑤信号放大:向各孔加入40μL的试剂6,反应15min;⑥检测:检测器判读光强度,并由控制器给出结果,约需3min。
1.2.2进一步检查
A组:阳性者做阴道镜检查。用白光或滤光在放大子宫颈图像的情况下,用饱蘸5%醋酸溶液的棉球贴覆宫颈表面30秒。如果宫颈上皮有病变,30秒后会出现一系列特征性变化。阴道镜检查凭此进行评估和诊断。
阴道镜检查:首先采用5% Lugol碘液涂抹子宫颈,碘染色过程约需15~20秒,观察60~90秒。阴道镜检查不满意,即看不清鳞柱交界,或病变伸入颈管内口,或活检钳不能触及病变,或疑有腺体病变时,可行宫颈管搔刮术(endocervical curettage,ECC)。阴道镜满意且异常者直接在病变处取活检。活检标本存放在福尔马林液中保存并及时送往病理室。
B组:HPV阳性者分流行VIA/VILI检查,异常者再行阴道镜检查。
VIA/VlLI:用阴道窥器使宫颈及阴道暴露,观察阴道壁黏膜色泽、厚薄,有无损伤、充血和赘生物等。用消毒棉球清洁阴道、宫颈,使宫颈上皮洁净。然后再用棉球饱蘸5%醋酸溶液,将其贴敷在宫颈表面半分钟左右。如果宫颈上皮有病变,30s后会出现一系列特征性变化,如醋酸白上皮等。再用5% Lugol碘液涂抹子宫颈,碘染色过程约需15~20s,观察60~90s。正常子宫颈上皮呈黑色或褐色,未染色或轻度染色区为可疑病变区,应取活检证实。
1.3 统计学方法
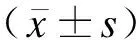
2 结果
2.1 不同筛查方案女性基本资料比较
两组筛查女性年龄、体质量指数(body mass index,BMI)、婚姻状况、文化程度、初次性生活年龄、初产年龄、绝经状态比较,差异均无统计学意义(P>0.05),见表1。

表1 不同筛查方案人群人口学特征比较[n(%)]Table 1 Comparison of demographic characteristics of population with different screening regimens[n(%)]
2.2 不同筛查方案组转阴道镜检查率比较
A组女性阴道镜转诊率显著高于B组女性,差异有统计学意义(P<0.01),见表2。
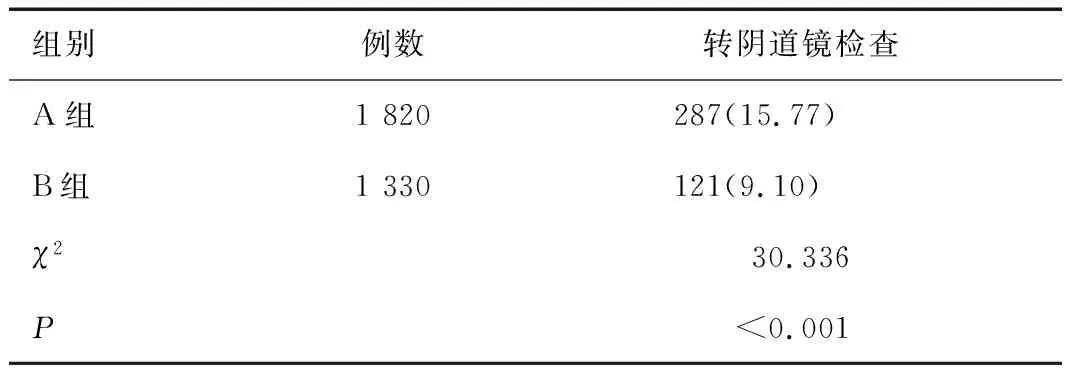
表2 不同筛查方案组转阴道镜检查率比较[n(%)]Table 2 Comparison of conversion rates of colposcopy in the groups with different screening regimens[n(%)]
2.3 不同筛查方案组宫颈病变检出率比较
两组女性CIN 1、CIN 2/3、宫颈癌检出率比较差异无统计学意义(均P>0.05),见表3。
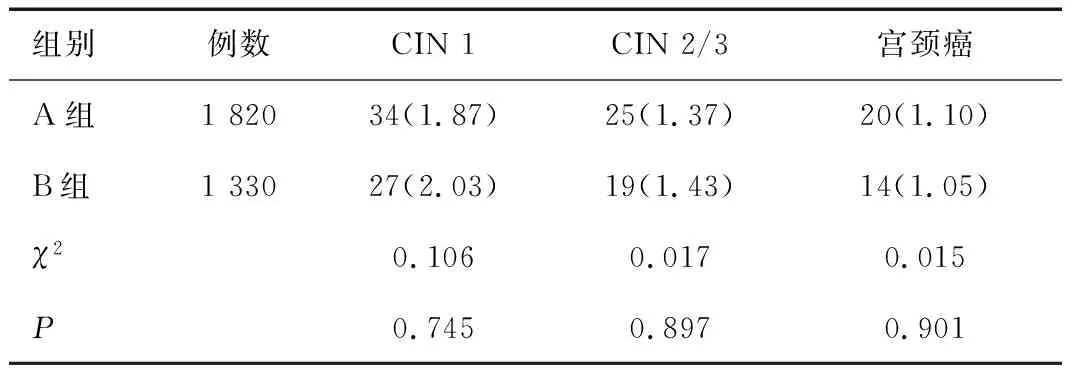
表3 不同筛查方案组宫颈病变检出率比较[n(%)]Table 3 Comparison of detection rates of cervical lesions in the groups with different screening regimens[n(%)]
2.4 不同筛查方案组CIN 2/3病变以上患者的单因素分析
两组女性中CIN 2/3病变以上患者年龄、BMI、婚姻状况、文化程度、初次性生活年龄、初产年龄、绝经状态比较差异无统计学意义(均P>0.05),见表4。
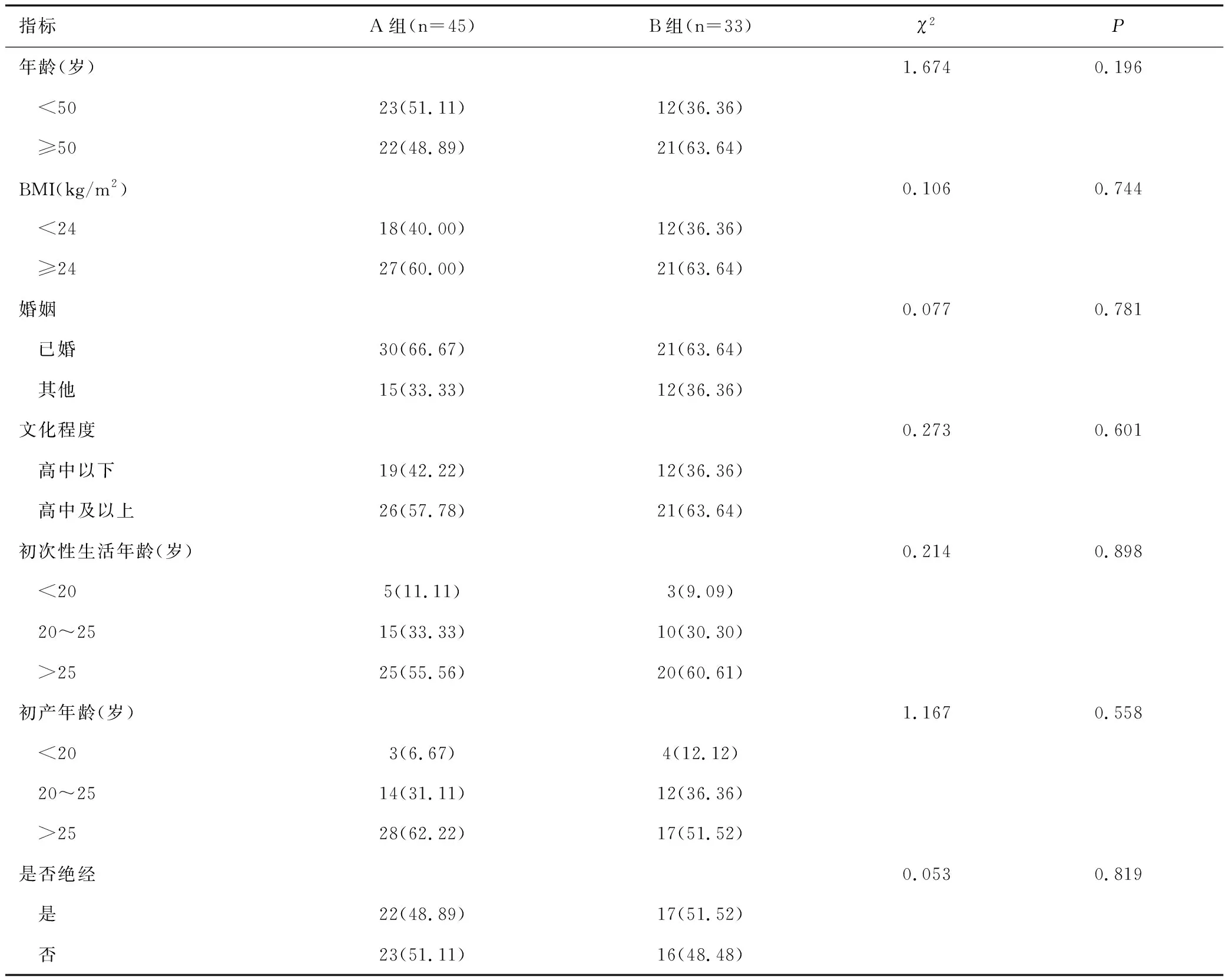
表4 不同筛查方案组CIN 2/3病变以上患者临床一般资料比较[n(%)]Table 4 Comparison of clinical general data of patients with CIN 2/3 or above lesions in the groups with different screening regiments[n(%)]
2.5 不同筛查方案组人均费用比较
B组女性人均筛查费用显著低于A组,差异有统计学意义(P<0.01),见表5。

表5 不同筛查方案组人均费用比较Table 5 Comparison of per capita cost in the groups with
3 讨论
3.1 宫颈癌筛查方法现状
宫颈癌是影响全球女性健康的恶性肿瘤,同时也是我国女性常见的生殖系统恶性肿瘤之一,防控形势严峻。近年来我国在宫颈癌防控领域投入巨大,但距消除宫颈癌的实施及目标仍存在差距[6]。因地制宜选择最佳的筛查策略是实施组织性筛查项目取得效果的关键,其中筛查方法是筛查策略的重要组成部分[7]。巴氏涂片的发明使宫颈癌筛查开始逐渐普及,HPV病毒感染致病学说的提出使宫颈癌的筛查从传统细胞学发展至病毒学检测,近年来随着分子生物学技术的发展,HPV E6/E7 mRNA、p16/Ki-67免疫细胞化学双染等也逐渐应用于宫颈癌筛查[8]。目前,两癌筛查是我国重要公共卫生项目,宫颈癌筛查已在全国普遍开展。我国不同地区宫颈癌筛查方法有所差异,多数地区常用TCT和HPV联合筛查。然而,该筛查方案不适用于经济较为落后的地区。因此,肉眼观察法虽然假阳性率较TCT和HPV高,但其价格低廉,适用于医疗资源落后地区。我国指南推荐在25~29岁年龄组女性中使用细胞学检测,在30~64岁年龄组女性中采用HPV检测、HPV和细胞学联合筛查或VIA/VILI[9]。
3.2 Care HPV联合VIA/VILI作为分流筛查宫颈癌的价值
目前提高筛查的覆盖面是降低妇女宫颈癌死亡率及发生率最重要且最直接的途径,但是筛查覆盖面的增加就意味着同时造成了筛查费用的增加。所以我们还需要对经济学做出评价,为卫生决策部门提供相关基础依据和参考。Care HPV是特别为医疗资源薄弱地区的妇女宫颈癌筛查所设计的,该方法操作简便,可定量检测14种高危HPV型别,筛查者当天即可得到HPV检测结果,并采取相应的随访和治疗手段,适用于资源贫乏地区的宫颈癌筛查[10]。针对中国的具体情况,特别是一些宫颈癌高发的省份,考虑技术的要求、实验室基础设施,care HPV策略是十分可行性的。采用VIA/VILI方法进行初筛可以使宫颈癌的发病率降低25%~30%,是发展中国家宫颈癌初筛的有效手段。但对于绝经期女性,由于其子宫颈鳞、柱转化区内移,该方法容易漏诊。一项评估VIA/VILI方法检测CIN 2+的诊断准确性和临床应用价值的meta分析结果显示其对CIN 2+及以上病变有一定的应用价值,适用于发展中国家和经济不发达地区的筛查[11]。本研究采用care HPV联合VIA/VILI作为分流共同筛查宫颈癌,结果显示A组女性阴道镜转诊率显著高于B组女性,差异有统计学意义(P<0.01),两组女性CIN 1、CIN 2/3、宫颈癌检出率比较差异无统计学意义(P>0.05),B组女性人均筛查费用显著低于A组(P<0.01),提示care HPV联合VIA/VILI筛查宫颈癌有较好的应用价值,降低了阴道镜检查率,对病变检出情况无显著影响,具有较好的卫生经济学优势。方婧等[12]评价了care HPV用于宫颈癌及癌前病变筛查的临床价值,结果发现care HPV与HPV-PCR试剂具有高度一致性,其在检出HPV感染上具有很好的灵敏度和特异性,检测耗时短,有望成为医疗资源相对贫乏地区子宫颈癌及癌前病变筛查的主要方法。另一项2012年对山西襄垣地区妇女进行宫颈癌筛查时发现,care HPV是一种简单、快捷,受检者易于接受的HPV-DNA检测方法,Care HPV优点包括:能够在较短时间内完成一次检测,对实验设备及操作人员的要求较低,还能够避免样品之间的交叉污染[13]。以上研究报道均与本研究结果相似。目前已有多个国家采用这项方法进行宫颈癌筛查进行人群验证,发现对CIN 2+病变及CIN 3+病变的灵敏度较高[14]。
由于可用于卫生服务的经济资源与当地经济发展状况相关,某种医疗措施能否在当地广泛顺利开展需要行可行性分析,评价其是否充分利用了当地有限的卫生资源,实现利益最大化。从整体及长远看来,B组方案是本次筛查中最合理的筛查方案。然而,本研究样本量较少,初筛后阳性人群较少,而最终的病理阳性人数少,故还需扩大样本量进一步验证其应用前景。
综上所述,care HPV联合VIA/VILI筛查宫颈癌有较好的应用价值,降低了阴道镜检查率,对病变检出情况无明显影响。

