黔中山地茶园不同种植方式下土壤细菌群落的研究
张 姣,徐 明,杨云礼,陈 驰,陈 进,张 健*
(1.贵州大学生命科学学院真菌资源研究所,贵州 贵阳 550025;2.贵州贵茶(集团)有限公司,贵州 贵阳 550025)
茶(Camelliasinensis)是亚热带和热带地区的重要经济作物,属多年生的常绿阔叶木本植物[1]。目前世界上种植茶树的国家和地区有60多个,中国是世界上茶叶种植面积最大和干毛茶产量最高的国家,且茶园种植面积呈现出逐年增加的趋势,2020年中国茶园种植面积达到316.5万hm2[2]。我国的茶叶产区主要包括西南茶区(云南、贵州、四川等)、华南茶区(广西、广东、福建等)、江南茶区(湖南、江西、浙江、安徽等)和江北茶区(河南、陕西、甘肃等)[3]。西南地区是茶树的主要原产地,贵州作为茶树原产地的中心之一,是我国茶园种植面积最大的省份,茶树资源十分丰富,除种植的50多个栽培品种之外,还分布着各种野生的和半野生的大茶树资源[4]。贵州属于典型的喀斯特地貌,大部分茶园由山地、林地或荒地开垦而成,该地独特的自然环境形成了适宜茶树生长和保证茶叶品质的生态条件[5]。
茶树根系、土壤和微生物是构成茶园独特生态系统的重要组成成分,土壤是微生物生长的大本营,生态系统中土壤质量退化程度与土壤微生物群落密切相关;微生物作为土壤的主要活性成分之一,在调节养分循环,影响植物生产力和生态系统的稳定性方面起至关重要的作用[6-7]。土壤细菌是土壤微生物中数量最多、分布最广和群落关系与功能最复杂的生物,参与营养元素循环、凋落物降解和土壤肥力变化等过程,能够对土壤生态系统生理生化过程做出敏感响应,同时这种变化能够反作用于无机环境并传递给整个生态系统[8-9]。已有研究表明茶园细菌群落的主要影响因素包括植被类型[10]、土壤类型[11]、土地利用方式[12]、土壤化学性质[13]以及茶园农业措施如套种、间作和覆盖等[14-16]。目前有关不同种植方式下茶园土壤微生物影响的研究鲜有报到。本研究以黔中地区山地茶园为研究对象,通过高通量测序技术揭示山地茶园不同种植方式(新茶园、普通茶园和碾茶园)下的土壤细菌群落特征,分析影响山地茶园土壤细菌群落的主要环境因子,以期为茶园土壤细菌群落的研究和科学管理等方面提供理论依据。
1 材料与方法
1.1 研究区域概况
选取贵阳市花溪区久安乡山地茶园作为研究对象,该地区主要集中分布在东经106°35′~106°37′,北纬26°30′~26°32′,属于亚热带季风温润区,气候温和湿润,雨量充沛,年降雨量为1000~1100 mm,海拔在1200~1400 m范围内,年平均气温14.8℃,年平均最高气温值在7月份为22~25℃,最低气温在1月份为4~6℃,无霜期260 d,土壤类型为黄壤,自然环境条件适宜茶树的生长[17]。
1.2 样地设置及样品采集
选取新茶园(Tx)、普通茶园(Tp)和碾茶园(Tn)3种不同种植管理方式的茶园样地,以周边马尾松林(Pinusmassoniana,Mp)作为对照(表1),每种种植方式下茶园设置2个重复,共8个样地,茶园均由马尾松林地改造而来,每种茶园种植方式如(表2)所示。在每个样地内随机选取6个点,利用土钻采集0~20 cm的土壤样品,每个样地的土壤样品为一份,装入塑封袋带回实验室,去掉石头等杂质,全部过2 mm孔径的筛子后分2份,一份在室内自然风干后用作土壤理化性质的测定,另一份冷冻干燥保存于-80℃的冰箱中,用于高通量测序提取土壤中的DNA。

表1 不同种植方式下茶园与马尾松林样地基本信息

表2 不同茶园的种植及管理方式
1.3 土壤理化性质测定
土壤pH测定采用浸提电位法(1:2.5土水比);土壤有机质(SOM)的测定采用重铬酸钾氧化-分光光度法;土壤全氮(TN)测定采用半微量凯氏定氮法;土壤全磷(TP)采用钼锑抗比色法;土壤有效磷(AP)采用双酸浸提-钼锑抗比色法[18]。
1.4 细菌DNA提取、扩增及测序
采用CTAB法对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng·μL-1。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物New England Biolabs公司的Phusion®High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶对细菌16S rRNA 基因的V4区域进行扩增,确保扩增效率和准确性。扩增引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。采用50 μL PCR扩增体系,反应程序为:98℃预变性1 min;30个循环包括(98℃,10 s;50℃,30 s;72℃,30 s);72℃,5 min。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测。将PCR产物送至上海美吉生物医药科技有限公司,利用Illumina MiSeq测序平台进行测序。
1.5 数据处理
MiSeq测序得到的是双端序列数据,根据PE reads之间的overlap关系,将成对的reads拼接(merge)成一条序列,同时对reads的质量和merge的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向,得到优化序列。利用Uparse(http://drive5.com/uparse/)按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。使用RDP Classifier(http://sourceforge.net/projects/rdp-classifier/)对OTU进行物种注释。应用mothur(http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity)对α多样性指数进行计算,并对α多样性进行分析;根据物种分类信息绘制物种相对丰度堆积柱状图;通过Venn图分析不同种植方式下茶园的共有属和特有属;运用冗余分析(RDA)对细菌群落和环境因子进行分析,运用Tax4Fun对菌群的功能和代谢途径进行预测分析。
2 结果与分析
2.1 不同种植方式下茶园土壤的化学性质
不同种植方式下茶园土壤理化性质的测定结果表明(表3):不同种植方式下茶园与马尾松林的pH 值、有机质、全磷、有效磷和全氮含量均存在差异。土壤pH值的范围在4.66~5.15之间,属酸性土壤;土壤有机质和全氮含量为普通茶园>碾茶园>新茶园>马尾松林,全磷和有效磷的含量均表现为普通茶园>新茶园>碾茶园>马尾松林,且马尾松林土壤的化学性质与茶园存在显著性差异(P< 0.05)。

表3 不同种植方式下茶园和马尾松林土壤基本化学性质
2.2 高通量测序结果
通过高通量测序分析,3种种植方式的茶园和马尾松林土壤中共测得651049条有效序列,共263656726个碱基,各样本序列数为72629~87831,序列长度为370~460 bp。8组样本中共检测到41门、111纲、266目、439科、852属、1767种和4793 OTUs。稀释曲线(图1)发现随着测序数据量的增加,OUT数目在急剧上升后逐渐趋于平缓,所有样品的覆盖度(coverage)均达到98%以上,表明该次测序结果能覆盖样本细菌群落中的大多数物种,即本次测序能够真实反应不同种植方式下茶园土壤细菌群落的种类与数量[19]。
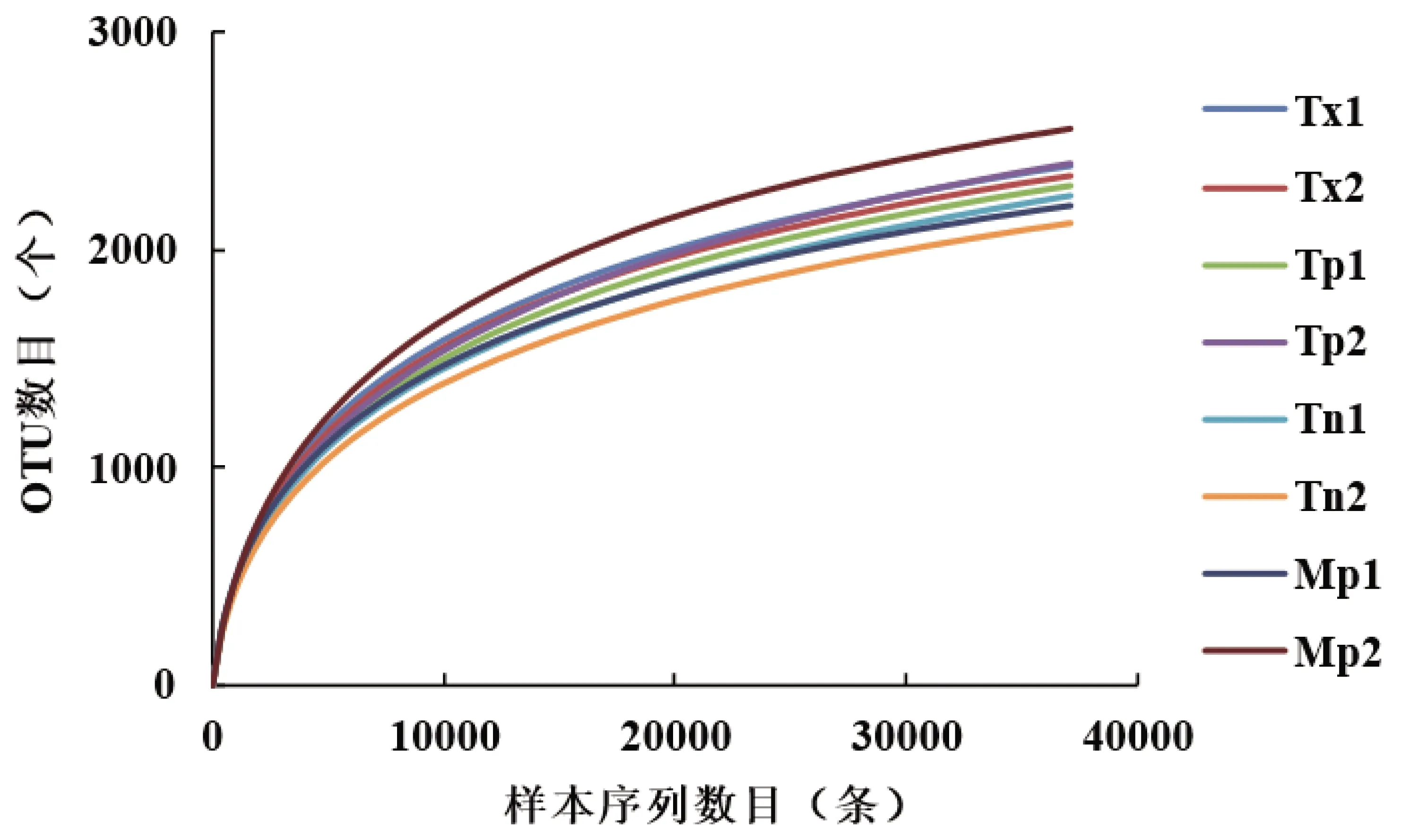
图1 不同种植方式下茶园和马尾松林土壤细菌稀释曲线
2.3 不同种植方式茶园土壤细菌OTUs分布
韦恩图可用来分析多个样品中所共有的和特有的OTUS数目,通过图2-a可直观体现不同样地类型间土壤细菌群落OTU组成的差异性。结果表明:在OUT水平上,新茶园(Tx)共检测到细菌3000个OTUs,普通茶园(Tp)中细菌3088个OTUs,碾茶园(Tn)中细菌2853个OTUs,3种茶园共有细菌1891个OTUs,新茶园、普通茶园和碾茶园土壤细菌群落的特有OTUs分别是390、476和384。3种茶园与马尾松林做Venn图分析(图2-b),马尾松林与茶园共有的OTUs数为1563,马尾松林特有的OTUs数为643(21%)。结果表明不同种植方式下土壤细菌群落组成存在差异。

图2 不同种植方式下茶园和马尾松林土壤细菌OTUs分布Venn图
2.4 不同种植方式茶园土壤细菌的多样性分析
多样性指数是微生物多样性研究中的重要参数指标,多样性指数越高表明细菌群落的丰富度和多样性越高,用Chao1指数和ACE指数表示细菌群落丰富度(Richness),用Shannon指数、Simpson指数表示细菌群落多样性(Diversity)。统计 8 个土壤样品细菌群落丰度及多样性的各项指标(表4),结果分析表明,新茶园与普通茶园的Shannon指数存在显著性差异(P<0.05),其余Alpha 多样性指数不存在显著性差异,且茶园与马尾松林之间也无显著性差异(P>0.05)。Shannon指数、Chao1指数、ACE指数均在新茶园中最高,不同种植方式下茶园Simpson指数大小分别是:碾茶园(Tn)>普通茶园(Tp)>新茶园(Tx)。说明新茶园土壤细菌群落多样性相对更为丰富[20],且随着种植年限的增加和人工管理的干预,会降低土壤细菌群落的丰度和多样性。
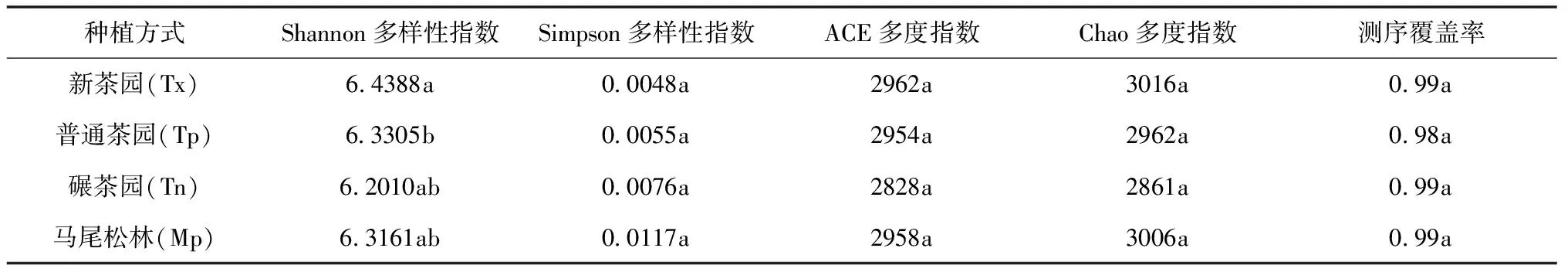
表4 不同种植方式下茶园与马尾松林土壤细菌Alpha多样性指数
2.5 不同种植方式茶园土壤细菌群落组成结构
将不同种植方式下茶园与马尾松林的细菌类群相对丰度做百分比堆积柱状图(图3),在门水平上,茶园和马尾松林的细菌群落结构大致相同,优势种群相似,但丰度略有不同,变形菌门Proteobacteria、放线菌门Actinobacteria、酸杆菌门Acidobactera、拟杆菌门Bacteroidetes、绿弯菌门Chloroflexi、黏菌门Myxococcota等是主要的细菌类群,其中优势菌群为变形菌门(47%~52.2%);其次是放线菌门(15.5%~19.2%)和酸杆菌门(9.92%~18.9%)。总体而言,由马尾松林转变为茶园后,茶园中放线菌门和酸杆菌门的相对丰度降低,在新茶园和马尾松林中WPS-2的相对丰度明显低于普通茶园和碾茶园,在普通茶园中绿弯菌门的相对丰度最低,新茶园和普通茶园中拟杆菌门的相对丰度明显高于碾茶园。经组间差异显著性检验表明(图4),不同种植方式下茶园和马尾松林土壤细菌群落无显著性差异(P> 0.05)。

图3 不同种植方式茶园和马尾松林土壤细菌群落门和属水平上的组成和相对丰度
马尾松林变耕为茶园后土壤微生物群落结构在属水平也存在差异。不同种植方式下茶园与马尾松林的优势属是大豆根瘤菌属Bradyrhizobium和鞘脂杆菌属Sphingomonas,其中大豆根瘤菌属在不同种植方式茶园和马尾松林的相对丰度分别是2.72%、3.57%、4.73%和10.65%,鞘脂杆菌属在不同种植方式茶园相对丰度明显高于马尾松林,经组间差异显著性检验表明细菌群落无显著性差异(P> 0.05)。表明土地由马尾松林转变为茶园后,会改变土壤微环境,但对土壤中优势菌群的影响不明显[21]。
2.6 土壤理化性质与细菌群落之间的关系
通过计算环境因子与菌群之间的Spearman等级相关系数发现,有14个属丰度与环境因子呈现显著正相关(P<0.05),有15个属丰度与环境因子呈现显著负相关(P<0.05)。表明不同细菌属在不同种植方式下具有一定差异。为更清晰的了解土壤理化性质造成的样品聚类和分离情况,选取属水平上细菌群落的相对丰度数据作为物种数据,土壤环境因子如pH值、有机质、全氮、全磷和有效磷作为土壤环境变量因子进行冗余分析(redundancyanalysis,RDA)(图5),3种种植方式不同的茶园与环境因子分析(图5-a)可知,第1序轴和第2排序轴的解释量分别为44.34%和27.49%,两轴累计解释量为71.83%,样本点分布相互离散,说明不同种植方式下土壤细菌群落结构存在差异且受土壤理化性质影响较大,全氮和有效磷是影响茶园细菌群落的主要因子。茶园和马尾松林与环境因子分析(图5-b)可知,第1序轴和第2排序轴的解释量分别为44.06%和18.74%,两轴累计解释量为62.8%,表明前 2 个轴的贡献值能很好地解释各因子对细菌群落的影响。普通茶园和碾茶园的样点分布存在交集,环境因子对细菌群落影响程度:有效磷(AP)>pH>有机质(SOM)>全磷(TP)>全氮(TN),其中有效磷对细菌群落分布有显著性影响(R2=0.7064,P=0.032),经Mantel Test检验达显著水平(R2=0.5657,P=0.012),综上所述:土壤有效磷是影响茶园土壤细菌群落的重要因子。

图5 土壤细菌群落与土壤环境因子的冗余分析
2.7 细菌群落功能预测分析
为了获得不同样本中细菌的功能,本研究使用Tax4Fun基于KEGG数据库进行细菌功能预测与注释发现,所有样本细菌KEGG pathway丰度基本相似,不同种植方式下茶园和马尾松林土壤细菌共得到6个生物代谢通路,其中新陈代谢Metabolism(60.88%~61.98%)和环境信息处理Environmental Information Processing(19.42%~20.92%)是土壤细菌功能的重要组成,与遗传信息处理Genetic Information Processing相关的占10.29%~10.87%,与参与细胞转化Cellular Processes相关的占4.91%~5.23%、还有少部分与人类疾病Human Diseases(1.74%~1.97%)和有机系统Organismal Systems(0.83%~0.89%)相关[22]。通过新陈代谢相关的通路来探讨不同种植方式下茶园和马尾松林土壤细菌群落的共存关系。新陈代谢处理由11个二级通路组成(图6),不同种植方式下茶园与马尾松林的二级通路相似,碳水化合物代谢和氨基酸代谢明显高于其他代谢途径,茶园的碳水化合物代谢和氨基酸代谢均高于马尾松林,但无显著性差异(P>0.05)。
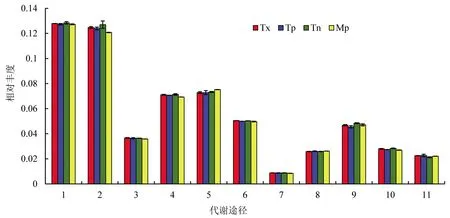
图6 不同种植方式茶园与马尾松林土壤细菌群落主要代谢通路特征
3 结论与讨论
土壤微生物种群的丰度和多样性在土壤质量、功能和土壤生态系统的可持续性方面起着重要的作用[23-24]。目前关于影响土壤微生物群落结构的因素在不同的研究中存在一定的差异,但大多都集中在土地利用方式转变和施肥等方面[25]。土壤中不同微生物类群在应对环境变化时会做出不同的应对策略。
已有研究表明,林地转为茶园后,土壤的细菌群落多样性和结构都发生显著变化,且改耕20年的茶园土壤经过长期施肥处理,土壤细菌群落的 ACE、Simpson、Shannon 多样性指数有所降低[26]。本研究基于高通量测序对不同种植方式下茶园和马尾松林土壤细菌群落进行研究,Alpha多样性指数结果表明除新茶园与普通茶园的Shannon指数外不同种植方式下茶园土壤细菌群落无显著性差异,新茶园的土壤细菌群落相对更丰富,马尾松林的土壤细菌群落丰富度最低,表明土壤由马尾松林转变为茶园时,提高了细菌群落的多样性,随着植茶年限的增加,细菌群落的多样性降低,原因可能是马尾松林转变为茶园初期,土壤受到人为干扰较大,这些人为干扰提高土壤细菌群落多样性,随着种植年限的增加,土壤长期种植单一作物和施肥,定向地选择出适应其环境的细菌群落,导致多样性指数的降低。
已有关于茶园土壤的研究中,大部分茶园的优势细菌门是放线菌门、变形菌门和酸杆菌门[27],变形菌门和酸杆菌门的丰富度与土壤营养程度有关,变形菌门生长迅速,且偏好营养丰富的环境,酸杆菌门属于寡营养细菌[28-30],本研究中门水平上的优势类群与已有研究结果一致。本研究中普通茶园拟杆菌门丰度高于碾茶园,这与已有研究结果拟杆菌门的相对丰度与土壤中氮含量呈正相关一致[31]。新茶园与马尾松林WPS-2的相对丰度明显低于普通茶园和碾茶园,这一结果与已报道WPS-2在于裸露、干燥、有机质贫乏和金属污染严重的土壤中的特征相符[32]。在属水平上,大豆根瘤菌属Bradyrhizobium为不同种植方式下茶园的优势属,大豆根瘤菌属是土壤中具有固氮和分泌生物活性物质的有益菌群,碾茶园对氮肥的需求量更高,因此大豆根瘤菌属在碾茶园中的相对丰度最高[33]。
土壤理化性质可以综合反映土壤的肥力水平,其改变也间接影响着微生物群落的组成与结构。已有研究表明随着植茶年限的增加,茶树土壤的pH降低,造成酸性土壤的原因可能与茶树自身的致酸性和茶园的施肥管理有关[34-35]。茶园的原生植被为马尾松林,由林地开垦为茶园后,为提高茶叶的质量与产量,对其进行人工管理与施肥等可能导致茶园中土壤养分含量高于马尾松林。有研究表明显著影响茶园微生物的化学因子包括pH、有效磷、速效钾、有机质、全磷、全氮等,其中有效磷和pH是影响茶园土壤细菌群落结构的主要土壤理化因子[36],本研究结果表明中有效磷是影响茶园土壤微生物的主要因子,pH、有机质、全氮和全磷也会对茶园细菌群落产生一定的影响。黔中地区属于典型的喀斯特地貌区域,地势复杂,具有水热条件差、物质循环速率慢等特征,由此磷元素含量成为限制土壤微生物的主要因素之一[37]。
土壤微生物多样性及其群落结构的改变会直接影响土壤的功能,土壤细菌群落的新陈代谢极为活跃,Tax4Fun代谢功能预测已初步揭示了马尾松林转变为茶园后土壤细菌群落的功能发生一定变化。已有研究表明氨基酸是合成许多代谢物的前体,这些代谢物在生物体的生长和其他生物过程中具有促进作用;碳水化合物代谢与固氮、溶磷等作用有关,这些代谢途径可促进植物的氮、磷循环[38]。因此不同种植方式下茶园土壤细菌群落功能的改变也可能间接影响土壤细菌群落的组成。

