构建酿酒酵母细胞工厂从头合成倍半萜类化合物α-新丁香三环烯和β-石竹烯
李晓东,杨成帅,王平平,严兴,周志华
(1 中国科学院分子植物科学卓越创新中心,合成生物学重点实验室,上海 200032; 2 中国科学院大学,北京100049; 3 中国科学院深圳先进技术研究院,深圳合成生物学创新研究院,中国科学院定量工程生物学重点实验室,广东 深圳 518055)
人参为五加科人参属植物人参(Panax ginseng)的根茎部分,是我国以及东亚、东南亚地区一种传统的名贵中药材,具有较高的药用价值和食用价值。在我国,人参用于强身、保健、抗癌和抗衰老已有超过2000 年的历史[1]。据《神农本草经》记载,人参“补五脏,安精神,定魂魄,止惊悸,除邪气,明目开心益智,久服身轻延年”。对人参的化学研究表明,其主要有效活性成分有人参皂苷、多糖类、人参炔醇、氨基酸和人参挥发油等[2]。其中,人参挥发油类组分有着不可或缺的作用。人参挥发油可以通过破坏菌体细胞壁、影响细菌物质和能量代谢来抑制细菌生长[3];同时可通过诱导细胞凋亡实现抗肿瘤作用[4];在心血管保护方面,人参挥发油还能显著抑制心肌缺血损伤,改善人体微循环[5]。
α-新丁香三环烯(α-neoclovene)和β-石竹烯(β-caryophyllene)是人参挥发油的主要成分之一[6],它们对于人参独特的药理功效有一定的贡献,具有良好的开发前景。β-石竹烯的生物活性研究表明,其具有抗癌[7]、抗炎、抗氧化及保护神经等多种生理活性[8]。β-石竹烯不仅自身具有抗癌活性而且还可以通过增加细胞膜的通透性来显著提高其他化疗药物的抗癌活性。例如,β-石竹烯可以增加紫杉醇对细胞膜的通透性[9],使其对结肠腺癌细胞DLD-1 的抑制活性提高10 倍。基于β-石竹烯的生物活性及其对人体的安全性,美国FDA 批准β-石竹烯作为食品添加剂使用[8]。但目前对α-新丁香三环烯的生物活性研究还非常少。
α-新丁香三环烯和β-石竹烯在生物能源方面的应用前景最近受到了广泛关注。从萜类化合物衍生而来的烷烃类化合物的结构与石油馏分燃料中化合物的结构相似,并具有与化石燃料相似的燃烧特性[10]。目前广泛使用的生物燃料主要以醇类分子为主,例如乙醇与丁醇,它们一般具有较高的含氧量,这不仅会影响燃料的能量密度(energy density),其在化石燃料中的添加还会加速设备的老化。与含醇生物燃料相比,倍半萜类生物燃料含氧量极低或不含氧,更适合作为化石燃料的替代品。近期有研究表明,在合成支链烷烃(synthetic ranched paraffins)中添加α-新丁香三环烯、β-石竹烯等倍半萜类化合物可以提高生物燃料的十六烷值(cetane number),降低燃料黏度,使其能够满足航空燃料的需求[11]。基于以上特性,α-新丁香三环烯等倍半萜类化合物燃料一度被认为是三大最具发展潜力的高能量密度航空燃料之一。
人参挥发油在人参中的含量仅占干重的0.081%~0.223%[12],且组成成分非常复杂,含有多种萜类、醇类、酮类、酚类和烷烃类等化合物,因此,仅通过植物提取与纯化的生产方式将难以满足α-新丁香三环烯和β-石竹烯在生物医药、保健食品及生物燃料等领域的应用需求。植物天然产物合成生物学的发展为人们提供了一种利用微生物细胞工厂定向合成稀有植物天然化合物的新策略[13]。通过解析目标化合物的生物合成途径,人们可以在微生物细胞中重构与优化合成途径,然后通过微生物发酵实现目标化合物的定向合成及规模化生产。近年来,这种新型的植物天然产物制备模式已被成功应用于多种萜类[14-15]、生物碱类[13,16]、黄酮类[17]等化合物的合成与应用中,该方法不仅能快速、大量地获得特定化合物单体用于其活性筛选,还能大幅降低化合物开发成本,保护珍稀植物资源。
α-新丁香三环烯和β-石竹烯的生物合成途径目前已得到解析(图1)。倍半萜类化合物在生物体内的共同前体为法尼基焦磷酸(farnesyl pyrophosphate,FPP),由甲羟戊酸(mevalonic acid,MVA)途径合成(图 1)。2016 年 Wu 等[18]在大肠杆菌底盘中对来源于4 种植物内生真菌的共26 个萜烯合酶(terpene synthase)进行了功能表征,其中的EC38-CS 是目前唯一被证实可以将FPP 转化为α-新丁香三环烯的倍半萜合酶(图1)。但是EC38-CS 的产物除了α-新丁香三环烯之外,还有α-芹子烯(α-selinene)、葎草烯(humulene)和β-石竹烯(β-caryophyllene)等,并且α-新丁香三环烯占其总产物的比例仅为4.76%。β-石竹烯的合成途径也已在2002年[19]得到解析,研究者在黄花蒿(Artemisia annua)中成功克隆得到倍半萜合酶元件QHS1,通过体外催化证实其可以高效催化FPP生成β-石竹烯且产物非常单一。
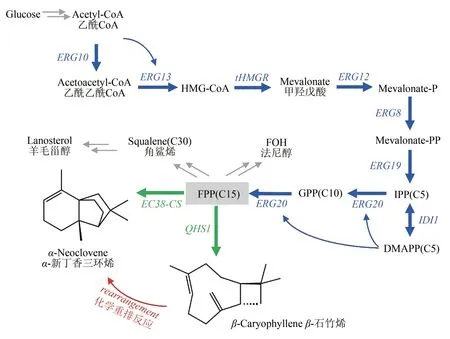
图1 α-新丁香三环烯和β-石竹烯的生物合成途径及化学转化Fig.1 Biosynthetic pathway and chemical conversion of α-neoclovene and β-caryophyllene
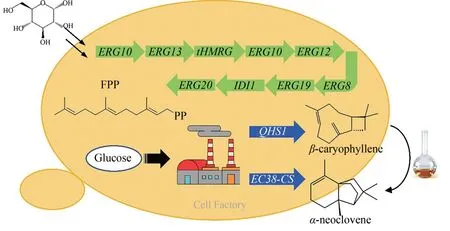
为了实现α-新丁香三环烯和β-石竹烯的高效合成,本工作在前人研究的基础上:①通过对酿酒酵母内源MVA 途径的全面强化,构建了高产倍半萜类化合物前体FPP的酵母底盘菌株,其前体产量比野生型菌株提高了458倍,可用于后续各种倍半萜类化合物细胞工厂的构建;②在FPP底盘菌株的基础上,通过异源表达植物内生真菌Hypoxylonsp. EC38 来源的倍半萜合酶基因ec38-cs,首次在酿酒酵母中实现了α-新丁香三环烯的高效从头合成,其发酵罐产量达到了487.1 mg/L;③在FPP 底盘菌株的基础上,通过异源表达黄花蒿来源的倍半萜合酶基因QHS1,在酿酒酵母中从头合成了β-石竹烯,其发酵罐产量达到了2949.1 mg/L,可用于β-石竹烯的工业化生产。
1 材料和方法
1.1 材料
1.1.1 菌株、基因及引物
本研究所涉及的菌株列于表1。本研究中用于途径构建与过表达的基因信息列于表2。本研究中涉及的寡核苷酸引物由生工生物工程(上海)股份有限公司、北京擎科新业生物技术有限公司和铂尚生物技术(上海)有限公司合成。

表1 本研究所涉及的菌株信息Tab.1 Strains used in this study

表2 本研究所涉及的基因Tab.2 Genes used in this study
1.1.2 培养基
SC 固体筛选培养基(100 mL):0.67 g 无氨基酸酵母氮源[生工生物工程(上海)股份有限公司],2.2 g D(+)-葡萄糖一水(国药集团化学试剂有限公司),2 g 琼脂粉(国药集团化学试剂有限公司)。
YPD固体筛选培养基(100 mL):1 g酵母提取物(OXOⅠD),2 g 细菌源蛋白胨No.2 (OXOⅠD),2.2 g D(+)-葡萄糖一水(国药集团化学试剂有限公司),2 g琼脂粉(国药集团化学试剂有限公司)。
YPD 发酵培养基(100 mL):1 g 酵母提取物(OXOⅠD),2 g 细菌源蛋白胨 No.2(OXOⅠD),2.2 g D(+)-葡萄糖一水(国药集团化学试剂有限公司)。
2×YPD 培养基(100 mL):2 g 酵母提取物(OXOⅠD),4 g 细菌源蛋白胨 No.2(OXOⅠD),4.4 g D(+)-葡萄糖一水(国药集团化学试剂有限公司)。
1.1.3 试剂
在酵母菌株构建中用于基因片段扩增的高保真 PCR 酶 : PrimerSTAR Max DNA Polymerase(Takara);用于酵母菌株菌落PCR 验证的PCR 酶:ExTaqDNA Polymerase(Takara);用于酵母菌株菌落PCR 验证的裂解液:Lysis Buffer for Microorganism to Direct PCR(Takara);用于酵母菌株发酵产物萃取的正十二烷: Dodecane(Sigma);β-石竹烯标准品购买于南通飞宇生物科技有限公司。
1.2 酿酒酵母感受态制备、转化及菌株构建方法
1.2.1 酿酒酵母感受态制备方法
首先,用无菌牙签从YPD 平板中挑取培养好的酿酒酵母菌株,接种于含有4 mL YPD 培养基的试管中,置于30 ℃,250 r/min 摇床中进行振荡培养,培养时间16 h 左右;测定试管中酵母细胞的浓度,吸取适量菌体进行稀释,用分光光度计测定其OD600值,含有1×106细胞/mL 稀释液OD600值为0.1;接下来,吸取2.5×108细胞接种到含50 mL 2×YPD 培养基的锥形瓶中,置于30 ℃、250 r/min 摇床中进行振荡培养,至OD600达到2.0(大约需要4 h);然后,用50 mL 无菌离心管在室温、3000g条件下离心5 min 收集菌体,并用25 mL 无菌水重悬、收集菌体两次;再次在室温、3000g条件下离心5 min收集菌体,并用1 mL无菌水重悬菌体,将其转移到1.5 mL 无菌离心管,13 000g离心1 min 收集菌体;最后,用1 mL 1 mol/L 山梨醇重悬菌体,以100 μL/管进行分装,冻存于-80 ℃以备后用,完成酵母感受态制备[20]。
1.2.2 酿酒酵母转化方法
从-80 ℃冰箱取出制作好的感受态细胞,置于室温环境中10 min,待融解后12 000g、1 min离心,吸去上层山梨醇,保留菌体待转化使用;同时,将配制好的ssDNA 用PCR 仪进行变性处理,99 ℃,5 min 后立即埋入冰盒中进行冷却,待转化时使用;配制360 μL 转化体系,其中PEG3350(0.5 kg/L)240 μL、ssDNA 50 μL、1 mol/L LiAc 36 μL、待转化 DNA 片段 34 μL;然后,将360 μL 转化体系加入到感受态细胞中并进行重悬,置于42 ℃水浴锅中热激40 min;之后,12 000g离心1 min 收集菌体,吸去上层转化体系,加入1 mL YPD 进行重悬,并置于30 ℃,200 r/min 摇床中进行振荡培养复苏3 h(如果是营养缺陷型筛选标记可省略此步骤);最后,12 000g离心1 min 收集菌体,吸去上层培养基/转化液,用适量无菌水对菌体进行重悬,并涂布于含有相应抗生素的YPD 或营养缺陷型的SC 平板中,倒置于30 ℃培养箱中培养,48 h 后便可对平板上的菌落进行相应验证。
1.2.3 酿酒酵母菌株构建方法
首先,设计引物,对酿酒酵母转化片段进行PCR扩增,片段包括:插入位点上游同源臂、启动子、基因片段、终止子、筛选标记和插入位点下游同源臂。相邻片段之间含有约70 bp 左右同源臂,用于酵母体内同源重组;然后,将PCR片段进行混合,片段加入量为1000 ng/kb,转化相应的酿酒酵母菌株,并对转化子进行PCR 验证。最后,挑选10 个阳性转化子进行发酵验证并对产物进行检测,选取目标产物产量最高的菌株进行保存并命名。
1.3 酿酒酵母菌株发酵及倍半萜产物抽提方法
用牙签在筛选平板上挑取阳性单克隆于5 mL YPD 试管中,30 ℃、250 r/min 摇床培养 24 h;将培养好的菌体以1∶100 的比例接种于含有10 mL YPD 液体培养基的50 mL 锥形瓶中,并加入1 mL十二烷萃取剂,30 ℃、250 r/min 摇床发酵培养96 h;将发酵液连同萃取剂置于15 mL 离心管,3000g离心5 min;吸取上层十二烷有机相,用于后续定性或定量分析。
1.4 角鲨烯、羊毛甾醇抽提方法
将菌株发酵液离心收集菌体;配制裂解液,50%乙醇和20% KOH 裂解液;用等体积裂解液悬菌体,置于沸水中裂解30 min,加入等体积正己烷混匀抽提1 h;离心取100 μL 上层正己烷有机相蒸干,加100 μL 乙醇溶解,用高效液相色谱(HPLC)进行检测。
1.5 酿酒酵母倍半萜代谢物的GC和GC-MS分析方法
使用岛津GC-2010Pro 气相色谱仪进行倍半萜检测,采用氢火焰离子(FⅠD)检测器。GC 分析条件如下:热电TG-5MS 型毛细色谱柱(30 m×0.25 mm,0.25 μm);进样口温度为200 ℃。
升温程序:初始温度为50 ℃,保持1 min,然后以10 ℃/min 升温至220 ℃并保持10 min,最后以30 ℃/min降温至50 ℃。
载气为高纯氮气,流量为32 mL/min;分流比为40∶1;检测器温度为250 ℃。
使用安捷伦GC-MS 7890-5977 进行GC-MS 检测,分析条件:离子源为EⅠ,温度为230 ℃;电子能量70 eV;接口温度为250 ℃;溶剂延时2 min;倍增器电压为1.165 kV;扫描范围30~550 ainu。根据NⅠST 2011 质谱库搜索质谱成分,质谱匹配因子(mass spectra match factor)>85%的成分可初步鉴定为该化合物。
1.6 酿酒酵母代谢物角鲨烯、羊毛甾醇的高效液相色谱(HPLC)分析方法
使用岛津LC20A XR高效液相色谱进行角鲨烯和羊毛甾醇的检测,分析条件如下:液相色谱柱为月旭Boltimate EXT-C18核壳柱(100 mm×2.1 mm,2.7 μm);流动相为水(A)和乙腈(B);检测波长为203 nm;流速为0.45 mL/min;流动相梯度程序:0~2.00 min 60%B,2.00~5.00 min 60%~100%B,5.00~17.00 min 100%B,17.00~20.00 min 60%B。
1.7 倍半萜细胞工厂发酵罐补料发酵方法
使用 1.3 L DASGⅠP 生物反应器(Eppendorf,Germany)对NCVBY01和CPLBY01进行批次补料发酵。采用合成培养基进行发酵且培养基成分与之前报道[21]的一致。发酵过程中,温度保持30 ℃,pH 通过流加氨水控制在5.0,同时通过调节搅拌速度和通气量将溶氧控制在30%以上。通过调节补料速度使发酵过程中乙醇含量低于0.5 g/L。
2 结果和分析
2.1 不同酵母出发菌株合成萜类前体化合物的潜能比较
与大肠杆菌等原核生物相比,酿酒酵母在萜类化合物的合成中具有一定的优势,因为其含有内源的MVA 途径(图1),可以合成倍半萜类化合物的共同前体FPP。BY4742 与CEN.PK2-1 为目前合成生物学中常用的两种酿酒酵母出发菌株,其在萜类化合物的合成与积累方面表现出不同特性[22],因此首先需要设计实验对这两种出发菌株的FPP生产潜能进行比较与评估。受限于目前的化合物检测手段,对FPP进行定量的检测依然难以实现。据报道,酵母内源的磷酸化酶可以将FPP转化为其去磷酸化的衍生物法尼醇(farnesol,FOH)[23],而 FOH 的检测方法相对成熟[23],因此通过对酵母发酵液中FOH 的定量检测来间接反映菌株中FPP的合成与积累,这成为目前对FPP检测的重要手段。
首先,通过对两种野生型酿酒酵母菌株发酵液中的FOH 进行检测,其结果如图2(a)、(b)所示,BY4742菌株中FOH的积累量为0.177 mg/L,是CEN.PK2-1 菌株的4 倍多(表3)。同时通过对FPP 下游产物角鲨烯(squalene)与羊毛甾醇(lanosterol)进行检测[图2(c)],其结果表明:BY4742 菌株角鲨烯产量为0.50 mg/L,为CEN.PK2-1 菌株的1.7 倍(表3);但是在羊毛甾醇产量上 BY4742 菌 株 却 略 低 于 CEN. PK2-1 菌株(表3)。

图2 用GC-FⅠD和HPLC分别检测菌株中FOH和角鲨烯、羊毛甾醇的积累量Fig.2 Analysis of FOH and squalene,lanosterol accumulated in engineered yeast strains by GC and HPLC
为了进一步评估这2个出发菌株合成萜类前体化合物的潜能,设计实验利用强启动子提高了它们各自 MVA 途径中的ERG8、EGR10和tHMGR基因的表达水平,分别构建了菌株SQTBY01 和SQTCEN01。对这两个工程菌株的发酵产物进行检测,结果如图2 所示。在产物净积累量方面,由BY4742 为出发菌株构建的菌株SQTBY01 合成FOH、角鲨烯和羊毛甾醇的产量均要高于菌株CEN.PK2-1 来源的SQTCEN01,分别为后者的9.0 倍、1.6 倍和 1.7 倍 (表 3);在 3 种产物提高量方面,SQTBY01 菌株相较于其出发菌株分别提高了 25.7 倍、102 倍和 14.8 倍,SQTCEN01 菌株相较于其出发菌株则分别提高了11.5 倍、107 倍和7.6 倍(表3)。以上结果表明,不论是萜类前体化合物的净积累量还是总产量提高的幅度,BY4742菌株均要优于CEN.PK2-1,因此BY4742 被选定为出发菌株用于后续倍半萜类化合物的底盘细胞与细胞工厂的构建。
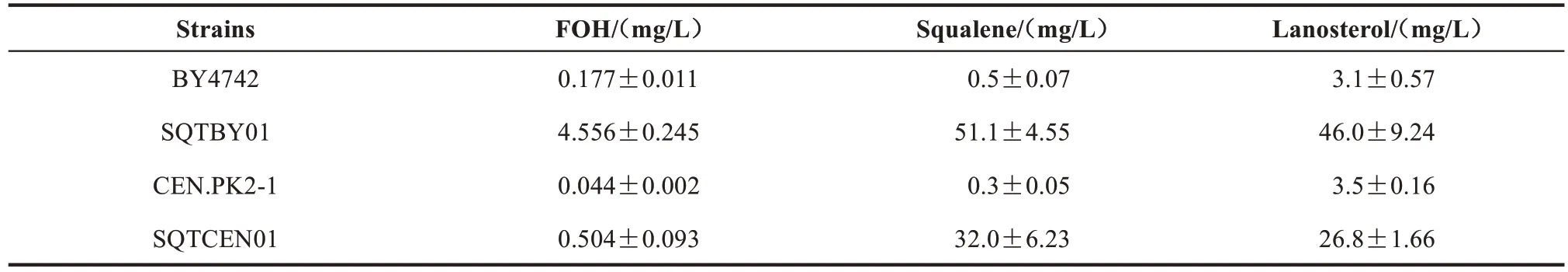
表3 FOH、角鲨烯和羊毛甾醇在菌株中的积累量Tab.3 Production of FOH,squalene and lanosterol in different yeast strains
2.2 高产FPP的酿酒酵母底盘菌株的构建
2.2.1 GAL80敲除菌株的构建
酿酒酵母半乳糖利用相关基因(GALgenes)的启动子(例如GAL1p、GAL7p和GAL10p等)具有较强的启动外源基因转录的能力[24],在构建酿酒酵母细胞工厂中具有十分广泛的应用。GAL80基因是参与抑制GAL系列基因转录的转录调节因子,在半乳糖不存在的条件下,通过与GAL系列基因启动子结合从而阻遏GAL基因的转录[25]。因此,在以葡萄糖为碳源的培养基中利用GAL系列基因的启动子首先需要敲除酿酒酵母内源的GAL80基因,以解除其对GAL系列启动子的阻遏。
首先GAL80基因通过移除整个开放阅读框(ORF)实现敲除[图3(a)],PCR 验证结果显示[图3(b)],GAL80基因已在目标菌株中成功敲除。此菌株被命名为BY4742Δ。

图3 BY4742Δ菌株的构建与PCR验证Fig.3 Construction and PCR verification of the strain BY4742Δ
2.2.2 高产FPP的倍半萜底盘菌株的构建
Acetyl-CoA经酿酒酵母MVA途径转化为FPP的过程,共有8个关键内源基因参与,依次为ERG10、ERG13、tHMGR、ERG12、ERG8、ERG19、IDI1和ERG20[26](图1)。上述基因被划分为两个模块[图4(a)],依次在敲除菌株BY4742Δ中进行强化。

图4 强化MVA途径的菌株构建与相应的FOH产量Fig.4 Construction of strains with an enhanced MVA pathways and their FOH production
首先,ERG10、ERG13、tHMGR、ERG12和ERG8五个基因与相应启动子、终止子进行连接,组成表达盒后,串联整合到BY4742Δ 菌株基因组的多拷贝delta位点[图4(a)],构建了菌株SQTBY02。检测SQTBY02 菌株的发酵产物表明,其发酵液中FOH 含量达到了15.44 mg/L,与出发菌株 BY4742Δ 相比有了 86 倍的提高[图 4(b)]。在SQTBY02 菌株的基础上,继续整合第2 个强化模块,即,将ERG19、IDI1和ERG20三个基因组成表达盒进行串联,同时再串联一个拷贝的tHMGR表达盒[图4(a)],共同整合到SQTBY02菌株基因组的多拷贝rDNA位点,构建了菌株SQTBY03。对SQTBY03 菌株进行发酵产物检测,其发酵液中FOH 含量达到了82.36 mg/L,比SQTBY02 菌株进一步提高了5.3 倍,与出发菌株BY4742Δ 相 比有了 458 倍 的提高 [图 4(b)]。SQTBY03 菌株可作为通用底盘细胞用于后续各种倍半萜细胞工厂的构建。
2.3 α-新丁香三环烯细胞工厂的构建
真菌Hypoxylonsp.EC38来源的ec38-cs是目前唯一报道可以合成α-新丁香三环烯的倍半萜合酶基因[18],将其用于α-新丁香三环烯细胞工厂的构建(图1)。为了提高ec38-cs在酿酒酵母中的表达水平,ec38-cs基因的全序列根据酿酒酵母密码子偏好性进行了密码子优化,优化后的基因被命名为synec38-cs。
为了增强菌株的稳定性,将synec38-cs基因在底盘菌株SQTBY03 基因组的X-4单拷贝位点进行了整合,并利用强启动子TEF1p控制该基因的转录[图5(a)],构建了菌株NCVBY01。在摇瓶发酵后,对NCVBY01 菌株产物进行了GC/MS检测与鉴定。与ec38-cs在大肠杆菌底盘中合成倍半萜的文献报道相比可以发现,NCVBY01 菌株(即ec38-cs在酵母底盘内)也合成了多种不同的倍半萜类化合物(表4),但是产物的比例发生了很大的变化,其中变化最为显著的是α-新丁香三环烯的含量从文献报道的4.76%增加到了39.9%(表4),这很可能是因为倍半萜合酶EC38-CS 在不同底盘细胞中催化活性发生变化造成的。α-新丁香三环烯在细胞工厂NCVBY01 的摇瓶产量为25.8 mg/L。接着在1 L 发酵罐中对NCVBY01 菌株进行补料发酵,在发酵140 h 时,菌株OD600值达到了450,其α-新丁香三环烯产量达到了487.1 mg/L,实现了较为高效的异源合成(表5)。
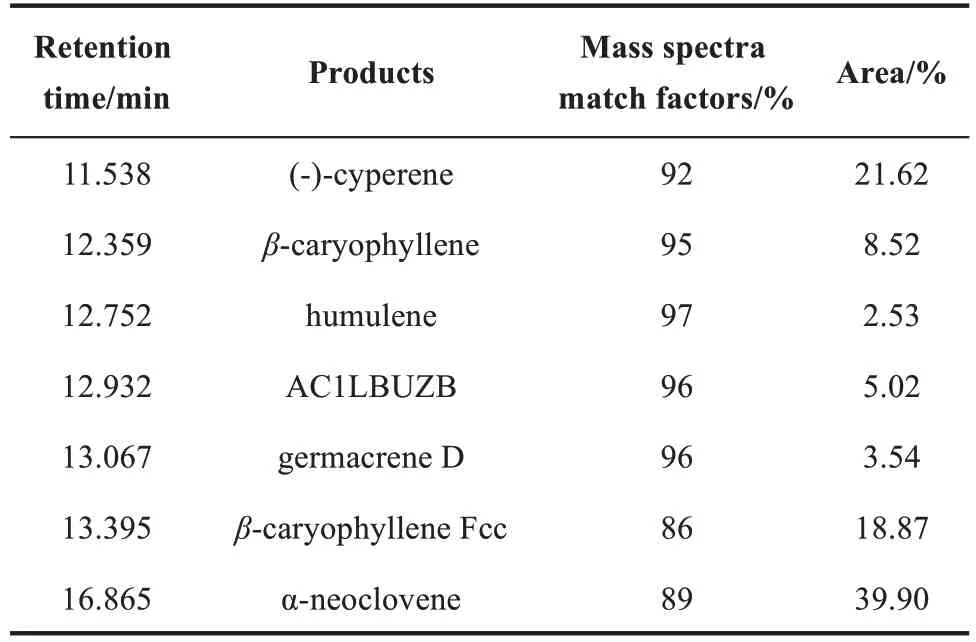
表4 GC/MS分析对NCVBY01菌株发酵副产物的鉴定Tab.4 GC/MS analysis for identification of by-products produced by NCVBY01

图5 NCVBY01和CPLBY01菌株的构建示意图及其发酵产物GC检测Fig.5 Construction of NCVBY01 and CPLBY01 and GC analysis of their α-neoclovene and β-caryophyllene productions
2.4 β-石竹烯细胞工厂的构建
为了构建β-石竹烯酵母细胞工厂,选择了黄花蒿来源的QHS1作为倍半萜合酶元件,它可以高效催化FPP且产物主要为β-石竹烯。首先,根据酿酒酵母密码子的偏好性对黄花蒿来源的石竹烯合酶QHS1基因进行了密码子优化,优化后的基因命名为synQHS1。然后,与α-新丁香三环烯细胞工厂的构建类似,从倍半萜通用底盘菌株SQTBY03 出发,将synQHS1基因整合到底盘菌株SQTBY03 基因组的X-4单拷贝位点[图5(b)],构建了菌株CPLBY01。CPLBY01 菌株的摇瓶发酵产物中成功检测到了β-石竹烯[图5(b)],其产量达到了250.4 mg/L,且产物中几乎没有其他倍半萜类副产物。在1 L 发酵罐中对CPLBY01 菌株进行补料发酵,在发酵140 h 时,菌株OD600值达到了446,其β-石竹烯产量达到了2949.1 mg/L(表5),唯一可以检测到的倍半萜副产物为α-humulene(表5)。

表5 NCVBY01和CPLBY01菌株倍半萜产物的发酵罐产量Tab.5 Yield of sesquiterpenes in NCVBY01 and CPLBY01 by fed-batch fermentation.
3 结 论
倍半萜类化合物具有多种多样的生理学功能,一直以来都是植物天然药物开发的重要源泉。然而由于其在植物中的含量往往极其稀少且成分复杂,要获得足够多、纯度高的化合物单体往往十分困难,这严重限制了其应用。本项研究以α-新丁香三环烯和β-石竹烯为例,利用合成生物学的原理与方法,成功构建了倍半萜通用的酿酒酵母底盘菌株及α-新丁香三环烯和β-石竹烯两种细胞工厂,为规模化制备α-新丁香三环烯和β-石竹烯及其他倍半萜类天然化合物奠定了重要基础。
2016年,Yang等[27]通过在大肠杆菌中强化乙酸利用元件、整合外源MVA 途径及异源表达石竹烯合酶基因QHS1,成功以乙酸为唯一碳源合成了β-石竹烯,其摇瓶产量为106 mg/L。通过进一步优化发酵条件,该菌株在发酵罐中合成β-石竹烯的产量达到了 1.05 g/L。2018 年,Wu 等[28]同样尝试了在大肠杆菌中合成多种倍半萜类化合物,其中,β-石竹烯的产量为100 mg/L。本研究通过对比两种酿酒酵母工程菌株BY4742 和CEN.PK2-1 在生产倍半萜类化合物方面的潜能,以菌株BY4742 为出发菌株,构建了生产倍半萜类化合物的通用底盘菌株SQTBY03,其MVA途径的整体代谢流量比出发菌株增强了458倍。在此底盘菌株中异源表达密码子优化的黄花蒿石竹烯合酶基因QHS1,获得的β-石竹烯细胞工厂CPLBY01,其摇瓶产量达到了250.4 mg/L,发酵罐产量达到了2949.1 mg/L,为目前大肠杆菌报道最高水平的2.5 倍以上,该菌株有望应用于β-石竹烯的工业生产中。
目前尚没有从头生物合成α-新丁香三环烯的报道,在功能鉴定真菌Hypoxylonsp.EC38 来源的倍半萜合酶基因synec38-cs时,研究者在大肠杆菌中搭建MVA 途径并异源表达该基因,鉴定到产物中有α-新丁香三环烯,但含量极低[18]。本研究中,在底盘菌株SQTBY03 中异源表达密码子优化的倍半萜合酶基因synec38-cs,获得的酿酒酵母细胞工厂NCVBY01,其α-新丁香三环烯的摇瓶产量为25.8 mg/L,发酵罐产量为487.1 mg/L,是目前首次报道的在微生物细胞工厂中合成α-新丁香三环烯,但与细胞工厂CPLBY01 的β-石竹烯产量相比,NCVBY01 菌株的α-新丁香三环烯产量相对较低,不到β-石竹烯产量的六分之一,这表明NCVBY01 菌株在α-新丁香三环烯产量方面还有较大的提升空间。其中限制其产量的关键因素在于目前采用的倍半萜合酶EC38-CS 并非最优元件,其催化活性及产物专一性方面皆有待改善。接下来可以通过对新合酶元件的挖掘或对现有EC38-CS元件进行改造,在提高底物FPP的转化率的同时,减少产物谱中副产物所占的比例,将有望进一步提高α-新丁香三环烯细胞工厂的产量。另外,已有文献报道,以浓硫酸为酸性试剂对同为倍半萜类化合物的β-石竹烯进行酸处理,可以在体外经过一步简单的化学重排反应生成α-新丁香三环烯[29],其转化率高达75%[30],而本研究中构建的β-石竹烯菌株其产量已接近3 g/L,这也为α-新丁香三环烯的制备提供了一条生物与化学结合的新合成途径。
致谢:本工作得到了国家重点研发计划(2019YFA09 04300)和国家自然科学基金(31921006)的支持。感谢中科院分子植物科学卓越创新中心胡文利老师在GC-MS分析上给予的帮助。
——结构和生物活性

