瘦素预处理对小鼠肝脏缺血再灌注损伤炎性因子及肝功能的影响
陈旭光 温军业 张曼 王溪溪
肝脏是合成蛋白质、脂肪、能量代谢的重要器官,具有解毒、免疫功能。作为肝动脉、门静脉双供血器官,肝脏对缺血敏感程度较高,容易发生肝缺血再灌注损伤(liver ischemia reperfusion injury,LIRI)。LIRI是指肝组织缺血重获血流灌注后,细胞结构和功能损伤加重,器官功能进一步恶化[1],常见于巨大肝癌切除、肝血管瘤切除、肝内胆管结石致肝叶萎缩、肝内胆管结石需行肝叶切除、肝移植及休克后复苏,它是一个多种炎性因子、多种细胞器相关联的复杂过程,在半肝切除手术过程中,需将肝血流短暂性阻断,并于切除操作结束后再次开通,因此极易引发肝缺血再灌注损伤。肝脏缺血再灌注损伤过程中,细胞因子,炎性反应,免疫细胞在此过程中起到关键作用。主要机制包括氧自由基生成、炎性反应、线粒体损伤、细胞凋亡、Ca2+超载和白细胞的活化等,往往导致机体预后不良[2,3]。坏死的肝细胞释放大量的细胞因子或者趋化因子,加重肝细胞损伤,造成肝功能障碍。瘦素(Leptin)是参与机体的摄食、体重调节、能量平衡及内分泌免疫等多种功能的重要信号物质,还与神经垂体激素的分泌、大脑发育、肿瘤的发生与发展、心血管系统功能稳态等的调节有关[4],又是与创伤修复密切相关的代谢因子。近年来,瘦素对肝缺血再灌注损伤的影响备受关注[5,6],瘦素处理有望成为一种治疗肝缺血再灌注损伤的治疗方法。本研究通过建立小鼠肝脏缺血再灌注损伤瘦素预处理模型,探讨瘦素预处理对小鼠肝脏缺血再灌注损伤炎性因子及肝功能的影响。
1 材料与方法
1.1 实验动物及分组 C57 BL/6雄性小鼠40只,8~10周,体重约18~20 g,购自北京维通利华实验动物技术有限公司[合格证号 SCXK(京)2016-0006,动物饲料及垫料均经放射线照射灭菌],昼夜循环12 h,环境温度21℃~25℃,相对湿度在65%左右,每5分钟换气1次,饲料由河北省人民医院临研中心提供。实验分为4组:假手术组、肝缺血再灌注损伤模型组(LIRI模型组)、LIRI瘦素预处理组和LIRI术后瘦素处理组,每组10只小鼠。
1.2 主要试剂 人工重组瘦素(Recombinant mouse leptin)购自美国R&D Systems 公司,丙二醛(MDA)和超氧化物歧化酶(SOD)试剂盒购自北京博迈斯科技发展有限公司,白细胞介素-6(IL-6)、白细胞介素-10(IL-10)试剂盒购自上海心语生物科技有限公司,肿瘤坏死因子-α(TNF-α)试剂盒和碱性磷酸酶(ALP)试剂盒购自上海佰晔生物科技中心,丙氨酸氨基转移酶(ALT)、γ-谷氨酰转移酶(γ-GT)试剂盒购自本生(天津)健康科技有限公司,戊巴比妥钠购自美国Sigma公司。
1.3 动物模型的制备及处理 实验前对4组小鼠均采取24 h禁食、12 h禁水处理。(1)肝缺血再灌注损伤模型组(LIRI模型组):于小鼠腹腔注射戊巴比妥钠溶液(40 mg/kg)使其麻醉,取仰卧位将小鼠固定于操作台上,75%酒精消毒胸腹部,逐层切开腹腔,游离并暴露第一肝门,解剖肝蒂,无创血管钳分离肝脏左叶、中叶肝蒂及肝右叶肝蒂的分界线,血管夹钳夹肝左叶及中叶肝蒂,不钳夹供应右支肝蒂的血管,夹闭血管30 s后肝左叶和中叶的颜色与肝右叶相比,由鲜红变为浅粉最后变白证明手术成功,拉拢对合皮肤并覆盖无菌湿纱布,60 min后撤掉血管夹,30 s左右后见可见肝左、肝中叶迅速变为鲜红色,表明肝缺血再灌注损伤模型制备成功,缝合腹部切口,再灌注6 h后处死小鼠,无菌分离钳分离采集肝脏和血清样本。(2)假手术组:75%乙醇消毒小鼠胸腹部,沿腹正中打开腹腔,分离钳解剖第一肝门,分离小鼠肝蒂左分叉,不夹闭肝叶供血,不进行任何其他处理,最后关腹。(3)LIRI瘦素预处理组:以下称瘦素预处理组,于肝缺血再灌注术前30 min,给予小鼠腹腔注射重组瘦素,剂量为 50 μg/kg。(4)LIRI术后瘦素处理组:以下称瘦素后处理组,小鼠肝缺血再灌注损伤术后30 min,给予小鼠腹腔注射重组瘦素,剂量为50 μg/kg。
1.4 小鼠血清制备和肝脏组织取材 各实验组小鼠于肝缺血再灌注术后6 h被颈椎脱臼处死,采用摘眼球取血法收集血液样品,在4℃下于离心机中离心(4 000 r/min,10 min),分离血清保存至-80℃冰箱中待测。之后用酒精对小鼠胸腹部进行消毒,无菌切开腹部正中,取肝脏组织并制备肝组织匀浆。
1.5 MDA和SOD水平的测定 取新鲜肝脏组织100 mg,用无菌剪刀将其剪碎并置于无菌器皿研磨成肝组织匀浆,离心10 min(4℃、80 000 r/min),取上清液保存至液氮中,检测标本前于冷水中进行消融,离心10 min(4℃、80 000 r/min),取上清液,按照试剂盒说明书用分光光度计测定、计算MDA和SOD水平。
1.6 炎性因子及肝功能的测定 各实验组小鼠血清中IL-6、IL-10、TNF-α、ALT、γ-GT和ALP的检测依据试剂盒说明进行。

2 结果
2.1 4组小鼠肝组织中SOD、MDA比较 与假手术组相比,各实验组小鼠肝脏组织匀浆MDA含量较高(P<0.05),SOD含量较低(P<0.05)。与LIRI模型组相比,LIRI瘦素预处理组的MDA较低(P<0.05)、SOD 含量较高(P<0.05);LIRI术后瘦素后处理组同样表现为MDA含量较低(P<0.05)、SOD含量较高(P<0.05)。见表1。
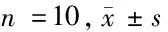
表1 4组小鼠MDA、SOD水平指标
2.2 4组小鼠血清中IL-6、IL-10、TNF-α比较 与假手术组相比,各实验组小鼠白细胞介素-6(IL-6)、小鼠白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)水平显著升高(P<0.05)。与LIRI模型组相比,LIRI瘦素预处理组的IL-10水平显著升高(P<0.05),IL-6、TNF-α水平显著降低(P<0.05);LIRI术后瘦素后处理组的IL-10水平显著下降(P<0.05),IL-6、TNF-α水平显著升高(P<0.05)。见表2。

表2 4组小鼠IL-6、IL-10和TNF-α水平指标
2.3 4组小鼠血清中ALT、γ-GT、ALP比较 与假手术组相比,各实验组丙氨酸氨基转移酶(ALT)、小鼠γ-谷氨酰转移酶(γ-GT)和碱性磷酸酶(ALP)水平均显著升高(P<0.05)。与LIRI模型组比较,LIRI瘦素预处理组的ALT、γ-GT和ALP均显著下降(P<0.05);LIRI术后瘦素后处理组表现为γ-GT和ALP均显著下降(P<0.05)。见表3。
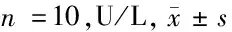
表3 4组小鼠肝功能指标结果
3 讨论
目前,肝脏缺血再灌注损伤的防治措施主要包括:缺血预处理、药物干预、减少缺血时间等[7]。其中,缺血预处理保护缺血再灌注损伤的机制包括减轻机体的氧化应激反应、抑制胞内钙离子超载、激活机体线粒体ATP钾离子通道、减轻炎性发应、改变凋亡相关蛋白等多种机制,从而减少肝脏组织细胞死亡以实现对器官保护作用。通过预处理方式对缺血再灌注损伤器官的保护作用已得到大量实验支持,相关报道表明预处理在对肝脏、肾脏、脑、心脏、肺等重要脏器的缺血再灌注损伤过程中均有保护作用[8-15]。其中,瘦素是近年来研究较多预防肝缺血再灌注损伤的药物。瘦素,由白色脂肪细胞分泌,是一种神经肽类物质,主要发挥着平衡能量、脂类代谢、胰岛素分泌、调节免疫功能、血红细胞生成、骨骼建成、血管发生等重要作用[16,17],与创伤修复密切相关,主要分为游离型和结合型两种。瘦素进入血液循环后,游离型的瘦素与特异性的蛋白结合,通过血脑屏障,与瘦素受体结合,进行信号传导,激活下丘脑中枢,参与机体的摄食、体温调节、能量平衡及内分泌免疫调节。
肝缺血再损伤的关键因子之一TNF-α,出现较早,由活化的单核-巨噬细胞释放的促炎因子,参与急性炎性反应及免疫应答、介导细胞线粒体毒性反应,使肝窦内皮细胞肿胀,激活中性粒细胞并释放ROS并造成细胞凋亡,干扰肝窦细胞内DNA正常复制,诱发枯否细胞并产生大量ROS,加重多形核粒细胞浸润和肝细胞损伤,诱发脂类、多肽产生导致肝细胞凋亡。TNF-α能够刺激血管内皮细胞表达表面黏附分子,加重肝缺血损伤,从而过度释放大量促炎因子引起的炎症过度反应综合征。可以通过刺激分泌蛋白,促使多脏器功能衰竭的发生,诱导肝缺血再灌注损伤的产生,导致血管通透性改变,进一步引起大量炎性因子和氧自由基的释放[18,19],最终引起机体的免疫调节失衡。
肝脏是IL-6主要来源器官,IL-6是体内的一种具有各多种生物学效应的细胞因子,是重要的炎性介质,其主要介导和调节免疫反应及炎性反应,刺激造血功能并参与组织修复。TNF-α能够激活NF-KB转录,从而激活诱导合成大量的IL-6,也介导IL-10的产生。IL-10是一种具有明显抗炎作用的细胞因子,是一种可以减轻系统性炎性反应并减少炎性细胞因子产生。本研究中发现,血清IL-6、IL-10和TNF-α的水平是判断炎性反应和患者病情严重程度的重要参考指标。其中,TNF-α与IL-10在肝缺血再灌注损伤过程中起的作用是相反的,TNF-α、IL-10比值可以作为肝缺血再灌注损伤严重程度的判断标准。
肝脏缺血再灌注损伤可产生大量的氧自由基。氧自由基异常表达及钙超载等可能是肝脏外科手术患者肝缺血再灌注损伤的危险因素。氧自由基和生物膜上的不饱和脂肪酸发生脂质过氧化反应,形成脂质过氧化物如MDA,MDA具有细胞毒性,可加剧细胞膜损伤,影响细胞正常生理功能。因此,通过测定体内MDA含量,可间接反映体内自由基对机体的损伤程度[20]。机体内自身存在氧自由基的清除系统,如酶类SOD、过氧化氢酶、过氧化物酶及维生素类,其中,SOD作为生物体内的一种抗氧化酶,是氧自由基的自然天敌,是机体内氧自由基的头号杀手,具有强有效的自由基清除能力[21],催化氧离子的歧化反应,并抑制MDA 对细胞的损伤,进而修复氧化损伤细胞。通过测定MDA和SOD的活性来判断肝缺血再损伤程度[22,23]。有研究表明,SOD的上调可以明显减轻肝组织在缺血再灌注中的损伤。本研究结果表明,小鼠肝脏缺血再灌注后,MDA 升高,SOD 下降,以肝缺血再损伤模型组明显、瘦素预处理组损伤程度明显较轻(瘦素预处理组小鼠肝脏匀浆组织的MDA含量降低、SOD含量增高),说明瘦素预处理减少炎性因子的聚集、减轻炎性反应、参与改善TNF-α介导的肝缺血再灌注损伤过程,提示瘦素预处理可减少氧自由基产生并减轻体内脂质氧化程度,降低肝脏缺血再灌注时的肝组织损伤。
肝缺血再损伤过程中,肝脏内细胞ATP产生障碍,钙离子释放,凋亡途径启动等使细胞加速凋亡。ALT是肝细胞受损后肝功能异常的常用指标之一,主要位于肝细胞细胞质内。ALP是广泛分布于人体肝脏、骨骼、肠、肾和胎盘等组织经肝脏向胆外排出的一种酶,主要见于阻塞性黄疸、原发性肝癌、继发性肝癌、胆汁淤积性肝炎等的检查。γ-GT是一种转移酶,参与谷胱甘肽的代谢,主要来自肝脏,γ-GT的活动性与肝脏疾病有良好的一致性,可作为反映肝细胞损害的指标,用于鉴别肝脏系统疾病,弥补ALP的不足。本研究发现,肝组织缺血再灌注过程中,肝功能指标明显下降,瘦素预处理可明显降低肝脏缺血再灌注时的肝组织损伤。
目前,通过动物实验研究肝缺血再灌注过程中仍在继续,多种减轻肝缺血再灌注损伤的途径越来越多。在临床过程中,对于肝脏较大手术,提前进行多种方式的预处理,可以更快的恢复肝功能,降低肝衰竭可能,使患者受益。综上所述,瘦素预处理在缺血再灌注损伤过程中,可降低IL-6、TNF-α、MDA的水平,提高SOD活性、IL-10 水平,降低肝功能指标,从而减轻炎性反应、氧化应激,降低氧自由基的产生,减轻机体的炎性反应,降低小鼠肝脏缺血再灌注的损害,为临床防治提供了理论依据。

