黄茅海浮游生物及其粒径结构的潮汐变化特征研究*
刘子嘉 李 芊, 3 陈寅超 帅义萍 马梦真
黄茅海浮游生物及其粒径结构的潮汐变化特征研究*
刘子嘉1, 2李 芊1, 2, 3①陈寅超1, 2帅义萍1, 2马梦真1, 2
(1. 热带海洋环境国家重点实验室 中国科学院南海海洋研究所 广州 510301; 2. 中国科学院大学 北京 100049; 3. 南方海洋科学与工程广东省实验室(广州) 广州 511458)
河口区浮游生物作为食物链的重要组成部分, 在海洋生物地球化学循环中起到重要作用。为了解黄茅海河口浮游生物及其粒径结构的时空分布特征, 于2017年8月17日至21日对黄茅海河口区域微微型浮游生物(pico-, <2 μm), 微型浮游生物(nano-, 2—20 μm)及小型浮游生物(micro-, 20—200 μm)及其粒径结构进行观测。结果显示, 河口外侧总叶绿素浓度最高, 为19.34 μg/L, 且大粒径浮游生物占比最高。底层水体受上溯海水影响较为明显, 表现出盐度及营养盐浓度随潮汐呈现显著的周期性变化。潮汐过程对不同粒径的浮游生物影响不同, 对微微型浮游生物影响较小, 对大粒径浮游生物影响较大。涨潮时, 表层标准化浮游生物粒径谱(NBSS)斜率增大, 大粒径浮游生物占比增多。落潮时, NBSS斜率减小, 小粒径浮游生物占比增多。潮汐过程及由其引起的营养盐、温度和可利用光强的改变是影响黄茅海河口浮游生物分布的主要因素。研究可为河口区浮游生态系统以及海洋生物地球化学循环过程等的研究提供重要依据。
浮游生物; 浮游生物粒径; 潮汐; 黄茅海
浮游生物作为海洋食物链的基本组成部分, 在海洋生物泵和碳循环过程中起到重要作用(Chisholm, 2000)。浮游生物的生长、摄食以及营养盐吸收等新陈代谢过程与其粒径结构息息相关(Dong, 2018)。小粒径的浮游植物由于比表面积较小而在资源贫乏的环境中更具优势, 而在资源丰富的环境中大粒径的浮游植物由于有更高的光合作用效率而更为丰富(Chisholm, 1992; Marañón, 2007)。也有研究指出, 营养盐与温度会共同影响浮游生物的粒径结构(Marañón, 2012), 温度升高或会导致浮游生物粒径减小(Yvon-Durocher, 2011)。除温度、盐度以及营养盐等环境因子外, 海洋物理过程(如: 潮汐、锋面等)也会影响浮游生物的粒径结构分布(Rodríguez, 2001; Sin, 2015; 施玉珍等, 2017)。
河口作为陆地与海洋间的纽带, 是研究海洋碳循环过程的关键场所(Li, 2018)。河口区浮游生物作为食物链的关键环节, 在河口生态系统以及生物地球化学循环过程中起着重要作用, 对其进行研究有着重要的理论与实践意义(郭沛涌等, 2003)。由于受到潮汐以及径流等过程影响, 河口区域水动力环境复杂。其中, 潮汐是影响河口区浮游生物分布的重要因子之一(Sin, 2015)。黄茅海河口是位于珠江口西侧的喇叭形河口湾, 上有虎跳门水道与崖门水道汇入, 下与南海相连, 为潮流优势型河口(高原等, 2010), 其环境主要受到河流径流和潮流所影响(Jia, 2019)。目前, 针对黄茅海河口的研究大多集中于对其潮汐动力特征、泥沙输运以及环境因子的变化等方面进行研究(杨名名等, 2016; 周争桥, 2019; Cui, 2019), 而对浮游生物及其粒径的分布和其随潮汐的变化特征研究仍然较少。
标准化浮游生物粒径谱(normalized biovolume size spectrum, NBSS)常被用来表征浮游生物粒径结构, 其斜率可以用来描述浮游生物的粒径分布情况(San Martin, 2006)。较小的斜率值表示浮游生物群落中小粒径生物占比较高, 且生态系统的能量传递效率较低(Zhang, 2019; Liu, 2021)。在标准化粒径谱斜率相近时, 粒径谱截距可以用来表征浮游生物群落总生物量的大小(Quinones, 2003), 较高的截距值表示浮游生物群落总生物量相对较高。通过对不同环境下浮游生物及其粒径结构的变化情况进行分析, 对其在黄茅海河口区域分布以及随潮汐变化特征进行探究, 有助于进一步了解该区域的生物地球化学循环过程, 也可以为生态建模以及模拟等提供科学依据。
1 材料与方法
1.1 样品采集与分析
调查于2017年8月在黄茅海水域进行, 共计包括3个采样站位。S1、S2及S3站位水深分别为7.8、3.1及7.8 m。其中, S1、S3站位水样采集于低低潮位时, S2号站位为时间序列站位(图1), 具体采样时间如表1所示。水体温度及盐度利用船载CTD进行测量, 通过CTD所携带的采水器对表层(距海表0.5 m)和底层(距海底0.5 m)水体样品进行采集。所采集水样预先经200 μm筛绢过滤, 用于测量营养盐以及叶绿素等, 各样品均取2个平行样。
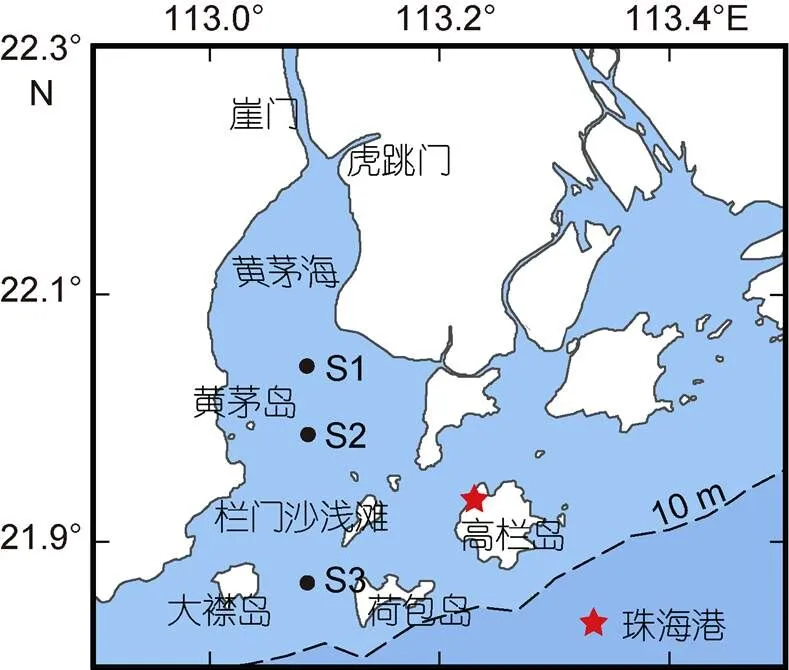
图1 黄茅海采样站位图
表1 各站位采样日期及采样时间
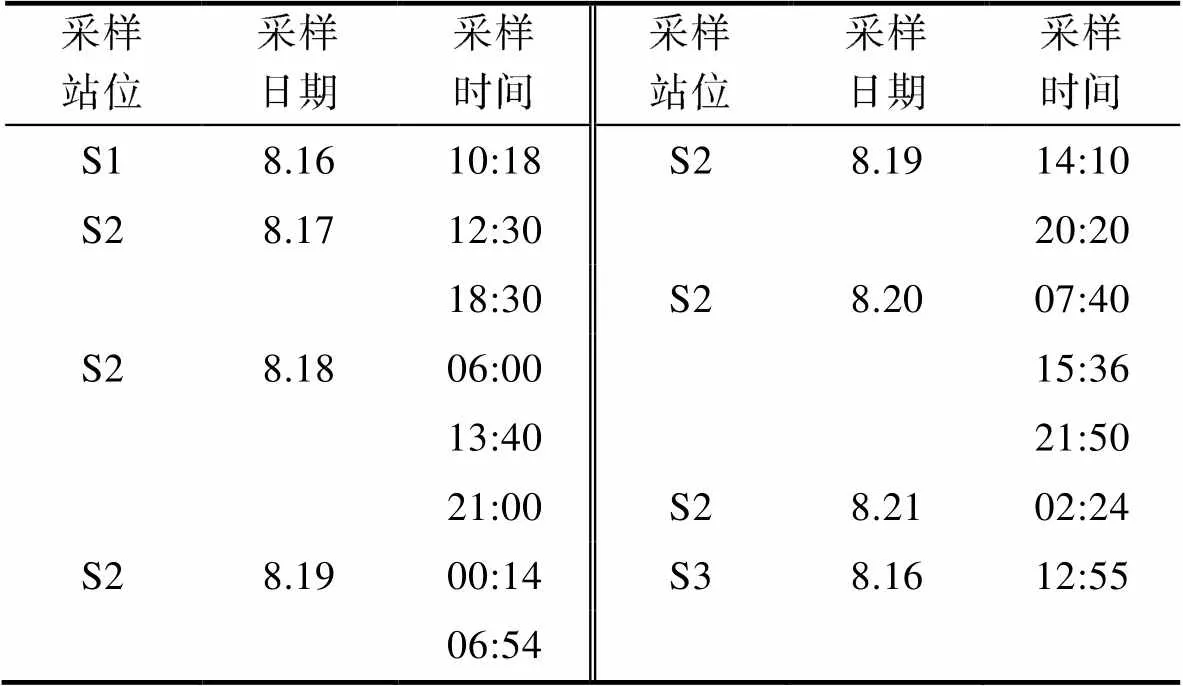
Tab.1 Date and time of sampling at each station
在50 kPa压强下, 选取500 mL预过滤水样在现场经0.7 μm玻璃纤维滤膜(GF/F)过滤。所得滤膜避光保存于-20 °C冰箱中, 用于总叶绿素浓度测量。同时, 保留100 mL经GF/F滤膜过滤后海水于聚乙烯瓶中冷冻保存于-20 °C, 用于营养盐浓度测量。实验室内, 在避光条件下将滤膜在90%的丙酮中萃取24 h, 4 000 r/min, 离心10 min后采用荧光法测定总叶绿素(Tchl) 浓度(Dong, 2018)。硅酸盐(Si)浓度、硝酸盐和亚硝酸盐(N+N)及可溶活性磷酸盐(SRP)利用SEAL AA3型流动注射分析仪在实验室内测定, 其检出限分别为0.02、0.02、0.03 μmol/L(Li, 2021)。
对于微微型浮游生物(pico-, <2 μm), 现场取50 mL预过滤水样经20 μm筛绢再过滤后, 保存2 mL滤液于冻存管中, 用终浓度为0.5%的多聚甲醛固定, 避光放置15 min后, 保存于液氮中。原绿球藻(, Pro)、聚球藻(, Syn)和微微型真核生物(picoeukaryotes, Euk) 的丰度在实验室内利用流式细胞仪(Beckman Coulter’s cytoflex S) 进行测量(周卫文等, 2020)。
在此次调查中仅采集表层微型浮游生物(nano-, 5—20 μm) 及小型浮游生物(micro-, 20—200 μm) 样品。其采集与测量过程参照San Martin等(2006)的方法, 将表层海水在现场经终浓度为1%的酸性鲁哥试剂固定后, 在实验室内由流式细胞摄像系统(FlowCAM)测量, 以获取其粒径数据。测量采用4倍物镜, 在自动触发模式下进行。每次测量结束后, 将无效图像从数据库中删除(气泡、重复图像等)(García-Muñoz, 2014)。
本文中所使用潮汐数据选取距离采样站位最近的珠海站于调查期间内的潮汐预报数据, 潮高基准面在平均海平面下148 cm (国家海洋信息中心, 2016)。
1.2 数据处理与标准化粒径谱构建
以由等效球直径(ESD, μm)计算得出的颗粒体积为尺度划分粒径级, 其值经由FlowCAM计算并导出, 并校正了由鲁哥试剂固定而导致的细胞收缩(Montagnes, 1994)。
粒径间隔的划分和标准化粒径谱的构建依据以下公式进行:
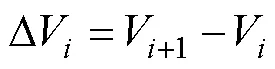
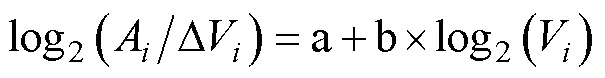
其中,V表示不同粒径级(μm3),A表示对应粒径级间隔(∆V)内颗粒的总体积(μm3/mL)(Blanco, 1994)。斜率(a)和截距(b)为标准化粒径谱线经线性回归后得到的常数。
1.3 统计及分析方法
本文中采样站位图使用软件Ocean Data View (ODV) v.4绘制, 其余用图使用软件Origin Pro 2018绘制。利用软件SPSS v.22.0 (SPSS) 进行相关数据统计分析。由于S1、S3站位样品采集于低低潮位时, 所以本文选取S2站位低低潮位时各变量均值与其余站位进行对比分析。
2 结果
2.1 调查水域环境特征
由潮汐曲线(图3)可知, 2017年8月17日至21日期间黄茅海水域的潮汐变化较为规律。在一个太阴日中呈现两次高潮和两次低潮, 且相邻两次高潮位潮高相差较大, 属于不正规半日潮混合潮特征。在观测期间内其潮高最大值为288 cm, 出现在21日8时13分。潮高最小值为20 cm, 出现在21日16时23分。
调查期间, 由S1至S3站位, 黄茅海水域表层温度略有上升(由30.80 °C上升至31.11 °C), 底层温度在S3站位最低, 为24.42 °C (图2a)。表层盐度由河口至外海逐渐升高(0.98—10.96), 底层盐度在S3站位最高, 为33.63 ‰ (图2b)。其中, S2站位水体表层温度与底层温度无显著性差异(=1.39,=26,>0.05) 。表层温度平均值为30.91 °C, 无显著周期性变化规律, 随时间呈现升温趋势(图3a)。底层温度平均值为30.45 °C, 在高高潮位时温度降低, 在其余潮位时温度较高, 随时间呈现升温趋势(图3a)。S2站位水体表层盐度显著低于底层盐度 (=-3.73,=26,<0.01) 。S2站位表层盐度平均值为5.82, 在低低潮位及高低潮位盐度值较低, 且与潮高呈显著正相关关系 (=0.76,=13,<0.01, 表2), 表明潮高较高时表层盐度较高。底层盐度平均值为13.55, 有明显的周期性变化规律, 与潮高有显著的正相关关系(=0.77,=13,<0.01, 表2) 。在一个太阴日内, 底层盐度在低低潮位时有极小值, 随后逐渐增大, 在高低潮位时无显著减小(图3b)。

图2 温度 (a)、盐度 (b)、硅酸盐 (Si, c)、硝酸盐和亚硝酸盐 (N+N, d)、可溶活性磷酸盐 (SRP, e)、总叶绿素a (Tchl a, f)、聚球藻 (Syn, g)、微微型真核生物 (Euk, h) 浓度、标准化粒径谱 (NBSS) 斜率以及截距 (i) 的水平分布曲线
注: S2站的数据为最低潮位时各变量的平均值
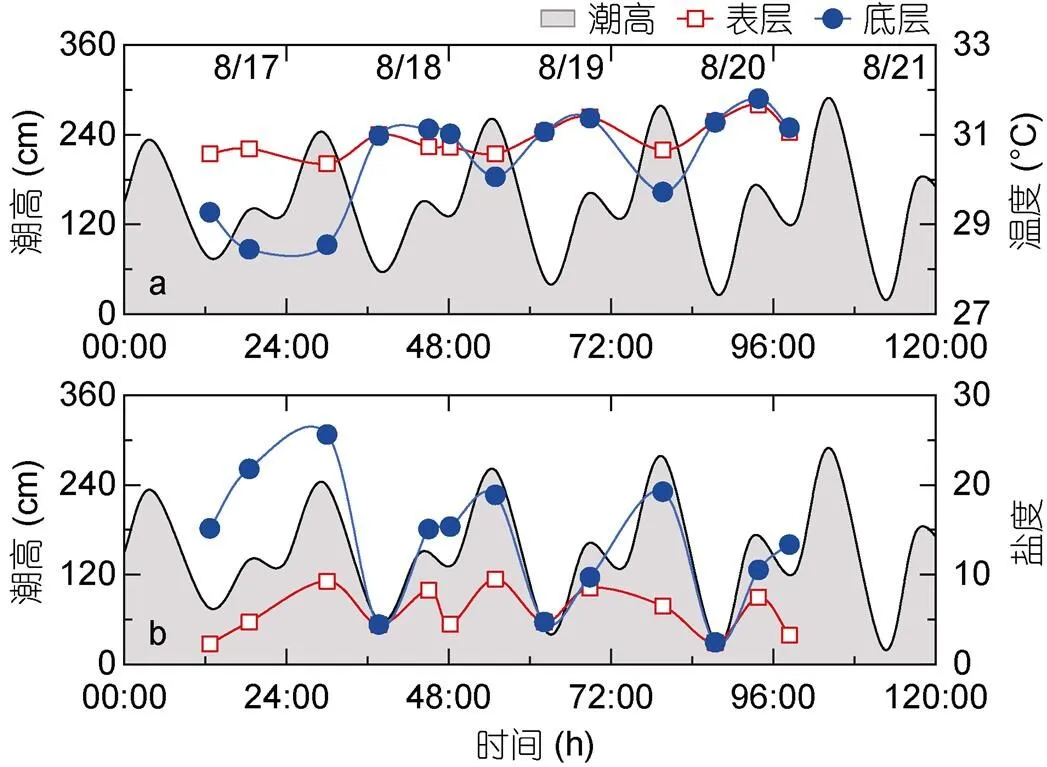
图3 温度(a)、盐度(b)及潮高随时间变化曲线
注: 采样日期(月/日)标注在图片顶部
调查期间, 硅酸盐(Si)浓度范围为18.22— 68.63 μmol/L, 硝酸盐及亚硝酸盐(N+N)浓度范围为20.74—94.61 μmol/L, 可溶活性磷酸盐(SRP)浓度范围为0.12—0.90 μmol/L, 这与前人的研究结果一致(黄向青等, 2012; 张伟等, 2015)。由S1至S3站位, Si、N+N以及SRP在表层和底层均呈现下降趋势, 在S3站位时浓度最低(图2c—e)。如图4所示, S2站位表层Si浓度平均值为51.49 μmol/L, 与底层浓度(43.38 μmol/L)无显著性差异(=1.91,=26,>0.05)。其中, 底层Si与潮高呈显著负相关(=-0.70,=13,<0.01, 表2), 在潮高较高时其浓度较低(图4a)。表层N+N浓度平均值为70.12 μmol/L, 显著高于底层N+N浓度 (51.15 μmol/L,=3.64,=26,<0.01), 底层N+N浓度与潮高呈显著负相关 (=-0.62,=13,<0.01, 表2), 在潮高较高时, N+N浓度较低 (图4b)。此外, 表层SRP浓度平均值为0.59 μmol/L, 与底层浓度(0.43 μmol/L)无显著性差异(=1.71,=26,>0.05), 底层SRP随潮高增加而显著线性减小(=-0.62,=13,<0.01, 表2), 在低低潮位时有极大值, 而在其余潮位时浓度减小(图4c)。
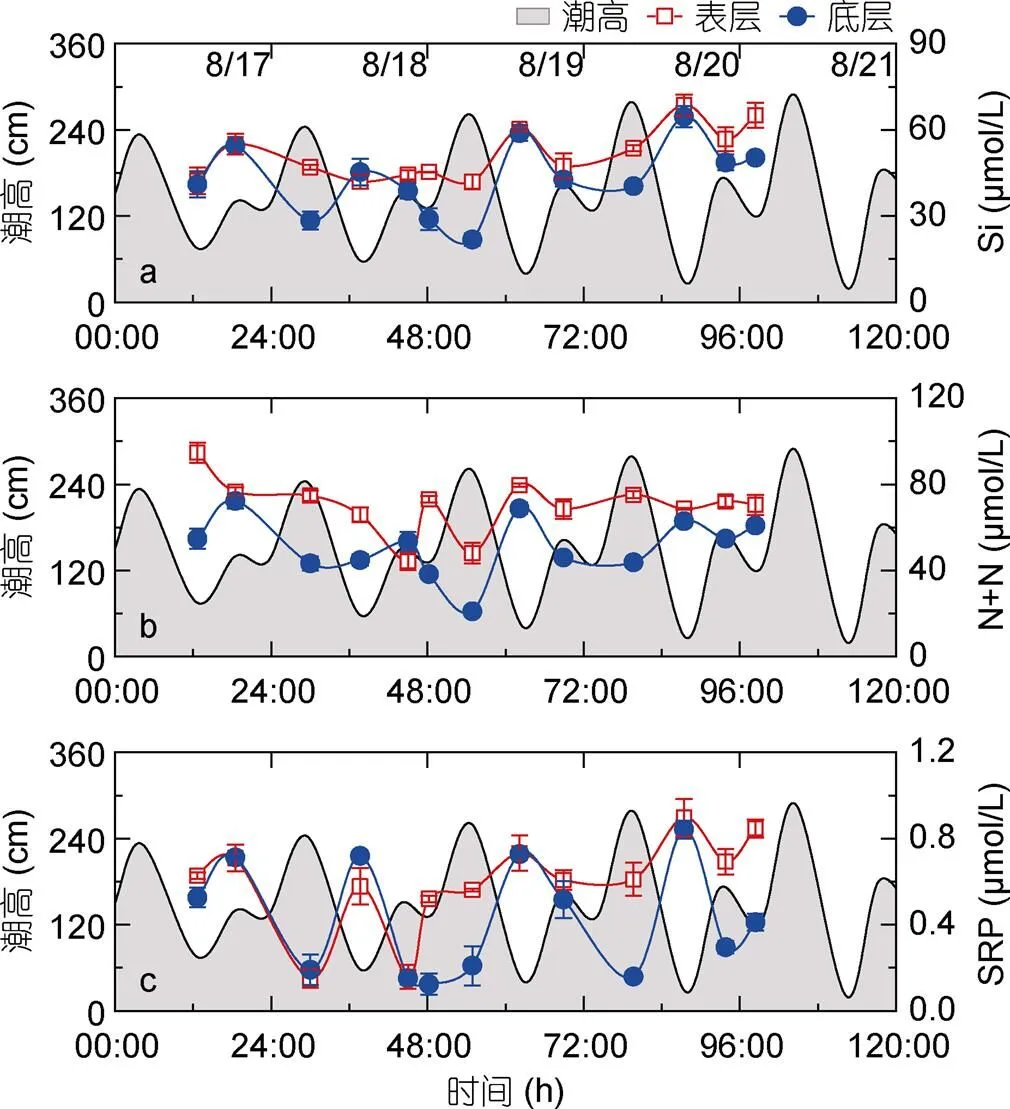
图4 硅酸盐 (Si)、硝酸盐和亚硝酸盐 (N+N)、可溶活性磷酸盐 (SRP) 浓度及潮高随时间变化曲线
2.2 叶绿素及微微型浮游生物群落结构的时空分布
由S1至S3站位, 表层与底层总叶绿素均逐渐增大(图2f), 在S3站位时浓度最高, 分别为19.34 μmol/L (表层)和18.88 μmol/L(底层)。其中, S2站位表层总叶绿素浓度在观测期内变化范围为2.16—8.31 μg/L, 平均浓度为4.87 μg/L, 随时间呈现较为明显的下降趋势, 无显著的周期性变化规律(图5a)。底层总叶绿素浓度显著高于表层总叶绿素浓度(=-2.73,=26,>0.05), 其变化范围为4.02—8.04 μg/L,平均浓度为4.87 μg/L, 与潮高呈显著的正相关关系(=0.57,=13,<0.05, 表2), 即潮高较高时, 底层叶绿素浓度较高(图5a)。
原绿球藻(Pro)在此次调查所采集的各个样品中均未被检出。表层聚球藻(Syn)浓度在S1站位最高, 为15.09×103cells/mL, 底层Syn浓度在S3站位最高, 为95.94×103cells/mL(图2g)。在S2站位(图5b), 聚球藻(Syn)浓度表层显著低于底层(=-2.73,=26,<0.05), 表层Syn浓度除极大值173.2×103cells/mL(8月18日, 06:00)外, 在低低潮位时浓度较低, 其余时间浓度小幅上升,平均浓度为28.62×103cells/mL。底层Syn浓度变化较为剧烈, 呈周期性变化, 平均浓度为99.11×103cells/mL, 在低低潮位时浓度较低, 在其他时间则浓度上升。表层微微型真核生物(Euk)由S1 (14.42×103cells/mL) 至S3 (4.2×103cells/mL) 站位逐渐降低, 底层Euk在S3站位浓度最高, 为28.41×103cells/mL(图2h)。在S2站位(图5c), 表层Euk平均浓度为5.97×103cells/mL, 与底层浓度无显著差异(=-1.43,=26,>0.05)。
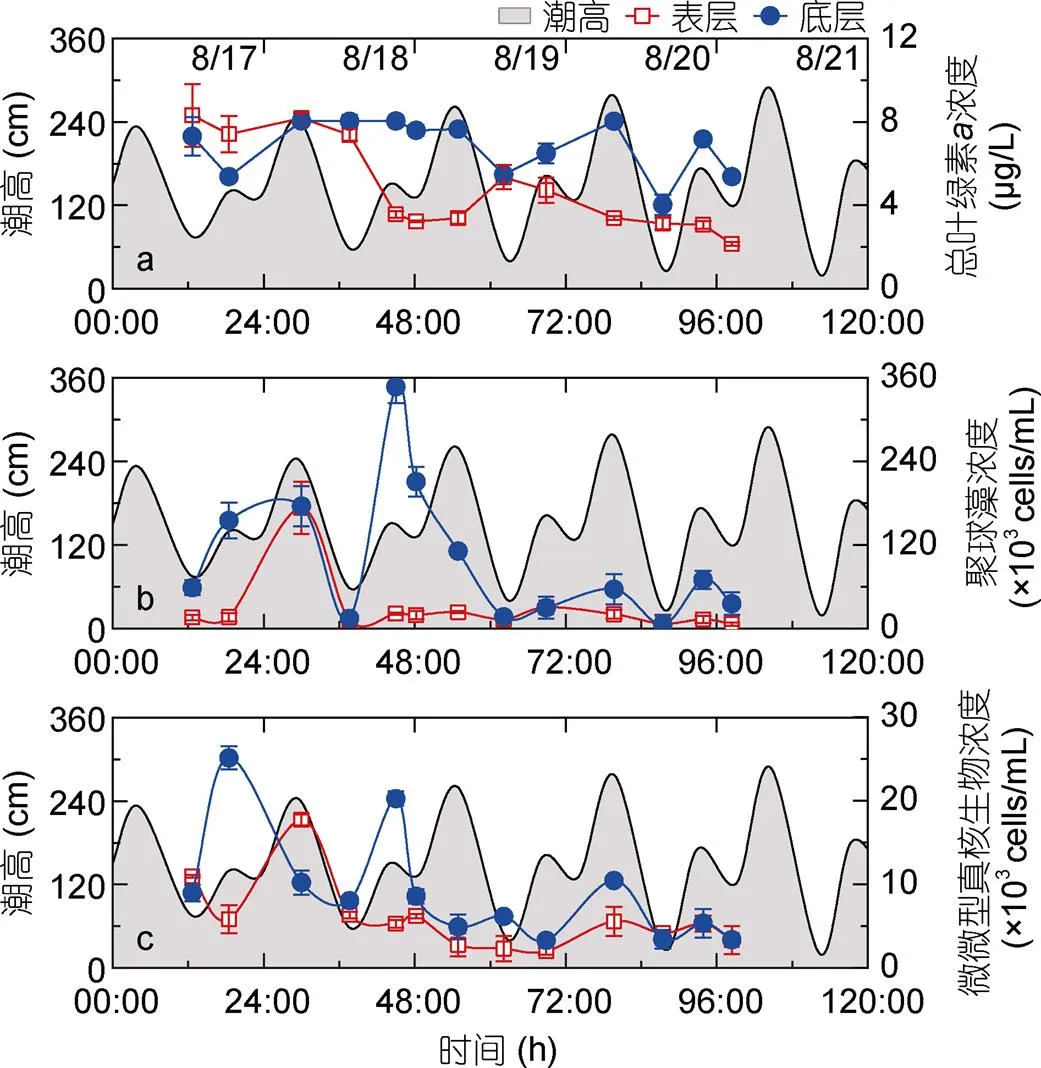
图5 总叶绿素(Tchl a)、聚球藻(Syn)、微微型真核生物(Euk)浓度及潮高随时间变化曲线
2.3 标准化粒径谱参数的时空分布
由S1至S3站位, S1与S2站位标准化粒径谱斜率无明显差异, S3站位斜率值最高(-0.75, 图2i), 表明S3站位大粒径生物相对占比最高。标准化粒径谱截距在S2站位最大(22.18, 图2i), 在S3站位截距值最小(18.24, 图2i), 表明相比较于其他站位, S2站位浮游生物总生物量相对较高。
此外, 根据标准化粒径谱参数分布折线图可知(图6), S2站位粒径谱斜率及截距随着时间的推移呈现周期性变化。一个太阴日内, 低低潮位时粒径谱斜率较小, 而后随着潮位的增高而逐渐增大, 且与潮高呈显著的正相关关系(图6a,=0.62,=13,<0.05), 表明在低低潮位时浮游生物群落中小粒径生物占比较高, 潮高较高时, 大粒径生物占比逐渐增大。此外, 标准化粒径谱截距也随时间呈现周期性变化(图6b)。在低低潮位时粒径谱截距有极大值, 而随着潮高的降低减小, 且与潮高呈显著负相关关系(=-0.69,=13,<0.01)。这表明在低低潮位时, 浮游生物总生物量较高, 而随着潮位的增加浮游生物总生物量逐渐降低。
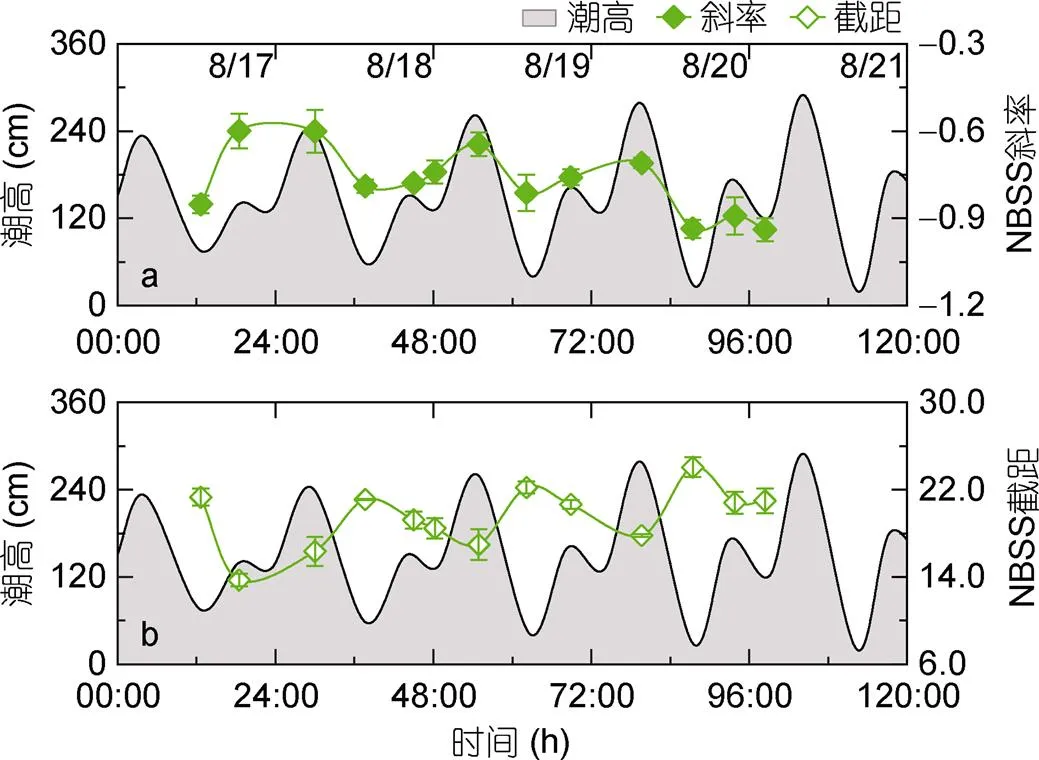
图6 标准化粒径谱(NBSS) 斜率、截距及潮高随时间变化曲线
2.4 浮游生物与环境因子的关系
由表2可知, S2站位表层水体总叶绿素与温度、盐度及营养盐等无显著相关性。底层总叶绿素浓度与表层Si (=-0.81,=13,<0.01)、N+N (=-0.70,=13,<0.01)以及SRP (=-0.69,=13,<0.72)呈现显著的负相关关系, 表明营养盐浓度越高, 总叶绿素浓度越低。表层Syn与SRP有显著的负相关关系(=-0.66,=13,<0.05), 表明随SRP浓度升高, Syn浓度降低。底层Syn也与底层SRP有显著负相关关系(=-0.62,=13,<0.05)。表层Euk与温度有显著的负相关关系(=-0.58,=13,<0.05), 表明温度越高则其浓度越小。其与表层SRP也有显著负相关关系(=-0.58,=13,<0.05), 表明表层SRP的增加并未促进表层Euk的生长。底层Euk与温度、盐度及营养盐等无显著相关性。
标准化粒径谱斜率与表层温度有显著的负相关关系(=-0.67,=13,<0.05), 表明随着温度的增加, 粒径谱斜率降低, 小粒径生物占比增加。其也与表层盐度呈显著的正相关关系(=0.57,=13,<0.05), 表明随着盐度的增加, 粒径谱斜率逐渐增大, 大粒径生物占比逐渐增大。此外, 表层斜率还和表层SRP浓度呈现显著的负相关关系(=-0.56,=13,<0.05), 表明随着SRP的增加, 粒径谱斜率逐渐减小, 小粒径生物占比增加。标准化粒径谱截距与表层温度呈显著的正相关关系(=0.63,=13,<0.05), 表明随着温度的增大, 浮游生物总生物量增高。
表2 S2站位各变量的Pearson相关分析结果
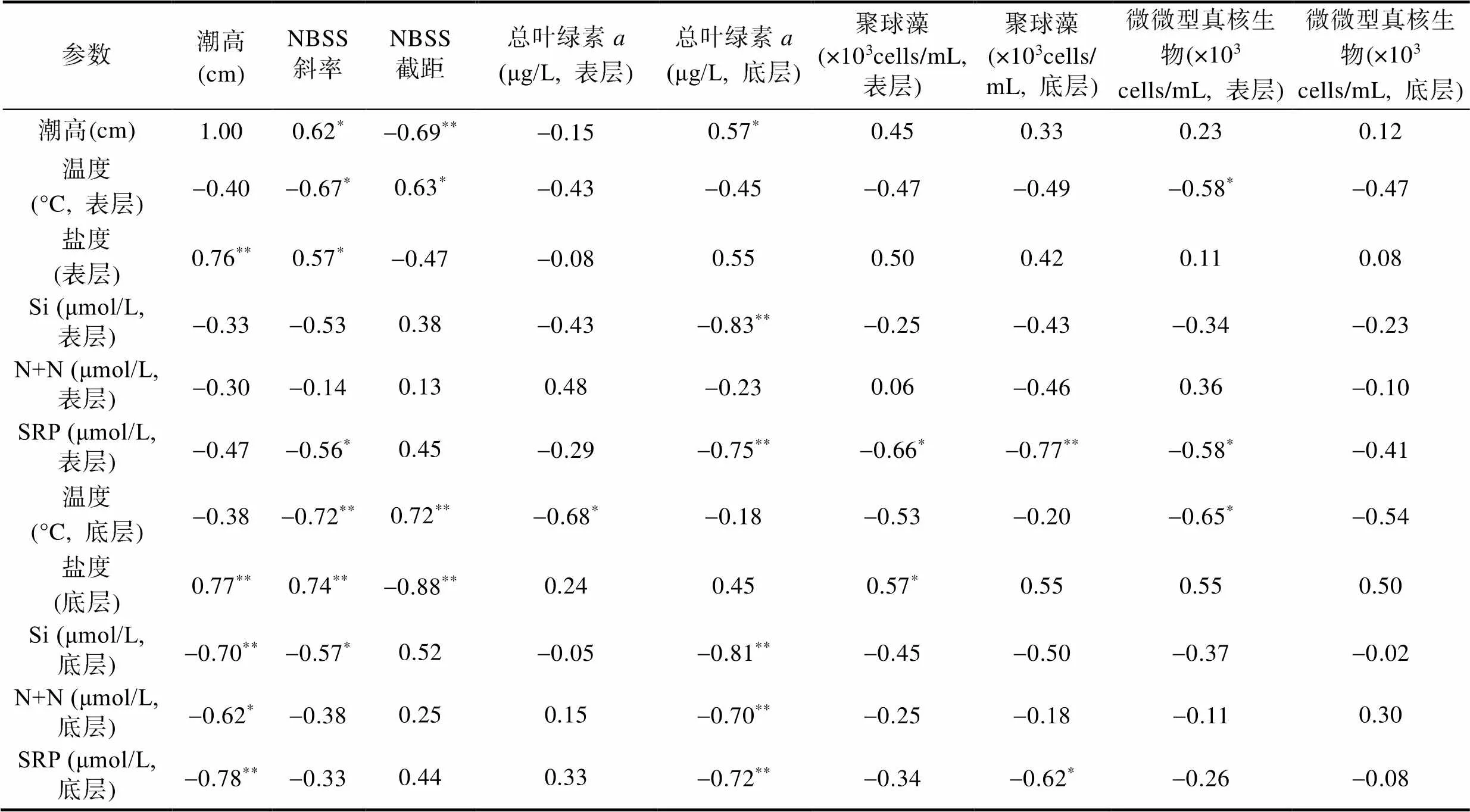
Tab.2 Results of Pearson correlation analysis between different variables at Station S2
注: *表示相关系数在0.05水平上显著, **表示相关系数在0.01水平上显著。
3 讨论
3.1 黄茅海潮汐特征及其对环境因子的影响
黄茅海河口位于珠江口西侧, 顶端有来自崖门和虎跳门的水体汇入其中(黄毅等, 2020)。调查期间, 黄茅海潮高随时间呈周期性涨落, 在一个太阴日内, 经历两次高潮和两次低潮, 且相邻两次高潮潮差较大(图3a), 属于不正规半日潮混合潮(杨名名等, 2016; 黄毅等, 2020)。
有研究指出, 黄茅海夏季的海水呈现高度成层或者似层状, 盐水楔随潮水涨落进退于栏门浅滩与赤鼻岛之间(黄方等, 1994)。本文中, S1与S2站位处于黄茅海夏季盐水楔涨落范围内(图1)。调查期间, 黄茅海水域的表层温度和盐度与底层差异较大, 呈现出较为明显的分层特征(图2a, 2b)。由河口内侧至外侧, 温度略有降低, 而盐度逐渐增大。这与Jia等(2019)在2011年夏季对黄茅海的调查结果是一致的, 主要是受到河口径流输入的影响。黄毅等(2020)的研究中曾指出, 栏门沙浅滩海域属于潮流上溯流与径流下泄流的交汇区域, 水动力条件相对较弱, 其以北海域受到径流作用的影响要强于潮汐作用。S2站位邻近于黄茅岛, 属于拦门沙浅滩以北海域。在调查期间, S2站位表层盐度与底层盐度则随潮水涨落有显著的周期性变化。在低低潮位时, 表底层盐度基本相同。相比较于表层盐度, 底层盐度随潮水上涨的增幅更为剧烈(图3b), 这表明S2站位底层受到外海高盐度海水上溯的影响更为强烈。
黄茅海水域营养盐的空间分布较为规律, 即其浓度由河口至外海呈现下降趋势(图2), 这也与夏季长江口营养盐的分布趋势是一致的(方涛等, 2008)。黄茅海海域的营养盐主要来自于陆源口门的排放, 外海水稀释作用的加强是导致营养盐浓度逐渐降低的原因(张伟等, 2015)。同时, 由河口至外海, 径流作用的影响逐渐降低也会导致营养盐浓度逐渐降低(Jia, 2019)。在S2站位, 表层的营养盐浓度普遍高于底层营养盐浓度(图4)。这是由于在雨季河口径流输入的水体与随潮汐涨落的盐楔间会形成强烈的温度及盐度跃层, 其存在会阻碍河流径流输入水体与上溯盐楔间物质的垂直交换(Cui, 2019)。尽管S2站位表层营养盐浓度随时间有波动, 但与潮高无显著相关性。表明表层营养盐浓度变化可能受到潮汐作用较弱。而根据潮高与底层营养盐的线性相关结果可知, 在涨潮时底层营养盐浓度显著降低(图4)。涨潮时, 来自外海的低营养盐海水随潮汐上溯使得底层营养盐浓度降低, 即海水上溯是影响底层营养盐浓度的主要原因(方涛等, 2008)。
3.2 黄茅海浮游生物的空间分布
调查结果显示, 黄茅海河口叶绿素表层与底层无明显差异, 且浓度整体较高(>2.16 μg/L)。其在S3站位最高, 达到19.34 μg/L (图2), 这可能由于受到外海赤潮的影响所致。如孙越峰等(2020)的研究所示, 辽河口夏季叶绿素在近河口处浓度较低, 在河口外侧浓度较高是由于受到河口外侧赤潮的影响。此外, 在高营养盐条件下, 较为浑浊的水体和较低的光照条件也会限制浮游植物的生长(Cloern, 1999)。黄茅海河口内侧尽管营养盐浓度较高, 其总叶绿素浓度却较低。这可能是由于黄茅海河口夏季受到径流较强的影响, 其上游悬浮颗粒较多, 较高的浊度影响了光照而限制了浮游植物的生长所导致(Jia, 2019)。当总叶绿素浓度较高时, 微微型浮游植物的占比较小, 而小型浮游植物的比例会随着总叶绿素浓度的增高而增大(Sin, 2000; Goericke, 2011)。小型浮游植物在河口外侧占比的增加可能是导致在S3站位标准化粒径谱斜率最高的原因。这也与前人的调查结果相一致, 即夏季在珠江口, 小型浮游植物在河口下游占据优势, 而在河口上游则为微微型浮游植物占比较高(黄邦钦等, 2005)。
盐度是影响微微型浮游生物分布的重要因素(Mitbavkar, 2012)。有研究表明, 水体盐度大于32.6的环境更利于原绿球藻(Pro)的生长, 且Pro在低营养盐水体中更为丰富, 夏季长江口Pro由于受到高营养盐环境的限制而未被观测到(Li, 2012)。黄茅海河口各站位均未观测到Pro的原因可能是由于较低的盐度以及较高的营养盐条件下, Pro的生长受到限制所导致。此外, 光照也是影响河口羽流区微微型浮游生物分布格局的重要条件(Jiao, 2002)。根据结果显示, 黄茅海各站位聚球藻(Syn)的垂向丰度差异较大, 在底层丰度较高(图2g)。这可能是由于夏季水体表层较强的光照抑制了Syn的生长, 而导致表层丰度较低(杨琳等, 2012)。对于微微型真核生物, 其群落组成复杂, 空间分布格局无法简单归因于物理或化学因素带来的影响(Jiao, 2002)。而结果中, 微微型真核生物(Euk)并未观测到明显的垂向分布差异(图2h), 这可能是由于所调查站位水深较浅所导致(杨琳等, 2012)。
3.3 潮汐对浮游生物及其粒径结构的影响
浮游生物的生长和粒径结构会受到营养盐、温度以及光照等因素的影响(Cloern, 1999; Dong, 2018)。调查期间, 底层叶绿素浓度与潮高呈显著的正相关关系。在涨潮时, 底层叶绿素浓度的上升可能是由于潮汐涨落的物理过程及所带来的化学变化共同所导致。S2站位营养盐浓度整体较高, 氮磷比显著高于Redfield比值(16:1)。S2站位底层总叶绿素浓度与营养盐呈显著的负相关关系, 高浓度的营养盐并未促进浮游植物的生长。孙越峰等(2020)在对辽河口海域的调查研究中也发现, 叶绿素浓度在夏季时与硝酸盐、磷酸盐、硅酸盐浓度呈显著负相关。在河口区域的高营养盐环境下, 可利用光强是影响浮游植物生长的重要因素(Pennock, 1985; 孙越峰等, 2020)。潮流作用引起的沉积物和底栖生物等的再悬浮, 以及由河口径流输入的悬浮颗粒物会导致水体浊度增大(Cloern, 1987, 1996), 可利用光强的降低可能是导致S2站位底层浮游植物的生长受到限制的原因。此外, 在潮汐作用下上溯的高叶绿素浓度的外海水的直接输入也可能是造成S2站位底层叶绿素浓度在涨潮时增大的原因之一。同时, 在河口区底栖微藻受到潮汐作用再悬浮进入底层水体(De Jorge, 1995), 也会造成浮游植物生物量变化。
有研究显示, 潮汐对浮游生物的影响与粒径相关(Sin, 2015)。从微微型浮游生物(Pico-, <2 μm) 至小型浮游生物 (Micro-, >20 μm), 其与潮高的关系随粒径增大而增强。在本文中, S2站位除Syn与SRP有显著负相关性以及Euk在表层与温度和SRP呈显著负相关外, Syn和Euk丰度在表层与底层与其与环境因子间并无显著相关性。这表明潮汐过程对Pico-生物的影响较小(Sin, 2015)。根据结果显示, S2站位标准化粒径谱斜率与潮高以及海水盐度呈现显著的正相关关系(表2)。黄茅海河口外侧盐度以及总叶绿素浓度较高, 且大粒径生物占比最高(图2)。在涨潮过程中, 河口外侧高盐度海水上溯, 大粒径生物随上溯海水的输入可能是影响S2站位表层浮游生物的粒径结构的原因之一。同时, 温度也是影响浮游生物粒径结构的重要因素(Morán, 2010)。温度较高时, 微微型浮游植物生长率以及微型浮游动物对浮游植物的摄食率较高(Dong, 2018)。由S2站位标准化粒径谱斜率与温度的显著负相关关系可知(表2), 小粒径生物所占比例随水体温度的增高而增大, 表明温度可能也是影响该位置浮游生物粒径结构的原因之一。此外, 有研究表明, 在光限制或者营养盐限制的条件下, 浮游生物群落通常以小粒径生物为主(Chisholm, 1992), 而在光照和营养盐充足的条件下, 大粒径浮游植物拥有更高的光合作用效率(Cermeño, 2005)。如: 硅藻不容易受到光抑制的作用, 能够更好地适应近岸海域光照强度的快速变化(Key, 2010)。夏季黄茅海河口表层光照充足, 且营养盐丰富。涨潮时, 高盐度海水上溯流与河口径流下泄流交汇而形成盐楔, 导致S2站位水体分层较为明显, 水体底部悬浮物质向表层的输送受到阻碍(黄方等, 1994; Cui, 2019)。S2站位表层高营养盐和光限制的环境下, 大粒径浮游生物生长占优势也可能是导致该站位大粒径浮游生物在涨潮时占比增多的原因。而落潮时, 盐楔向河口外侧退去, S2站位表层与底层的层化现象减弱, 底部悬浮颗粒物的输入会导致水体浊度增加(De Jorge, 1995; Cloern, 1996)。且较小粒径的物质由于密度较低, 更容易被悬浮(Wang, 2013)。因此, 低低潮位时可利用光的减弱以及水体底部小粒径底栖微藻等的输入可能是造成S2站位在落潮时小粒径生物占比增高的原因。
4 结论
夏季, 黄茅海河口区为不正规半日潮混合潮, 浮游生物及其粒径结构的分布受到潮汐影响显著。河口内侧受径流影响较强, 营养盐浓度较高。由河口至外海, 总叶绿素浓度逐渐增大, 且大粒径生物占比在河口外侧最大。潮汐过程对底层水体影响较为明显, 并造成盐度及营养盐的改变。其引起的底层再悬浮过程, 以及由海水上溯所引起的底层营养盐浓度和光照强度的变化影响了浮游生物的粒径结构和分布情况。潮汐对不同粒径的浮游生物影响不同, 对微微型浮游生物影响较小, 对较大粒径浮游生物的影响较为明显, 涨潮时表层标准化粒径谱斜率增大, 较大粒径浮游生物占比增加。
致谢 感谢中山大学海洋科学学院吴加学老师及其课题组成员为本研究中的样品采集工作提供的大力支持和帮助。
方 涛, 李道季, 孔定江等, 2008. 夏秋季长江口及毗邻海域N、P营养盐分布及其潮汐变化. 海洋环境科学, 27(5): 437—442
孙越峰, 秦艳杰, 李洪波等, 2020. 辽河口海域叶绿素的时空分布特征及其影响因素. 环境保护科学, 46(2): 44—48
张 伟, 孙 健, 聂红涛等, 2015. 珠江口及毗邻海域营养盐对浮游植物生长的影响. 生态学报, 35(12): 4034—4044
杨 琳, 汪 岷, 刘冠群等, 2012. 胶州湾微微型浮游植物丰度及其与环境因子的相关性分析. 海洋与湖沼, 43(5): 967—975
杨名名, 吴加学, 张乾江等, 2016. 珠江黄茅海河口洪季侧向余环流与泥沙输移. 海洋学报, 38(1): 31—45
周卫文, 李 芊, 葛在名等, 2020. 珠江口羽流锋浮游植物群落对大气沉降的生态响应. 热带海洋学报, 39(4): 50—60
周争桥, 2019. 基于实测资料的珠江口海域风和潮汐特征分析. 海洋湖沼通报, (1): 47—53
国家海洋信息中心, 2016. 潮汐表(2017第3册台湾海峡至北部湾). 北京: 海洋出版社, 251
施玉珍, 张才学, 张际标等, 2017. 水东湾海域浮游植物潮汐分布特征及其与环境因子的关系. 生态学报, 37(18): 5981—5992
郭沛涌, 沈焕庭, 刘阿成等, 2003. 长江河口浮游动物的种类组成、群落结构及多样性. 生态学报, 23(5): 892—900
高 原, 赖子尼, 庞世勋等, 2010. 黄茅海河口虎跳门和崖门浮游动物群落的比较. 生态科学, 29(2): 121—126
黄 方, 叶春池, 温学良等, 1994. 黄茅海盐度特征及其盐水楔活动范围. 海洋通报, 13(2): 33—39
黄 毅, 吴 洁, 殷征欣等, 2020. 珠江口黄茅海底质沉积中介形类的生态类型及其分布特征. 海洋开发与管理, 37(6): 89—94
黄向青, 林进清, 张顺枝等, 2012. 珠江口海水化学要素分布和水质特征. 海洋湖沼通报, (3): 162—174
黄邦钦, 洪华生, 柯 林等, 2005. 珠江口分粒级叶绿素和初级生产力研究. 海洋学报, 27(6): 180—186
Blanco J M, Echevarría F, García C M, 1994. Dealing with size-spectra: some conceptual and mathematical problems. Scientia Marina, 58(1—2): 17—29
Cermeño P, Estévez-Blanco P, Marañón E, 2005. Maximum photosynthetic efficiency of size-fractionated phytoplankton assessed by14C uptake and fast repetition rate fluorometry. Limnology and Oceanography, 50(5): 1438—1446
Chisholm S W, 1992. Phytoplankton size. In: Falkowski P G, Woodhead A D, Vivirito K eds. Primary Productivity and Biogeochemical Cycles in the Sea. Environmental Science Research. Boston: Springer, 213—237
Chisholm S W, 2000. Stirring times in the Southern Ocean. Nature, 407(6805): 685—686
Cloern J E, 1987. Turbidity as a control on phytoplankton biomass and productivity in estuaries. Continental Shelf Research, 7(11—12): 1367—1381
Cloern J E, 1996. Phytoplankton bloom dynamics in coastal ecosystems: a review with some general lessons from sustained investigation of San Francisco Bay, California. Reviews of Geophysics, 34(2): 127—168
Cloern J E, 1999. The relative importance of light and nutrient limitation of phytoplankton growth: a simple index of coastal ecosystem sensitivity to nutrient enrichment. Aquatic Ecology, 33(1): 3—15
Cui Y S, Wu J X, Ren J, 2019. Physical dynamics structures and oxygen budget of summer hypoxia in the Pearl River Estuary. Limnology and Oceanography, 64(1): 131—148
De Jorge V N, Van Beusekom J E E, 1995. Wind-and tide-induced resuspension of sediment and microphytobenthos from tidal flats in the Ems estuary. Limnology and Oceanography, 40(4): 776—778
Dong Y, Li Q P, Liu Z J, 2018. Size-dependent phytoplankton growth and grazing in the northern South China Sea. Marine Ecology Progress Series, 599: 35—47
García-Muñoz C, García C M, Lubián L M, 2014. Metabolic state along a summer north-south transect near the Antarctic Peninsula: a size spectra approach. Journal of Plankton Research, 36(4): 1074—1091
Goericke R, 2011. The size structure of marine phytoplankton- What are the rules? California Cooperative Oceanic Fisheries Investigations Reports, 52: 198—204
Jia H L, Chen M R, Su W, 2019. Structural characteristics and associated factors influencing phytoplankton abundance and species composition in Huangmaohai Bay, Pearl River Estuary. Journal of Coastal Research, 35(1): 72—81
Jiao N Z, Yang Y H, Koshikawa H, 2002. Influence of hydrographic conditions on picoplankton distribution in the East China Sea. Aquatic Microbial Ecology, 30(1): 37—48
Key T, McCarthy A, Campbell D A, 2010. Cell size trade-offs govern light exploitation strategies in marine phytoplankton. Environmental Microbiology, 12(1): 95—104
Li Q P, Ge Z M, Liu Z J, 2021. Transparent exopolymer particles in a coastal frontal zone of the Northern South China Sea and the associated biogeochemical implications. Journal of Geophysical Research: Biogeosciences, 126(2): e2020JG005893
Li Q P, Zhou W W, Chen Y C, 2018. Phytoplankton response to a plume front in the northern South China Sea. Biogeosciences, 15(8): 2551—2563
Li Y, Li D J, 2012. Spatial distributions of picoplankton and viruses in the Changjiang estuary and its Adjacent Sea area during Summer. Journal of Marine Sciences, 2012: 465168
Liu Z J, Li Q P, Ge Z M,, 2021. Variability of plankton size distribution and controlling factors across a coastal frontal zone. Progress in Oceanography, 197: 102665
Marañón E, Cermeño P, Latasa M, 2012. Temperature, resources, and phytoplankton size structure in the ocean. Limnology and Oceanography, 57(5): 1266—1278
Marañón E, Cermeño P, Rodríguez J, 2007. Scaling of phytoplankton photosynthesis and cell size in the ocean. Limnology and Oceanography, 52(5): 2190—2198
Mitbavkar S, Rajaneesh K M, Anil A C, 2012. Picophytoplankton community in a tropical estuary: detection of-like populations. Estuarine, Coastal and Shelf Science, 107: 159—164
Montagnes D J S, Berges J A, Harrison P J, 1994. Estimating carbon, nitrogen, protein, and chlorophyllfrom volume in marine phytoplankton. Limnology and Oceanography, 39(5): 1044—1060
Morán X A G, López-Urrutia Á, Calvo-Díaz A, 2010. Increasing importance of small phytoplankton in a warmer ocean. Global Change Biology, 16(3): 1137—1144, doi: 10. 1111/j.1365-2486.2009.01960.x
Pennock J R, 1985. Chlorophyll distributions in the Delaware estuary: regulation by light-limitation. Estuarine, Coastal and Shelf Science, 21(5): 711—725
Quinones R A, Platt T, Rodríguez J, 2003. Patterns of biomass-size spectra from oligotrophic waters of the northwest Atlantic. Progress in Oceanography, 57(3—4): 405—427
Rodríguez J, Tintoré J, Allen J T, 2001. Mesoscale vertical motion and the size structure of phytoplankton in the ocean. Nature, 410(6826): 360—363
San Martin E, Harris R P, Irigoien X, 2006. Latitudinal variation in plankton size spectra in the Atlantic Ocean. Deep Sea Research Part II: Topical Studies in Oceanography, 53(14—16): 1560—1572
Sin Y, Jeong B, Park C, 2015. Semidiurnal dynamics of phytoplankton size structure and taxonomic composition in a macrotidal temperate estuary. Estuaries and Coasts, 38(2): 546—557
Sin Y, Wetzel R L, Anderson I C, 2000. Seasonal variations of size-fractionated phytoplankton along the salinity gradient in the York River estuary, Virginia (USA). Journal of Plankton Research, 22(10): 1945—1960
Wang Y P, Voulgaris G, Li Y, 2013. Sediment resuspension, flocculation, and settling in a macrotidal estuary. Journal of Geophysical Research: Oceans, 118(10): 5591—5608
Yvon-Durocher G, Montoya J M, Trimmer, M, 2011. Warming alters the size spectrum and shifts the distribution of biomass in freshwater ecosystems. Global Change Biology, 17(4): 1681—1694
Zhang W J, Sun X X, Zheng S, 2019. Plankton abundance, biovolume, and normalized biovolume size spectra in the northern slope of the South China Sea in autumn 2014 and summer 2015. Deep Sea Research Part II: Topical Studies in Oceanography, 167: 79—92
TIDAL EFFECTS ON PLANKTON COMMUNITY AND SIZE-STRUCTURE IN THE HUANGMAO BAY OF THE SOUTH CHINA SEA
LIU Zi-Jia1, 2, LI Qian1, 2, 3, CHEN Yin-Chao1, 2, SHUAI Yi-Ping1, 2, MA Meng-Zhen1, 2
(1. State Key Laboratory of Tropical Oceanography, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Guangdong Laboratory of Southern Ocean Science and Engineering (Guangzhou), Guangzhou 511458, China)
As a key component of the aquatic food chain, plankton plays an important role in the marine biogeochemical cycle. To explore the temporal and spatial patterns of the plankton community, a field survey was carried out in the Huangmao Bay of the South China Sea (SCS) from August 17thto 20th, 2017. We estimated the plankton size structure based on the normalized biovolume size spectrum (NBSS) by FlowCAM and the composition of the picoplankton community by flow cytometry. Our results suggest that the highest concentration of total chlorophyll-was located outside the bay where large-sized plankton was relatively dominant. The onshore intrusion of seawater had a great impact on the bottom layer, leading to periodical salinity and temperature fluctuations during each tidal cycle. The tidal variation showed distinct effects on the plankton of different sizes. Picoplankton was merely affected by tidal forcing, but large-sized plankton was greatly influenced. In addition, a substantial increase in the NBSS slope (a higher fraction of large-sized plankton) was observed during high tides, while the NBSS slope decreased substantially (a higher fraction of small-sized plankton) during low tides. Therefore, the tidal forcing along with the changes in nutrients, temperature, and light were the main drivers affecting the distribution of plankton in the Huangmao Bay. This study may provide valuable data and insights for a better understanding of planktonic ecosystem dynamics and the biogeochemical cycle in the coastal area of the SCS.Key words plankton; plankton size; tide; Huangmao Sea
* 广东省特支计划领军人才项目, 2019TX05H216号; 南方海洋科学与工程广东省实验室 (广州) 重大专项, GML2019ZD0305号。刘子嘉, 博士研究生, E-mail: zijialiu@outlook.com
李 芊, 博士生导师, 研究员, E-mail: qianli@scsio.ac.cn
2021-04-27,
2021-06-16
Q178
10.11693/hyhz20210400107