黑鲷(Acanthopagrus schlegelii)对海月水母(Aurelia coerulea)的摄食研究*
李冬辰 张 芳
黑鲷(Acanthopagrus schlegelii)对海月水母(Aurelia coerulea)的摄食研究*
李冬辰1, 2, 3, 4张 芳1, 2, 3, 4①
(1. 中国科学院海洋研究所 中国科学院海洋生态与环境科学重点实验室 青岛 266071; 2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237; 3. 中国科学院大学 北京 100049; 4. 中国科学院海洋大科学研究中心 青岛 266071)
传统研究结果表明水母的捕食者很少, 认为它是海洋食物网的死胡同, 但是越来越多的研究表明水母存在于很多生物的胃中。为研究生态系统中水母的上层营养级状况以及水母种群动态变化的捕食性影响机制, 以黑鲷为研究对象, 通过室内实验, 研究了黑鲷对海月水母不同发育期的摄食情况。研究结果表明: 黑鲷对海月水母各发育期的摄食情况不尽相同, 黑鲷无法直接摄食附着在波纹板上的水螅体; 黑鲷对碟状体的摄食是吞食性的, 15 °C条件下黑鲷对碟状体的摄食率最大可达到(15.487±1.150) ind./(g·d); 黑鲷对小水母体的摄食是吞食性的, 对较大水母体的摄食是蚕食性的, 这种摄食能力受自身体长大小和水母伞径大小的双重影响, 随着体长的增加, 黑鲷能摄食更大伞径的海月水母; 黑鲷对给定伞径海月水母的摄食能力存在阈值, 增大水母密度, 不会导致黑鲷摄食量的增加; 高密度下黑鲷更倾向于摄食水母体口腕部分。研究结果为理解海月水母碟状体的高死亡率提供了可能性新认知, 为理解胶质类在海洋生态系统中的消亡提供了理论。
水螅体; 碟状体; 幼水母体; 摄食
近年来我国近海出现水母数量暴发的现象, 对暴发海域的生态系统、渔业生产、旅游业、沿岸工业等造成威胁。水母类身体富含水分, 营养含量较低。人们一直以来认为它的天敌很少, 是海洋食物网的“死胡同” (Arai, 1997; Doyle, 2007; Schaafsma, 2018)。过去关于水母捕食者的报道较少, 应用传统胃含物分析的方法, 仅在翻车鲀()、鲳科、棱皮龟()、丽龟()、海龟()、美洲螯龙虾()等的胃含物中发现过水母的组分(Weiss, 1970; Ennis, 1973; Welch, 1997; Purcell, 2001; Arai, 2009; Russell, 2011)。随着检测技术的发展, 越来越多的生物被认定为水母捕食者, 其中有超过100种海洋鱼类被认定为水母捕食者(Pauly, 2009)。在地中海针对主要经济鱼类的胃含物分析中发现, 欧洲鳗鲡()与金头鲷()分别是水母暴发时与暴发后的主要捕食者(Marques, 2019)。除了被鱼类捕食, 水母类也受到龙虾的青睐, 在对爱德华岩龙虾()的叶状幼体以及日本龙虾()和长足龙虾()成体胃含物分析时均检测到水母DNA (Chow, 2011; Connell, 2014)。也有研究表明, 沉降的水母尸体是挪威峡湾中龙虾经济种挪威海螯虾()食物的重要组成部分(Sweetman, 2014; Ates, 2017; Dunlop, 2017), 其他生物如扁船蛸()等也会以水母类为食(Heeger, 1992)。这些不同的研究表明, 捕食水母的生物遍布海洋。不仅如此, 水母类也有作为活体饵料的可能性, Wakabayashi等(2012, 2016)和Suzuki等(2016)先后在室内使用水母类成功将九齿扇虾()和毛缘扇虾()培育至稚龙虾阶段, 是目前为数不多的成功养殖龙虾的案例。因此, 越来越多的证据表明水母不仅不是“死胡同”, 而且还可能被用作一种资源。
黑鲷(), 又名黑棘鲷, 属于棘鲷属, 暖温性底层鱼类, 喜栖息于近岸岩礁海区、内湾以及咸淡水水域, 广泛分布于包括我国沿海在内的西北太平洋温暖水域(陈大刚等, 2015), 2—5月为其繁殖季节, 因其经济价值极高, 人工养殖技术成熟, 是我国重要的增养殖放流的对象。研究表明, 自然情况下黑鲷喜食石莼、毛蚶、牡蛎等生物(孙鹏等, 2021)。有研究认为黑鲷是水母的捕食者, 但黑鲷对于海月水母不同阶段的摄食情况未见报道。研究水母的捕食者以及摄食率对研究生态系统中水母的上层营养级状况, 对评估水母种群数量动态变化都具有重要意义。基于此, 本论文研究了不同体长大小的黑鲷对不同发育阶段海月水母的摄食情况, 为评估水母的种群数量及其在海洋生态系统能量流动中的作用提供参考资料。
1 材料与方法
黑鲷100尾(4—7 cm)于2020年7月27日取自威海圣航养殖场。幼体取回后, 养于1 000 L的桶中, 每日9:30换水, 17:00投喂人工饵料, 保持通气, 养殖水温与自然水温同步, 适应性培养一段时间后, 开始实验。实验所用各发育阶段的海月水母均来自中国科学院海洋研究所水母实验室培养, 每日投喂卤虫。
1.1 海月水母伞径和湿重的测定
实验用各阶段海月水母, 用抄网捞出后, 悬空15 s以尽可能沥干水分, 然后用厨房用纸吸干水母表面剩余水分, 置于实验台上, 用20 cm直尺(精度1 mm)测量伞径, 用电子天平(精度0.01 g)测量其湿重, 拟合得到伞径和湿重的回归方程。
1.2 黑鲷对海月水母水螅体的摄食研究
随机取30尾4 cm黑鲷幼体, 分成3组, 每组10尾置于15 L聚丙烯塑料箱中, 塑料箱中加入10 L过滤海水, 保持通气, 放置于生化培养箱中。随机取波纹板, 将其剪为6个5 cm×5 cm的正方形小块, 用镊子、巴氏吸管将波纹板上较小的水螅体移去, 只保留直径≥1 mm的水螅体。上述3组黑鲷饥饿24 h后, 观察无粪便排出说明饥饿处理完全, 测量其体长与总重量。水螅体饥饿24 h后, 对6个平板分别拍照计数以确定水螅体分布与数量。
从6个波纹板中随机取3个分别放入上述3个塑料箱中, 剩余3个做空白对照, 开始实验。实验进行24 h后, 取出波纹板再次拍照计数以及观察水螅体分布位置来确定有无摄食行为的发生并计算黑鲷对海月水母水螅体的摄食率[ind./(g·d)]。实验全程在生化培养箱中进行, 温度与自然水温同步, 设置为24 °C, pH为7.8, 溶解氧为(7.8±0.2) mg/L, 盐度32。
分别取5、7 cm黑鲷进行同样的实验步骤, 考虑到黑鲷体长增大与实验容器限制, 不同的是在后续实验中减少黑鲷的数量, 5 cm的个体每组放4尾, 7 cm的个体每组放2尾进行实验。
1.3 黑鲷对海月水母碟状体的摄食研究
随机取24尾4 cm黑鲷幼体, 分成3组, 每组8尾置于15 L聚丙烯塑料箱中, 塑料箱中加入10 L过滤海水, 保持通气, 放置于生化培养箱中, 温度设置为15 °C。上述3组黑鲷饥饿24 h后, 观察无粪便排出说明饥饿处理完全, 测量其体长与总重量; 取实验室内新释放的碟状体进行实验, 碟状体直径800—1 800 μm, 实验开始前24 h停止投喂卤虫。用巴氏吸管分别吸取100只碟状体置于上述3个塑料箱中, 同时取3个相同塑料箱, 只放入碟状体做空白对照, 开始实验。实验进行24 h后, 计数塑料箱中剩余的碟状体, 计算黑鲷对海月水母碟状体的摄食率[ind./(g·d)]。实验全程在生化培养箱中进行, 考虑到野外碟状体出现时的实际温度, 将温度设置为15 °C, pH为7.8, 溶解氧为(7.8±0.2) mg/L, 盐度32。
在5、7 cm黑鲷摄食碟状体实验中, 将碟状体数量设置为200只, 减少黑鲷的数量, 5 cm个体每组4尾, 7 cm个体每组2尾。
1.4 黑鲷对不同伞径海月水母水母体的摄食研究
随机取24尾4 cm黑鲷幼体, 分成3组, 每组8尾置于15 L聚丙烯塑料箱中, 塑料箱中加入10 L过滤海水, 保持通气, 放置于生化培养箱中, 饥饿处理; 海月水母水母体按照其伞径分为3组: 10、30和40 mm, 在实验前24 h停止投喂卤虫, 三种伞径下分别取1只放置于生化培养箱中单独培养。24 h后, 观察黑鲷无粪便排出说明饥饿处理完全, 测量其体长与总重量; 准确测量水母体伞径(mm)及湿重。
将3种大小的水母体分别放置到上述3个塑料箱中, 开始实验。实验开始后, 每隔1 h观察有无摄食行为的发生、记录水母体活性以及黑鲷对水母体各部位有无优先摄食情况并用相机记录, 24 h后取出剩余水母体称重, 观察其各部位被摄食情况, 确定黑鲷所能摄食水母体的伞径范围及其摄食率。实验全程在生化培养箱中进行。温度设置24 °C, pH 7.8, 溶解氧为(7.8±0.2) mg/L, 盐度32。重复3次。
分别取5、7 cm黑鲷进行同样的实验步骤, 5 cm的个体每组放4尾, 7 cm的个体每组放2尾进行实验。
1.5 黑鲷对不同密度下海月水母水母体的摄食研究
随机取24尾4 cm黑鲷幼体, 分成3组, 每组8尾置于15 L聚丙烯塑料箱中, 塑料箱中加入10 L过滤海水, 保持通气, 放置于生化培养箱中, 温度设置为24 °C。上述3组黑鲷饥饿24 h后, 观察无粪便排出说明饥饿处理完全, 测量其体长与总重量; 根据上述实验结果, 取伞径10 mm的水母体6只放置于生化培养箱中培养, 在实验前24 h停止投喂卤虫, 24 h后准确测量其伞径并称重。
将6只水母体随机分成三份, 每份2只分别放入到上述3个塑料箱中, 开始实验。实验开始后, 每隔1 h观察有无摄食行为的发生、水母体活性如何以及黑鲷对水母体各部位有无优先摄食情况, 24 h后, 取出剩余水母体称重, 观察其各部位被摄食情况, 如果完全被摄食, 则增加单次投喂水母数量(2、3、4、5……), 直至出现不完全摄食情况为止, 确定黑鲷对不同密度下海月水母水母体的摄食率。实验全程在生化培养箱中进行。理化参数分别为: 温度24 °C; pH 7.8; 溶解氧(7.8±0.2) mg/L, 盐度32。
上述实验完成后, 再分别选取30、40 mm的水母体进行实验。随后再测定5、7 cm黑鲷对不同密度下海月水母水母体的摄食率。
1.6 数据分析
所有数据均采用SPSS进行单因素方差分析或独立样本检验, 数据不符合正态分布时, 先进行数据转换再进一步分析, 显著差异<0.05。
2 结果与分析
2.1 海月水母伞径-湿重关系式
本文获得的海月水母的湿重随伞径的增加呈指数型增长(图1), 伞径-湿重表达式为:
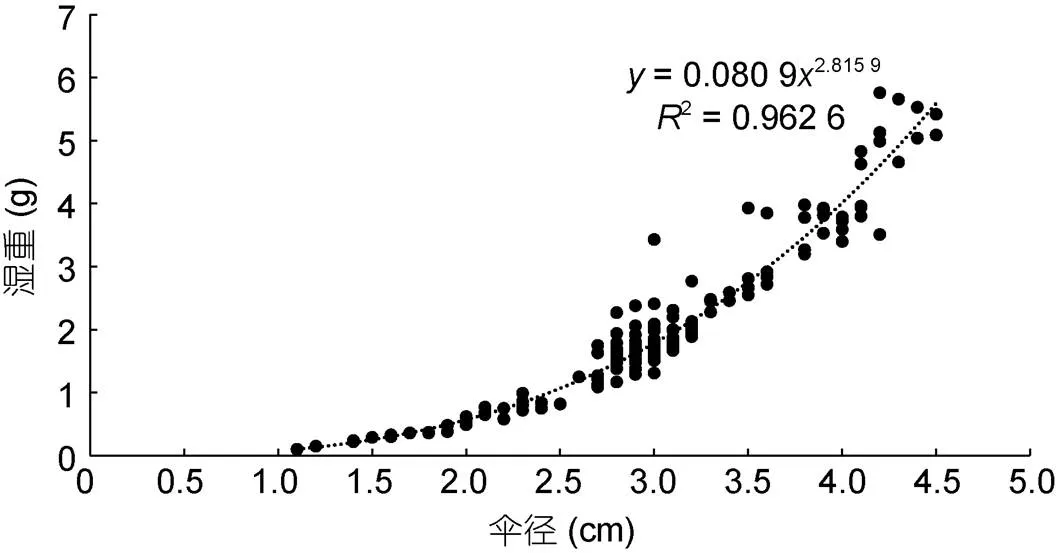
图1 海月水母湿重-伞径关系

其中为水母体湿重(g), BD为水母体伞径(cm)。
下文中出现海月水母湿重, 均由公式(1)计算得到。
2.2 黑鲷对海月水母水螅体的摄食
通过对比放有黑鲷的波纹板上实验前后水螅体的数量及分布位置, 未见明显变化, 因此认为黑鲷不会直接摄食附着在波纹板上的海月水母水螅体。
2.3 黑鲷对海月水母碟状体的摄食
实验结果表明, 黑鲷对海月水母碟状体具有极强的摄食能力(图2), 最大可达到15.487 ind./(g·d), 黑鲷对碟状体的摄食是吞食性的。单因素方差分析结果显示, 不同体长的黑鲷对碟状体的摄食能力存在显著差异(<0.05), 7 cm的黑鲷对碟状体摄食率显著高于4 cm个体 [(8.266±1.844) ind./(g·d)] (<0.05)。5和7 cm的黑鲷的摄食率差别不明显(<0.05)。

图2 黑鲷对海月水母碟状体的摄食率 [单位: ind./(g·d)]
2.4 黑鲷对不同伞径海月水母水母体的摄食
实验过程中观察到黑鲷对小水母体的摄食属于吞食性, 对较大水母体的摄食是蚕食性的, 黑鲷会优先摄食水母体的口腕部分, 然后再摄食伞部(见录像, http://dx.doi.org/10.11693/hyhz20210300072)。放入水母后, 摄食作用不会立即发生, 而是需要经过一段时间的缓冲。实验结果表明, 黑鲷对海月水母的摄食能力不仅受自身的影响, 也受水母体大小的影响。
不同体长黑鲷对同一伞径水母体的摄食能力不同, 其中, 4 cm体长的黑鲷只能摄食伞径30 mm以下的水母体, 而5、7 cm黑鲷可以摄食伞径40 mm以下的水母体(图3)。

图3 黑鲷对海月水母幼水母体的摄食率[单位: ind./(g·d)]
黑鲷的体长一定时, 其对水母体的摄食能力与水母体伞径成反比(图3)。各个体长的黑鲷对10 mm水母体的摄食率均最大, 4 cm黑鲷对10 mm水母体的摄食率显著高于对30 mm水母体的摄食率(<0.05), 5 cm黑鲷对不同伞径水母体的摄食率之间存在显著差异(<0.05), 7 cm黑鲷对10 mm水母体的摄食率显著高于对30、40 mm水母体的摄食率(<0.05), 后两者之间无显著差异(>0.05), 对5、7 cm黑鲷而言, 其对碟状体与10 mm水母体的摄食率无显著差异(>0.05)。黑鲷对同一伞径水母体的摄食率与体长并无明显关联, 当水母体伞径为10 mm时, 摄食率随体长增加而上升, 而当水母体伞径为30 mm时, 各体长黑鲷摄食率无显著差异(>0.05)。
以单位时间单位重量黑鲷所能摄食水母的湿重来看(图4), 对10 mm水母体而言, 三种体长黑鲷个体的摄食率存在显著差异(<0.05), 其中7 cm黑鲷摄食率[(1.192±0.058) g/(g·d)]>5 cm黑鲷摄食率[(1.029±0.068) g/(g·d)]>4 cm黑鲷摄食率[(0.364±0.042) g/(g·d)]。对30 mm水母体而言, 5 cm黑鲷摄食率[(3.071±0.896) g/(g·d)]显著高于4 cm黑鲷[(0.904±0.205) g/(g·d)]与7 cm黑鲷[(1.324±0.154) g/(g·d)](<0.05)。比较5 cm与7 cm黑鲷对40 mm水母体的摄食率发现, 二者无显著差异(<0.05)。同一体长下的黑鲷对不同伞径的水母体摄食能力也不相同, 4 cm黑鲷更倾向于摄食伞径30 mm的水母体(<0.05); 5 cm黑鲷对30 mm水母体的摄食能力尤为突出(<0.05), 而对10 mm与40 mm水母体的摄食能力无显著差异(>0.05); 7 cm黑鲷对10、30、40 mm水母体的摄食能力无显著差异(>0.05)。摄食率最高值出现在5 cm黑鲷-30 mm水母体组, 为3.071 g/(g·d); 最低值为0.364 g/(g·d), 在4 cm黑鲷-10 mm水母体组出现。
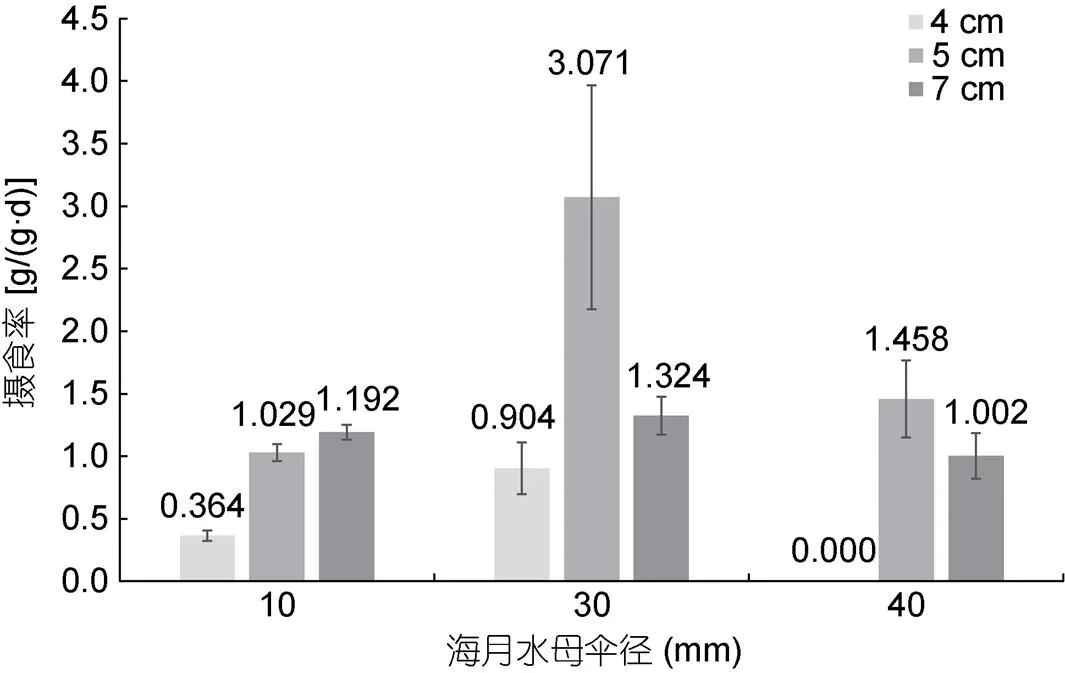
图4 黑鲷对不同伞径海月水母的摄食率[单位: g/(g·d)]
2.5 黑鲷对不同密度海月水母水母体的摄食
在确定最大摄食率的过程中, 进行了黑鲷对不同密度下海月水母的摄食研究。表1为不同体长黑鲷所能摄食不同伞径水母体的最大数量(以将放入的水母体全部吃尽为准), 在此基础上, 继续增大水母密度, 不会导致黑鲷摄食量的增加, 黑鲷会优先摄食所有水母的口腕而剩余部分伞部(图5), 因此, 我们把放入的水母体被全部吃尽时的数量定义为最大摄食量。
表1 24 h黑鲷所能摄食水母体的最大数量

Tab.1 The maximum amount of Aurelia coerulea that can be taken in 24 h
3 讨论
实验所用的海月水母与自然情况下饵料不同, 这可能导致其伞径-湿重关系与现有公式不同(表2), 因此在使用实验室培养个体的同时测量其伞径与湿重, 共166头, 重新拟合了伞径-湿重关系。将本实验测得的关系式与已有关系式比较可知, 实验室培养个体的伞径-湿重关系与Uye等(2015)测得的相近, 与Yoon等(2019)发表的有些差异, 这可能是由于不同海域盐度差异导致(Wright, 1997)。

图5 残余的海月水母
水母虽然富含水分, 能量含量较低, 但其易消化的特性使得其成为某些鱼类的理想食物(Purcell, 2001; Arai, 2003; Purcell, 2009; Briz, 2017; Miyajima-Taga, 2017; Marques, 2019)。有研究发现大马哈鱼消化水母类的速度是消化虾类的20倍(Arai, 2003)。也就是说, 对一些特定的捕食者来讲, 水母的低能量可能被它们的易消化性所抵消。因此, 与鱼类或甲壳类相比, 水母实际上可以为捕食者提供相当的能量。本研究表明, 黑鲷对海月水母碟状体以及小水母体具有一定的摄食能力, 这对于研究钵水母碟状体的种群补充率以及胶质化水母的高值利用具有一定的意义。
表2 海月水母伞径-湿重关系式

Tab.2 Relationship between bell diameter and wet weight of Aurelia coerulea
本研究发现, 黑鲷不会直接摄食水螅体。自然状态下水螅体喜附着于漂浮码头的底面和人工构筑物的表面, 这与本实验中所使用的波纹板有些不同, 实验中波纹板始终置于聚丙烯塑料箱底, 波纹板凹凸不平, 且黑鲷为端位口, 上下约等长, 二者共同作用可能对黑鲷的摄食行为形成阻碍。此外, 对海月水母而言, 水螅体与碟状体、幼水母体的营养水平可能存在差异, 这也会导致黑鲷拒食水螅体, 具体原因还需进一步探索。研究表明, 自然情况下海月水母的水螅体经常附着在双壳类的表面(Miyake, 2002), 而软体动物在黑鲷的胃含物中所占比例较高(孙鹏等, 2021), 这说明黑鲷有可能在摄食软体动物的同时将其表面附着的水螅体间接摄食掉, 这种间接摄食作用可能比某些直接摄食作用更显著(Marques, 2016)。
黑鲷对海月水母碟状体的最大摄食率可达到(15.487±1.150) ind./(g·d), 远远高于Marques等(2016)测定的金头鲷对海月水母碟状体摄食率[(0.05±0.02) prey item/(gfish·h)]。约99%的碟状体在发育为水母体之前死亡(Ishii, 2004), 但其高死亡率的机理至今仍未明确。Suzuki等(2016)发现滤食类生物贻贝()具有较强的摄食海月水母碟状体的能力。与滤食性生物的被动摄食不同, 黑鲷对碟状体具有主动选择性, 黑鲷对碟状体的高摄食率, 说明黑鲷可能对海月水母碟状体的高死亡率起着重要作用。
观察伞径-湿重关系可以发现, 随着伞径的增加, 其湿重呈指数型增长, 对于10 mm海月水母而言, 以数量为单位表示的摄食率更能体现真实水平。实验黑鲷对10 mm海月水母的最高摄食率为(15.161±2.538) ind./(g·d), Marques等(2016)测定的金头鲷对10 mm海月水母摄食率最高为(0.15±0.03) ind./(g·h)。单从实验室数据来看, 黑鲷对海月水母水母体的摄食能力强于金头鲷, 且与金头鲷不同的是, 黑鲷也能摄食碟状体。黑鲷对海月水母碟状体与小水母体的大量摄食, 可以在一定程度上限制水母暴发的规模。
黑鲷对不同伞径的海月水母摄食能力不同, 在对金头鲷的研究中也发现了这种现象, 这种差异可能与其自身口器的大小有关(Russo, 2007)。针对银鲳()的研究发现, 银鲳对10 mm海月水母摄食率可以达到它们自身湿重的10.8倍[(10.83±1.43) g/(fish·d)](Liu, 2014); 绿鳍马面鲀()每天可以摄食自身体重10倍的沙海蜇()(Miyajima-Taga, 2017), 而本次实验中测得的黑鲷对水母体的最大摄食率仅为(3.071±0.896) g/(g·d)。尽管如此, 也不能忽视黑鲷的重要性。海洋生物对水母的捕食作用不仅对水母灾害的防控具有重要意义, 还可应用于经济物种的养殖中。在银鲳的饵料中增加海月水母和海蜇(), 可以有效提高其生长速度(Liu, 2015)。仅用海月水母投喂丝背细鳞鲀(), 丝背细鳞鲀仍可正常生长, 将水母与磷虾混合投喂时, 可显著提高丝背细鳞鲀的增长速度(Miyajima, 2010)。除鱼类外, 水母还可以成为龙虾的饵料, Wakabayashi等(2012)用两种钵水母(海月水母和太平洋黄金水母)及其碟状体成功将九齿扇虾培育至稚龙虾期, 并观察到其发育期由7期缩短为6期(Wakabayashi, 2012); Wakabayashi等(2016)又用上述两种钵水母作为饵料, 成功将毛缘扇虾从卵培育至稚龙虾。对九齿扇虾叶状幼体的研究发现, 其有抵御刺细胞的能力, 且能以最低2 mm直径的海月水母碟状体为食(Wakabayshi, 2012)。在黑鲷的人工养殖过程中, 水母配合饵料投喂是未来一个可能的研究方向。
同期实验室内进行的另一项实验表明, 即使在水母高密度下, 黑鲷仍能正常生存并以水母为食(张芳等, 未发表), 除此之外黑鲷与其他几种致灾水母的相互作用仍值得研究。在对真鲷()的研究中发现, 海月水母可以捕食7 mm以下的真鲷幼鱼(Nakayama, 2003), 但海月水母对黑鲷幼鱼的作用尚不明确。针对增殖放流个体而言, 以山东为例, 黑鲷每年的放流月份为6—10月份, 放流大小为4 cm与8 cm, 而6—10月同时也是水母旺发的时间(张芳等, 2009), 其中6月份正是碟状体与幼水母体数量高峰期, 黑鲷的增殖放流有可能在一定程度上限制海月水母的种群规模。
4 结论
黑鲷对海月水母各发育期的摄食情况不尽相同, 黑鲷无法直接摄食附着在波纹板上的水螅体; 黑鲷对海月水母碟状体及幼水母体均具有摄食能力, 对碟状体的摄食是吞食性的, 对碟状体的摄食率最大可达到(15.487±1.150) ind./(g·d); 对水母体的摄食是蚕食性的, 这种摄食能力受自身体长大小和水母伞径大小的双重影响, 随着黑鲷体长的增加, 其能摄食更大伞径的海月水母。黑鲷对水母体的摄食能力存在阈值, 增大水母密度, 不会导致黑鲷摄食量的增加, 高密度下黑鲷会更倾向于摄食水母体口腕部分。黑鲷对碟状体及10 mm幼水母体摄食作用最强。研究结果为理解海月水母碟状体的高死亡率提供了新的解释依据, 为理解水母灾害可能的高值利用提供了可能。
孙 鹏, 凌建忠, 张 辉等, 2021. 基于高通量测序的象山港海域黑鲷()食性分析. 生态学报, 41(3): 1221—1228
张 芳, 孙 松, 李超伦, 2009. 海洋水母类生态学研究进展. 自然科学进展, 19(2): 121—130
陈大刚, 张美昭, 2015. 中国海洋鱼类. 青岛: 中国海洋大学出版社
Arai M N, 1997. A Functional Biology of Scyphozoa. London: Chapman & Hall
Arai M N, 2009. The potential importance of podocysts to the formation of scyphozoan blooms: a review. Hydrobiologia, 616(1): 241—246
Arai M N, Welch D W, Dunsmuir A L, 2003. Digestion of pelagic Ctenophora and Cnidaria by fish. Canadian Journal of Fisheries and Aquatic Sciences, 60(7): 825—829
Ates R M L, 2017. Benthic scavengers and predators of jellyfish, material for a review. Plankton and Benthos Research, 12(1): 71—77
Briz L D, Sánchez F, Marí N, 2017. Gelatinous zooplankton (ctenophores, salps and medusae): an important food resource of fishes in the temperate SW Atlantic Ocean. Marine Biology Research, 13(6): 630—644
Chow S, Suzuki S, Matsunaga T, 2011. Investigation on natural diets of larval marine animals using peptide nucleic acid-directed polymerase chain reaction clamping. Marine Biotechnology, 13(2): 305—313
Connell S C, O'Rorke R, Jeffs A G, 2014. DNA identification of the phyllosoma diet ofandsp. Z. New Zealand Journal of Marine and Freshwater Research, 48(3): 416—429
Doyle T K, Houghton J D R, McDevitt R, 2007. The energy density of jellyfish: estimates from bomb-calorimetry and proximate-composition. Journal of Experimental Marine Biology and Ecology, 343(2): 239—252
Dunlop K M, Jones D O B, Sweetman A K, 2017. Direct evidence of an efficient energy transfer pathway from jellyfish carcasses to a commercially important deep-water species. Scientific Reports, 7: 17455
Ennis G P, 1973. Food, feeding, and condition of lobsters,, throughout the seasonal cycle in bonavista bay, newfoundland. Journal of the Fisheries Research Board of Canada, 30(12): 1905—1909
Heeger T, Piatkowski U, Möller H, 1992. Predation on jellyfish by the cephalopod. Marine Ecology Progress Series, 88: 293—296
Ishii H, Kojima S, Tanaka Y, 2004. Survivorship and production ofephyrae in the innermost part of Tokyo Bay, Japan. Plankton Biology and Ecology, 51(1): 26—35
Liu C S, Chen S Q, Zhuang Z M, 2015. Potential of utilizing jellyfish as food in culturingjuveniles. Hydrobiologia, 754(1): 189—200
Liu C S, Zhuang Z M, Chen S Q, 2014. Medusa consumption and prey selection of silver pomfretjuveniles. Chinese Journal of Oceanology and Limnology, 32(1): 71—80
Marques R, Bouvier C, Darnaude A M, 2016. Jellyfish as an alternative source of food for opportunistic fishes. Journal of Experimental Marine Biology and Ecology, 485: 1—7
Marques R, Darnaude A M, Crochemore S, 2019. Molecular approach indicates consumption of jellyfish by commercially important fish species in a coastal Mediterranean lagoon. Marine Environmental Research, 152: 104787
Miyajima Y, Masuda R, Kurihara A, 2010. Juveniles of threadsail filefish, Stephanolepis cirrhifer, can survive and grow by feeding on moon jellyfish. Fisheries Science, 77(1): 41—48
Miyajima-Taga Y, Masuda R, Yamashita Y, 2017. Feeding capability of black scraperon giant jellyfishevaluated through field observations and tank experiments. Environmental Biology of Fishes, 100(10): 1237—1249
Miyake H, Terazaki M, Kakinuma Y, 2002. On the polyps of the common jellyfishin kagoshima bay. Journal of Oceanography, 58(3): 451—459
Nakayama S, Masuda R, Takeuchi T, 2003. Effects of highly unsaturated fatty acids on escape ability from moon jellyfishin red sea breamlarvae. Fisheries Science, 69(5): 903—909
Pauly D, Graham W, Libralato S, 2009. Jellyfish in ecosystems, online databases, and ecosystem models. Hydrobiologia, 616(1): 67—85
Purcell J E, 2009. Extension of methods for jellyfish and ctenophore trophic ecology to large-scale research. Hydrobiologia, 616(1): 23—50
Purcell J E, Arai M N, 2001. Interactions of pelagic cnidarians and ctenophores with fish: a review. Hydrobiologia, 451(1/3): 27—44
Russell D J, Hargrove S, Balazs G H, 2011. Marine sponges, other animal food, and nonfood items found in digestive tracts of the herbivorous marine turtlein Hawai'i. Pacific Science, 65(3): 375—381
Russo T, Costa C, Cataudella S, 2007. Correspondence between shape and feeding habit changes throughout ontogeny of gilthead sea breamL., 1758. Journal of Fish Biology, 71(3): 629—656
Schaafsma F L, Cherel Y, Flores H, 2018. Review: the energetic value of zooplankton and nekton species of the Southern Ocean. Marine Biology, 165(8): 129
Suzuki K S, Kumakura E, Nogata Y, 2016. Incidental consumption of ephyrae of moon jellyfishs.l. by three filter-feeding sessile organisms: laboratory experiments. Fisheries Science, 82(6): 923—930
Sweetman A K, Smith C R, Dale T, 2014. Rapid scavenging of jellyfish carcasses reveals the importance of gelatinous material to deep-sea food webs. Proceedings of the Royal Society B: Biological Sciences, 281(1796): 20142210
Uye S, Shimauchi H, 2005. Population biomass, feeding, respiration and growth rates, and carbon budget of the scyphomedusain the Inland Sea of Japan. Journal of Plankton Research, 27(3): 237—248
Wakabayashi K, Nagai S, Tanaka Y, 2016. The complete larval development offrom hatching to the nisto and juvenile stages using jellyfish as the sole diet. Aquaculture, 450: 102—107
Wakabayashi K, Sato R, Ishii H, 2012. Culture of phyllosomas of(Decapoda: Scyllaridae) in a closed recirculating system using jellyfish as food. Aquaculture, 330/333: 162—166
Wakabayshi K, Sato R, Hirai A, 2012. Predation by the phyllosoma larva ofon various kinds of venomous jellyfish. Biological Bulletin, 222(1): 1—5
Weiss H M, 1970. The diet and feeding behavior of the lobster,, in Long Island Sound. Connecticut: Doctor Dissertation of University of Connecticut
Welch D W, 1997. Anatomical specialization in the gut of Pacific salmon (): evidence for oceanic limits to salmon production? Canadian Journal of Zoology, 75(6): 936—942
Wright D A, Purcell J E, 1997. Effect of salinity on ionic shifts in mesohaline scyphomedusae, chysaora quinquecirrha. Biological Bulletin, 192(2): 332—339
Yoon E A, Lee K, Chae J, 2019. Density estimates of moon jellyfish () in the yeongsan estuary using nets and hydroacoustics. Ocean Science Journal, 54(3): 457—465
INGESTION OF LARGE JELLYFISHBY BLACK SEA BREAM
LI Dong-Chen1, 2, 3, 4, ZHANG Fang1, 2, 3, 4
(1. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laboratory of Marine Ecology and Environmental Sciences, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China)
Jellyfish are voracious predators and they have historically often been viewed as the trophic dead ends. However, this view has been challenged in more and more studies recently. To study the upper trophic level of jellyfish in the ecosystem and the mechanism of predation on jellyfish population, the characteristics of ingestion of on moon fishby black sea breamwas experimentally studied. All the life stages (polyp, ephyra and medusa) ofversus different total length (4, 5, and 7 cm) of black sea bream were investigated. Results reveal that, the black sea bream could not prey on polyps that were attached to corrugated boards. The maximum ingestion rate of black sea bream on ephyrae was (15.487±1.150) ind./(g·d)occurred at 15 °C; the total length of black sea bream and bell diameter of jellyfish affected the ingestion rate. With the grow-up of black sea bream, it can prey on larger jellyfish individual. There was a threshold of predation ability of black sea bream on jellyfish at a given umbrella diameter, and providing more jellyfish could not increase the predation amount. This study is insightful for understanding the high mortality rate of ephyrae, and provided a theoretical basis for interpreting the disappearance of gelatinous zooplankton.
polyp; ephyrae; medusae larvae; ingestion rate
* 国家重点研发计划, 2017YFC1404405号; 山东省支持青岛海洋科学与技术试点国家实验室重大科技专项, 2018SDKJ0504-3号; 中国科学院战略性先导科技专项(A 类), XDA11060203号; 国家自然科学基金项目, 42076166号。李冬辰, 硕士研究生, E-mail: 980413124@qq.com
张 芳, 硕士生导师, 研究员, E-mail: zhangfang@qdio.ac.cn
2021-03-22,
2021-05-07
Q958.8
10.11693/hyhz20210300072