谷子对干旱胁迫的生理生态响应
严加坤,张宁宁,张岁岐
1 榆林学院生命科学学院, 榆林 719000 2 中国科学院水利部水土保持研究所土壤侵蚀与旱地农业国家重点实验室, 杨凌 712100
水分不足是限制干旱半干旱地区农业生产的重要环境因素之一[1],植物在长期的适应干旱过程中进化出一系列的生理生化反应来响应环境水分变化[2- 3]。谷子(SetariaitalicaL.)是我国起源的特色作物,由于其具有较高营养价值,所以在全民营养危机[4]及种植业结构调整的大背景下再次成为我国西北干旱半干旱地区广泛种植的经济作物[5]。但由于西北地区降雨量小、月际分布不均,水分不足严重影响谷子产量,限制了谷子产业的发展。因此,提高谷子的耐旱性并进行耐旱育种已成为保障谷子高产稳产的重要途径。
叶片光合作用是植物维持生长的物质基础。干旱引起植物叶片气孔导度的降低,进而降低蒸腾速率,减少叶片蒸腾以改善植物水分状态;然而这种调节会阻碍CO2进入叶片,最终由于气孔限制影响光合作用[6]。研究显示,提高干旱胁迫下高粱叶片气孔导度能有效提高其净光合速率[7]。但干旱胁迫妨碍光合色素的正常合成,并且会加速其分解,最终导致叶绿素含量下降。目前,不充分灌溉的灌溉制度导致玉米叶片叶绿素含量显著降低[8], 因此,提高干旱胁迫下植物叶片叶绿素含量对维持光合作用具有重要意义。另外,干旱胁迫会降低作物光系统Ⅱ的光化学效率,影响作物体内活性氧自由基代谢和脂膜流动性;通常植物通过增加可溶性糖和氨基酸含量(如:脯氨酸等)来调节细胞渗透势,进而达到应对干旱胁迫的目的[9]。干旱显著提高谷子叶片脯氨酸、可溶性总糖、和淀粉含量以提高其抗旱性[9]。其中,可溶性糖和淀粉构成的非结构性碳在植物应对非生物胁迫如:干旱、温度、光照及盐害中起重要作用[10-13]。研究表明:干旱胁迫诱导玉米叶片非结构性碳积累提高玉米综合抗旱性,且抗旱能力较强的玉米品种在干旱条件下具有更强的非结构性碳积累能力[14]。刘亚静等[9]对大气CO2浓度升高和干旱互作对谷子生长的研究中发现,干旱胁迫下CO2浓度升高提高了可溶性糖含量,降低了淀粉含量从而缓解干旱胁迫对谷子的生长抑制。可见,可溶性糖积累对谷子抗旱性的提高具有重要作用。对谷子的转录组数据分析显示,干旱条件下谷子β-淀粉酶基因表达剧烈上调[15],而β-淀粉酶正是淀粉水解形成可溶性糖的直接催化剂。由此说明,非结构性碳组成(淀粉/可溶性糖)可能是影响谷子抗旱性的重要因素。
长期以来,围绕谷子适应干旱机理方面国内外做了大量研究,取得了重要的研究成果,如干旱下谷子气孔调控机理[16]、筛选出一批重要的抗旱基因[17-19]。然而大部分研究主要集中在苗期渗透胁迫等[20]方面,对干旱条件下谷子重要生育期光合响应特征及非结构性碳代谢缺少深入研究,而谷子是我国典型的抗旱耐瘠特色作物,因此研究谷子的抗旱过程中光合及碳代谢响应机制具有重要理论意义。本文拟采用盆栽控水的方法,研究(1)不同抗旱性谷子品种响应干旱胁迫的光合特征,功能叶片非结构性碳组成及相关基因表达情况,(2)外源施用β-淀粉酶活性抑制剂α-环糊精[21]条件下谷子各生理指标的变化旨在为进一步分析探索碳代谢在谷子逆境应答中的功能和机制提供一些有益线索。
1 材料与方法
1.1 试验材料及设计
(1)试验1 不同抗旱性谷子品种干旱适应特征研究
以干旱敏感谷子品种安04(An04)和抗旱性较强的品种豫谷1号(Yugu1)为材料[15],试验所用种子由山西农业大学农学院韩渊怀教授提供。
试验在防雨棚内进行,试验材料种植在圆柱形塑料桶(高30 cm,直径30 cm)内,试验所用土壤为大田20 cm表层的黄绵土(有机质3.2 g/kg,pH 8.6,全氮0.3 g/kg,全磷0.5 g/kg,全钾18.3 g/kg,碱解氮16.1 mg/kg,速效磷4.8 mg/kg,速效钾65.8 mg/kg),每桶装入风干土8.5 kg,基础肥料施用同当地生产水平一致,在拔节期追肥。种子均匀点播于土壤表层2 cm处,每个品种种植30盆、共60盆,并且控制土壤含水量为田间持水量75%±5%,每天18:00通过人工称重补充水分。待幼苗长至3叶期选取长势一致的幼苗定苗至每盆4株,土壤表面添加2 cm高蛭石保水,同时开始控水试验。试验设置正常供水组(WW):保持土壤水分为田间持水量75%±5%,干旱处理组(WD):3叶期后保持土壤水分为田间持水量35%±5%。分别在拔节期和开花期取样进行生理指标测定,在成熟期测产。
(2)试验2 β-淀粉酶功能验证
为验证β-淀粉酶在谷子抗旱中的作用设计试验2,以山西农业大学最新创制xiaomi[22]为材料,在室内人工气候箱进行。试验材料种植在圆形塑料桶(高15 cm,直径10 cm)内,试验所用土壤为草炭土(Pindstrup Mosebrug A/S,Ryomgaard, Denmark),播种方法同试验1;种子出苗后每盆定苗3株,长至3叶期开始干旱处理。试验设置四组:正常供水组(WW):保持充分供水;正常供水+α-环糊精组(WWα):保持充分供水并且每两天叶片喷施20 mmol/L α-环糊精;干旱处理组(WD):停止浇水,自然干旱;干旱处理+α-环糊精组(WDα):停止浇水并且每两天叶片喷施20 mmol/L α-环糊精。α-环糊精喷施以沾湿叶片为准,对照喷施相同剂量的纯净水。试验处理10天后进行各生理指标的测定。
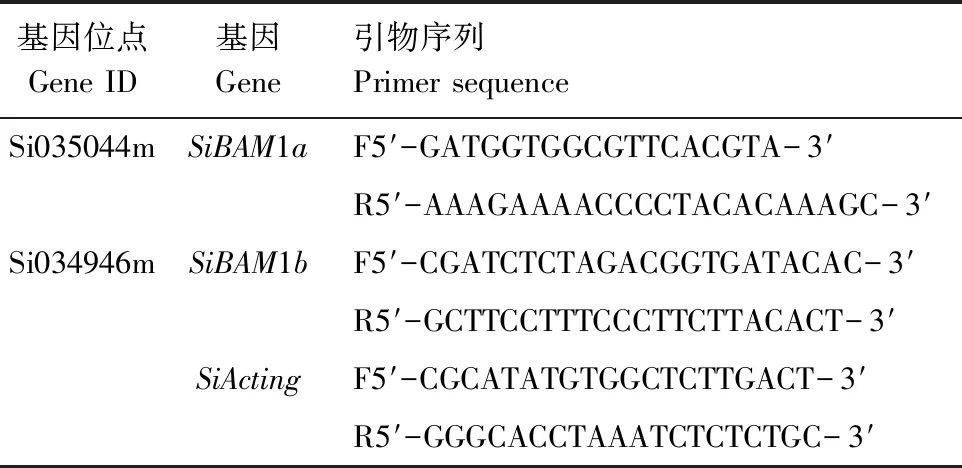
表1 实时定量PCR所用引物信息
1.2 测定内容和方法
1.2.1生物量、测产及相关指标
试验 1:在拔节期和开花期分别取5株测定地上部生物量。取地上部分分别装入样品袋,105 ℃ 杀青25 min,75 ℃烘干至恒重后称重,即为地上部生物量。在成熟期测产,地上部分按盆收取之后 75 ℃ 烘干至恒重后称重即为地上部生物量,之后手工脱粒称取粒重,即为每盆产量。通过人工数粒测定千粒重。在花后15天用卷尺测量植株拉直后的最大高度作为株高,每处理重复10次。用直尺测定旗叶长度并测定最宽处的宽度。
试验2:取8株测定地上部生物量,方法同试验1。
1.2.2光合参数及叶片指标
试验1:光合参数采用Li-6400便携式光合仪(LI-COR Inc., Lincoln,NE,USA),分别在拔节期、开花期及花后10天测定。具体方法为:在晴天10:00—1:00 am 测定完全展开的新叶(拔节期)、旗叶(开花期及花后10天)的净光合速率、气孔导度和蒸腾速率,测定参数设定为光量子密度1000 μmol m-2s-1、 流量 500 μmol/s、叶温28 ℃。采用PhotosynQ MultispeQ V2[23]测定仪测定光系统II最大化学效率(Fv/Fm);采用乙醇浸提比色法[24]测定拔节期新叶及开花期旗叶叶绿素含量;采用硫酸蒽酮比色法[24]测定可溶性糖和淀粉含量;采用Barrs and Weatherley方法[25]测定叶片相对含水量。
开花期取样,液氮冷冻后放入超低温冰箱-80 ℃保存备用,试验所用引物序列见表1。
采用全式金EasyPure® Plant RNA Kit提取总RNA,经EasyScript® One-Step gDNA Removal and cDNA Synthesis SuperMix反转录后使用TransStart® Tip Green qPCR SuperMix利用FTC—3000P实时荧光定量PCR仪进行实时定量测定,数据采用2-ΔΔCt[26]法计算。
试验2:采样后分别测定β-淀粉酶活性[27],淀粉和可溶性糖含量[24]及脯氨酸[24]含量。
1.3 数据处理
利用SPSS 19.0进行ANOVA 方差分析,用最小显著差异法(LSD)进行多重比较,显著性水平为P=0.05。采用Sigmaplot12.5 绘图。
2 结果与分析
2.1 干旱对两个品种谷子生物量、产量及相关性状的影响
由表2可知,干旱胁迫严重限制了两个谷子品种的产量形成(安04和豫谷1号分别减产71.2%和56.0%),但其对不同品种的生物量和产量的影响程度不同。正常水分条件下,两个谷子品种地上部生物量在拔节期和开花期均不存在显著性差异(P>0.05);而干旱胁迫下,豫谷1号的地上部生物量显著高于安04的地上部生物量(P<0.05)。在成熟期,正常水分条件下,安04的生物量和产量比豫谷1号分别高7.1%和12.4%;但干旱胁迫下,豫谷1号具有更高的生物量和产量,比安04分别高27%和35.7%(P<0.05),表明豫谷1号比安04具有更强的维持产量的能力;但干旱胁迫并没有对两个谷子品种千粒重产生显著性影响(P>0.05)。
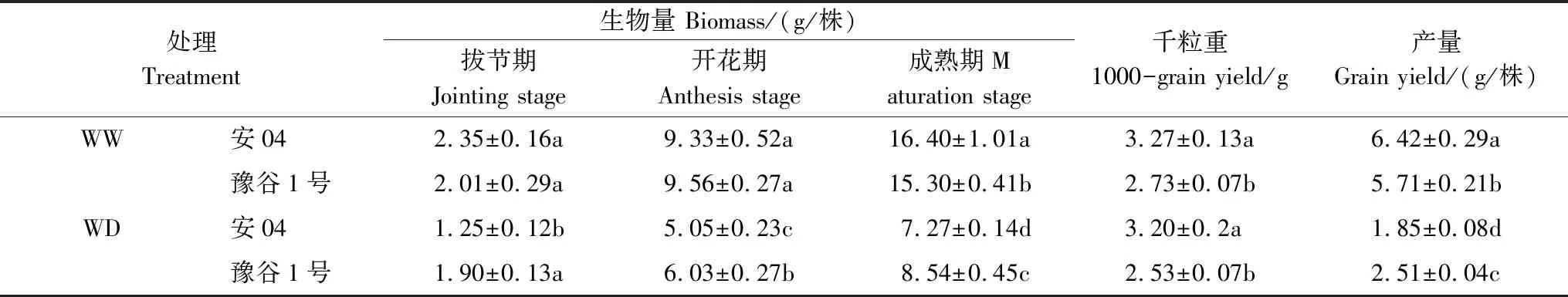
表2 不同水分条件下两个谷子品种谷子产量及其相关性状
干旱胁迫显著降低了两个谷子品种的株高和旗叶叶长(图1),其中安04株高下降幅度(30.8%)大于豫谷1号下降幅度(21.2%);虽然干旱胁迫显著降低了旗叶叶长,但品种种间并不存在显著性差异(P>0.05)。干旱胁迫虽显著降低了安04的旗叶宽度(P<0.05),但其对豫谷1号并没有产生显著性影响(P>0.05)。
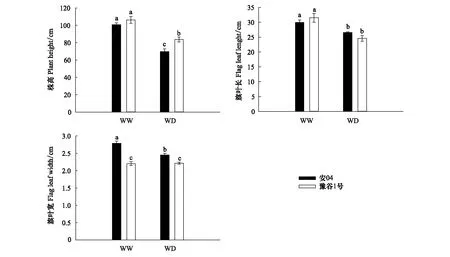
图1 不同水分条件下两个谷子品种株高、旗叶叶长和叶宽Fig.1 Plant height, flag leaf length and leaf width of two millet cultivars under different water conditionsWW:正常供水 Well-watered;WD:水分匮缺(干旱) Water deficit
2.2 干旱对两个谷子品种谷子叶片光合及水分参数的影响
两个谷子品种的叶片净光合速率在各生育期均呈现出相似的变化趋势(图2)。正常水分条件下,安04的叶片净光合速率高于豫谷1号,且在开花期和花后10天均达到显著性水平(P<0.05);但干旱胁迫下,豫谷1号的叶片净光合速率在不同生育期均显著大于安04(P<0.05)。然而,两个谷子品种的最大光化学效率在拔节期各处理及各品种间均不存在显著性差异(P>0.05),但干旱胁迫下,开花期及花后10天,豫谷1号的最大光化学效率显著高于安04(P<0.05)。
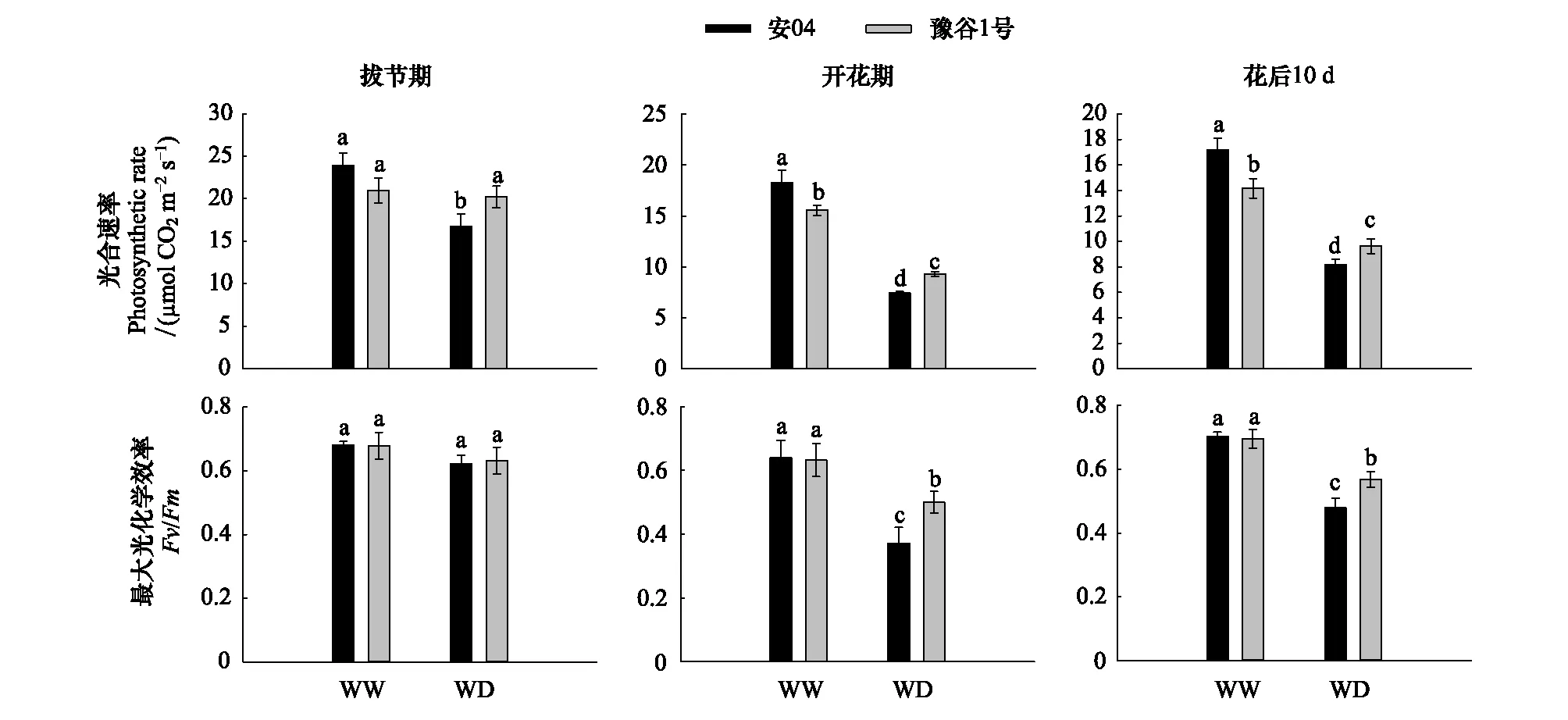
图2 不同水分条件下两个谷子品种的光合相关参数Fig.2 Photosynthetic parameters of the two millet cultivars under different water conditions不同字母代表显著性差异(P<0.05)
拔节期,干旱胁迫显著降低了安04的叶绿素a、叶绿素b及总叶绿素含量(表3),而同期豫谷1号中仅叶绿素a表现出显著性降低现象(P<0.05)。开花期,两个谷子品种的叶绿素a、叶绿素b及总叶绿素含量均出现显著性降低(表3),但安04降幅更大,其中叶绿素a、叶绿素b及总叶绿素含量分别降低45.9%、43.3%和43.3%,豫谷1号分别降低43.9%、28.2%和29.1%。
图3显示,在两种水分条件下,两个谷子品种的叶片气孔导度呈现完全相反的现象,蒸腾速率的变化趋势与叶片气孔导度完全一致。正常水分条件下,拔节期和开花期安04的叶片气孔导度和蒸腾速率均显著大于豫谷1号(P<0.05)。而干旱胁迫下,豫谷1号的叶片气孔导度和蒸腾速率均显著大于安04(P<0.05)。而两个谷子品种的叶片相对含水量表现不同,正常水分条件下,拔节期及开花期安04和豫谷1号叶片相对含水量无显著性差异(P>0.05);但干旱胁迫下,安04叶片相对含水量显著低于豫谷1号(P<0.05)。

表3 不同水分条件下两个谷子品种的叶绿素含量
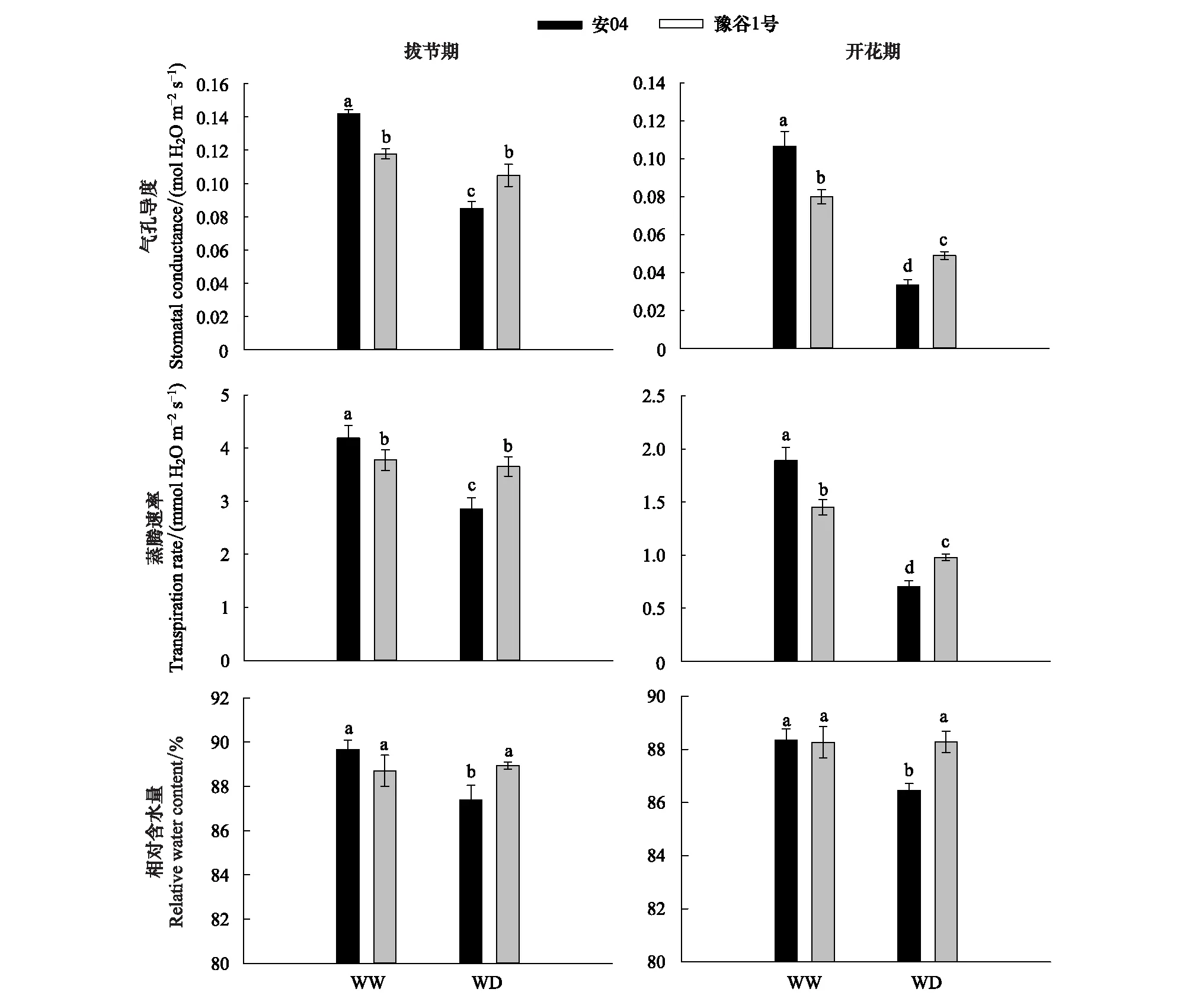
图3 不同水分条件下两个谷子品种叶片水分参数Fig.3 Leaf water parameters of two millet cultivars under different water conditions
2.3 叶片非结构性碳及相关基因表达
图4显示,干旱胁迫均显著增加了拔节期和开花期豫谷1号的叶片可溶性糖含量(P<0.05),但安04叶片可溶性糖含量没有发生显著性变化(P>0.05)。然而,干旱胁迫对两个谷子品种叶片淀粉含量的影响显著不同,其中拔节期,干旱胁迫显著性降低了安04叶片的淀粉含量(P<0.05),但豫谷1号叶片的淀粉含量则呈现出升高的趋势;开花期,两个谷子品种叶片的淀粉含量没有表现出显著性差异。同时,干旱胁迫下豫谷1号在拔节期和开花期均表现出更高的叶片非结构性碳的积累(P<0.05),而安04 叶片非结构性碳在两种水分条件下并不具有显著性差异(P>0.05)。
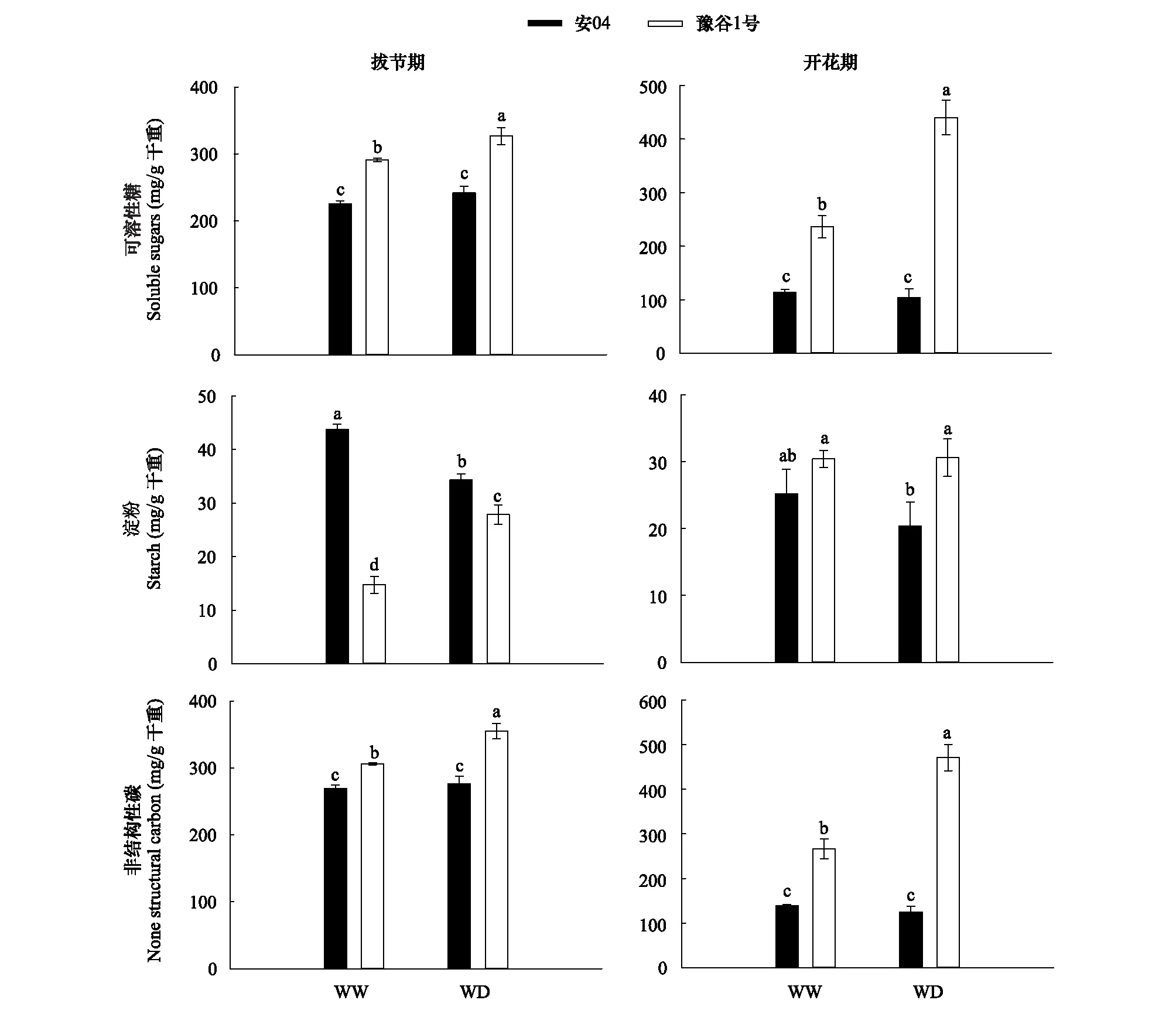
图4 不同水分条件下两个谷子品种叶片非结构性碳组成Fig.4 Leaf unstructured carbon of two millet cultivars under different water conditions
开花期旗叶β-淀粉酶基因表达结果显示:干旱胁迫显著提高了SiBAM1基因表达水平(图5)。干旱胁迫下,安04SiBAM1a表达水平为正常水分下1.80倍,SiBAM1b为正常水分下1.78倍;豫谷1号SiBAM1a表达水平为正常水分下4.87倍,SiBAM1b为正常水分下6.05倍。表明干旱胁迫下,豫谷1号β-淀粉酶基因在旗叶中表达增量显著高于安04(P<0.05)。

图5 开花期旗叶β-淀粉酶基因表达Fig.5 Gene expression of β-amylase in flag leaf at anthesis stageSiBAM1a:谷子β-淀粉酶1a Setaria italica β-amylase 1a;SiBAM1b:谷子β-淀粉酶1b Setaria italica β-amylase 1b
2.4 β-淀粉酶基因功能验证
如图6所示,干旱胁迫显著降低了xiaomi生物量(50.7%),外源施用α-环糊精进一步加剧了干旱导致的生长抑制。β-淀粉酶活性分析显示,外源施用α-环糊精显著抑制了不同水分条件下xiaomi叶片β-淀粉酶活性。而β-淀粉酶活性降低导致淀粉水解受到抑制,表现为干旱胁迫下xiaomi叶片具有更高的淀粉含量和更低的可溶性糖含量。脯氨酸含量结果表明,外源施用α-环糊精显著降低了两种水分条件下的脯氨酸含量。
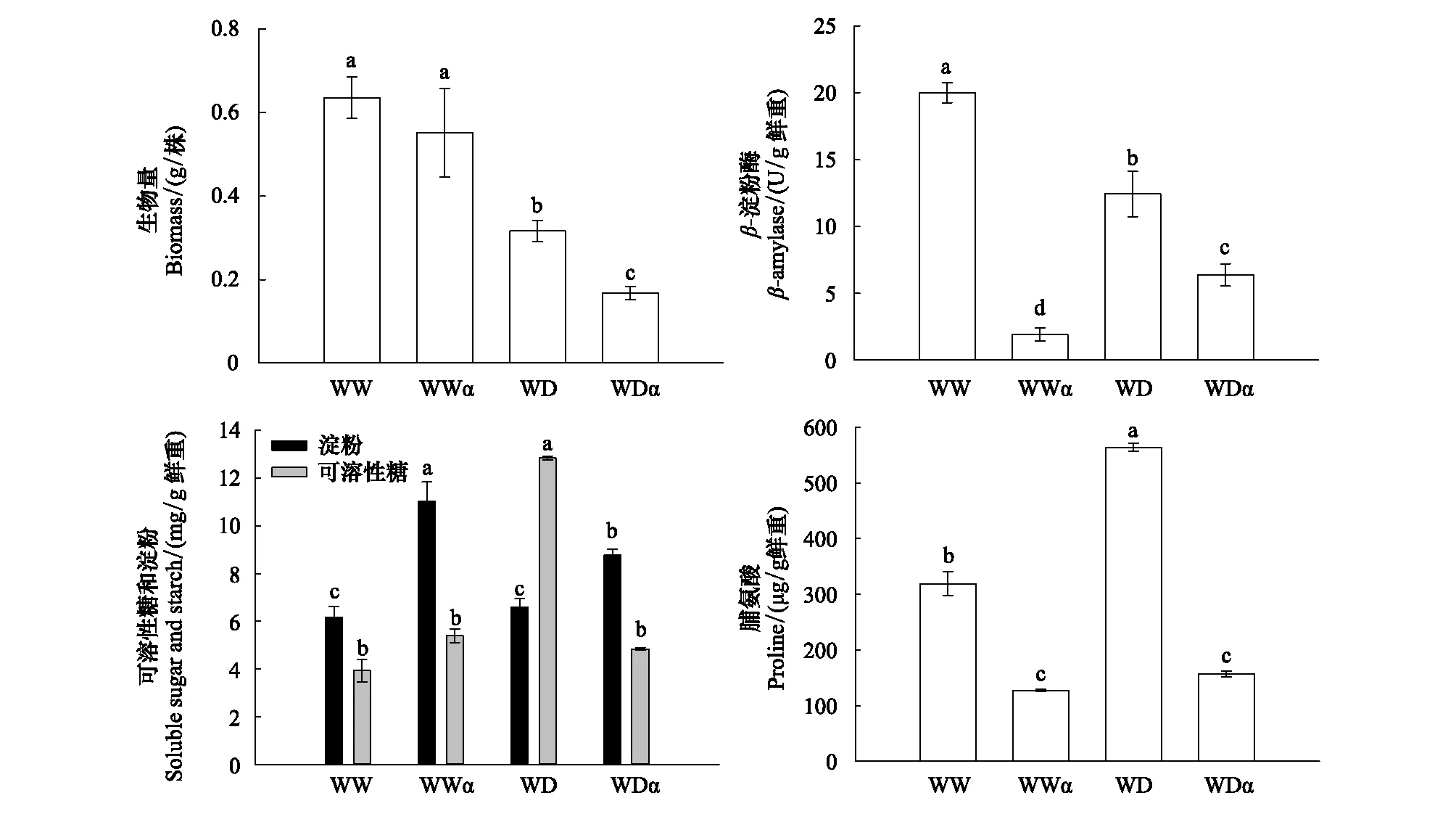
图6 外源α-环糊精对干旱胁迫下谷子xiaomi生物量、β-淀粉酶活性、可溶性糖和淀粉及脯氨酸含量的影响Fig.6 Effects of exogenous α-Cyclodextrin on biomass, β-amylase activity, soluble sugar, starch and proline content of millet under water deficit conditionWWα:正常供水+ α-环糊精 Well-watered+α-cyclodextrin;WDα:水分匮缺(干旱)+ α-环糊精 Water deficit+α-cyclodextrin
3 讨论
3.1 干旱对谷子光合参数的影响
干旱导致作物光合速率降低[7, 28],而提高叶片净光合速率是提高干旱胁迫下作物产量的重要途径[29-30]。本研究中不同抗旱性谷子品种在干旱胁迫下呈现出不同的光合响应模式,总体表现为高光合速率对应较高的籽粒产量,这与前人研究结果相一致[30]。光合速率的降低主要是由于气孔关闭导致的气孔限制和光合色素的降解及合成受阻等造成的非气孔限制引起的[31]。本实验中安04谷子叶片气孔导度下降幅度远大于豫谷1号(图3),说明安04降低的光合速率可能受到气孔限制的影响要大于豫谷1号。最大化学效率Fv/Fm反映光系统反应中心利用光能的最大能力,是胁迫条件下光系统受损程度的判定标准之一[32]。本研究中拔节期两种水分条件下各品种Fv/Fm并不存在显著性差异,说明在胁迫初期光系统损害程度较轻;而叶绿素含量则出现显著性差异,但其下降的幅度远小于开花期,说明谷子叶片叶绿素含量轻微下降对光系统损伤影响较小。开花期叶片净光合速率的下降可能是干旱诱导的叶绿素降解或合成受阻导致光系统损害程度和气孔限制双重影响的结果;而干旱诱导叶绿素降解或合成受阻可能与叶片的水分状况有关,如豫谷1号维持了相对更高的叶片相对含水量,提高叶片相对含水量有助于缓解干旱对作物植株的伤害进而提高其对干旱的耐受能力[33]。
3.2 β-淀粉酶与改善谷子抗旱性
干旱胁迫下,非结构性碳积累对植物响应胁迫具有重要作用[34-35]。干旱胁迫下,麻栎幼苗会提高整株非结构性碳水平而提高叶片非结构性碳含量,说明非结构性碳含量积累可能有助于与抗旱性的提高[34];而马铃薯则提高块茎中非结构性碳含量来缓解干旱胁迫导致的产量抑制[35];因此,叶片的非结构性碳积累是植物抗性提高的重要因素之一。本研究中抗旱性较强的豫谷1号其功能叶片非结构性碳含量要高于安04,并且干旱胁迫显著诱导了豫谷1号非结构性碳积累,这种在干旱胁迫下叶片非结构性碳急剧积累有可能是豫谷1号维持较高光合速率及产量的重要机制之一。
淀粉是植物夜间新陈代谢所需的重要物质来源,可溶性糖是植物呼吸作用的能量基础。长期干旱胁迫显著提高了高粱叶片可溶性糖含量,而淀粉含量虽有提高但并不显著[36];本研究中抗旱性较强品种积累了更高的可溶性糖,说明可溶性积累可能是植物抵御干旱的重要途径。干旱胁迫下,刺槐幼苗可能通过将叶片内临时存储的少量淀粉转化成其直接利用的可溶性糖的方式,以维持其正常的新陈代谢[37]。β-淀粉酶介导的淀粉分解是可溶性糖形成的最主要来源。烟草中超表达枳PtrBAM1基因能有效提高β-淀粉酶活性诱导蔗糖和可溶性糖积累从而提高烟草对冷胁迫和冻害的抗性,而柠檬PtrBAM1突变体则由于不能诱导蔗糖和可溶性糖积累而降低其抗冷性[38]。渗透胁迫导致拟南芥AtBAM1表达从而降低光照条件下淀粉积累提高可溶性糖含量来适应水分变化[39]。在茶树中,通过调控BAM表达和活性来增强茶树对干旱等胁迫的抗性也已得到证实[40]。本研究中干旱胁迫下豫谷1号大幅度上调SiBAM1a和SiBAM1b基因表达,这可能是谷子叶片可溶性糖积累的重要原因之一。
外源施用β-淀粉酶活性专一性抑制剂α-环糊精进一步降低了干旱胁迫下谷子生物量积累,并且可溶性糖含量显著减少(图6),说明β-淀粉酶水解淀粉是谷子叶片可溶性糖积累的主要来源。此外,α-环糊精显著降低了叶片脯氨酸含量,这与Zanella等[41]研究发现β-amylase 1干旱胁迫下水分淀粉以维持脯氨酸合成的结果相一致;而可溶性糖和脯氨酸作为渗透调节物质对维持细胞正常的含水量和膨压具有重要作用[42]。因此,干旱胁迫诱导谷子β-淀粉酶基因表达及β-淀粉酶活性升高,从而提高淀粉水解形成可溶性糖及渗透调节物质脯氨酸的含量是谷子抗旱性改善的重要物质基础。
4 结论
干旱胁迫显著抑制了光合速率等相关性状,进而影响谷子产量,谷子可以通过提高β-淀粉酶基因表达及活性来适应干旱;干旱胁迫下,提高谷子β-淀粉酶活性,加强淀粉水解成可溶性糖,进一步影响叶片脯氨酸的合成对提高谷子抗旱性具有重要作用。抗旱性较强的谷子品种豫谷1号通过维持较高的叶片叶绿素含量、净光合速率、光系统II最大化学效率及叶片相对含水量等途径,从而获得较高的产量,与β-淀粉酶介导的淀粉分解导致可溶性糖积累有重要关系。此外,干旱胁迫下,豫谷1号具有较高叶片蒸腾的情况下,依然维持高的叶片相对含水量可能与其根系吸水能力有关,需要进一步试验研究。
致谢:山西农业大学王兴春教授提供xiaomi系列材料。

