双管离子选择性微电极制备方法研究
李进海,薛 琳,周 桥,黄 岚,王忠义
双管离子选择性微电极制备方法研究
李进海1,薛 琳2,周 桥1,黄 岚1,王忠义1※
(1. 中国农业大学信息与电气工程学院,北京 100083;2. 北京联合大学智慧城市学院,北京 100101)
双管离子选择性微电极被广泛应用于植物细胞外离子流速和细胞内离子活度的测量,但双管离子选择性微电极(Ion-Selective Microelectrode,ISME)的制备过程繁琐,不可控因素多,制备成功率低。针对存在的问题,该研究提出了一种简易、快速的双管ISME制备方法。首先,介绍了双管微电极制备、硅烷化和电极尖端灌充液态离子交换剂(Liquid Ion Exchanger,LIX)的具体流程;其次,对制备的双管ISME的能斯特斜率和响应时间进行了测试。试验结果表明,使用蒸汽硅烷法对双管微电极进行硅烷化处理,最优硅烷化温度、二甲基二氯硅烷剂量和硅烷化时间分别为150 ℃、45L和90 min;制备的双管氢离子、钾离子、钙离子、氯离子选择性微电极的能斯特斜率分别为54.08、56.51、27.08和-58.80 mV/dec;4种双管ISME的响应时间介于0.20~0.42 s之间。研究结果表明,由该研究制备方法制作的双管ISME,可以满足植物细胞外离子流速和细胞内离子活度信息检测的要求。双管ISME的快速制备,降低了离子选择性微电极技术的应用难度,将有利于植物电生理检测试验的进行和离子选择性微电极技术在农作物育种、生理抗逆、植物营养吸收与同化等研究领域的应用。
微电极;试验;双管离子选择性微电极;硅烷化;制备方法
0 引 言
离子选择性电极(Ion-Selective Electrode,ISE)是一种电化学传感器,可将溶液中特定离子的活度转换为电位,因此也称为特定离子电极(Specific Ion Electrode,SIE)。由于离子选择性电极功能的实现需要借助对特定离子具有选择性响应的电极膜,因此又称为膜电极。根据国际纯化学和应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)建议,离子选择膜分为液态膜、固态膜和特殊膜等[1]。液态膜又称液态离子交换剂,具有良好的线性检测范围和快速的动态响应时间,可作为离子选择性膜灌充在玻璃微电极的尖端,制成离子选择性微电极。离子选择性微电极技术实现了在介观时空尺度对植物的电生理活动的监测,包括对植物细胞外离子流速的动态检测和对细胞内特定离子活度的实时测量[2-3]。
细胞外离子流速动态检测是指在不损伤生物活体样品的前提下动态监测离子进出细胞膜的过程[4-5]。1974年,美国海洋生物学实验室(Marine Biological Laboratory,MBL)的神经科学家Jaffe等[6]首次提出了无损检测的原始概念,并采用振动电极技术实现了对细胞外电流信号的测量。1990年,Kühtreiber等[7]在已有的细胞外电流检测系统的基础上,利用微电极振动技术和离子选择性电极首次记录到了细胞外的钙离子流速,开创了离子跨膜研究由静态转为动态的先河。细胞外离子流速检测可以在不破坏细胞的情况下检测离子进入细胞的流速和方向,为判断植物的生理状态提供依据[8-9]。目前应用该技术可以测量的离子包括钙离子(Ca2+)、氢离子(H+)、钾离子(K+)、钠离子(Na+)、氯离子(Cl-)、镁离子(Mg2+)、镉离子(Cd2+)、铵根离子(NH4+)和硝酸根离子(NO3-)等[10-12]。细胞内离子活度的测量,实际上是将膜电位测量技术与离子选择性微电极技术相结合,在活体条件下直接将离子选择性微电极刺入单个细胞,测定细胞内特定离子活度的实时变化。该技术被广泛用于分析离子在细胞中的区域化分布和研究植物对养分离子的吸收机制[13-15]。ISME的成功制备是实现离子选择性测量的先决条件。ISME分为单管和双管ISME,通常使用硼硅酸盐玻璃毛细管拉制而成,其内部灌充电解质溶液和液态离子交换剂。单管ISME制备工艺成熟,制作过程比较简单,但无法消除电迁移或膜电位变化对数据获取产生的干扰,影响测量数据的准确性。双管ISME可以很好地解决试验中的干扰问题,能够获取更为准确的生理信息数据,但制作过程繁琐、不可控因素多,制备成功率低[16-18]。
综上,为了获取更为准确的离子活度和离子流速信息,针对双管ISME制备存在的问题,本研究利用单根隔壁式(一管双腔)硼硅酸盐玻璃毛细管制作双管微电极,提出一种简易、高效的双管微电极灌充方法,并确定了双管ISME的硅烷化参数,对制备的双管钾离子、钙离子、氢离子、氯离子选择性微电极的能斯特斜率和响应时间进行测试。双管ISME的快速制备,将有利于促进离子选择性微电极技术在农作物育种、生理抗逆和植物营养吸收与同化等研究领域的应用。
1 双管离子选择性微电极(ISME)工作原理
1.1 双管离子选择性微电极(ISME)测定植物细胞外离子流速

但当植物细胞产生动作电位时,细胞(或者组织)作为一个点源会影响细胞外空间中的电场分布[22-23],此时电迁移对离子流速测量的影响不可忽略。此时伴随电极需同步测得两测量点1和2处的电压值21和22。基于能斯特-普朗克(Nernst-Planck)方程,得到准确的离子流速如式(2)所示。
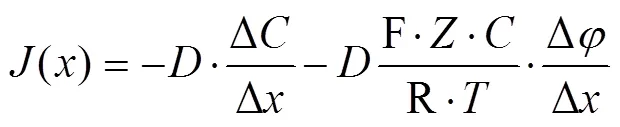
式中F为法拉第常数,F=96 485.33 C/mol;为基液中待测离子的浓度,mol/L。为绝对温度,K;R为理想气体常数,R=8.314 J/(K·mol);为离子的化合价;Δ为伴随电极在1和2间的电势差,V。
1.2 双管离子选择性微电极(ISME)测定植物细胞内离子活度
植物细胞膜电位的测量通常是将尖端直径小于1m的单管玻璃微电极内部灌充电解质溶液,然后刺入细胞,通过氯化银电极、前置放大器与数据采集系统相连,经模数转换后得到膜电位的变化数值[20]。微电极刺入植物细胞后,测得的电极与基液中参比电极间的电势差即为细胞的膜电位。若将硅烷化后的单管微电极尖端灌充LIX后再刺入植物细胞,则可对细胞内特定离子的离子活度进行选择性测量(图1)。在进行植物细胞内离子活度测量时,测得的数据是ISME与基液中参比电极间的电势差3(mV),这个电势差不仅包含ISME刺入细胞后,ISME响应离子活度的能斯特电势i(mV),还包含该细胞的膜电位4(mV)。因此,欲得到准确的离子活度值,需要先扣除膜电位的影响,即i=3-4,再将i经过该电极的能斯特方程计算后,可得到相应离子在细胞内的离子活度。
1.液态离子交换剂 2.离子选择性微电极的内充电解液 3.伴随电极的内充电解液
1.Liquid ion exchanger 2.Filling electrolyte solution of the ISME 3.Filling electrolyte solution of the accompanying electrode
注:1和2为双管ISME测定细胞外离子流速时的2个测量点;11和12分别为离子选择性微电极在2个测量点测得的电压值,mV;21和22为伴随电极在2个测量点测得的电压值,mV;3和4分别为利用双管ISME测定细胞内离子活度时离子选择性微电极和伴随电极测得的电压值,mV。
Note:1and2are the two measuring points for the double-barreled ISME to measure the extracellular ion flux;11and12are the voltage values measured by the ISME at1and2, respectively, mV;21and22were the voltage values measured by the accompanying electrode at the two measuring points, mV;3and4are the voltage values measured by the ISME and the accompanying electrode respectively when the intracellular ion activity was measured by double-barreled ISME, mV.
图1 双管离子选择性微电极工作原理示意图
Fig.1 Schematic diagram of working principle of double-barreled Ion-Selective Microelectrode (ISME)
2 双管离子选择性微电极(ISME)的制备
2.1 双管微电极的制备
双管ISME的制备分为3步,分别为制作双管微电极,双管微电极硅烷化以及在双管微电极尖端灌充LIX,因此制备双管ISME首先要制作双管微电极。传统双管微电极的制备方法极为复杂,制作流程如图2a所示。1)将2支硼硅酸盐玻璃毛细管固定。2)将2支固定在一起的玻璃毛细管穿过加热丝,加热后将玻璃毛细管扭转180°。3)使用拉制仪(P97,Sutter,美国)将扭转后的玻璃毛细管拉制成尖端直径符合要求的微电极。4)利用酒精灯将双管微电极中的伴随电极尾端烧弯,便于将LIX与电解液从电极尾部灌入后使用压力推至电极尖端。传统双管微电极制备采用上述工艺的主要原因是传统双管ISME制备无法采用简单地正向灌充LIX的方法而只能选择背向灌充LIX。本研究在解决了双管ISME正向灌充LIX工艺的基础上(详见2.3)利用隔壁式硼硅酸盐玻璃毛细管¾Septum Theta(TST150-6;World Precision Instruments,美国)制作双管微电极(图2b),该方法无需复杂的制备工艺,只需使用拉制仪将隔壁式硼硅酸盐玻璃毛细管拉制成尖端直径为6~10m的双管微电极。
2.2 双管微电极的硅烷化
硼硅酸盐玻璃表面存在大量游离的OH-基团,具有亲水疏脂的特性,导致具有脂类特性的LIX无法在电极的尖端长时间保持[24]。硅烷化的目的是使微电极的管壁呈现亲脂性,进而提高电极的使用寿命。双管微电极中伴随电极的内充液是电解质溶液,硅烷化后易在电极尖端形成空腔,因此硅烷化时,使用耐高温的导热硅脂将伴随电极末端封住,也可以使用医用凡士林。本研究使用蒸汽硅烷法对双管微电极进行硅烷化处理(图3),硅烷化试剂为二甲基二氯硅烷。硅烷化器皿为100 mL的玻璃烧杯,使用硅胶薄膜将烧杯口罩住,硅胶薄膜上有孔洞用于固定电极。硅烷化时,将电极尖端朝上放置,非尖端插入孔洞,薄膜的弹性会将电极紧密束缚,随后整体放入恒温箱中加热。本研究关于电极硅烷化的试验,是在以往关于单管离子选择性微电极硅烷化研究基础上进行的[24],其目的是为了进一步探索双管离子选择性微电极尖端保持LIX能力最强时的硅烷化条件。
2.3 双管微电极的灌充
灌充LIX在双管ISME的制备过程中最为困难。传统双管ISME制备时采用2支单管玻璃毛细管合并而不使用1支双管玻璃毛细管,目的是为了将玻璃毛细管的末端弯曲,以便于灌充。微电极的灌充分为正向灌充和背向灌充。正向灌充时,先在微电极的内部灌注电解质溶液,然后将电极尖端接触LIX池,随后LIX会被吸入到微电极的尖端。正向灌充时使用的LIX量较少,可使用商品化的离子载体混合物(如表1所示)。由于背向灌充成功率低,为了降低成本一般自行配制LIX:将一定比例的离子载体、增塑剂、添加剂和基质溶解于四氢呋喃,混合均匀后用微量进样器将LIX从离子选择性微电极的尾部注入,随后在干燥瓶中放置3 d,待四氢呋喃完全挥发后,电极尖端会留下固态或半固态的离子选择性膜,最后向微电极内灌注电解质溶液。
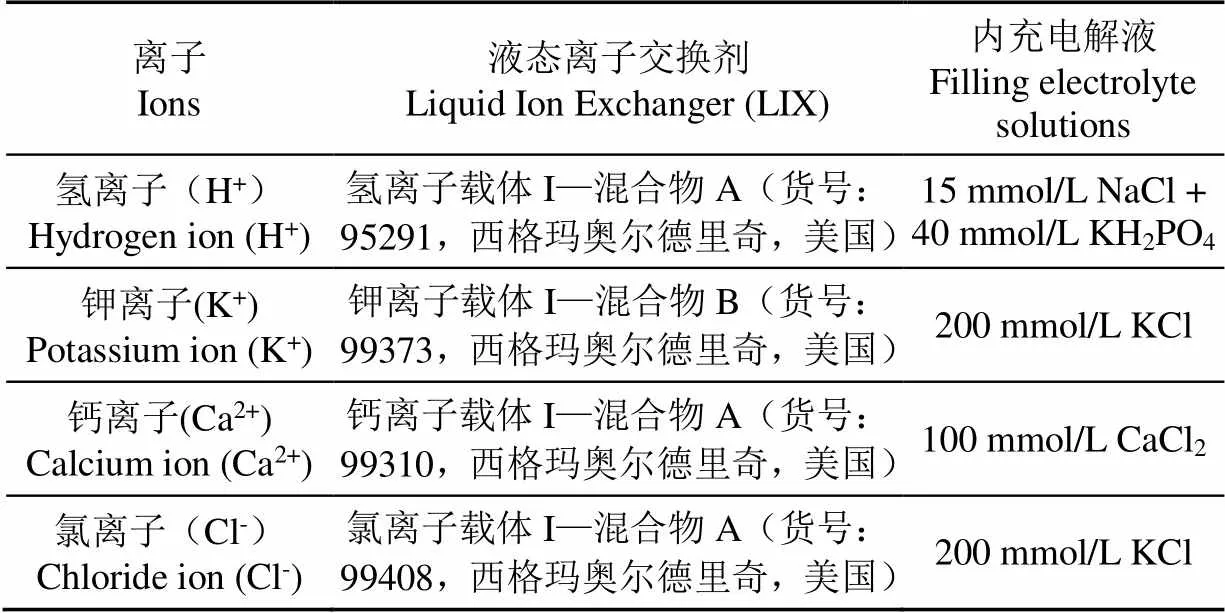
表1 商用液态离子交换剂及其对应的内充电解液
正向灌充方法简单,电极制作成功率高。背向灌充的过程较为繁琐,存在一些不可控的因素,电极制作成功率低,例如电极尖端离子选择性膜的成型容易出现问题、无法与管壁有效贴合、或者膜上存在孔隙等;同时,背向灌注电解液时,电解液与液态膜可能无法形成有效的接触液面;亦或在电极中存在无法排出的气泡甚至气柱等。正向灌充在单管ISME制备中得到广泛的应用,而在双管ISME制备中却不适用。主要原因是双管ISME的伴随电极在灌充时会同步吸入LIX(硅烷化的目的只是提高LIX在玻璃微电极尖端的保持能力)。即使利用压力将LIX从伴随电极中推出,LIX也会从离子选择性电极再次被吸入到伴随电极尖端,这也是自行配制的离子选择性膜需要呈现半固态(流动性较弱)的原因。
双管ISME尖端灌充LIX的具体过程如下:
1)配制琼脂溶液。使用与伴随电极电解液成分相同的无机盐溶液配制浓度为0.3%~0.5% 琼脂溶液,并用磁力搅拌器将琼脂溶液搅拌加热至沸腾;
2)使用微量进样器将10L沸腾的琼脂溶液注入伴随电极,随后使用压力注入法将溶液推至电极尖端;
3)在琼脂溶液凝固前,使用微量进样器向伴随电极中灌注20L电解质溶液,其成分与基液成分相同。由于琼脂溶液中无机盐离子浓度与伴随电极内充液中无机盐离子浓度相同,因此不会对后续的测量产生影响;
4)使用微量进样器向离子选择性微电极内灌充30L电解液(表1),并使用压力注入的方法将电解液推至电极尖端;
5)使用正向灌注的方法灌充LIX。将双管ISME接触LIX池,LIX会被吸入离子选择性微电极,伴随电极由于琼脂块的阻挡,不会吸入LIX。
需要注意的是,琼脂溶液的凝固时间随着琼脂浓度的增加而缩短,浓度过高,琼脂溶液会在伴随电极尖端快速凝固;反之,若浓度过低则容易产生气泡。伴随电极的内充液为100 mmol/L氯化钾溶液,测量离子流速时的伴随电极内充液为基液,一般为2 mmol/L 氯化钾和1 mmol/L氯化钙的混合溶液。使用改进灌充方法制备的双管ISME如图4所示。
3 双管离子选择性微电极(ISME)性能测试
双管ISME的性能测试在中国农业大学开发的自参考离子选择性微电极技术(Self-referencing Ion Electrode Technique,SIET)测试系统[20]上进行。该系统采用离子选择性玻璃微电极和膜电位玻璃微电极作为传感器,将传感器通过高输入阻抗前置放大器连接到动态测量系统,实现对植物细胞外离子流速、细胞内离子活度以及细胞膜电位的测量。
3.1 硅烷化效果测试
电极硅烷化的效果直接决定了ISME的使用寿命。薛琳[24]通过大量试验验证了时间(min)、温度(℃)、试剂用量(L)等因素对单管ISME硅烷化效果的影响。发现当硅烷化器皿为100 mL,二甲基二氯硅烷剂量、硅烷化时间和温度分别为20L、30~45 min、150 ℃时,硅烷化的效果最佳,并确定影响硅烷化效果的敏感性因素由大到小依次为硅烷化温度、硅烷化试剂用量和硅烷化时间[20]。本研究对改进的双管ISME进行硅烷化时,发现在20L、30~45 min、150 ℃的组合参数下,硅烷化效果并不稳定,因此通过设计电极的硅烷化梯度试验,对双管ISME的硅烷化参数进行调整,以找到普适性最强的双管ISME硅烷化组合参数。
3.2 能斯特斜率测试
能斯特斜率是检验离子选择性微电极制作成功与否的标准。利用离子选择性电极检测植物细胞外离子流速和细胞内离子活度前,需要对电极的能斯特斜率进行标定。ISME的实测能斯特斜率可由电极浸入溶液时的电位(,mV)与标定液中待测离子的离子活度之间的关系得到,如式 (3)所示。然后与式(4)得到的理论能斯特斜率值进行比较。离子选择性微电极的实测能斯特斜率应不小于理论能斯特斜率的90%,否则电极被认为不符合工作要求[25]。
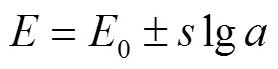
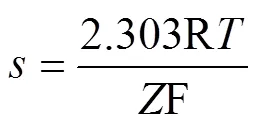
式中0为能斯特截距,mV;为能斯特斜率,mV/dec。测试得到的能斯特斜率与理论值越接近,说明电极性能越好。
3.3 响应时间测试
测量植物细胞外离子流速时,需要将ISME以固定时间在1与2间2个固定点间(图1)做往复运动。ISME分别在2个固定点处短暂停留,分别测出ISME在1、2处的响应电位值。电极在2个测量点停留的时间可由系统设置,但必须不小于选择性膜的响应时间。响应时间是指从离子选择性微电极接触标定液时起到电极电位稳定值的95%所经过的时间[25],本研究测试了K+、Ca2+、H+、Cl-共4种双管ISME的响应时间,测试现场如图5所示。
4 结果与分析
4.1 最优硅烷化参数
由于硅烷化对温度最为敏感,使得硅烷化的效果不容易被控制,因此本研究在课题组先前研究获取的单管微电极硅烷化参数的基础进行进一步研究[24],在保持温度(150 ℃)不变的条件下,通过调整硅烷化试剂用量和硅烷化时间来获取最优参数组合。使用的硅烷化器皿容积为100 mL,一次性硅烷化6根电极,硅烷化试剂为二甲基二氯硅烷。由于烧杯材料为高硼硅酸盐玻璃,因此在首次硅烷化时对烧杯进行硅烷化处理。处理时使用硅胶薄膜将烧杯罩住,向烧杯内注入200L二甲基二氯硅烷,在150 ℃温度下烘烤2 h,使烧杯壁完全硅烷化。试验时,将尖端灌充100m LIX的双管ISME在溶液中以0.5 Hz的频率往复移动30 min,显微镜下观察尖端LIX的剩余量,剩余量越多,保持液态离子交换剂的能力越好。双管ISME硅烷化梯度试验设计如表2所示。
不同种类ISME所需的硅烷化条件不同,相对而言,Ca2+选择性电极对电极硅烷化的条件要求并不苛刻,而Cl-选择性电极随着应用硅烷化试剂量和时间的增加,测试时尖端仍会有少量的LIX渗出,虽然会在一定程度上影响尖端电位的稳定,但短时间测量不会产生较大影响。由表2试验数据可知,使用45L试剂(二甲基二氯硅烷)在150 ℃下烘烤90 min得到的离子选择性电极保持液态离子交换剂能力的普适性最强。
注:每组试验的样本数为6,液态离子交换剂剩余量为每组样本的平均值±标准差;“—”是由于该试验条件下,部分电极尖端的LIX出现分段现象,这是由于“过硅烷化”导致的,此时电极不可用。
Note: The number of samples in each group was 6. The remaining amount of the liquid ion exchanger was means ± standard deviation of each set of samples. “—” means the segmentation phenomenon of LIX at some electrode tips under this test condition, which was caused by “hyper-silanization”, and the electrodes were not available at this time.
4.2 能斯特斜率
本研究对制备的K+、Ca2+、H+、Cl-双管ISME的能斯特斜率进行测试,其结果如表3所示。由于温度的变化会对实际测得的电极能斯特斜率产生影响,此次试验选定在室温25 ℃下进行。此条件下一价离子的能斯特斜率理论值的绝对值为59.16 mV/dec,二价离子绝对值为29.28 mV/dec。当实测能斯特斜率达到理论能斯特斜率的90%时,一价离子实测能斯特斜率的绝对值不小于53.24 mV/dec,二价离子绝对值不小于26.35 mV/dec。由表3可知,利用文中方法制作的双管ISME的实际能斯特斜率均可以到达理论值的90%以上,可以满足植物细胞外离子流速和细胞内离子活度的测量要求。表3中离子选择性微电极的实际能斯特斜率低于理论值的原因,是由于离子选择性微电极虽然对某种离子具有选择性,但并非仅对特定离子具有选择性,即溶液中的同价离子也有可能被ISME检测到,这些离子通常被称为干扰离子。例如,K+选择性电极对Na+也具有一定的选择性,只是该电极对K+的选择性更高。此外影响电极实际能斯特斜率的因素还有很多,例如室内温度过高或过低都会影响电极的实际能斯特斜率。由于存在诸多因素的影响,从试验中积累的经验以及获取的数据上看,对于实际能斯特斜率的绝对值而言,一价离子(55±5 mV/dec),二价离子(26 ±3 mV/dec)都是可接受的。
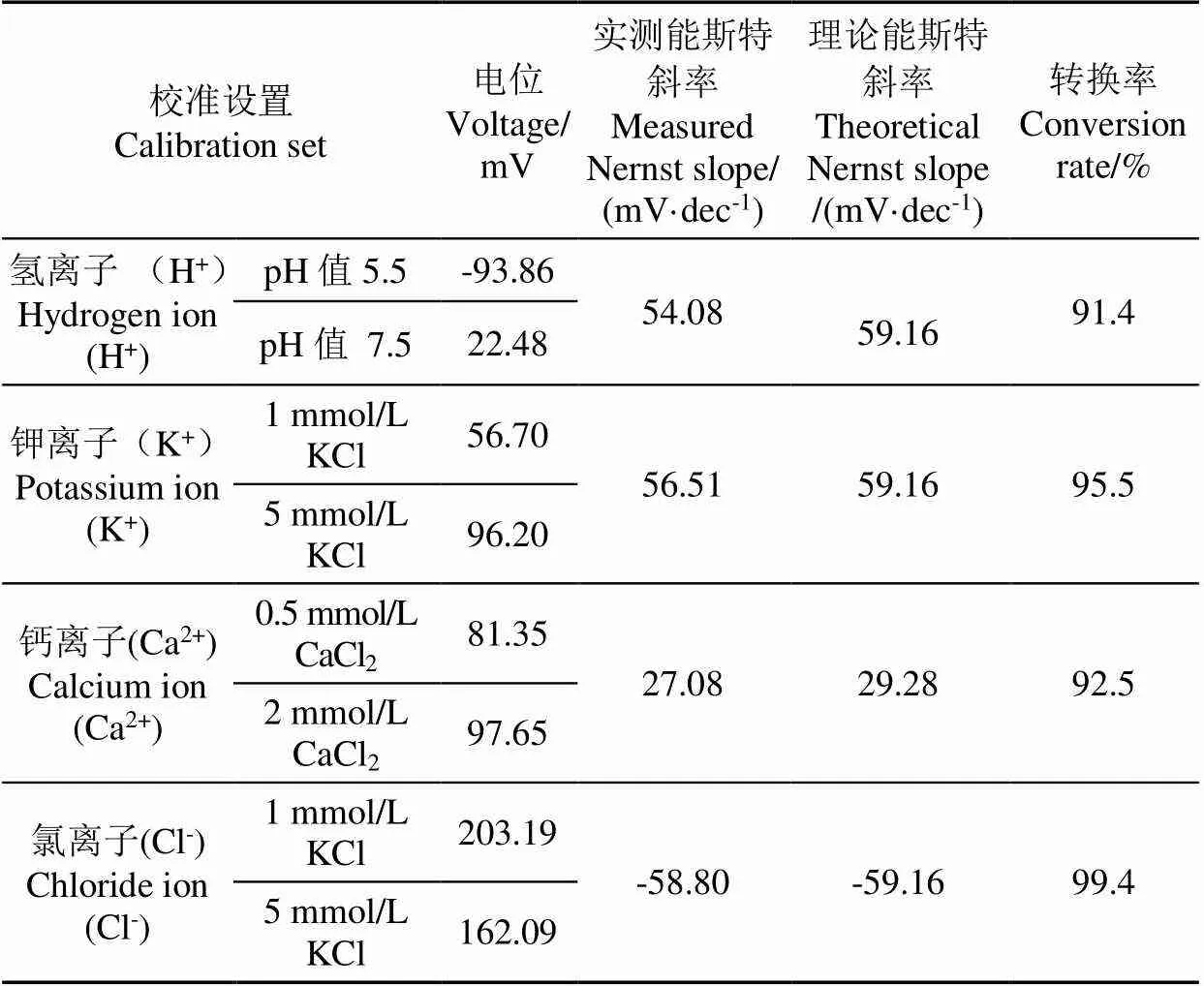
表3 双管离子选择性微电极的能斯特斜率测试结果
4.3 响应时间
响应时间的测试结果如表4所示。响应时间的最大值是决定离子选择性微电极性能的重要因素。在进行离子流速测量时,电极响应时间越长,电极往复移动的时间间隔就会越大,电极的数据采集频率就会越低,这势必会影响到电活动快速变化时离子流速信息的记录。因此,需要依据响应时间确定电极的振动频率。试验结果显示,Ca2+选择性电极测试时出现了最长的响应时间为0.42 s,因此电极在测试时的停留时间须高于0.42 s。目前文献中使用SIET技术测试细胞外离子流速时,ISME的数据采集频率为0.5 Hz[26-28],对应的电极的往复移动周期为2 s,此时电极每次在2个固定点间的移动时长为1 s,在2个测量点的停留时间各为0.5 s(大于0.42 s),满足本研究测试双管离子选择性电极对响应时间的要求。因此,使用双管ISME测试离子流速时,0.5 Hz是一个较为合理的数据采集频率。
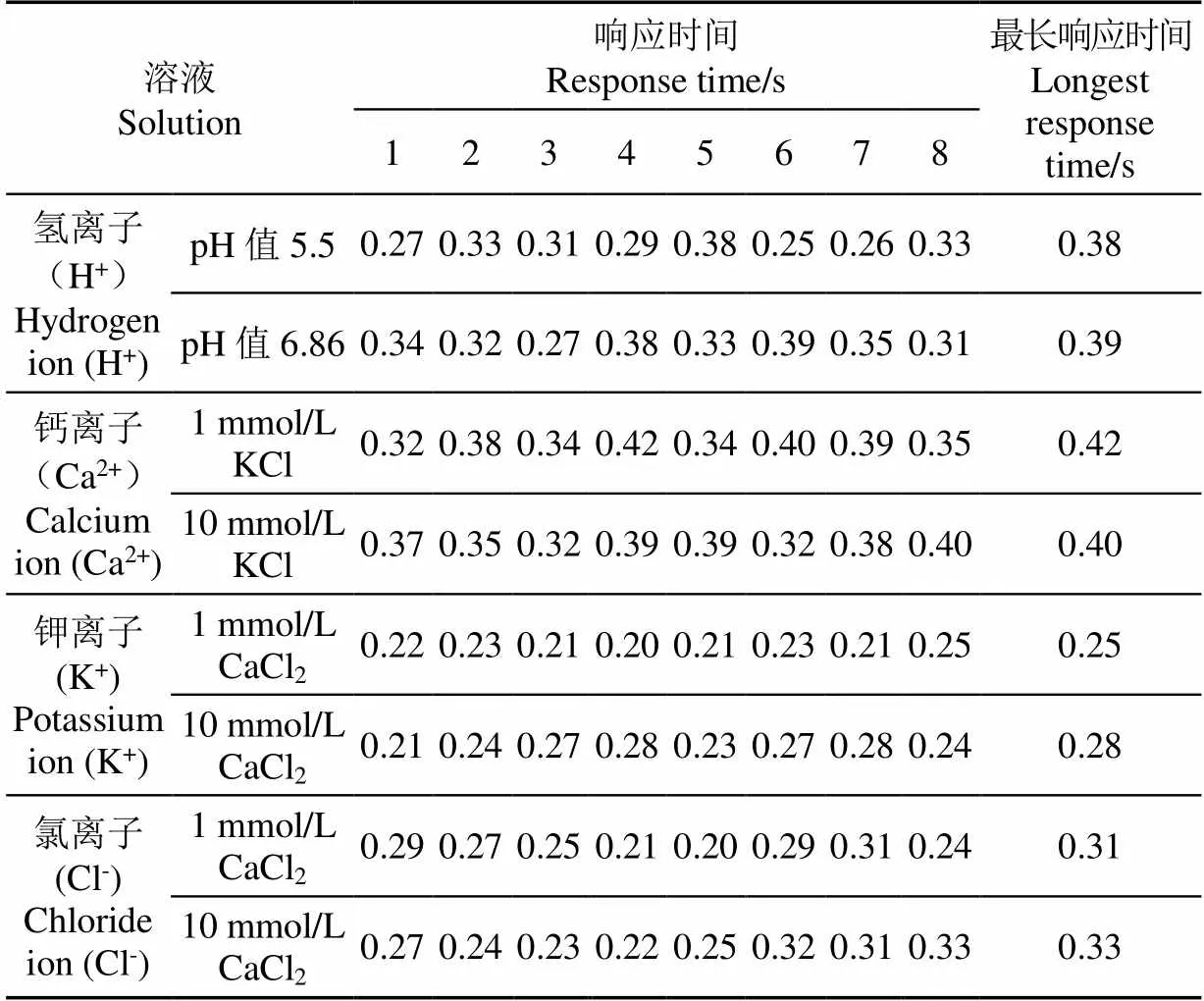
表4 双管离子选择性微电极的响应时间测试结果
注:1~8为试验次数,响应时间为从电极接触溶液开始到接触电位稳定所需时间的95%。
Note: 1-8 represent the number of tests. Responded time was 95% of the time from the start of the electrode contact with the solution to the stabilization of the contact potential.
5 结 论
本研究提出了一种简易的双管离子选择性微电极制备方法,解决了传统双管离子选择性微电极制备过程繁琐、不易制备成功的难题。本研究的主要结论如下:
本研究详细介绍了双管微电极制备和电极尖端灌充液态离子交换剂的具体流程,并确定双管微电极的最优硅烷化温度、二甲基二氯硅烷剂量和硅烷化时间分别为150 ℃、45L和90 min。制备的双管氢离子、钾离子、钙离子、氯离子选择性微电极的能斯特斜率达到了54.08、56.51、27.08和-58.80 mV/dec,可以满足离子选择性电极使用要求;4种双管ISME的响应时间介于0.20~0.42 s之间,并以此为依据确定了离子流速测量时电极的移动频率(0.5 Hz)。将双管离子选择性微电极制备方法化繁为简,有利于促进离子选择性微电极技术在农业工程、作物育种、生理抗逆以及植物细胞营养等研究领域的广泛应用。
[1] Ammann D. Ion Selective Microelectrodes: Principles, Design and Application[M]. Berlin: Springer Science & Business Media, 2013.
[2] Li J H, Yue Y, Wang Z Y, et al. Illumination/Darkness-induced changes in leaf surface potential linked with kinetics of ion fluxes[J/OL]. Frontiers in Plant Science, [2019-10-10], https: //www. sci-hub. se/10. 3389/fpls. 2019. 01407.
[3] Wang Y, Dindas J, Rienmüller F, et al. Cytosolic Ca2+signals enhance the vacuolar ion conductivity of bulging Arabidopsis root hair cells[J]. Molecular Plant, 2015, 8(11): 1665-1674.
[4] Gill M B, Zeng F R, Shabala L, et al. The ability to regulate voltage-gated K+-permeable channels in the mature root epidermis is essential for waterlogging tolerance in barley[J]. Journal of Experimental Botany, 2018, 69(3): 667-680.
[5] Wu H H, Shabala L, Zhou M X, et al. Root vacuolar Na+sequestration but not exclusion from uptake correlates with barley salt tolerance[J]. The Plant Journal, 2019, 100(1): 55-67.
[6] Jaffe L F, Robinson K R, Nuccitelli R. Local cation entry and self-electrophoresis as an intracellular localization mechanism[J]. Annals of the New York Academy of Sciences, 1974, 238(1): 372-389.
[7] Kühtreiber W M, Jaffe L F. Detection of extracellular calcium gradients with a calcium-specific vibrating electrode[J]. The Journal of Cell Biology, 1990, 110(5): 1565-1573.
[8] Wu H H, Shabala L, Azzarello E, et al. Na+extrusion from the cytosol and tissue-specific Na+sequestration in roots confer differential salt stress tolerance between durum and bread wheat[J]. Journal of Experimental Botany, 2018, 69(16): 3987-4001.
[9] Al Nayef M, Solis C, Shabala L, et al. Changes in expression level ofOsHKT1; 5 alters activity of membrane transporters involved in K+and Ca2+acquisition and homeostasis in salinized rice roots[J/OL]. International Journal of Molecular Sciences, [2020-07-06], https: //www. mdpi. com/1422-0067/21/14/4882
[10] Yan X F, Wang Z Y, Huang L, et al. Research progress on electrical signals in higher plants[J]. Progress in Natural Science, 2009, 19(5): 531-541.
[11] Li J H, Fan L F, Zhao D J, et al. Plant electrical signals: A multidisciplinary challenge[J/OL]. Journal of Plant Physiology, [2021-04-06], https: //doi. org/10. 1016/j. jplph. 2021. 153418.
[12] Wegner L H, Li X W, Zhang J, et al. Biochemical and biophysical pH clamp controlling net H+efflux across the plasma membrane of plant cells[J]. New Phytologist, 2021, 230(2): 408-415.
[13] Rubio L, García D, García‐Sánchez M J, et al. Direct uptake of HCO3−in the marine angiosperm(L.) Delile driven by a plasma membrane H+economy[J]. Plant, Cell & Environment, 2017, 40(11): 2820-2830.
[14] Rubio L, García-Pérez D, García-Sánchez M J, et al. Na+-dependent high-affinity nitrate, phosphate and amino acids transport in leaf cells of the seagrass(L.) Delile[J/OL]. International Journal of Molecular Sciences, [2018-05-22], https: //doi. org/10. 3390/ijms19061570.
[15] Demes E, Besse L, Cubero-Font P, et al. Dynamic measurement of cytosolic pH and [NO3−] uncovers the role of the vacuolar transporterin cytosolic pH homeostasis[J]. Proceedings of the National Academy of Sciences, 2020, 117(26): 15343-15353.
[16] Deveau J S T, Lindinger M I, Grodzinski B. An improved method for constructing and selectively silanizing double-barreled, neutral liquid-carrier, ion-selective microelectrodes[J]. Biological Procedures Online, 2005, 7(1): 31-40.
[17] Haack N, Durry S, Kafitz K W, et al. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue[J/OL]. Journal of Visualized Experiments, [2015-09-05], http: //www. jove. com/video/53058.
[18] Rubio L, García-Pérez D, Davies J M, et al. Short-term response of cytosolic NO3−to inorganic carbon increase inleaf cells[J/OL]. Frontiers in Plant Science, [2020-06-10], https: //www. frontiersin. org/articles/10. 3389/fpls. 2020. 00955/full
[19] Xue L, Zhao D J, Wang Z Y, et al. The calibration model in potassium ion flux non-invasive measurement of plants[J]. Information Processing in Agriculture, 2016, 3(2): 76-82.
[20] Wang Z Y, Li J H, Zhou Q, et al. Multi-channel system for simultaneous in situ monitoring of ion flux and membrane potential in plant electrophysiology[J]. IEEE Access, 2018, 7: 4688-4697.
[21] Donini A, O'Donnell M J. Analysis of Na+, Cl-, K+, H+and NH4+concentration gradients adjacent to the surface of anal papillae of the mosquito Aedes aegypti: application of self-referencing ion-selective microelectrodes[J]. Journal of Experimental Biology, 2005, 208(4): 603-610.
[22] Holt G R, Koch C. Electrical interactions via the extracellular potential near cell bodies[J]. Journal of Computational Neuroscience, 1999, 6(2): 169-184.
[23] Agudelo-Toro A, Neef A. Computationally efficient simulation of electrical activity at cell membranes interacting with self-generated and externally imposed electric fields[J/OL]. Journal of Neural Engineering, [2013-02-14], http: //iopscience. iop. org/1741-2552/10/2/026019.
[24] 薛琳. 逆境下的作物离子交换无损检测与分析关键技术研究[D]. 北京:中国农业大学,2016.
Xue Lin. Key Technique of Non-Invasive Ion Flux Recording and Analyzing in Crop Under Abiotic Stress[D]. Beijing: China Agriculture University. 2016. (in Chinese with English abstract)
[25] 薛琳,赵东杰,侯佩臣,等. 自参考离子选择性电极技术应用中的微电极制备及测试[J]. 农业工程学报,2013,29(16):182-189.
Xue Lin, Zhao Dongjie, Hou Peichen, et al. Test and preparation of microelectrode in applications of self-referencing ion electrode technique[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 29(16): 182-189. (in Chinese with English abstract)
[26] Sun J, Chen S L, Dai S X, et al. NaCl-induced alternations of cellular and tissue ion fluxes in roots of salt-resistant and salt-sensitive poplar species[J]. Plant Physiology, 2009, 149(2): 1141-1153.
[27] Newman I, Chen S L, Porterfield D M, et al. Non-Invasive Flux Measurements Using Microsensors: Theory, Limitations, and Systems[M]. Totowa: Humana Press, 2012.
[28] Niu M L, Xie J J, Chen C, et al. An early ABA-induced stomatal closure, Na+sequestration in leaf vein and K+retention in mesophyll confer salt tissue tolerance in Cucurbita species[J]. Journal of Experimental Botany, 2018, 69(20): 4945-4960.
Preparation of double-barreled ion-selective microelectrodes
Li Jinhai1, Xue Lin2, Zhou Qiao1, Huang Lan1, Wang Zhongyi1※
(1.100083,; 2.100101,)
Ion-Selective Microelectrode (ISME) technology has widely been used to evaluate the plant electrical activity in mesoscopic space-time scale, including dynamic measurements on extracellular ion fluxes and intracellular ion activities. But the interference of electromigration or membrane potential changes has posed a great challenge on the traditional single-barreled ISME during the electrophysiological experiments, particularly on the accuracy of measured data. In this study, a double-barreled ISME monitoring scheme was proposed to eliminate the influence of potential drift on the measurement for more accurate information of ion flux. A simple and rapid preparation process of double-barreled ISMEs fabrication was also developed to widen the application of ion-selective electrode technology. Septum Theta (a borosilicate glass capillary with two cavities) was used to fabricate the improved double-barreled microelectrode during preparation, particularly on the silanization and liquid ion exchanger filling in the microelectrode tip of double-barreled ISME. The experimental measurements were conducted for the Nernst slope and response time of double-barreled ISMEs. A standardized feasibility plan was provided for the preparation and performance testing of double-barreled ISMEs. Experimental results showed that the optimal silanization temperature, dimethyldichlorosilane dosage, and silanization time were 150 ℃, 45L, and 90 min, respectively, when the double-barreled microelectrodes were silanized by the steam silane. In this case, the double-barreled ISME that filled 100m liquid ion exchanger in the tip was reciprocated in the test solution at a frequency of 0.5Hz for 30min, where the remaining amount of liquid ion exchanger was observed under the microscope. The remaining amount of liquid ion exchanger was (100±0)m in the double-barreled potassium ion, calcium ion, and hydrogen ISMEs’ tip. In double-barreled chlorine ISMEs, the remaining amount of liquid ion exchanger in the tip was (90±8.2)m. The Nernst slopes of double-barreled hydrogen ion, potassium ion, calcium ion, and chlorine ISMEs were 54.08, 56.51, 27.08, and -58.80 mV/dec, respectively. The measured Nernst slope of ISMEs was more than 90% of the theoretical value suitable for the requirements of the application. The response time of ion-selective electrodes with different liquid ion exchangers was between 0.2 and 0.42 s. Therefore, 0.5 Hz was a reasonable vibration frequency for the measurement of extracellular ion fluxes with the double-barreled ISMEs. The experimental results demonstrated that the double-barreled ISME developed by the improved preparation can well meet the requirements of ISME technology, thereby effectively capturing the extracellular ion fluxes or intracellular ion activities of plant cells. Consequently, the facile preparation of double-barreled ISME can be expected to greatly reduce the experimental difficulty of ISME fabrication. The finding can also provide a great contribution to acquire experimental data of plant physiological detection and applications in agricultural engineering, crop breeding, physiological stress tolerance, and cellular nutrition.
microelectrodes; test; double-barreled ion-selective microelectrodes; silanization; preparation method
李进海,薛琳,周桥,等. 双管离子选择性微电极制备方法研究[J]. 农业工程学报,2021,37(16):24-30.doi:10.11975/j.issn.1002-6819.2021.16.004 http://www.tcsae.org
Li Jinhai, Xue Lin, Zhou Qiao, et al. Preparation of double-barreled ion-selective microelectrodes[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(16): 24-30. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.16.004 http://www.tcsae.org
2021-01-11
2021-05-11
国家自然科学基金项目(61571443)
李进海,博士生,研究方向为生物系统感测与智能装备。Email:lijinhai@cau.edu.cn
王忠义,博士,教授,研究方向为生物系统感测与智能装备。Email:wzyhl@cau.edu.cn
10.11975/j.issn.1002-6819.2021.16.004
O657.15
A
1002-6819(2021)-16-0024-07

