白肉灵芝水提物对神经元损伤的保护作用及其机制
王昱,秦序,何九军,王逸璇
(1.陇南师范高等专科学校农林技术学院,甘肃 成县 742500;2.陇南特色农业生物资源研究开发中心,甘肃 成县 742500;3.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
白肉灵芝是我国灵芝属中一个重要种类,菌肉洁白,多糖和三萜等活性成分含量较高,被视为高品质的灵芝种类[1].现代药理研究表明白肉灵芝中的生物活性成分稳定性高且易通过机体血脑屏障,能促进新生神经元的发生[2-3],因此在防治神经退行性疾病中备受关注.本课题组前期研究表明白肉灵芝水提物(Ganodermaleucocontextumaqueous extracts,GLAE)在增加皮肤弹性和减少皮肤皱纹形成方面有重要作用[4].而基于炎症反应、神经营养因子及相关特异蛋白分子在神经元损伤发挥保护作用的重要地位,已被学者们认为是诊断神经功能退行性疾病的重要指标与有效治疗靶点.研究发现在炎症损伤中,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1(interleukin-1β,IL-1β)是引起神经元炎症的重要因子,也是反映脑组织损伤的重要指标[5-6].脑源性神经生长因子(brain derived neurotrophic factor,BDNF)、β-神经生长因子(β-nerve growth factor,β-NGF) 、原肌球蛋白受体激酶 B(tropomyosin receptor kinase B,TrkB)和原肌球蛋白受体激酶 A(tropomyosin receptor kinase A,TrkA)是重要的神经营养蛋白及受体,对神经元的生长、发育、分化、维持和损伤修复具有重要作用[7-10].为了进一步探讨GLAE的生物学作用,本研究采用脂多糖(lipopolysaccharide,LPS)诱导神经细胞炎症损伤模型,运用ELISA法、免疫组化化学法、Western-blot和PCR等技术对GLAE的抗炎作用机制进行了研究,以期为GLAE的临床应用提供试验依据.
1 材料与方法
1.1 试剂及仪器
白肉灵芝水提物为本实验室培养制备,上海生物工程有限公司测序鉴定为白肉灵芝(Ganodermaleucocontextum).根据文献[2],取白肉灵芝子实体干品粉碎机粉碎,60目过筛,96 ℃水浴提取6 h,离心,收集上清,过滤,滤液冻干,得到GLAE.
脂多糖(LPS)来源Escherichia coli 055:B5,Sigma 公司;白细胞介素1(IL-1β)、肿瘤坏死因子α(TNF-α)放射免疫试剂盒均购自武汉博士德生物工程研究所,批号分别为EK0393、EK0526;ELISA检测试剂盒(BDNF和β-NGF),北京百奥莱博科技有限公司,批号分别为ZN2813-TXC、ZN2820-LPN;兔单抗TrkB、TrkA、BDNF、NGF购自Cell signaling 公司,批号为4603、4602、ab222060、ab52918;β-actin,Cell signaling 公司,批号4970L;HRP 标记山羊抗兔IgG购自Servicebio 公司,批号 GB23303;RNA抽提试剂盒、反转录试剂、实时荧光定量PCR试剂购自Taka Ra公司;引物由Invitrogen(上海) 公司设计合成.
主要仪器设备:DYCPZ 型电泳槽、DYY-IB 型电泳仪(北京市六一仪器厂);DKZ系列恒温水浴箱(上海一恒科技有限公司);Image Lab 凝胶分析系统(美国 Bio-Rad 公司);TGL-16M高速台式冷冻离心机(美国Beckman-coulter公司);Nikon FX-35WA显微镜(日本Nikon公司);7900 HT Sequence Detection System定量PCR仪(美国ABI公司).
1.2 试验动物与给药
10周龄健康SD大鼠50只,雌雄各半,体质量200~250 g,由兰州大学实验动物中心提供,生产许可证:SCXK(甘) 2005-0007.在恒温(21~23 ℃)、恒湿(45%~65% )、12 h明暗周期的饲养室,全价颗粒饲料喂养,自由进食和饮水.正常饲养7 d 后用随机区组法分为5组,每组10只:对照组、模型组、GLAE低、中、高剂量组[50、100、200 mg/kg)].按照试验动物福利伦理规章分别给模型组和GLAE组大鼠连续2周每日腹腔注射LPS溶液(以体质量计)0.25 mg/kg[11-12],对照组腹腔注射等体积生理盐水.同时GLAE组均按10 mL/kg进行灌胃给药[4],1 次/d,对照组灌胃等体积的生理盐水.
1.3 ELISA 法检测大脑额叶皮层IL-1β、TNF-α、BDNF和 β-NGF含量检测
末次给药后,迅速取大脑额叶皮层,洗净、冰浴匀浆,3 000 r/min离心15 min,取上清液,参考试剂盒说明书测定脑组织L-1β、TNF-α、BDNF和β-NGF含量.
1.4 免疫组织化学法观察大脑额叶皮层NGF蛋白的表达
采用免疫组化SP法(链霉菌抗生物素蛋白—过氧化物酶连结法):末次给药后,取大鼠大脑额叶皮层数块置于4%多聚甲醛固定,经脱水、石蜡包埋后冠状位切片,厚6 μm,脱蜡、抗 原修复后,用3% H2O2室温孵育10 min,正常兔血清室温封闭30 min,然后用NGF抗体(1∶200),4 ℃孵育过夜;次日取出切片以PBS冲洗后,再依次滴加生物素化羊抗兔IgG 孵育30 min,SABC工作液孵育30 min,最后DAB显色,苏木素复染,空白对照以PBS代替一抗.常规乙醇脱水、二甲苯透明、中性树胶封片,在显微镜下观察并拍照.
用美国Image-pro plus 5.0专业图像分析软件进行图像分析.从NGF阳性反应的切片中各选3张,检测活性物质在大脑皮层中表达的强度.测量时保证光源的稳定,并且取图之前预热20 min以上,采图时各项设置包括光源、光圈大小、白平衡、曝光强度、敏感度、对比度等均改为手动调节且固定,以保证每次取图系统的设置值一样.取平均光密度和积分光密度2个指标,测量值的平均值为最终灰度值.
1.5 Western blot 各组大脑额叶皮层TrkB、TrkA、BDNF、NGF蛋白的表达
按照常规方法提取细胞总蛋白,BCA蛋白质试剂盒分别测定各试验组蛋白量.依次加样、SDS-PAGE凝胶电泳、转膜和室温封闭.按抗体说明书加入兔抗鼠一抗TrkB、TrkA、BDNF、NGF(均为1∶1 000),4 ℃冰箱过夜,充分洗涤,加偶联辣根过氧化物酶(HRP)的二抗IgG(1∶2 000),ECL显色,以β-actin(1∶2 000)作为内参照,运用Image Lab 软件进行曝光成像,采用Quantity one 软件分析条带灰度值,试验重复3次.
1.6 PCR检测各组大脑额叶皮层TrkB、TrkA、BDNF、NGF mRNA的表达
取大鼠大脑额叶皮层,加入Trizol后在冰浴中匀浆,4 ℃ 12 000 r/min离心 15 min,取上清液通过酚-氯仿抽提RNA,将抽提的RNA 进行逆转录反应,实时荧光定量PCR扩增.PCR按照试剂盒说明书进行操作,反应完毕采用 ABI 7500 软件分析,用公式 2-△△Ct方法进行相对定量.

表1 目的基因引物序列
1.7 数据处理
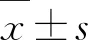
2 结果与分析
2.1 各试验组大鼠大脑额叶皮层炎症细胞因子的变化
由图1可知,模型组大鼠大脑额叶皮层TNF-α和IL-1β含量均较对照组显著增高,有极显著的统计学意义(P<0.01).与模型组比较,GLAE低、中、高剂量组大鼠大脑额叶皮层TNF-α和IL-1β含量均较模型组不同程度降低,有显著统计学意义(P<0.05,P<0.01).

同列数据肩标不同小写字母表示差异显著(P<0.05);肩标不同大写字母表示差异极显著(P<0.01);肩标相同字母或无字母标注表示差异不显著(P>0.05).
2.2 各试验组大鼠大脑额叶皮层BDNF和 β-NGF含量的变化
由表2可知,与对照组相比,模型组大鼠大脑额叶皮层BDNF和 β-NGF含量均极显著下降(P<0.01);与模型组比较,GLAE低、中、高剂量组大鼠大脑额叶皮层BDNF和 β-NGF 含量显著升高(P<0.05,P<0.01).

表2 各试验组大鼠大脑额叶皮层BDNF和 β-NGF 含量比较
2.3 各试验组大鼠大脑额叶皮层NGF蛋白的表达
由图2可知,NGF蛋白阳性表达定位于细胞膜和细胞质内,部分细胞核着色,呈棕黄色,阴性对照组细胞无NGF阳性表达.由表3可知,与对照组相比,模型组大鼠大脑额叶皮层NGF蛋白表达的平均光密度和积分光密度极显著降低(P<0.01),表明NGF蛋白的阳性细胞数极显著减少(P<0.01).与模型组相比,GLAE低、中、高剂量组大鼠大脑额叶皮层NGF蛋白表达的平均光密度和积分光密度显著增加(P<0.05,P<0.01),表明NGF蛋白的阳性细胞数显著增加(P<0.05,P<0.01).

表3 各试验组大脑额叶皮层NGF蛋白表达的比较

A:对照组;B:模型组;C:GLAE低剂量组;D:GLAE中剂量组;E:GLAE高剂量组;F:阴性对照组; “→”表示阳性细胞.
2.4 各试验组大鼠大脑额叶皮层TrkB、TrkA、BDNF、NGF蛋白的表达
由图3可知,与对照组相比,模型组大鼠大脑额叶皮层TrkB、TrkA、BDNF、NGF蛋白表达量极显著下降(P<0.01);与模型组比较,GLAE低、中、高剂量上调了大鼠额叶皮层TrkB、TrkA、BDNF、NGF蛋白的表达水平(P<0.05,P<0.01).

图3 大脑额叶皮层TrkB、TrkA、BDNF、NGF蛋白印迹分析
2.5 各试验组大鼠大脑额叶皮层TrkB、TrkA、BDNF、NGF mRNA的表达
由图4可知,与对照组相比,模型组大鼠大脑额叶皮层TrkB、TrkA、BDNF、NGF mRNA表达显著下调(P<0.01);与模型组比较,GLAE低、中、高剂量上调了大鼠大脑额叶皮层TrkB、TrkA、BDNF、NGF mRNA表达水平(P<0.05,P<0.01).

图4 各试验组大鼠大脑额叶皮层TrkB、TrkA、BDNF、NGF mRNA表达比较
3 讨论
神经炎症反应与多种疾病的发生密切相关,减少炎症因子和相关分子的表达,可降低阿尔茨海默病(AD)、抑郁症、享廷顿病、帕金森病等疾病的发生率或延迟发病、改善症状[11-14],说明神经炎症参与了AD、抑郁症等的病理生理学过程.在发生神经炎症时,脑组织相关炎症因子(如TNF-α、IL-1β、COX-2)含量明显增高,通过激活自身信号转导,引起炎症细胞因子产生进一步增加,形成正反馈,导致神经细胞凋亡、与脑组织的损伤程度呈正相关性[7-8].LPS是一种诱导动物模型神经炎症的常用诱导剂[15].所以,本试验采用 LPS 诱导大鼠建立神经元炎症损伤模型,结果显示模型组大鼠大脑额叶皮层TNF-α和IL-1β含量显著增加,经GLAE干预后,额叶皮层TNF-α和IL-1β含量显著降低,这提示GLAE能抑制炎症因子的释放,拮抗脑神经炎症反应,从而发挥保护脑的作用.
研究表明,神经营养因子是一类由神经所支配的组织产生的且为神经元生长与功能维持所必需的蛋白质分子,但神经营养因子的失常、缺失或不足,往往导致神经系统某些疾病的发生和神经再生的失败[16].这提示用这类因子治疗神经退行性疾病或促进神经再生具有可能性,也是目前研究或诊断治疗神经溃变性疾病的重要靶点.NGF 是最早被发现的神经营养因子之一,能促进中枢和外周神经元的生长、发育、分化、成熟,维持神经系统的正常功能,加快神经系统损伤后的修复[7].BDNF是含量最多的神经营养因子,在神经元存活、分化及突触可塑性调节中起重要作用[17-18].BDNF和NGF转录表达的蛋白分子可促进神经细胞的修复、存活及再生,从而减轻细胞损伤[19-20].在LPS诱导的神经损伤动物模型实验中发现,脑组织中BDNF表达减少,神经元凋亡增加,再生能力降低,而将BDNF注入脑组织时可明显改善损伤症状[21-22].TrkB、TrkA 是神经营养因子最主要催化受体,其中mNGF是TrkA的首选配体,mBDNF是TrkB的首选配体.BDNF和NGF蛋白与受体TrkB、TrkA的结合可调节神经元细胞的生长、存活、分化和可塑性[9-10].本试验研究显示,模型组大鼠大脑额叶皮层呈现神经营养因子及其相关因子表达水平显著下调,经GLAE干预后,大脑额叶皮层的神经营养因子BDNF、NGF 及其受体TrkA、TrkB蛋白和mRNA表达都显著上调.Keefe 和Ola等[23-24]研究表明BDNF /TrkB、NGF /TrkA 信号通路异常可介导神经元死亡、功能缺失或紊乱继而导致认知功能的障碍,而激活 BDNF /TrkB、NGF /TrkA 信号通路能明显改善学习记忆能力和促进神经元的再生.因此推测GLAE可通过BDNF /TrkB、NGF /TrkA 信号通路发挥对抗炎症反应而保护神经细胞的作用.
4 结论
综上所述,GLAE对LPS所致的神经元损伤有一定的保护作用,这种作用可能与GLAE抑制炎症因子水平,激活BDNF /TrkB、NGF /TrkA信号通路,增加神经营养因子含量,促进大脑皮层神经元生长有关.

