上皮样胶质母细胞瘤的CT和MRI表现与病理分析*
1.河南省人民医院&郑州大学人民医院医学影像科 (河南 郑州 450003)
2.河南省人民医院&郑州大学人民医院病理科 (河南 郑州 450003)
陈翠云1 郭芳芳2 付芳芳1 李晓栋1 朱绍成1 王梅云1,*
上皮样胶质母细胞瘤(epithelioid glioblastoma,Ep-GBM)是2016年WHO在中枢神经系统肿瘤分类(修订的第4版)中正式提出的一种少见的胶质母细胞瘤亚型,其病理分级为Ⅳ级,其病理特征具有大量的上皮样细胞和部分横纹肌样细胞为特征的弥漫性星形细胞胶质瘤[1]。新分类首次在常规组织学基础上增加了分子基因型的信息,进而提高诊断中枢神经系统肿瘤的准确性,并可进一步改善患者的治疗和预后情况。由于该肿瘤报道较少,多数临床医生对其认识不足,术前常被误诊为其它类型肿瘤。因此本研究搜集5例手术病理证实为Ep-GBM患者的临床资料,结合国内外文献复习,通过对其临床、影像特征及病理进行回顾性分析,以提高对该病的 认识。
1 资料与方法
1.1 一般资料2018年3月至2019年12月于河南省人民医院收集5例Ep-GBM患者,均行颅内肿瘤切除,术后病理诊断为上皮样胶质母细胞瘤(Ep-GBM)Ⅳ级,其中男1例,女4例,年龄38~61岁,平均年龄53.4岁,病变位于颞叶2例,额叶1例,枕叶1例,侧脑室三角区1例。主要临床表现为头疼、头晕、记忆力减退、意识障碍,并伴有恶心、呕吐等症状。
1.2 方法2例行头颅CT(computerized tomography, CT)平扫,5例行头颅MRI(magnetic resonance imaging,MRI)平扫和增强检查。CT检查:采用Philips Brilliance 16扫描,患者取仰卧位,采用听眦线从颅底至颅顶扫描,扫描准直器宽度32mm,管电压120kV,电流300mAs,螺距1.5,矩阵512×512。MRI检查:采用Siemens 3.0T,12通道头线圈扫描,患者取仰卧位,横断位SE序列T1WI (TR 220ms,TE 2.61ms),T2WI(TR 3000ms,TE 113ms),FLAIR (TR 8150ms,TE 96.0ms),DWI扫描采用平面回波成像序列(echo-planar imaging,EPI)(TR 3100ms,TE 82ms),矢状位T1WI(TR 220ms,TE 2.61ms)。增强扫描:使用拜耳高压注射器经肘静脉注入钆喷酸葡胺(Gd-DTPA)0.2kg/mL,后再注射20mL生理盐水,注射速率2.5mL/s,行横断位、矢状位T1WI扫描。
2 结 果
2.1 CT、MRI表现5例患者,其病灶均位于幕上,颞叶2例,额叶1例,枕叶1例,侧脑室三角区1例,病灶均为单发,边界较清楚,病灶大小约2.3~7cm。3例病灶位于脑皮质下白质,1例病灶位于脑白质深部,1例病灶位于侧脑室三角区。2例行CT平扫,病灶呈低、稍低密度,边界不清,瘤体与水肿分界不清。5例行MRI扫描,病灶实性部分T1WI(T1Weighted Imaging)呈稍低、低信号,T2WI(T2Weighted Imaging)呈稍高信号,FLAIR呈稍高信号,DWI(diffusion weighted imaging)呈混杂稍高信号/低信号;病灶囊性部分及坏死区T1WI呈低信号,T2WI、FALIR呈高信号,DWI呈低信号;出血部分T1WI、T2WI、DWI均呈低信号;增强扫描3例囊实性病灶,实性部分及囊壁明显强化,1例实性呈“花环状”明显强化,1例实性呈不均匀明显强化。3例肿瘤周围水肿较明显,2例肿瘤周围轻度水肿。1例行磁共振波谱(magnetic resonance spectroscopy,MRS)分析,肿瘤区NNA峰明显下降,Cho峰明显升高。

表1 5例上皮样胶质母细胞瘤的影像表现

续表1
2.2 病理表现大体标本:5例患者肿瘤手术切除,标本为灰红、灰白不规则肿块,1例瘤内可见出血灶,1例瘤内可见灶性坏死。镜下观察:5例肿瘤细胞弥漫分布,排列紧密,可见由上皮样肿瘤细胞区域、部分横纹肌细胞区域及局灶的典型胶质母细胞瘤(GBM)区域构成。胞浆呈嗜酸性,核大,位于胞质一侧,核分裂多见。瘤内微血管可见明显增生,部分肿瘤细胞围绕血管分布。免疫组织化学结果:vimentin(+),S-100(+),GFAP(+),ATRX(+),P53突变型10%~20%,Ki-67表达10%~35%。分子病理学结果:IDH1无突变,3例BRAF V600E突变。
2.3 典型病例分析典型病例影像分析结果见图1。
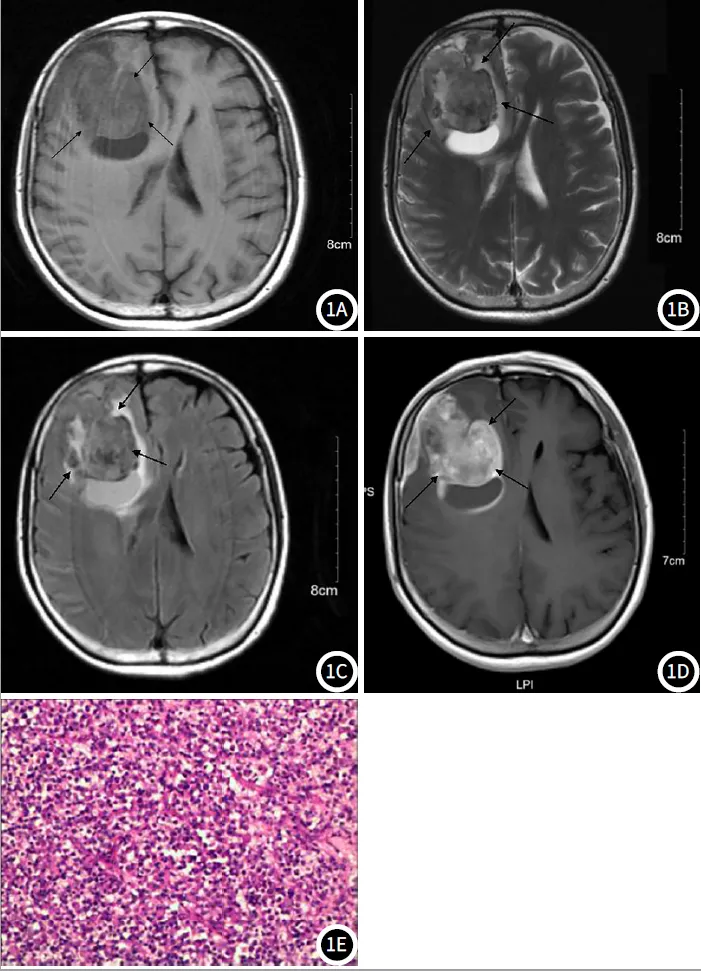
图1 女,59岁,右侧额叶占位性病变(黑色箭头),图1A~1D分别为磁共振(MRI)扫描图像。图1A:T1WI呈稍低、低信号;图1B:T2WI呈稍高、高信号;图1C:FLAIR呈稍高、高信号;图1D:T1WI增强,实性部分及囊壁明显强化,囊壁光整;图1E:病理图,均为HE染色,放大倍数(×200)。
3 讨 论
临床特点Ep-GBM患者主要临床表现为头疼、头晕、记忆力减退、意识障碍,并伴有恶心、呕吐等症状,因此该病患者的临床症状不具有特异性。本研究5例病例中,1例男性,4例女性,男女之比1∶4,与文献报道的该病多见于男性不同[2]。Ep-GBM好发于儿童及青年人。本研究中4例(4/5)发病年龄较大,1例(1/5)为青年人发病,虽然与文献报道[3-5]有一定差异,但与Huang等[6]报道7例E-GBM患者的发病年龄相似。主要原因可能与本组收集的例数较少有关。Ep-GBM多位于脑实质表浅部或间脑,幕上脑叶均可以发病,但以颞叶和额叶最常见[7-8]。本研究病例发病部位与既往报道相似[6,9],2例(2/5)病灶位于颞叶,3例(3/5)病灶位于脑实质表浅部。有文献报道侧脑室室管膜下区易是发生胶质瘤部位之一,本研究有1例(1/5)病灶位于侧脑室三角区[9]。因此,结合文献分析,本研究认为Ep-GBM发病位置表浅可作为该病与传统的胶质母细胞瘤鉴别之一。因Ep-GBM位置表浅,易出现肿瘤细胞脱落并沿脑脊液播散,从而使肿瘤细胞沿脑膜和、或脊膜种植转移,李娟等[10]报道Ep-GBM发生远隔转移可高达69.2%。本研究病例均为单发,并且未发现脑脊膜转移者,可能有以下原因:一方面本研究收集的病例数少,另一方面与患者脑脊液及脊髓MRI检查率较低有关。因此,临床医生应重视定期复查脑脊液及脊髓MRI检查,及早发现有无转移病变。
影像特点:本研究中,仅2例(2/5)行CT扫描,CT显示病灶呈稍低、低密度影,瘤体与周围水肿分界不清,因此CT在显示病变内新鲜出血及钙化占有优势,但在显示病灶部位、边界、瘤周水肿及强化特点不及MRI[11]。本研究中5例患者均行MRI平扫和增强检查,MRI显示病灶为囊实性或实性肿块,实性部分可出血或坏死,囊性部分大小不一,病灶边界清晰。本组病例中,3例(3/5)病灶表现为囊实性肿块,囊壁光整且无壁结节,结合既往文献[12]分析,认为此特点是鉴别Ep-GBM与传统的胶质母细胞瘤的特点之一。1例病灶实性部分明显强化,中心坏死区未见强化,呈“花环状”表现,不易与传统的胶质母细胞瘤鉴别。本研究仅1(1/5)例病灶实性部分合并出血,而据文献报道[13],Ep-GBM合并出血,可高达75%,但在传统的胶质母细胞瘤中,出血较少见,病灶内出血率仅为7.8%[14]。有学者[15]认为Ep-GBM常伴有出血的原因可能与肿瘤内新生的毛细血管异常增殖明显及肿瘤细胞易侵犯毛细血管有关。由于这些新生的毛细血管缺乏正常的血脑屏障,使血管壁通透性增加,从而导致肿瘤周围水肿形成,FLAIR序列在显示肿瘤周围水肿方面具有优势,本研究3例(3/5)肿瘤周围水肿较明显,2例(2/5)肿瘤周围水肿较轻。
病理特点:Ep-GBM由形态较一致的上皮样或横纹肌样瘤细胞构成外,部分区域呈现地图样坏死和微血管增生。Ep-GBM免疫组化vimentin和S-100呈阳性,ATRX(+)、GFAP呈灶性阳性,大部分区域呈阴性,P53突变型达10%~20%,Ki-67表达10%~35%,IDH1无突变,与文献报道的一致[2]。而有文献报道BRAF V600E表达超过50%呈阳性[16],在传统胶质母细胞瘤仅达3%~6%[17]。与文献报道[1,6]相似,本研究中,3例(3/5)Ep-GBM患者伴有BRAF V600E突变。因此,结合文献报道,本研究认为BRAF V600E基因突变是Ep-GBM患者一个特征性标志物。
诊断与鉴别诊断:根据Ep-GBM发病年龄、部位及MRI影像特征,多数术前能够诊断,但仍需与下列疾病进行鉴别诊断:1)不典型脑膜瘤:属于脑外肿瘤,CT密度及MRI信号不均匀,与脑实质分界不清,与之鉴别较难,但MRS分析脑膜瘤无NAA峰,可作为重要的鉴别依据。本研究中,仅1例(1/5)做MRS分析,结果得出NAA峰明显下降,Cho峰明显上升,符合脑内胶质瘤表现。2)多形性胶质母细胞瘤:常见于45~75岁中老年人,男性多于女性,多位于脑白质深部,呈浸润性生长,强化方式呈“花环样”强化。本研究有1例(1/5)患者强化方式不易与传统胶质母细胞瘤鉴别[17-18]。3)巨细胞型胶质母细胞瘤:多发于40~60岁,常见于颞叶及顶叶皮层下,瘤周水肿较轻,多见囊壁和附壁结节并强化。而Ep-GBM囊壁光整无壁结节,该特点可作为鉴别点之一。4)转移瘤:多发Ep-GBM易误诊为转移瘤,转移瘤多见于年龄较大者,且常有原发病史,转移瘤的环形强化是环厚薄不均,一般近皮质侧厚近白质侧薄,这是皮层侧血供较白质侧血供丰富所致[19]。
治疗与预后Ep-GBM属于高级别胶质瘤,预后较差,多数为早期进展,中位生存期约为6.3个月。本研究5例患者中,2/5(40%)术后4个月死亡,1/5(20%)术后11个月死亡,2/5(40%)术后存活。该病目前主要治疗方式为手术切除肿瘤,术后辅助放疗、化疗或同时联合放疗和化疗。该病约50%伴有BRAF V600E基因突变,可尝试靶向药物治疗,并有待进一步研究[20-21]。
本文的不足:收集的病例较少,在总结分析临床发病年龄、部位及影像特征具有一定的局限性,需在今后工作中收集更多的病例,逐渐补充和完善临床及影像特征。
总之,Ep-GBM作为一种亚型胶质母细胞瘤,其临床和MRI表现具有一定的特征性。因此,临床工作中发现脑部肿瘤,中年人以下发病,病变位于表浅,增强后实性部分及囊壁明显强化,囊壁光整且无壁结节,术前要考虑到该病的可能。

