间歇低氧与间歇运动对心梗大鼠心肌HIF-1α、miR-126表达及血管新生影响的对比研究
宋 伟,田振军
有研究显示,造成全球人口“寿命损失”的前五大影响因素中心血管疾病是首因(Murray et al.,2015)。2020年,我国拥有心血管患病人数约3.3亿,心血管病死亡占城乡居民总死亡原因的首位,农村为46.66%,城市为43.81%。(《中国心血管健康与疾病报告2020》编写组,2021)。现阶段尽管临床药物及介入治疗取得较大进展,但心肌梗死(myocardial infarction,MI)仍然是导致心血管病患者发病和死亡的主要病因(Rosamond et al.,2008)。目前,心脏康复作为心肌梗死后治疗的最后一环,对于降低患者死亡率,提高患者生存质量意义重大。因此,心梗病人心脏康复手段的选择也一直是学者关注的热点。
低氧适应可以增加心脏的缺血耐受,故被认为是一种有效的保护手段。Mortimer等(1977)研究发现,高原地区生活的居民心肌梗死的发病率和死亡率要低于平原地区居民。间歇性低氧(intermittent hypoxia,IH)是指人或动物在一段时间多次交替进入低氧和常氧环境的过程(Navarrete-opazo et al.,2014)。已有文献表明,合理的IH适应可以增加心脏的缺氧耐受,缓解心脏缺血损伤带来的多种临床表现,如梗死面积、缺血后的心肌收缩紊乱以及心律失常等,具有明显的心脏保护作用(Akat et al.,2018;Lien et al.,2018)。运动被认为是心脏康复的主要手段,已有文献报道间歇运动(interval training,IT)在改善左心室泵血功能、提高心梗患者V˙O2max(Ulbrich et al.,2016)、增加患者运动耐受等方面优于传统的持续运动(Warburton et al.,2005)。IH和IT作为天然的非药物性心脏康复手段(Alánová et al.,2017),同时具有方法简便、易于应用且无明显副作用的优点,但鲜见对于两者在改善心梗心功能方面的对比研究。
缺血是激发心肌梗死自我保护机制的诱因,以血管新生为基础的侧枝循环形成是心肌梗死早期修复的关键。文献表明,多个microRNA(miRNA)参与了心肌梗死后血管新生的调控过程(Saif et al.,2014),其中,较为熟知的是miR-126。前期研究发现,间歇运动可显著上调心梗心脏miR-126,抑制其下游靶蛋白PIK3R2/SPRED1表达,促进心脏梗死边缘区血管新生,产生心脏保护效应(宋伟等,2017)。但是对于运动上调miR-126表达的具体机制尚未完全阐明。缺氧诱导因子1(HIF-1)是一个关键核转录因子,其生理功能主要取决于HIF-1α亚基,通过调控下游基因表达可以促进缺血心肌的血管新生(Pugh et al.,2003)。运动和低氧都可以引起HIF-1α升高(李铁瑛等,2018),但鲜见HIF-1α的表达与miR-126上调关联的研究。本研究对比IH和IT对MI大鼠心功能的改善,并探讨HIF-1α和miR-126之间的关系,进一步揭示运动及低氧改善MI心功能的可能机制。
1 研究对象与方法
1.1 实验动物分组与MI模型制备
雄性3月龄SD大鼠40只(西安交通大学医学院实验动物中心提供,动物合格证号:SCXK2012-201),标准啮齿类动物干燥饲料分笼饲养,自由饮食。适应性喂养1周后,随机选取8只大鼠为假手术组,剩余32只采用左冠状动脉前降支(left coronary artery descending,LAD)结扎法制备MI模型,术后存活30只,随机分为假心梗组(S)、心梗组(MI)、心梗+间歇低氧组(MIH)、心梗+间歇运动组(MIE)(图 1)。

图1 实验动物分组Figure 1. ExperimentalAnimal Programs
MI模型制备:大鼠称重,腹腔麻醉(戊巴比妥钠30 mg/kg),呼吸机(AL-V8)连接人工面罩辅助呼吸,肢体导联监测心电图(Powerlab/8ST生物信号采集处理系统)。开胸,暴露心脏,体视显微镜(SZX16 OLMPUS)下采用3/8曲形圆体缝合针在左心耳和肺动脉圆锥交界处下缘2 mm处进针,肺动脉圆锥旁出针,进针深度为0.3~0.5 mm,出针后采用5-0丝线进行缝扎,肉眼可见结扎远端心肌颜色变浅或变白,心电图ST段抬高或T波倒置为结扎成功标志,探查无出血后留管逐层关胸并排气。假手术组仅穿线不结扎。
1.2 IH与IT方案
IH方案:参考Manukhina等(2013)方案,MIH组大鼠于术后1周放入低氧帐篷(HYP-123,Hypoxic training system,USA)中(表1),氧浓度仪全程监测氧气浓度,其余各组吸入气中氧浓度分数(fraction of inspiration O2,FIO2)为21%,即处于常氧环境。
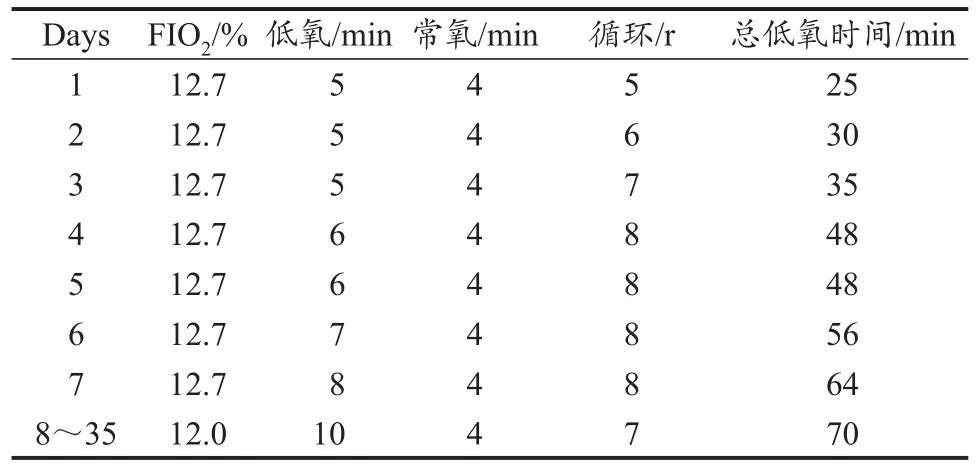
表1 大鼠间歇低氧干预方案Table 1 Interittent Hypoxia Conditioning Program
IT方案(Moreira et al.,2013):MIE组大鼠术后1周开始跑台适应性训练(15 m/min,30 min/天×5天),适应性训练1周后进入正式训练。方案:10 m/min×10 min热身,之后以 25 m/min×4 min(85%~90%V˙O2max)和 15 m/min×3 min(50%~60%V˙O2max)依次交替运动7轮,最后以10 m/min速度运动1 min,运动总时间为60 min,每周5天,正式训练时间为4周。
1.3 细胞培养及低氧处理
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)由中国人民解放军空军军医大学惠赠。高糖DMEM(Gibco)添加10%的新生小牛血清(Invitrogen Life Technologies)和1%的青霉素-链霉素在二氧化碳培养箱(371,Thermo Fisher Scientific)中常规培养(37℃,5%CO2,21%O2),隔天换液,3~4天传代1次。待细胞处于对数生长期时,置于三气培养箱内(3131,Thermo Fisher Scientific)分别培养1 h、2 h、3 h、4 h、6 h、8 h、12 h、24 h,低氧方案为1%O2、5%CO2和94%N2(王授衔等,2017)。
1.4 心功能测定及样品处理
4周训练结束次日,腹腔麻醉,导管经右颈总动脉逆行送入左心室,待所记录的压强波形稳定后,采用Powerlab/8ST生物信号采集处理系统记录左室收缩压(left ventricular systolic pressure,LVSP)、左室舒张末压(left ventricular end-diastolic pressure,LVEDP)、左室压力最大上升和最大下降速率(±dp/dtmax)等指标。心功能测试完毕立即开胸,摘取心脏,称重,部分甲醛固定用于组织学实验,剩余速入液氮,24 h后移入超低温冰箱(Thermo Scientific)用于分子生物学实验。剥取大鼠右侧胫骨,游标卡尺测量胫骨长度,计算心脏重量与胫骨长度比值(HW/TL)。
1.5 实验方法、仪器和试剂
1.5.1 Masson染色
甲醛固定标本48 h后,常规石蜡包埋(BMII型病理组织包埋机),连续切片(5 μm,LEICA RM2126切片机),常规Masson染色结束后,测量染色切片心肌胶原容积分数(collagen volume fraction,CVF),CVF=胶原面积/心肌组织总面积×100%。
1.5.2 Westren Blot
取心梗边缘区心肌组织或HUVECs加入预冷蛋白抽提试剂,匀浆,4℃离心取上清,BCA法测定蛋白浓度并定量(Bio Tek Epoch)。常规制胶、上样、电泳、转膜,3%BSA室温封闭 1 h,孵育一抗 HIF-1α(1∶800,Abcam)、Ets-2(1∶1 000,GeneTex)、VEGF(1∶800,Proteintech),4 ℃过夜。次日复温30 min,回收一抗,TBST清洗,二抗(1∶10 000)室温孵育1 h,洗二抗,ECL发光,凝胶成像系统(全能型Bio-Rad Chemidoc MP)成像,内部参照为GAPDH。
1.5.3 RT-qPCR
常规Trizol试剂盒提取心梗边缘区心肌组织或HUVECs总RNA,严格按照逆转录试剂盒(miScript II RT Kit,Qiagen)操作步骤在实时荧光定量PCR仪(Bio Rad CFX96)获得cDNA产物,20 μl体系进行RT-qPCR反应,内部参照为U6。rno-miR-126基因上游引物序列为GGCATTACTTTTGGTACGCGAAA。U6上下游引物及miR-126下游引物皆为 Qiagen提供,退火温度为 70 ℃。比较 Ct法(2-ΔΔCT)计算miR-126相对表达量。
1.5.4 免疫荧光组织化学染色
切片脱蜡至水,抗原修复,小鼠单克隆抗增殖细胞核抗原抗体(PCNA,1∶50,CST)和兔多克隆von Willebrand因子抗体(vWF,1∶400,Abcam)共同孵育4℃过夜。复温45 min,PBS洗涤后滴加FITC/TRITC标记的山羊抗兔/小鼠IgG二抗(1∶100,Jackson Immuno Research)和 DAPI(1∶800,Sigma),37℃孵育1 h。免疫荧光染色图像由全自动倒置荧光显微镜(蔡司,Axio Observer.Z1)获得。
1.6 数据处理
Masson染色切片经光镜观察、拍照(BX51 OLYM-PUS),Image Pro-plus 6.0软件进行CVF测量;Western Blot实验结果采用Adobe Photoshop CS6和Image J软件处理;使用SPSS 17.0软件包对数据进行one-way ANOVA分析;所有数据经GraphPad Prism 5.0 Demo软件转换作图。实验结果用平均数±标准差(M±SD)表示,显著性差异选择P<0.05和P<0.01水平。
2 结果
2.1 心脏质量、心胫比及心功能检测
心脏质量及心胫比结果显示,与S组相比,MI组和MIE组心脏质量(HW)均显著性升高(P<0.05,P<0.01);与MI组相比,MIH组HW显著性下降(P<0.05);与MIH组相比,MIE组HW显著性升高(P<0.01)。各组心胫比(HW/TL)变化与HW保持一致,且各组胫骨长度(TL)均无显著性差异(表2)。

表2 心脏质量及心胫比结果Table 2 Results of HW and HW/TL
反映各组大鼠心功能的血流动力学指标显示,与S组比较,MI组大鼠LVSP、±dp/dtmax均显著降低(P<0.01),LVEDP显著升高(P<0.01);与MI组比较,MIH组和MIE组LVSP、+dp/dtmax均显著升高(P<0.05),LVEDP均显著降低(P<0.05,P<0.01);与MIH组比较,MIE组LVSP显著升高(P<0.05),LVEDP显著降低(P<0.05;图2)。

图2 心脏血流动力学检测结果Figure 2. Test Results of Cardiac Hemodynamic
2.2 心肌血管新生及Masson染色观察
心肌Masson染色CVF统计结果显示,与S组比较,MI组显著升高(P<0.01);与MI组比较,MIH组、MIE组显著降低(P<0.01;图3)。

图3 心肌Masson染色结果(比例尺=200 μm)Figure 3. Results of Masson Staining of Cardiac Muscle(Scale bar=200 μm)
PCNA为细胞增殖核抗原,vWF为内皮细胞标记物,DAPI是一种能与DNA强力结合的荧光染料。免疫荧光的双染结果显示,PCNA为红色,vWF为绿色,DAPI为蓝色;心肌PCNA+/vWF+的统计结果显示,与MI组相比,MIH组、MIE组表达显著上调(P<0.05,P<0.01);与MIH组相比,MIE组表达显著上调(P<0.01;图4)。
VEGF表达的Western Blot结果显示,与S组比较,MI组表达显著上调(P<0.05);与MI组比较,MIE组表达显著上调(P<0.01;图4)。

图4 心肌免疫荧光结果(比例尺=150 μm)Figure 4. Results of Myocardial Immunofluorescence(Scale bar=150 μm)
2.3 心肌HIF-1α、Ets-2蛋白及miR-126表达
HIF-1α表达的Western Blot结果显示,与S组比较,MI组表达显著上调(P<0.01);与MI组比较,MIH组、MIE组表达显著上调(P<0.05,P<0.01);与MIH组相比,MIE组表达显著上调(P<0.05)。各组Ets-2表达的Western Blot结果均无显著差异(图5)。
miR-126的RT-qPCR结果显示,与S组比较,MI组表达显著下调(P<0.01);与MI组比较,MIH和MIE组表达均显著上调(P<0.05,P<0.01);与MIH组比较,MIE组表达显著上调(P<0.01;图5)。

图5 心肌HIF-1α、Ets-2蛋白及miR-126的RT-qPCR表达结果Figure 5. Expression Results of RT-qPCR of Myocardial HIF-1α、Ets-2 and miR-126
2.4 低氧条件下HUVECs细胞HIF-1α、miR-126表达
不同低氧时间刺激后HUVECs细胞HIF-1α的Western Blot和miR-126的RT-qPCR表达结果显示(图6),与常氧组相比,低氧2 h后两者表达均达到峰值(P<0.01);与低氧2 h组对比,低氧3 h、4 h、6 h、8 h、12 h、24 h后两者均出现显著性降低(P<0.01),其变化趋势高度一致。

图6 不同低氧时间HUVECs HIF-1α、miR-126表达结果Figure 6. Expression Results of HIF-1α,miR-126 at Different Hypoxic Times in HUVECs
3 分析讨论
3.1 间歇低氧和间歇运动干预降低心梗心肌纤维化、改善心功能的比较分析
心肌梗死之后会出现心肌肥厚、心室壁变薄、细胞凋亡和心肌间质纤维化等多种心脏结构的重塑,这是很多心血管疾病共同的病理基础,也是导致心功能衰竭的主要诱因。IH和IT作为一种天然的、非药物性的受损心脏康复手段,受到学者的广泛关注。本研究不仅证实了IH和IT均能有效改善MI心脏心功能(与之前的报道相一致)(Jia et al.,2018;Xu et al.,2011),而且也发现了 IT 的保护作用优于IH。当然,不同的IH和IT方案带来的效果可能不同,本研究所选取的IH和IT方案是基于文献报道且在实践中被证明对缺血心脏心功能起到很好改善作用的适宜方案(Almendros et al.,2014;Wisløff et al.,2009)。心血管系统健康是多因素影响的结果,其中心肌纤维化程度的变化是其中重要一环。心肌纤维化可增加心室壁硬度,降低心室壁功能,导致心脏顺应性下降,心功能不全甚至衰竭。本研究发现,心肌梗死后心肌代偿性纤维化程度明显增加。与MI组相比,MIH组和MIE组心肌替代纤维化程度明显降低。有趣的是,MIH和MIE之间并无差异,说明IH和IT可以减轻心肌梗死引起的代偿性纤维化,但这并不是导致心功能差异的主要原因。
心肌肥厚是心肌对持续性负荷的一种代偿反应,是导致心血管疾病死亡的危险因素,从病理生理学角度分析心肌肥厚可分为生理性和病理性两种。本实验结果显示,与S组比较,MI组大鼠心脏质量和心胫比增加明显;表明心梗心脏会出现诸如间质纤维化、胶原蛋白合成增加等病理性心肌肥大,导致心肌收缩力下降;与MI组比较,MIH组心脏质量和心胫比出现了显著降低,说明IH可能一定程度上通过逆转心梗心脏的病理性变化进而影响心功能,这种可逆性变化为临床干预提供了基础;与MI组比较,MIE组大鼠心脏质量和心胫比显著升高,提示,IT可促进心梗心脏的生理性肥大,心肌结构更加均匀和协调,心肌收缩力和心功能明显提高。由于心脏生理性肥大和病理性肥大存在本质区别,故本研究认为,IH和IT干预过程可能涉及不同的作用机制。
3.2 间歇低氧和间歇运动可能通过HIF-1α上调miR-126表达,促进心梗心肌血管新生
运动可以诱发多种效应,如氧化应激、炎症、低氧等。在这些因素作用下,机体相关的因子、蛋白表征会出现变化进而调控下游靶器官功能。心肌梗死的治疗,血运重建是关键。血管新生是指在已有血管网络中通过内皮细胞的增殖和迁移而形成新的血管,在心肌损伤修复中较为常见。激活心脏血管新生通路是一种重要的治疗和康复策略,在多种形式的心脏疾病动物模型中已经得到了验证。虽然在梗死心脏中可以观察到代偿性血管新生,但其血管新生的数量远远不足(Fernández-hernando et al.,2007;Karam et al.,1990)。因此,心肌梗死后治疗性血管生成方案具有重要的临床应用价值。为了评估IH和IT对心梗心肌血管新生产生的影响,本研究利用免疫荧光双染的方法分析了心肌梗死边缘区PCNA和vWF阳性颗粒数目。结果表明,IH和IT均能促进心梗心肌的血管新生,而IT的作用更明显。
血管新生是一个极其复杂的过程(Weis et al.,2011)。miR-126在血管内皮细胞中高度表达,被认为是血管新生的主要调控因子之一(Chistiakov et al.,2016)。Wang等(2008)研究发现,miR-126缺失小鼠会导致出血或部分胚胎死亡,原因是内皮细胞增殖及血管新生方面的缺陷。存活的突变体在MI后心肌基本丧失血管新生的能力。而转染miR-126的间充质干细胞移植可以改善小鼠心脏梗死区血管生成和心功能(Chen et al.,2011)。因此,miR-126在心梗心肌的血管新生中具有重要的作用,本研究表明,IH和IT均可上调miR-126的表达,且IT的上调更为显著,这与本研究的免疫荧光实验结果吻合。那么,IH和IT诱导miR-126上调的机制又是什么呢?对miR-126上游的研究中发现,敲减HUVECs中Ets-2后,miR-126表达下降约20%(Harris et al.,2010)。Ets-2是Ets转录因子家族中的一员,在血管生成、炎症和重塑中发挥重要作用(Sato et al.,2001),但是Western Blot结果显示,各组Ets-2 表达均无显著差异,表明miR-126表达上调可能另有原因。有研究表明,细胞对缺氧和运动的反应在很大程度上是通过激活HIF-1实现的(Tekin et al.,2010)。HIF-1是一个核转录因子,最早是由Semenza等(1992)在人肝癌Hep3B细胞核提取物中发现,由低氧敏感的α亚基和β亚基构成。HIF-1的生理功能主要取决于其HIF-1α亚基,α亚基在细胞质中表达,可根据氧浓度的变化来调节HIF-1的活性,进而介导细胞对低氧的应答。已知HIF-1可调节200多种下游靶基因的转录表达,并通过多种生物学机制实现对缺血心肌的保护(丁然然等,2015)。为了进一步分析HIF-1α与miR-126两者之间的关系,本研究首先通过TransmiR v2.0数据库进行了预测,发现miR-126是HIF-1α潜在的激活靶点(Ong et al.,2014);随后又通过HUVECs细胞实验证实,随着低氧时间的延长,HIF-1α表达先升高后降低,在低氧2 h表达出现峰值,miR-126的表达结果与HIF-1α高度一致,提示,HIF-1α很可能是miR-126的上游。有趣的是,在体实验的结果与离体实验出现了部分差异,与S组相比,MI组miR-126的表达结果与HIF-1α正好相反。李国达等(2015)对大鼠心梗后7天、14天、28天的心肌梗死边缘区miR-126动态表达进行了研究,发现随着梗死时间的延长,miR-126的表达量逐渐增加,在心梗后第14天,miR-126的表达量最高,随后逐渐降低。本研究MI组miR-126的测试时间为第28天,从时间窗考虑低氧效应已经衰减;IH和IT两种干预手段所产生的持续低氧刺激也许是导致miR-126的表达持续上调的原因。目前,鲜见关于miR-126上游调控因子的研究,不同病理生理条件下的调控机制也存在很大差异,关于运动上调miR-126表达的确切机制还需要进一步的深入研究。
4 结论
间歇低氧和间歇运动可能通过HIF-1α上调心梗心肌miR-126表达,促进心肌血管新生,改善心功能,且间歇运动产生的效果要优于间歇低氧。提示,对于临床上不适宜进行运动康复治疗的缺血性心脏病患者,间歇低氧可以作为一种很好的替代和补充。

