舒郁胶囊在大鼠脑内的化学成分鉴定及对5-HT3R通道功能的影响*
李 芳,王海苹,狄建英,香秋梅,王 倩,杨 赓,魏 盛
(1.北京市丰台区妇幼保健院,北京 100069;2.金诃藏药(山东)健康产业有限公司,山东 济南 250101;3.首都医科大学附属北京安贞医院急诊危重症中心,北京 100029;4.山东中医药大学中医药经典理论教育部重点实验室,山东 济南 250355)
舒郁胶囊是名老中医张珍玉教授研发的治疗抑郁症之肝郁气滞证的处方,由柴胡、白芍、香附、甘草组成,具有疏肝解郁、调畅情志的作用[1-2]。课题组前期实验证实舒郁胶囊在治疗抑郁症肝气郁证、郁怒情绪等情感障碍方面有着独特的作用[3-4],但舒郁胶囊发挥该中枢作用的具体有效成分、主要靶点和作用环节均不明确。有研究表明5-HT3受体拮抗剂有抗焦虑和抗抑郁作用[5],能够增强5-羟色氨再摄取抑制剂的抗抑郁样作用[6],但5-HT3R介导的离子通道功能影响抑郁症抑郁情绪的机制尚不明确。针对这些关键问题,笔者运用LC-ESI-MS技术对舒郁胶囊给药后大鼠海马的吸收成分和代谢产物进行化学成分辨识。同时,本实验复制了抑郁情绪模型大鼠并用舒郁胶囊进行干预,以含药血清作为细胞给药方式,以5-HT3R蛋白表达及通路电流改变为研究对象,试图从5-HT3R功能水平寻找舒郁胶囊调节抑郁症抑郁情绪的作用靶点和作用机制。
1 材 料
1.1 药物与试剂 氟西汀(礼来苏州制药有限公司,批号:H20110742);柴胡提取物(柴胡提取率为20%,即5 g生药提取出1 g提取物)、舒郁胶囊(新药临床批件2008L11169)和白芍提取物(芍药苷含量35%)均由青岛海川创新生物天然药物研究中心提供。
芍药苷标准品(批号:110736-2005030)、柴胡皂苷A标准品(批号:110777-201208)、柴胡皂苷D标准品(批号:110778-201208)(中国食品药品检定研究院);5-HT3R激动剂phenylbiguanide(Sigma公司,货号:164216);5-HT3AR一抗(Abcam公司,货号:ab51950);5-HT3A二抗(Abcam公司,货号:ab16248);5-HT3BR一抗(Santa Cruz公司,货号:sc-51198);5-HT3B二抗IgG-HRP(Santa Cruz公司,货号:sc-2020);乙腈(德国Merck公司,LC-MS级);甲醇(美国Thermo Fisher公司,LC-MS级);甲酸(美国Sigma Aldrich Fluka公司,LC-MS级)。
1.2 主要仪器 Multiclamp 700B膜片钳放大系统(美国MDC公司);电泳仪、蛋白印迹转移装置(美国伯乐公司);Agilent 1100 series液相色谱仪系统(美国Agilent公司);XRXvideo旷场监控装置(上海欣软信息科技有限公司);Agilent XCT plus型电喷雾离子阱质谱仪系统(美国Agilent公司);Micropipette puller P97微电极拉制仪(美国Sutter公司)。
1.3 实验动物 SPF级雄性Wistar大鼠64只,体质量160~200 g,由北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)2002-0003;新出生24 h内的SPF级Wistar大鼠,由山东中医药大学实验动物中心提供,动物生产许可证号:SCXK(鲁)2011-0003。大鼠进入实验室在温度(23±2)℃和40%~60%湿度环境下适应性饲养1周,动物实验设计均经过山东中医药大学实验动物伦理委员会批准,批准号:DWSY2017 03013,动物实验操作遵从美国NIH颁布《实验动物护理和使用指南》。实验中取材脑组织的大鼠采用心脏灌流法处死,其余大鼠采用颈椎脱臼法处死。
2 方 法
2.1 HPLC-ESI-MSn法的色谱条件和质谱检测 色谱柱:Kromasil C18100 R(250 mm×4.6 mm,5 μm);流动相:0.2%冰醋酸(V/V)水溶液(A)和乙腈(B);柱温:30 ℃;流动相洗脱梯度:0~6 min,2%~5%B;6~12 min,5%~12%B;12~28 min,12%~15%B;28~43min,15%~25%B;43~56min,25%~34%B;56~70 min,35%~40%B;70~81 min,40%~65%B;81~90 min,65%~100%B;流速:1 mL/min,进样量:20 μL。质谱检测条件:负离子扫描模式,雾化气(N2)压力:40.0 psi,离子源温度:350 ℃,扫描范围(m/z):100~1400,电离源电压:3.5kV,多级质谱碰撞电压:1V。
2.2 大鼠脑组织样品制备及检测 将24只雄性Wistar大鼠随机分为4组,每组6只,分别灌胃给予纯净水[5 mL/(kg·d)]、舒郁胶囊内容物[0.41 g/(kg·d)]、柴胡提取物[0.32 g/(kg·d)]和白芍提取物[36 mg/(kg·d)],连续灌胃4 d。将第4天灌胃后的大鼠,用生理盐水心脏灌流,冰上分离大鼠海马、额叶、下丘脑、纹状体、小脑和脑干,置于-80 ℃冰箱备用。将各脑核团分别精密称质量并记录,匀浆,沉淀蛋白,涡旋1 min,在4 ℃条件下离心20 min(15 000 g)。将上清液转移至干净EP管中,吹干,复溶,涡旋,高速离心15 min,吸取20 μL上清液,利用HPLC-ESI-MS进样分析。
2.3 抑郁情绪模型大鼠及含药血清制备 采用旷场实验和糖水偏好实验[7]选取得分相近的大鼠40只,随机分为4组,每组10只。(1)正常对照组,给予纯净水,5 mL/(kg·d),简称正常组;(2)抑郁情绪模型组,进行28 d孤养结合慢性温和刺激[8],同时给予纯净水,5 mL/(kg·d),简称抑郁组;(3)舒郁胶囊组,按“(2)”项中方法进行抑郁情绪造模,同时给予舒郁胶囊,0.41 g/(kg·d),简称舒郁组;(4)氟西汀组,按“(2)”项中方法进行抑郁情绪造模,同时给予氟西汀,10 mg/(kg·d)(相当于成人临床8倍剂量)。每天灌胃给药2次,造模28 d完成后即进行模型评价(旷场实验、糖水偏好实验结合宏观行为药理学观察)。末次灌胃给药90 min后[9],麻醉并腹主动脉取血,静置30 min后高速离心,合并同组血清分装放置于-80 ℃冰箱,使用时将血清常温解冻,灭活并用0.45 μm微孔滤膜过滤。
2.4 培养及孵育海马神经元原代细胞 取新出生24 h内的Wistar大鼠,无菌分离海马组织,37 ℃培养箱0.125%胰酶消化15 min,终止消化,清洗,将上清液滴加在被多聚赖氨酸包被好的细胞培养板上,培养4 h,轻摇,清洗,然后继续培养24 h以后,更换为配制好的不含血清的培养基,并置于恒温培养箱中继续培养,此后每3 d换液1次(每次半量更换)。于第8天细胞培养基中分别加入正常组血清、抑郁组血清、舒郁组血清及氟西汀组血清至最终体积分数为10%,然后继续培养24h,用Western blotting方法检测5-HT3A受体和5-HT3B受体蛋白表达,利用全细胞膜片钳技术记录5-HT3受体激动剂加入后介导的离子通道电流。
2.5 Western blotting法检测海马神经元原代细胞5-HT3A/3B受体的蛋白表达 将含血清(10%)培养基孵育24 h后的海马神经元原代细胞分组裂解,提取裂解后的神经元总蛋白,其中每组取10 μL用BCA法做蛋白含量检测,其余使蛋白变性分装后置于-20℃冰箱备用。取10μL室温融化后的备用样品,经SDSPAGE电泳分离,湿法转膜。将NC膜装入孵育袋并加入已经稀释好的相应anti-5-HT3A(1∶200)一抗和anti-5-HT3B(1:5 000)一抗,封口,孵育4 ℃过夜;洗膜3次,然后放入孵育袋并分别加入相应anti-5-HT3A(1∶400)二抗和anti-5-HT3B(1∶400)二抗,封口,室温孵育2 h;洗膜3次,显影和定影检测杂交信号。5-HT3A/3B受体的相对表达量为其与内参β-actin的灰度比值。
2.6 全细胞膜片钳技术记录5-HT3受体门控离子通道电流 在电压钳模式下记录5-HT3R通道电流,所充电极内液成分和灌流用外液成分参考文献记录,钳制电压为-70 mV,微电极电阻3~5 Mohm,滤波器滤波频率为2.9 kHz,采样频率为20 kHz[10]。通过细胞旁Y管快速灌流方式给予PBG(phenybiguanide,10 μmol/L)和其他各组灭活后的血清,在倒置显微镜下通过微电极操纵仪控制电极入液情况,随时观察电极入液、电极接近细胞膜及封接过程电阻变化,串联电阻Ra<20 Mohm的细胞记录入实验,用PClamp10.0软件采集每组6个海马神经元原代细胞的5-HT3受体通道电流数据。
2.7 统计学方法 所有数据先进行正态分布和方差齐性检验,符合要求后再进行参数检验。5-HT3A/3B受体相对表达量及5-HT3受体通道电流密度值数据采用单因素方差进行数据统计,利用GraphPad Prism 9.0统计软件作图。计量资料以()表示,组间比较应用单因素方差分析,两两比较采用Bonferroni's multiple comparisons test,以P<0.05为差异有统计学意义。
3 结 果
3.1 舒郁胶囊在大鼠海马组织中的化学成分鉴定 通过LC-ESI-MSn方法检测得到舒郁胶囊在大鼠海马核团和额叶核团各化学成分保留时间和质谱信息。(见表1)根据舒郁胶囊入血成分和代谢产物[9],通过比对对照品和相关文献,化合物一级及二级质谱信息、保留时间等,对可能通过血脑屏障的化学成分进行分析,确定为进入脑核团的化学成分及其代谢产物。由此共鉴定出舒郁胶囊进入大鼠额叶和海马中的化学成分有5个,其中4个成分为白芍提取物组共同的化学成分,1个成分为柴胡提取物组共有的化学成分,而下丘脑、纹状体、小脑、脑干均未检测到该5种化学成分。
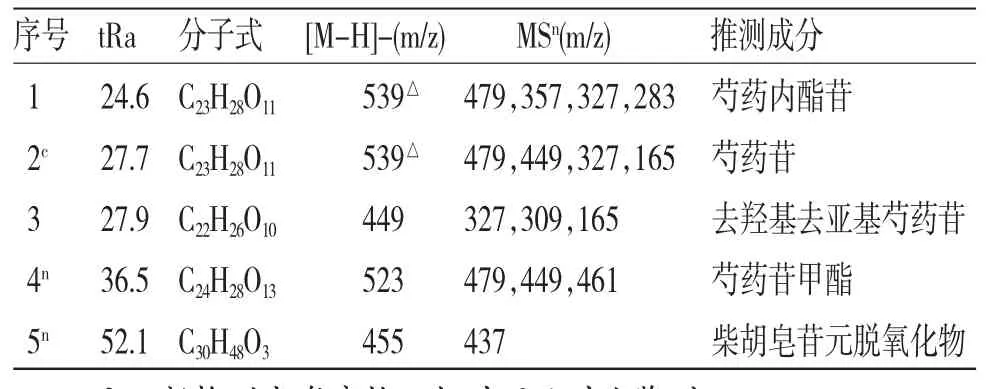
表1 舒郁胶囊给药后大鼠海马和额叶中的成分表
化合物1(tR=27.7 min)通过与对照品比对,将其鉴定为芍药苷。芍药苷的相对分子质量为480,根据元素组成分析,其分子式应为C23H28O11。在碰撞诱导过程中,准分子离子m/z 479丢失122 Da(苯甲酸基团)生成碎片离子m/z 357,进一步裂解失去一分子甲醛(30 Da)产生碎片离子(m/z 327)。另外,在二级质谱图谱中,准分子离子m/z 479还可以发生碰撞裂解直接失去一分子的甲醛(30 Da)产生碎片离子(m/z 449)。这些特征离子都提示该化合物结构中应该含有1分子的甲醛和苯甲酸基团。基于以上分析,该化合物可以初步推断为芍药苷。芍药苷可能的ESI-MS/MS裂解途径见图1,ESI-MS/MS质谱见图2。
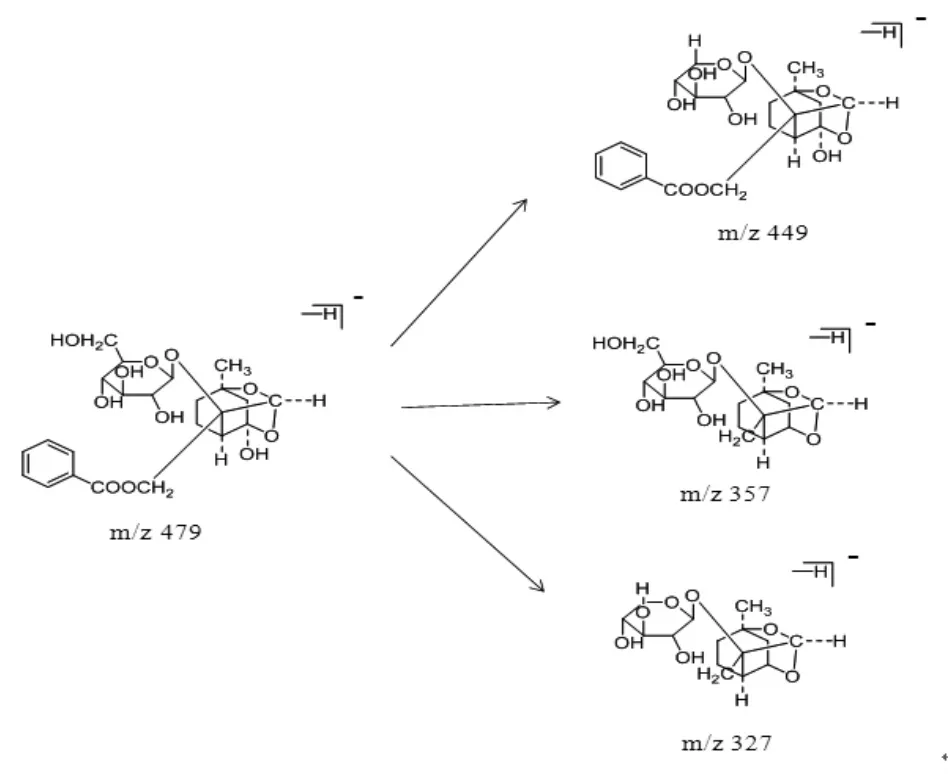
图1 芍药苷可能的ESI-MS/MS 裂解途径
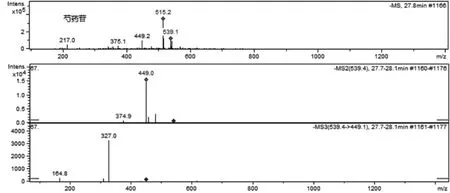
图2 芍药苷ESI-MS/MS 质谱图
化合物2(tR=24.6 min)与芍药苷对照品有相同的溶剂离子峰,其ESI-MS谱产生了[M-H+CH3COO]-离子(m/z 539),并进一步裂解产生ESI-MS谱m/z 479,继续中性丢失122 Da(苯甲酸)、30Da(甲醛)而产生m/z 357、m/z 327和m/z283[M-H-122-30-44]-离子。它们的裂解途径与芍药苷类似,ESI-MS/MS质谱见图3。根据文献中报道的单萜类成分[11],此化合物可鉴定为芍药内酯苷。
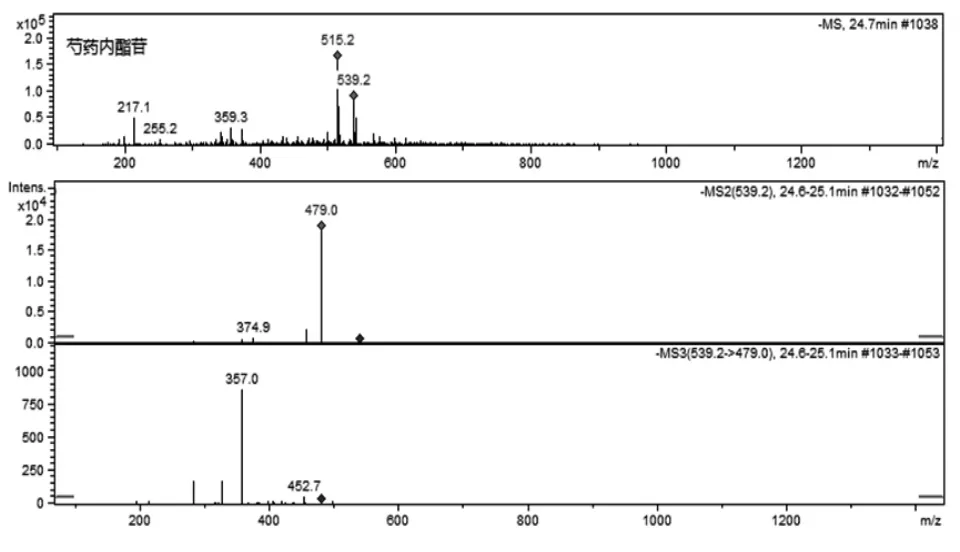
图3 芍药内酯苷ESI-MS/MS 质谱图
化合物3(tR=27.9 min)ESI-MS谱产生了基峰离子m/z 449离子,MS/MS裂解中性丢失122 Da、18 Da等特征裂解途径,生成碎片离子m/z 327和m/z 309碎片离子,继而中性丢失162 Da(葡萄糖残基),形成m/z 165碎片离子。结合文献资料[11],将其鉴定为去羟基去亚甲基芍药苷。
化合物4(tR=36.5 min)在ESI-模式下得到m/z 523离子峰,该化合物相对分子质量比芍药苷多44 Da,并且与芍药苷有共同的碎片离子m/z 479、449,m/z 479([M-H-44]-)离子中性丢失18Da(1分子H2O)得到m/z 461碎片离子,推测该化合物可能是芍药苷甲酯。这可能是芍药苷经过甲酯化反应后极性变小,易于透过血脑屏障进入大脑组织。
化合物5(tR=52.1 min)在ESI-模式下得到m/z 455离子峰,根据前期舒郁胶囊内容物化学成分分析及各化学成分在血中移行成分分析结果[12],对可能进入脑组织的药物成分进行研究。柴胡可能的入脑成分是柴胡皂苷元m/z 471,但该成分的提取离子流却不存在,而存在m/z 455[M-H]-离子。柴胡皂苷元进入脑组织之前必须进行脱氧化物反应。以柴胡皂苷D为例,其准分子离子峰[M-H]-为m/z779(推测元素组成为C42H68O13),在m/z 779发生裂解失去162 Da(1分子葡萄糖基团)产生m/z 617[M-H-Glc]-碎片离子,然后进一步丢失1分子鼠李糖基团(146 Da)产生柴胡皂苷元m/z 471的碎片离子[M-H-Glc-Rha]-。该碎片离子继续发生脱氧化反应,得到相对分子质量比柴胡皂苷元小16 Da。结合质谱碎片信息和对照品裂解规律,可推测该化合物为柴胡皂苷元脱氧化物,其ESI-MS/MS质谱图见图4。柴胡皂苷D可能的ESI-MS/MS裂解途径见图5。
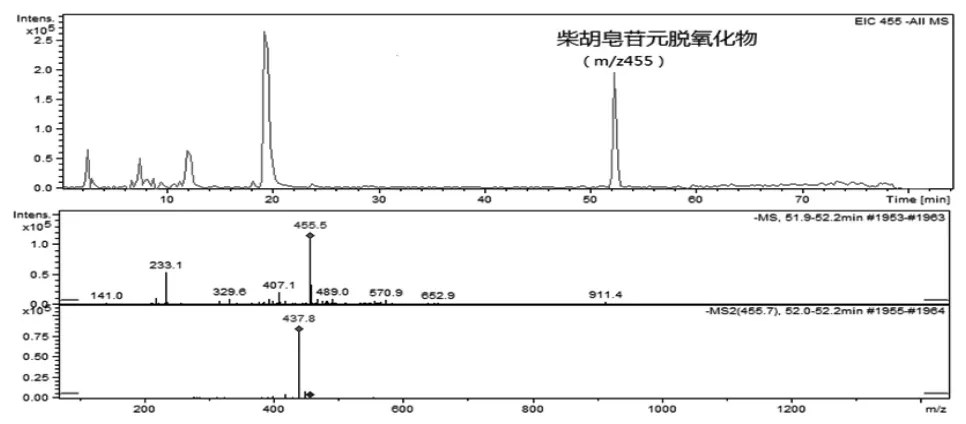
图4 柴胡皂苷元脱氧化物ESI-MS/MS 质谱图
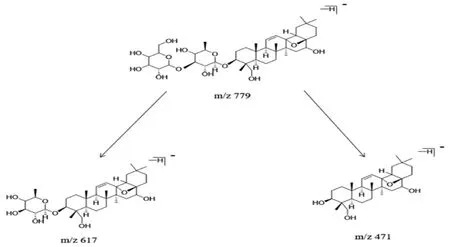
图5 柴胡皂苷D 可能的ESI-MS/MS 裂解途径
3.2 各组大鼠海马神经元原代细胞5-HT3A/3B受体的蛋白表达各组大鼠海马神经元原代细胞5-HT3A/3BR蛋白表达结果见图6~7。与正常组血清所孵育的海马神经元比较,抑郁组大鼠海马神经元原代细胞5-HT3A受体和5-HT3B受体蛋白表达量明显升高(P<0.05);与抑郁组比较,氟西汀组和舒郁组大鼠海马神经元原代细胞5-HT3A受体和5-HT3B受体蛋白表达量明显降低(P<0.05或P<0.01)。

图6 各组大鼠海马神经元原代细胞5-HT3A 受体和5-HT3B 受体蛋白表达Western blotting 图
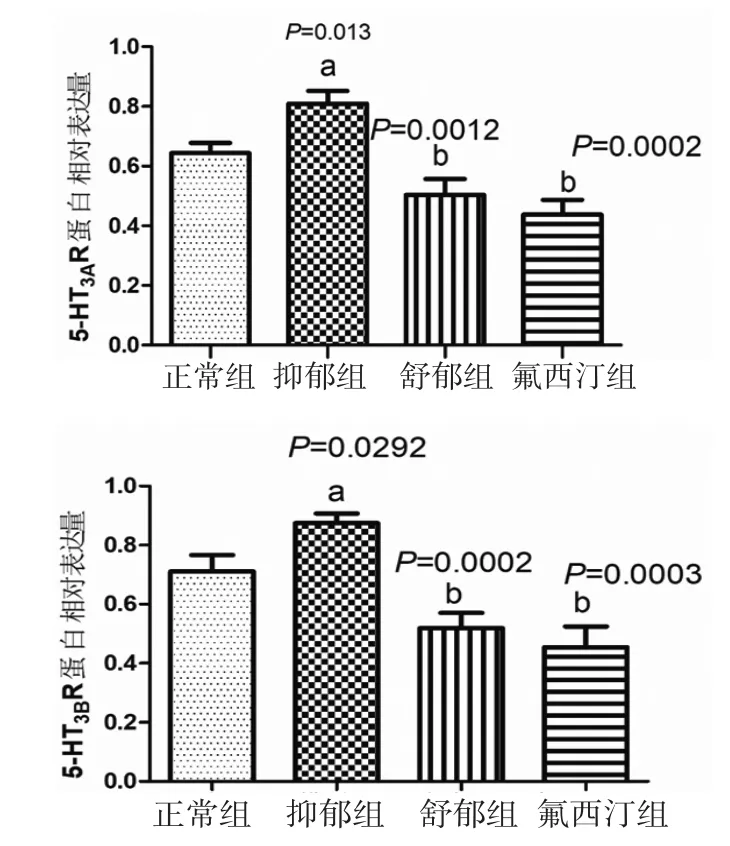
图7 各组大鼠海马神经元原代细胞5-HT3A 受体和5-HT3B 受体蛋白表达比较(,n=6)
3.3 全细胞膜片钳电流记录大鼠海马神经元原代细胞5-HT3受体电流 各组大鼠5-HT3R激活电流实验结果见图8。灌流给予5-HT3R激动剂后,各组大鼠海马神经元原代细胞可产生一个明显移动的电流,其电流密度值统计结果见图9。与正常组比较,抑郁组大鼠海马神经元原代细胞的电流密度值明显增强(P<0.05);与抑郁组比较,氟西汀组和舒郁组大鼠海马神经元原代细胞电流密度值均明显减弱(P<0.01)。
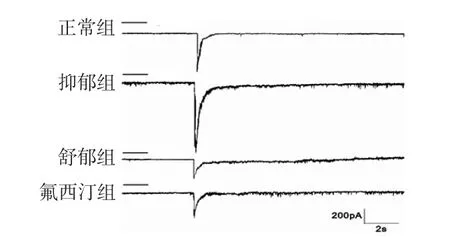
图8 各组大鼠海马神经元原代细胞5-HT3R 激活电流反应
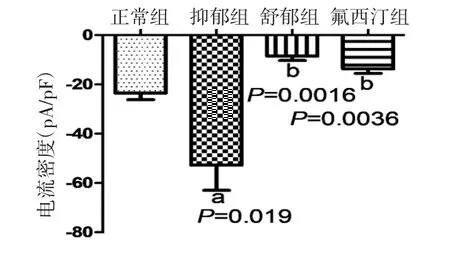
图9 各组大鼠海马神经元原代细胞5-HT3 受体通道电流比较(,n=6)
4 讨 论
本研究表明,舒郁胶囊在大鼠脑内的吸收成分和代谢产物主要有芍药苷、芍药苷甲酯、去羟基去亚甲基芍药苷、芍药内酯苷及柴胡皂苷元脱氧化物,其中白芍提取物对照组大鼠脑内均可检测到前3种成分,柴胡提取物对照组大鼠脑内检测到柴胡皂苷元脱氧化物的存在。舒郁胶囊的君药是白芍和柴胡,课题组以往数据显示白芍提取物在大鼠脑内的吸收成分有芍药苷和芍药内酯苷[12]。这两种化学物质也是本实验舒郁胶囊的脑内吸收成分。前期研究显示,舒郁胶囊在血中的吸收成分均含有芍药苷和芍药内酯苷[10],结合本实验检测到的大鼠入脑化学成分,可以推测舒郁胶囊被吸收入血后,一部分以原型成分通过血脑屏障进入脑内,如芍药苷和芍药内酯苷;另一部分化学成分则经过脱氧化反应转化成小分子(如去羟基去亚甲基芍药苷、芍药苷甲酯及柴胡皂苷元脱氧化物)才能透过血脑屏障,以代谢产物的形式进入脑内,或者进入脑内的芍药苷和芍药内酯苷在脑内直接代谢为芍药苷甲酯和去羟基去亚甲基芍药苷。这些脑组织内的化学成分和代谢产物是舒郁胶囊发挥抗抑郁作用的物质基础。
5-HT3受体通道属于非选择性配体门控阳离子通道,由5个亚基构成,每个亚基均由细胞外域,跨膜区和胞内结构域构成[13]。药物成分或者大鼠体内化学成分结合这些受体的细胞外域部分,可引发跨膜离子通道的打开和离子(如Na+、K+、Ca2+等阳离子)的流通,从而驱动5-HT3受体通道电流的形成。本实验抑郁组血清孵育的海马神经元原代细胞电流密度值明显增强,可能是因为抑郁组血清异常的化学成分过度结合了5-HT3AR和5-HT3BR,致使5-HT3AR和5-HT3BR蛋白表达异常升高,也可能是因为抑郁组血清直接影响了Na+、K+、Ca2+离子流通。这与文献中经前期综合征肝气郁证模型大鼠血清改变5-HT3受体电流的趋势相同[10]。同样,电压门控离子通道的钠离子和钾离子通道部分亚基蛋白表达的异常改变,也会影响神经元兴奋性、神经递质释放、动作电位和细胞信号转导等[14-16],从而改变了Na+、K+、Ca2+离子通道的功能。文献研究表明,经前烦燥障碍肝气逆证模型大鼠情绪调控脑区(海马区和额叶)5-HT3R蛋白表达减少,恰好反证了本实验抑郁情绪模型大鼠海马区5-HT3R蛋白表达的异常升高。由此推测,抑郁情绪模型大鼠在Na+、K+、Ca2+相关的通道蛋白异常表达等反复刺激中,体内化学物质不断改变,促使脑内5-HT3A/3BR蛋白表达发生异常,同时导致5-HT3受体介导的离子通道功能发生异常。这些异常的5-HT3R反过来又加重抑郁情绪,如此周而复始,共同推进。
5-HT3R离子通道可通过Na+、K+和Ca2+来介导突触前和突触后神经元的快速去极化反应[18],进而改变5-HT3R通道的功能。研究表明白芍提取物和柴胡提取物均能通过调节5-HT3R通道电流及5-HT3R蛋白表达而发挥其抗抑郁样情绪的作用[19-20]。舒郁胶囊以白芍和柴胡共为君药来发挥发挥疏肝解郁、调畅情志的功效。这些共同佐证了本实验舒郁胶囊通过下调5-HT3R蛋白表达和下调5-HT3R通道电流来拮抗抑郁情绪。研究表明,舒郁胶囊能发挥5-HT3R拮抗剂作用调控神经元Ca2+内流,从而达到神经元细胞内Ca2+的动态平衡[21-22]。可以推测,舒郁胶囊通过拮抗神经元细胞外Ca2+内流而促使了5-HT3R通道电流密度的降低。有研究显示芍药苷可以产生微弱的电压依赖性Na+和延迟整流K+的抑制[23],由此可见,舒郁胶囊可能通过本身药物成分与5-HT3R不同亚基的结合活性来影响5-HT3R离子通道的功能,也有可能通过改变神经元Na+、K+和Ca2+在5-HT3R通道的通透性和流动性来调节5-HT3R功能。
本实验证明,舒郁胶囊经大鼠灌胃吸收后,能够通过血脑屏障,进入大鼠额叶和海马组织,但是仍旧需要我们继续探讨舒郁胶囊的化学成分或代谢产物在大鼠脑内的作用靶点和富集性问题,以更精准的数据研究药物的作用位点。同时,抑郁组和舒郁组大鼠海马神经元5-HT3R电流的变化,证明了不同状态下海马神经元5-HT3R功能的改变。这些离体细胞实验为将来研究海马组织的脑片膜片钳实验提供了科学依据,同时在体额叶组织5-HT3受体功能的改变,也有待于用脑片膜片钳实验进一步探索。

