蒲公英甾醇通过NOD1/NF-κB通路对Hp相关性胃炎脾胃湿热证小鼠改善作用研究*
李翰嵩,贾纯亮,梁 磊,张 磊,王 剑,刘远廷
(唐山市人民医院,河北 唐山 063000)
幽门螺杆菌(Helicobacter pylori,Hp)是一种定植于胃黏膜上皮细胞的慢性致病菌,可引起功能性消化不良、胃癌前病变(胃异型增生、肠黏膜化生等)和胃癌[1-2]。Hp因参与胃癌的发展,被WHO归为Ⅰ类致癌物[3]。Hp感染后胃黏膜发生炎症改变称为Hp相关性胃炎(Hp associated gastritis,HAG),临床上以脾胃湿热证症状最为常见[4]。核苷酸结合寡聚化结构域1(nucleotide binding oligomerization domain1,NOD1)是一种重要的模式识别受体,可识别并结合病原相关分子模式,激活核因子κB(nuclear factor kappaB,NF-κB)信号通路,诱导大量促炎性细胞因子分泌,使机体发生炎症反应[5]。蒲公英甾醇是从中药蒲公英中分离的一种五环三萜化合物,具有抗炎、抗肿瘤活性,可通过调控NF-κB通路抑制炎症反应,被用于多种炎症相关疾病的治疗[6-7]。目前,蒲公英甾醇对脾胃湿热证HAG的临床治疗研究较少,因此本研究拟通过建立脾胃湿热证HAG模型,探讨蒲公英甾醇对脾胃湿热证HAG小鼠的炎症抑制作用及机制,以期为蒲公英甾醇相关药物研发及脾胃湿热证HAG的临床治疗提供理论支持。
1 材料与方法
1.1 实验动物 8周龄健康SPF级C57BL/6小鼠80只,雌雄各半,体质量(22±4)g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号:SCXK(湘)2016-0002。SPF级环境饲养,温度20~25 ℃,相对湿度45%~55%,亮暗循环时间比1∶1,自由饮食、饮水,适应性饲养7 d。实验严格遵循《实验动物管理条例》,确保动物福利伦理,经医学实验动物管理委员会审核批准。
1.2 药物与试剂 蒲公英甾醇(上海源叶生物科技有限公司,批号:B20940,HPLC≥98%);Hp菌种(美国ATCC公司,编号:700392);NOD1激动剂二氨基庚二酸(γ-D-glu-mesodiaminopimelic acid,iE-DAP)(美国InvivoGen公司,批号:20190312);快速尿素酶检测试剂盒(上海国药生物公司);兔抗鼠p65、p-p65抗体(美国Santa Cruz公司,批号:20190122);兔抗鼠β-actin抗体(英国Abcam公司,批号:20181106);小鼠干扰素诱导蛋白10(IFN-γ-inducible protein 10,IP-10)ELISA试剂盒(批号:20190207)、小鼠干扰素β(interferon β,IFN-β)ELISA试剂盒(批号:20181223)均购自深圳欣博生物科技有限公司。
1.3 主要仪器 SY96A型全自动酶标仪(芬兰雷勃公司);LV150N型光学显微镜(日本Nikon公司);CFX96型荧光定量PCR仪、1658033型电泳仪(美国Bio-rad公司)。
1.4 造模与分组[8]80只C57BL/6小鼠随机分为正常组(17只)和造模组(63只)。采用复合病因(肥甘饮食+湿热环境+Hp菌液)方法制备脾胃湿热证HAG小鼠模型。造模组小鼠给予高脂饲料自由饮食,12 d后开始置于湿热箱饲养,温度(32±2)℃,相对湿度95%,6 h/d,17 d后开始灌胃Hp菌液,1×109CFU/mL,0.2 mL/d,每2 d感染1次,共5次,定植2周,感染及定植Hp期间继续给予高脂饲料及湿热箱饲养;正常组小鼠给予正常饮食+常规环境+同步饲养。第37天正常组及造模组分别随机选取5只、15只小鼠,断头处死后取胃黏膜组织进行快速尿素酶试验及HE染色。小鼠反应迟钝、精神不振、毛发松弛无光泽、喜聚少动、肛温升高、体质量减轻、大便稀软、快速尿素酶试验结果阳性及HE染色结果显示脾胃湿热证慢性浅表性胃炎,提示造模成功。将剩余的48只造模小鼠按照随机数字表法分为模型组、蒲公英甾醇组、iE-DAP组、蒲公英甾醇+iE-DAP组,每组12只。
1.5 实验给药 蒲公英甾醇组小鼠灌胃蒲公英甾醇[9](生理盐水配制),2.5 mg/kg,1次/d,连续灌胃4周;iE-DAP组小鼠腹腔注射iE-DAP,100 μg/只[10],1次/周,连续注射4周;蒲公英甾醇+iE-DAP组小鼠灌胃蒲公英甾醇,2.5 mg/kg,1次/d,腹腔注射iE-DAP,100 μg/只,1次/周,连续给药4周;正常组和模型组小鼠灌胃、腹腔注射等体积生理盐水。
1.6 观察指标
1.6.1 小鼠一般情况 实验过程中观察各组小鼠精神状态、大便性状、饮水、饮食、体质量、肛温、毛色及皮毛顺滑度等。
1.6.2 小鼠血清IP-10和IFN-β水平 药物干预结束后次日,脱颈处死各组小鼠,采集下腔静脉血,室温静置1 h,3 000 r/min(离心半径10 cm)离心10 min,上清即为血清样品。酶标板设置空白孔、标准品孔和样品孔,空白孔不加样品,标准品孔加不同浓度标准品,样品孔先后加40 μL样品稀释液和10 μL血清样品,晃动混匀后封板,37 ℃孵育0.5 h,清洗液洗涤5次,吸水纸上拍干,除空白孔外,每孔各加50 μL酶标试剂,混匀后封板,37 ℃孵育1 h,清洗液洗涤5次,拍干,每孔加100 μL TMB显色液轻轻震荡混匀,37 ℃避光20 min,标准品孔前5孔出现颜色梯度变化时,加50 μL终止液终止显色反应,以空白孔调零,450 nm波长测量吸光度值(OD值),根据标准品浓度绘制标准曲线,计算样品浓度。
1.6.3 Hp定植率 取小鼠胃组织,称质量后加入PBS于匀浆器中匀浆,取100 μL匀浆液按照快速尿素酶检测试剂盒说明书操作步骤进行检测,溶液在15 min内颜色由黄色变为粉红色或红色,尿素酶实验阳性;溶液仍为黄色则尿素酶实验阴性。匀浆液梯度稀释后于哥伦比亚培养平板(含抗生素)上,37 ℃培养7 d,对平板上Hp菌落数量计数,以lgCFU与胃组织质量比值表示Hp定植,记为lgCFU/g。
1.6.4 小鼠胃黏膜组织病理学变化 取部分胃组织,10%甲醛固定,梯度酒精脱水,石蜡包埋,切片机进行组织切片(厚度为4 μm),60 ℃烤片12 h,二甲苯脱蜡,酒精水化,苏木精-伊红(HE)染色,梯度酒精脱水,二甲苯透明,中性树胶封片,光学显微镜下观察胃黏膜炎症情况。
1.6.5 小鼠胃组织中NOD1 mRNA和受体相互作用蛋白2(receptor-interacting protein 2,RIP2)mRNA的表达水平 取50 mg胃组织,加液氮研磨,采用Trizol试剂提取总RNA,超微量分光光度计检测总RNA浓度和纯度,将RNA反转录为cDNA。PCR反应体系:10 μL 2×SYBR Green Master Mix,1 μL 2.5 μmol/L上下游引物,2 μL cDNA,6 μL DEPC-ddH2O;反应程序:95 ℃预变性60 s;95 ℃变性15 s;60 ℃退火15 s;72 ℃延伸45 s,循环40次。以GAPDH为内参,采用2-ΔΔCT法计算目的基因相对表达量。实验重复3次。qPCR引物使用premier 6.0设计,序列见表1。

表1 引物序列
1.6.6 小鼠胃黏膜组织p65、p-p65蛋白的表达水平 取100 mg胃组织,加液氮研磨后提取总蛋白,BCA法检测蛋白浓度。95 ℃使蛋白变性,10%SDS-PAGE电泳,80 V恒压电泳30 min,100 V恒压电泳约1 h(溴酚蓝接近胶板底端),转膜仪将蛋白转至PVDF膜上,300 mA恒流转膜1 h,5%脱脂牛奶室温封闭1 h,分别用p65、p-p65和β-actin(1∶1 000)一抗4 ℃孵育过夜,TBST洗膜10 min×3次,HRP标记的二抗(1∶2 000)室温孵育1 h,TBST洗膜10 min×3次,加ECL发光液于暗室中曝光显影。实验重复3次,采用Image J软件分析蛋白条带灰度值,以目的蛋白条带灰度值/内参β-actin蛋白条带灰度值的比值,作为目的蛋白相对表达量。
1.7 统计学方法 采用SPSS 24.0统计软件进行分析,计量资料以()表示,多组间比较采用单因素方差分析,进一步两组间比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠一般情况 正常组小鼠精神状态良好,小便、大便、饮水和饮食正常,体质量逐渐增加,肛温基本恒定,皮毛光泽顺滑;造模组小鼠在建模过程中出现精神不振,懒动,反应迟钝,小便黄,大便稀软,饮水减少,食欲下降,体质量减轻,皮毛松弛无光泽等脾胃湿热证表现。蒲公英甾醇组小鼠灌胃开始后精神状态好转,活动量增加,小便颜色变淡,大便逐渐成形,饮水、饮食量增加,体质量高于模型组,肛温低于模型组;iE-DAP组小鼠较模型组脾胃湿热证症状加重,蒲公英甾醇+iE-DAP组小鼠较iE-DAP组脾胃湿热证症状明显减轻。
2.2 各组小鼠血清IP-10、IFN-β水平比较 模型组小鼠血清IP-10、IFN-β水平均明显高于正常组(P<0.05);蒲公英甾醇组小鼠血清IP-10、IFN-β水平均明显低于模型组(P<0.05);iE-DAP组小鼠血清IP-10、IFN-β水平均明显高于模型组(P<0.05);蒲公英甾醇+iE-DAP组小鼠血清IP-10、IFN-β水平均明显高于蒲公英甾醇组(P<0.05);蒲公英甾醇+iE-DAP组小鼠血清IP-10、IFN-β水平均明显低于iE-DAP组(P<0.05)。(见表2)
表2 各组小鼠血清IP-10、IFN-β 水平比较()
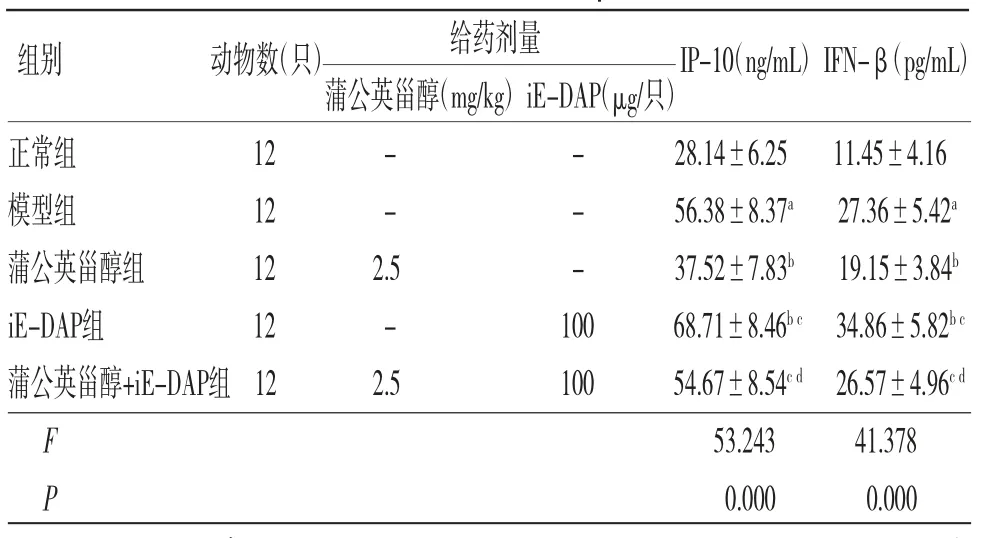
表2 各组小鼠血清IP-10、IFN-β 水平比较()
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与蒲公英甾醇组比较,cP<0.05;与iE-DAP组比较,dP<0.05
2.3 各组小鼠Hp定植率比较 蒲公英甾醇组小鼠Hp定植率低于模型组(P<0.05);iE-DAP组小鼠Hp定植率高于模型组(P<0.05);蒲公英甾醇+iE-DAP组小鼠Hp定植率高于蒲公英甾醇组(P<0.05);蒲公英甾醇+iE-DAP组小鼠Hp定植率低于iE-DAP组(P<0.05)。(见表3)
表3 各组小鼠Hp 定植率比较(,lgCFU/g)
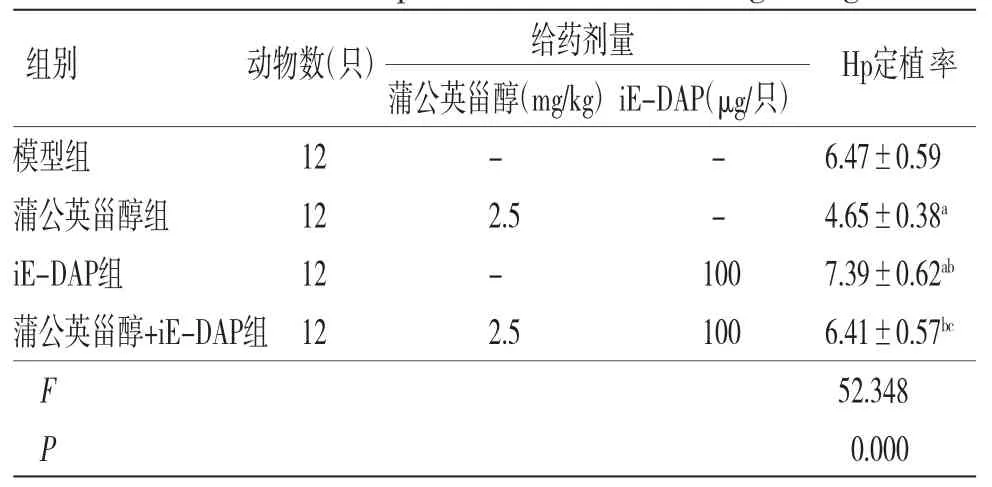
表3 各组小鼠Hp 定植率比较(,lgCFU/g)
注:与模型组比较,aP<0.05;与蒲公英甾醇组比较,bP<0.05;与iE-DAP组比较,cP<0.05
2.4 各组小鼠胃黏膜组织病理变化 正常组小鼠胃黏膜上皮结构完整、腺体排列整齐、无炎症细胞浸润及充血肿胀;模型组小鼠胃黏膜充血肿胀、上皮结构破坏,腺体结构萎缩、排列无序,固有层有炎症细胞浸润;蒲公英甾醇组小鼠胃黏膜表面光滑、腺体排列整齐、少部分轻度充血水肿、炎症细胞浸润较模型组明显减轻;iE-DAP组小鼠胃黏膜组织病理损伤程度较模型组加重;蒲公英甾醇+iE-DAP组小鼠胃黏膜组织病理损伤较iE-DAP组明显减轻。(见图1)
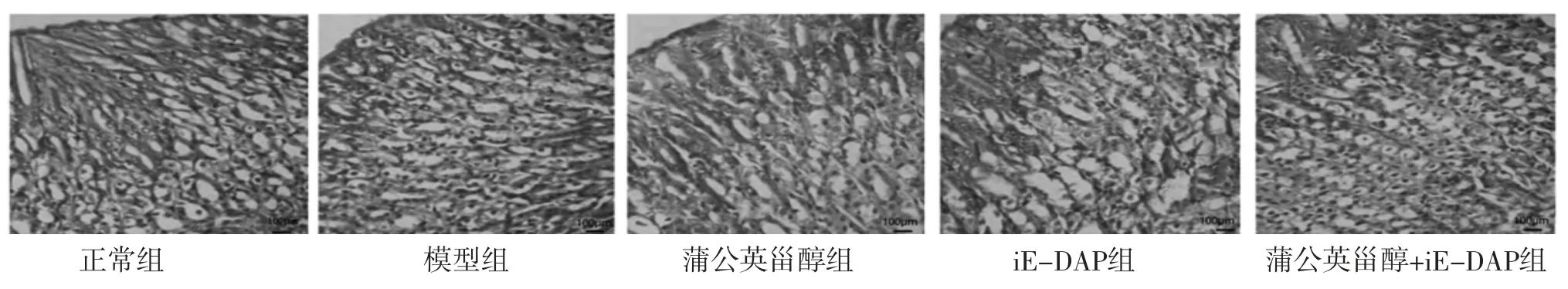
图1 各组小鼠胃黏膜组织病理学变化(HE,×200)
2.5 各组小鼠胃组织中NOD1 mRNA和RIP2 mRNA表达水平比较 模型组小鼠胃组织NOD1 mRNA和RIP2 mRNA相对表达量均明显高于正常组(P<0.05);蒲公英甾醇组小鼠胃组织中NOD1 mRNA和RIP2 mRNA相对表达量均明显低于模型组(P<0.05);iE-DAP组小鼠胃组织中NOD1 mRNA和RIP2 mRNA相对表达量均明显高于模型组(P<0.05);蒲公英甾醇+iE-DAP组小鼠胃组织中NOD1 mRNA和RIP2 mRNA相对表达量均明显高于蒲公英甾醇组(P<0.05);蒲公英甾醇+iE-DAP组小鼠胃组织中NOD1 mRNA和RIP2 mRNA相对表达量均明显低于iE-DAP组(P<0.05)。(见表4)
表4 各组小鼠胃组织中NOD1 mRNA、RIP2 mRNA表达水平比较()
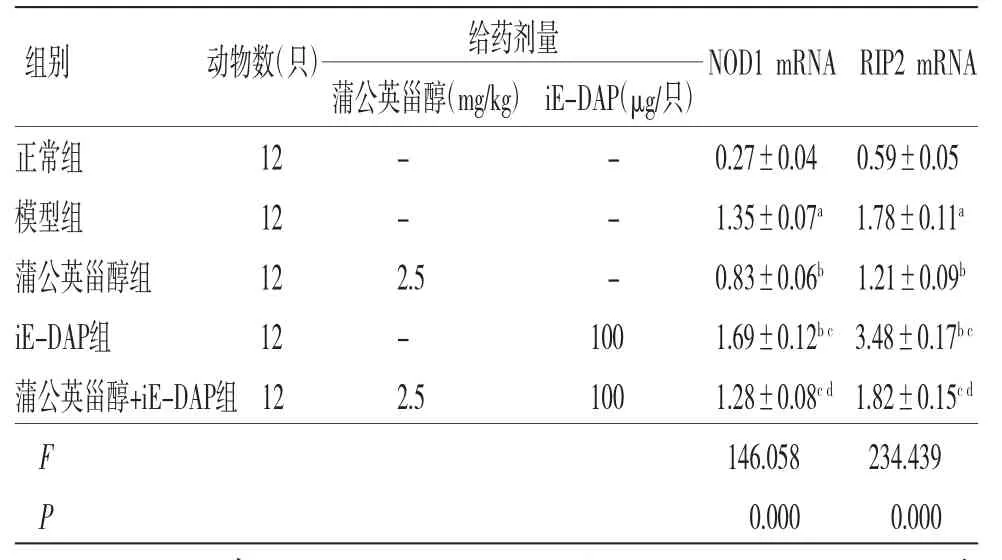
表4 各组小鼠胃组织中NOD1 mRNA、RIP2 mRNA表达水平比较()
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与蒲公英甾醇组比较,cP<0.05;与iE-DAP组比较,dP<0.05
2.6 各组小鼠胃黏膜组织p65、p-p65蛋白表达水平比较 各组小鼠胃黏膜组织p65蛋白表达水平比较,差异无统计学意义(P>0.05)。模型组小鼠胃黏膜组织p-p65蛋白表达水平高于正常组(P<0.05);蒲公英甾醇组小鼠胃黏膜组织p-p65蛋白表达水平明显低于模型组(P<0.05);iE-DAP组小鼠胃黏膜组织p-p65蛋白表达水平明显高于模型组(P<0.05);蒲公英甾醇+iE-DAP组小鼠胃黏膜组织p-p65蛋白表达水平明显高于蒲公英甾醇组(P<0.05);蒲公英甾醇+iE-DAP组小鼠胃黏膜组p-p65蛋白表达水平明显低于iE-DAP组(P<0.05)。(见表5、图2)
表5 各组小鼠胃黏膜组织p65、p-p65 蛋白表达水平比较()
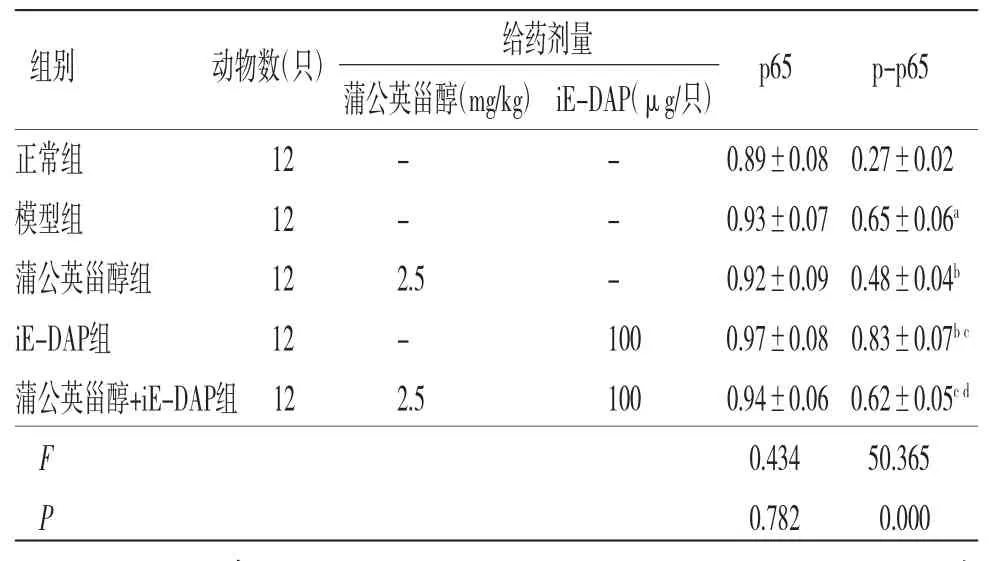
表5 各组小鼠胃黏膜组织p65、p-p65 蛋白表达水平比较()
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与蒲公英甾醇组比较,cP<0.05;与iE-DAP组比较,dP<0.05

图2 各组小鼠胃黏膜组织p65、p-p65蛋白表达Western blotting图
3 讨 论
Hp是革兰氏阴性螺旋形细菌,据统计全球约44亿人感染Hp,尽管多数Hp阳性患者无明显症状,但感染易导致各种临床疾病的发生发展[11]。中医学认为Hp感染具有“湿热”邪气的相似特征,脾胃湿热环境有利于Hp的生长繁殖。西医治疗通常以四联疗法根除Hp为主,但易引起患者高耐药性、高复发率及肠道菌群紊乱等问题。中医药具有低毒、高效、副作用小、不易复发且不易产生耐药等优势,因此,中药用于多种疾病的治疗。本研究旨在探讨蒲公英甾醇对HAG的治疗效果。
蒲公英具有清热解毒、利尿通淋、消肿散结的功效。蒲公英包含多种有效成分,如菊苣酸、绿原酸、甾醇、倍半萜烯内酯和多糖等,具有抗肿瘤、抗氧化、抗补体及降血糖等生物学功效。其中,蒲公英甾醇是其主要有效活性成分之一,CHE L等[12]研究发现,蒲公英甾醇可以减轻溃疡性结肠炎小鼠结肠组织损伤,抑制炎症反应和细胞凋亡。ZHENG F等[13]研究表明,蒲公英甾醇可抑制NF-κB激活,降低血管炎症反应。JIANG S H等[14]研究显示,蒲公英甾醇可通过调节小鼠炎症反应,发挥对类风湿性关节炎的保护作用。本研究结果显示,经蒲公英甾醇干预后,小鼠一般情况好转,胃黏膜病理损伤程度减轻,血清IP-10、IFN-β水平降低,Hp定植减少,提示蒲公英甾醇可改善HAG小鼠脾胃湿热证症状,抑制炎症反应。
模式识别受体主要包括RIG-I样受体、Toll样受体、NOD样受体及胞浆病毒DNA受体。其中,NOD1是NOD样受体家族成员之一,在炎症细胞、内皮细胞和血管平滑肌细胞中高度表达,能识别G-肽聚糖衍生肽iE-DAP,通过半胱天冬酶活化募集结构域以ATP依赖的方式寡聚化并与RIP2相互作用[15]。NOD1/RIP2相互作用导致NF-κB激活,驱动趋化因子、促炎性细胞因子及Ⅰ型干扰素产生与释放[16]。JEON D等[17]研究表明,蒲公英提取物可以通过抑制NF-κB通路减轻LPS诱导的人脐静脉内皮细胞炎症变化。SANG R等[18]研究显示,蒲公英甾醇可通过抑制NF-κB炎症信号通路和抗凋亡信号通路预防伴刀豆球蛋白A诱导的小鼠急性肝炎损伤。本研究结果显示,蒲公英甾醇可下调HAG小鼠胃组织中NOD1 mRNA、RIP2 mRNA和p-p65蛋白表达,NOD1受体激动剂iE-DAP则呈相反的作用效果,iE-DAP和蒲公英甾醇同时处理后,iE-DAP对通路相关基因转录和蛋白表达的促进作用被逆转,提示蒲公英甾醇可通过调控NOD1/NF-κB通路改善HAG小鼠脾胃湿热证症状,抑制炎症反应。
综上所述,蒲公英甾醇可改善HAG小鼠脾胃湿热证症状,抑制炎症反应,作用机制可能与调控NOD1/NF-κB通路有关。

