鸭甲型肝炎病毒1型与3型双重TaqMan实时荧光定量PCR检测方法的建立与应用
林梦舟,吴 双,徐建生,谢 军,吴 植,姜 勇,朱善元*
(1.扬州大学兽医学院,扬州 225009;2.江苏农牧科技职业学院 江苏省兽用生物制药高技术研究重点实验室,泰州 225300;3.江苏立华牧业股份有限公司,常州 213000)
近年来,随着中国水禽养殖产业的快速发展,鸭常见的传染性疾病不断增多[1],导致鸭病的发病率和死亡率居高不下,给临床检测和防控带来了困扰,严重影响了水禽产业的健康发展,带来了巨大经济损失[2]。
鸭病毒性肝炎(duck viral hepatitis,DVH)是由鸭甲型肝炎病毒(duck hepatitis virus A,DHAV)引起的一种急性、高度接触性的病毒性传染病[3],主要侵害4周龄以内的雏鸭,剖检时典型特征为肝肿大并带有出血点[4],可通过消化道和呼吸道感染[5]。DHAV分为DHAV-1、DHAV-2和DHAV-3三种不同的基因型[6]。2010年以前,国内发病以DHAV-1型为主,2013年以后DHAV-3发病率明显高于DHAV-1[7];同时也存在混合感染的现象[8],二者的临床症状相似,仅凭剖检病变难以进行鉴别诊断[9-10]。
实时荧光定量PCR方法具有快速、高效、敏感性高、特异性强等特点[11],本研究中建立的DHAV-1和DHAV-3双重TaqMan荧光定量PCR方法不仅能高效检测混合感染情况,还可以准确测定动物组织的病毒载量。临床疑似样品的检测结果表明,该方法适合临床推广、可适用于大规模样品检测。
1 材料与方法
1.1 病原和SPF雏鸭
DHAV-1、DHAV-3、新型鸭呼肠孤病毒(NDRV)、番鸭呼肠孤病毒(MDRV)、鸭坦布苏病毒(DTMUV)、鸭腺病毒3型(DAdV-3)、新城疫病毒(NDV)、鸭细小病毒(DPV)、H9N2亚型禽流感病毒(H9N2-AIV)、鸭圆环病毒(DuCV),其中NDV基因来源为新城疫Ⅳ系活疫苗(LaSota),其余均由江苏省生物制药高技术研究重点实验室鉴定、分离和保存。SPF种鸭蛋购自山东昊泰实验动物繁育有限公司,由本实验室自行孵化至10日龄或出雏,SPF雏鸭转移至隔离器饲养。
1.2 主要试剂
FastPure Gel DNA Extraction Mini Kit、FastPure Plasmid Mini Kit购自南京诺唯赞生物科技有限公司,Viral RNA/DNA Kit DNA/RNA提取试剂盒购自CWBIO,TE引物稀释液、DNA稀释液(荧光定量专用)购自生工生物工程(上海)股份有限公司,DNA 酶(TaKaRaTaqversion 2.0 plus dye)、Premix ExTaq(Probe qPCR)、Premix Taq PrimeScript RT Master Mix反转录试剂盒、E.coliDH5α均购自宝生物工程(大连)有限公司,克隆载体pGEM®T-easy 购自Promega 公司,2000 bp DNA marker、50 bp DNA marker均购自Solarbio,FastPrep-24TM5G 高速匀浆仪购自美国MP公司,Veriti PCR仪和 QuantStudio 3 Real-time PCR System 均购自美国应用生物系统公司(Applied biosystems)。
1.3 引物的设计及合成
从NCBI/GenBank上下载DHAV-1(89株)和DHAV-3(35株)的基因序列,经过BioEdit软件分析,使用Gene Runner 和Primer Express软件分别针对保守的VP1序列设计一对特异性标准品引物(表1)和一对特异性荧光定量PCR引物与探针(表2),BLAST结果表明引物和探针具有良好特异性,引物和探针均由生工生物工程(上海)股份有限公司合成。
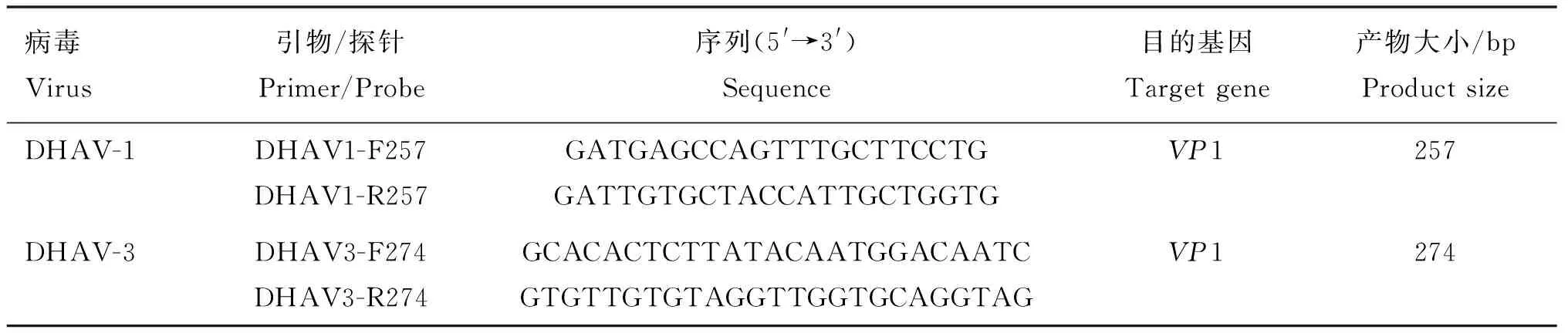
表1 标准品引物序列
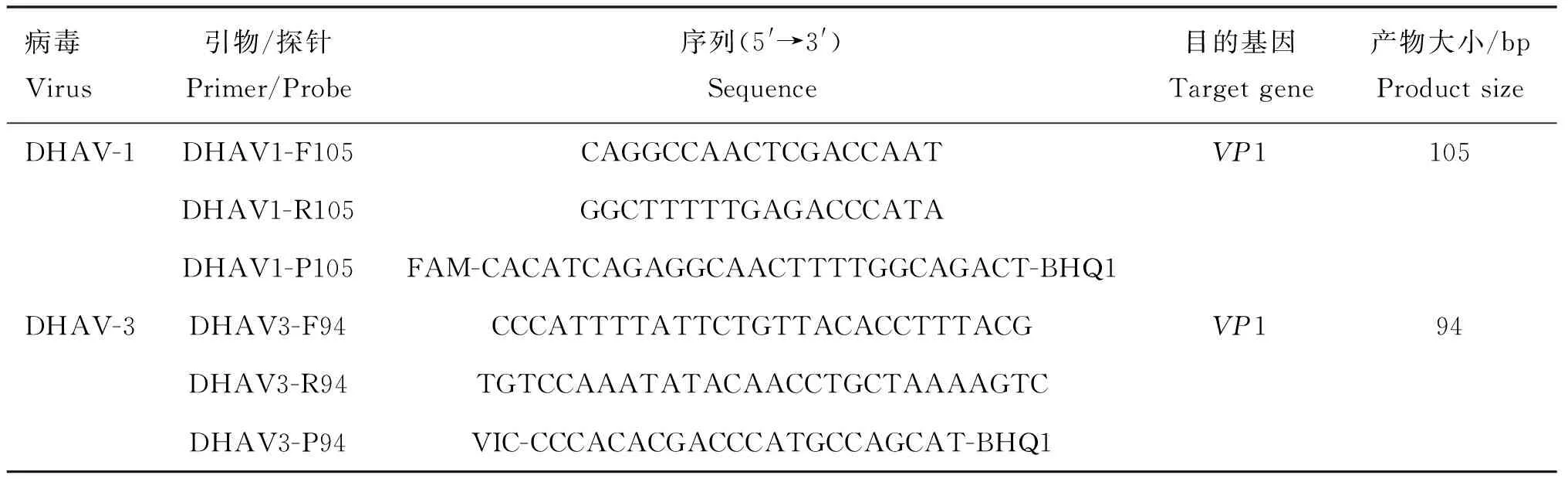
表2 荧光定量PCR引物及探针序列
1.4 核酸提取及反转录
剪取常规PCR方法鉴定的DHAV-1、DHAV-3阳性病料,与PBS按1∶9加入到2 mL研磨管中,使用FastPrep-24TM5G匀浆机将样品匀浆,经过10 min高速(10 000 g·min-1)离心后,吸出上清。参照Viral RNA/DNA Kit DNA/RNA提取试剂盒、PrimeScript RT Master Mix反转录试剂盒说明书,对DHAV-1、DHAV-3、NDRV、MDRV、DTMUV、DAdV-3、NDV、DPV、H9N2-AIV、DuCV进行核酸提取与反转录。
1.5 重组质粒标准品的制备
以提取的DHAV-1、DHAV-3基因组为模板分别进行VP1基因的PCR扩增,体系:2×TaqPCR Master Mix 25 μL、上下游引物(10 μmol·L-1)各2 μL、模板2 μL,无核酸酶的灭菌水补至终体积50 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃ 30 s、58 ℃ 30 s、72 ℃ 60 s,35个循环;72 ℃终延伸 5 min;-4 ℃保存。PCR产物经2%琼脂糖凝胶电泳后切下与预期大小一致(DHAV-1为257 bp、DHAV-3为274 bp)的目的条带,参照FastPure Gel DNA Extraction Mini Kit 凝胶回收试剂盒说明书进行回收,得到目的片段后与 pGEM®T-easy 载体连接,再转化至E.coliDH5α感受态细胞中。涂布菌液于AIX板进行蓝白斑筛选,挑取白斑进行摇菌,经菌液PCR鉴定及酶切鉴定正确的菌液送南京擎科生物科技有限公司测序。参照FastPure Plasmid Mini Kit 质粒提取试剂盒说明书提取质粒,用微量蛋白核酸定量仪测定质粒浓度,重组质粒拷贝数由下式计算[12]:
质粒拷贝数=(6.02×1023)×(质粒含量×10-9)/(质粒长度×660)
将DHAV-1与DHAV-3的质粒分别稀释至2×109copies·μL-1后,合并为1×109copies·μL-1的混合质粒,再作10倍梯度稀释,制备得109~101copies·μL-1的标准质粒。
1.6 双重 TaqMan荧光定量PCR检测方法的建立及优化
1.6.1 反应条件的优化 通过调整引物浓度、探针浓度和退火温度,摸索双重q-PCR的最优反应体系与反应条件,阴性判定标准为无S型扩增且无Ct值。
1.6.2 标准曲线的建立 将测序正确的质粒按拷贝数进行梯度稀释,在建立DHAV-1和DHAV-3单重q-PCR检测方法的基础上建立了DHAV-1和DHAV-3双重q-PCR标准曲线。
1.6.3 特异性试验 分别取 NDRV、MDRV、DTMUV、DAdV-3、NDV、DPV、H9N2-AIV、DuCV的DNA或RNA按照相同条件代替DHAV-1与DHAV-3进行q-PCR检测,灭菌超纯水为阴性对照,以验证其特异性。
1.6.4 敏感性试验
1.6.4.1 检测阳性质粒的敏感性:将上述10倍梯度稀释(105~101copies·μL-1)的标准品作为扩增模板进行q-PCR,确定其敏感性。
1.6.4.2 检测病料的敏感性:提取新鲜病料的RNA并反转录,按已建立的标准曲线进行定量。确定拷贝数后10倍梯度稀释,用作模板验证敏感性。
1.6.5 重复性试验 使用106~104copies·μL-1的标准质粒来确定其重复性,组间及组内变异系数均进行3次重复。
1.7 动物试验组织样品检测
为了初步验证临床疑似样品的检出率,利用q-PCR 方法分别鉴定出仅含有DHAV-1或DHAV-3的2份阳性病料,取出这2份阳性病料进行研磨、离心,将上清过滤后经尿囊腔接种10日龄SPF鸭胚,收取尿囊液传代5次。分别取第5代次尿囊液按照103ELD50的量经腿部肌内注射接种7日龄SPF雏鸭,设置PBS对照组,剂量均为0.2 mL·只-1,每组各3只。48 h后剖解,取其心、脑、脾、肝。核酸提取与反转录方法同“1.4”。利用已建立的双重定量方法对各器官内的病毒进行定量检测。
1.8 临床样品检测
选取2017—2019年来自苏中、苏北地区规模化养鸭场的40份疑似感染鸭肝炎病毒的组织样品,处理方法同“1.7”,使用相同的DHAV1-105与DHAV3-94引物,应用建立的q-PCR 方法与常规 PCR 方法分别进行检测,比较两种方法的阳性率(阳性数/总检测数)。
2 结 果
2.1 双重q-PCR反应条件的优化
将引物和探针分别稀释至10 μmol·L-1,使用矩阵法寻找最优引物用量(0.1、0.2、0.3、0.4、0.5、0.6 μL)、探针用量(0.1、0.2、0.3、0.4、0.5、0.6 μL)和退火温度(57、58、59、60、61和 62 ℃)。DHAV-1反应条件:95 ℃ 30 s;95 ℃ 5 s,62 ℃ 31 s,共40次循环;DHAV-3优化后退火温度为61 ℃,其余条件与DHAV-1一致。在此单重检测方法的基础上,优化引物、探针浓度和退火温度后,得到双重q-PCR反应体系: 12.5 μL 2×Premix ExTaq(Probe qPCR),0.5 μL 50×ROX Reference Dye,DHAV-1与DHAV-3上下游引物各0.6 μL,探针分别为0.8与0.5 μL,1.0 μL DNA模板,灭菌超纯水分别为9.0和9.3 μL。退火温度为60 ℃。
2.2 标准曲线的绘制
DHAV-1与DHAV-3分别选择FAM和VIC为荧光基团。使用浓度为1×108~1×103copies·μL-1的标准质粒作为模板,按照已优化的反应条件进行q-PCR检测,以拷贝数的对数为横坐标,Ct值为纵坐标建立标准曲线(图1),其中,DHAV1-VP1的线性关系表达式为Y1=-3.116X+42.385,R2=1,E= 109.36%;DHAV3-VP1的线性关系表达式为Y2=-3.147X+41.366,R2=0.999,E=107.876%。扩增效率和相关系数良好,说明建立的标准曲线具有可靠性。
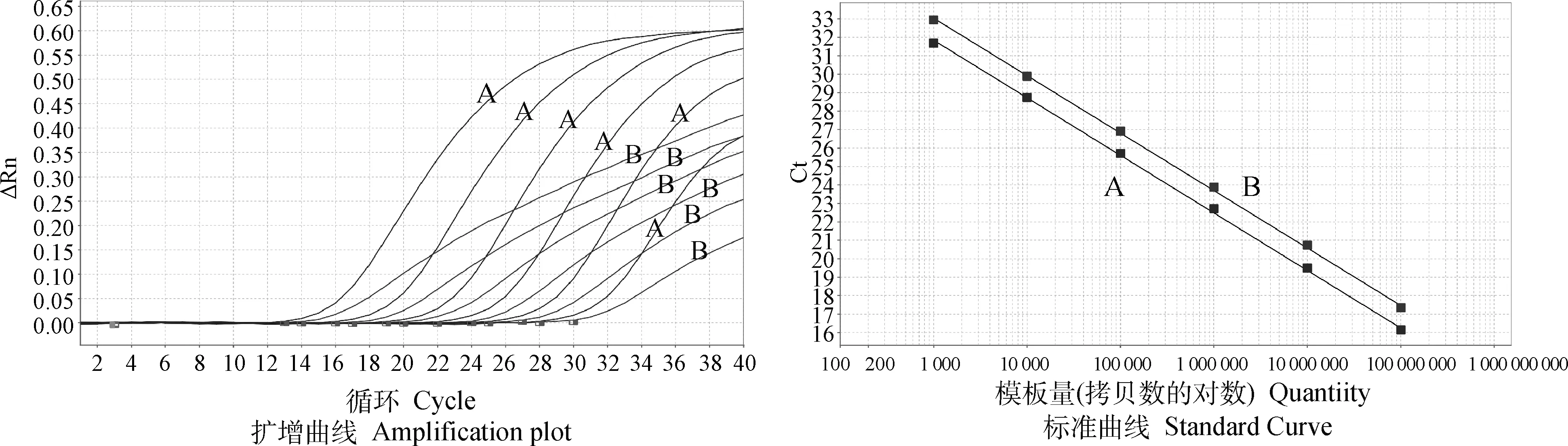
A.DHAV-3;B.DHAV-1
2.3 双重q-PCR的特异性
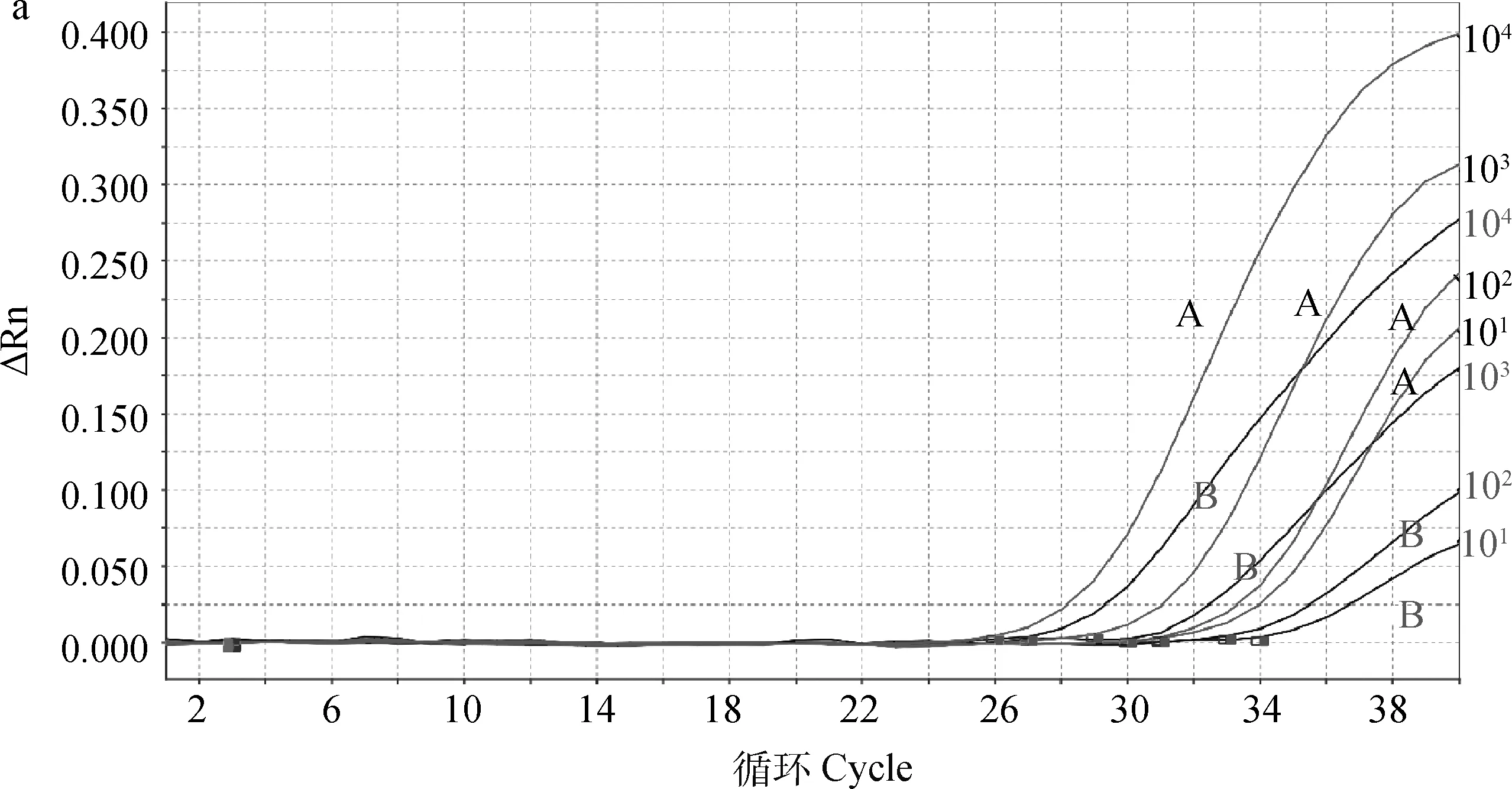
应用本研究建立的双重TaqMan荧光定量PCR方法对DHAV-1、DHAV-3、NDRV、MDRV、DTMUV、DAdV-3、NDV、DPV、H9N2-AIV和DuCV的基因组进行检测,结果(图2)显示,DHAV-1和DHAV-3出现S型扩增曲线,为阳性扩增,其他病毒和阴性对照均为阴性扩增,表明该检测方法特异性优良。
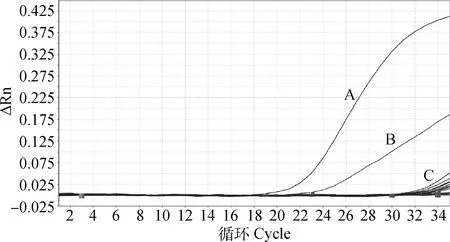
A.DHAV-3;B.DHAV-1;C.阴性对照及其他病毒
2.4 双重q-PCR的检测敏感性
2.4.1 标准品PCR检测的敏感性 采用本研究已经建立的检测方法,将105~101copies·μL-1的标准品作为扩增模板分别进行常规PCR检测与q-PCR检测,结果如图3和图4a,DHAV-1与DHAV-3的常规PCR检测灵敏度分别为104、103copies·μL-1,q-PCR 检测灵敏度均为10 copies·μL-1,比较两种方法的结果,可见使用双重TaqMan荧光定量PCR检测方法比常规PCR检测方法的灵敏度分别提升了1 000倍和100倍,表明本研究建立的检测方法可大大提高最低检测限。
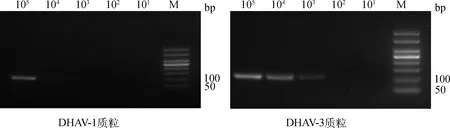
图3 DHAV-1(左)与DHAV-3(右)常规PCR灵敏度(标准品)
2.4.2 病料PCR检测的敏感性 将DHAV-1与DHAV-3的cDNA按已建立的标准曲线进行定量,并分别稀释至2×105后混合,再进行10倍梯度稀释得到105~101copies·μL-1的病料标准品。以病料标准品为模板进行q-PCR检测,结果(图4b)与质粒标准品一致,说明本方法可以运用于临床检测。
a.标准品(105~101 copies·L-1);b.组织病料(105~101 copies·L-1);A.DHAV-3;B.DHAV-1
2.5 双重q-PCR的重复性
以106~104copies·μL-1的标准质粒为模板,同一批次做三个重复验证组内变异系数,做三个批次验证组间变异系数,结果表明,DHAV-1、DHAV-3的组内变异系数均小于0.76%,组间变异系数均小于0.61%,说明建立的双重TaqMan荧光定量PCR检测方法有良好的重复性。
2.6 动物试验组织样品检测
攻毒后24~48 h雏鸭均出现明显角弓反张,并且很快死亡,剖解后取心、脑、脾和肝等脏器组织,用已建立的双重q-PCR方法分别对DHAV-1与DHAV-3攻毒组鸭心、脑、脾、肝进行定量检测,检测结果如图5,DHAV-1与DHAV-3感染病鸭的各器官内均含有病毒,肝和脾内病毒含量最高,DHAV-1感染量达到(7.0~7.3)×105copies·mg-1,DHAV-3感染量达到(2.5~2.6)×107copies·mg-1。
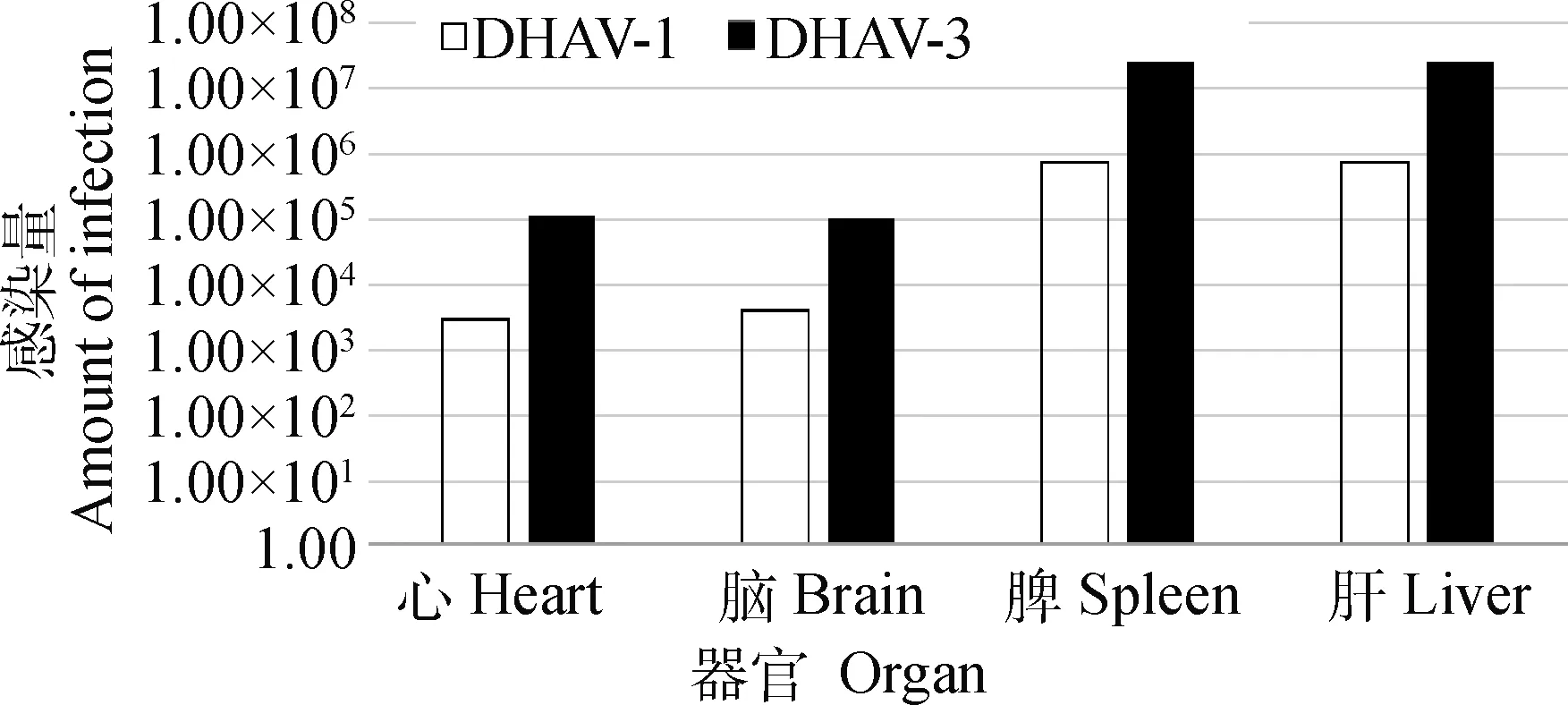
图5 DHAV-1与DHAV-3攻毒组各器官病毒含量
2.7 临床样品检测
应用本研究中建立的双重Taqman荧光定量PCR检测方法对来自苏中、苏北地区的疑似患病鸭的心、脑、脾、肝等临床样品进行检测,并与常规PCR检测结果进行对比。结果显示,q-PCR的DHAV-1阳性率为37.5%(15/40),DHAV-3阳性率为60%(24/40),其中混合感染的阳性率为7.5%(3/40),总阳性率为90%(36/40);常规PCR方法的DHAV-1阳性率为20%(8/40),DHAV-3的阳性率为52.5%(21/40),总阳性检出率为(72.5%)。其中,q-PCR检测中高Ct值(>35)的样品使用常规PCR方法并不能检出。临床检测结果显示,鸭肝炎病毒的感染情况复杂,存在混合感染的现象,并且常规PCR的检测无法实现对病毒筛查的全面覆盖,因此建立灵敏、高度特异的双重检测方法尤为重要。
3 讨 论
DHAV属于小 RNA 病毒科,DHAV-1与DHAV-3是国内流行的两种基因型[13],具有相同的基因组结构[14],大小约为7.7 kb[15]。其基因组主要由5′端非编码区、开放阅读框、3′端非编码区和Poly(A)尾巴构成[16]。整个开放阅读框编码三种成熟的结构蛋白(VP0、VP1和VP3)和9种非结构蛋白(A1-2A2-2A3-2B-2C-3A-3B-3C-3D)[17]。
近年来,随着养殖业的不断发展,鸭养殖量不断增加,一旦暴发鸭病毒性肝炎,就会导致大量雏鸭死亡,造成巨大的经济损失。在我国,同时存在DHAV-1和DHAV-3的流行,但由于这两种病原引起的雏鸭发病症状和病理变化都非常相似,在临床上难以区分[18]。此外,由于抗原性不同,经中和试验和荧光抗体试验证实,DHAV-1与DHAV-3不能形成交叉保护[19],实际情况下DHAV-1疫苗不能避免雏鸭感染DHAV-3。及时确诊DHAV的发生和流行,并评估当前的流行趋势,有助于最大程度地减少损失。因此,建立针对该疾病的高效、精确、灵敏和特异的检测方法十分重要,有助于确定病原的类型,并且对疾病的预防、治疗和控制有重大意义。
目前,PCR是用于DHAV检测的首选方法。但是,传统的PCR测试需要多个步骤,耗时较长,而且假阳性率高、特异性差。q-PCR与传统PCR相比更具优势,可同时兼顾定性与定量[20],并且时间成本更低,更适用于样品的大规模检测。在已报道的研究中,刘海燕等[21]建立的一种针对DHAV-1的单一q-PCR 检测方法,检测灵敏度为20 copies·μL-1;胡琴等[22]开发了用于DHAV-3的q-PCR检测方法,检测限为10 copies·reaction-1。试验结果表明,本研究建立的双重q-PCR检测方法同样具有单一q-PCR 检测方法的快速、特异、灵敏等优点。
为了评估该方法,对7日龄雏鸭进行了攻毒试验,以及对2017—2019年间来自苏中、苏北地区的40份疑似鸭肝炎病毒感染的样品进行检测。动物试验中组织样品检测结果显示,DHAV-1与DHAV-3感染病鸭的肝和脾中病毒含量明显高于其他脏器,分别可达到(7.0~7.3)×105copies·mg-1和(2.5~2.6)×107copies·mg-1。临床样品检测结果显示,DHAV-1、DHAV-3和混合感染的阳性检出率分别为37.5%、60%和7.5%。以上结果验证了本研究中所建立方法的准确性、灵敏性、重复性及可靠性。
4 结 论
本研究中建立的DHAV-1与DHAV-3 双重TaqMan实时荧光定量PCR检测方法在103~108copies·μL-1内建立了标准曲线且线性关系良好;DHAV-1与DHAV-3的检测灵敏度均可达到10 copies·μL-1;证明建立的检测方法检测范围广,灵敏度高及特异性优良。该双重q-PCR检测方法可作为一种诊断和检测DHAV-1、DHAV-3及其混合感染的可靠工具,有助于对鸭肝炎病毒进行分子流行病学研究。

